丙戊酸钠对癫痫样放电海马神经元铁死亡的抑制作用及其机制
(青岛大学附属医院神经内科,山东 青岛 266003)
癫痫是一种由神经元异常、同步、过度放电导致的慢性神经系统疾病[1]。癫痫病因复杂且发病机制至今尚未明确,研究发现,细胞程序性死亡是癫痫的发病机制之一[2-4]。铁死亡是近几年提出来的由铁依赖性的氧化应激引起的调节性细胞死亡形式[5-6],在动物模型中已经证实铁死亡与癫痫的发生密切相关[7-9],但其参与癫痫的具体分子机制尚不明确。丙戊酸钠(VPA)是经典的抗癫痫药物之一,其作用机制主要是通过阻滞钠离子通道以及增强抑制性神经递质γ-氨基丁酸(GABA)而发挥作用。相关研究表明VPA可通过抑制氧化应激途径发挥神经保护作用[10-12],因此VPA可能通过抑制铁死亡发挥抗癫痫作用。目前尚未有研究揭示VPA抑制癫痫发作是否与铁死亡有关,因此本研究通过构建无镁诱导的癫痫细胞模型,在细胞层面探讨铁死亡参与癫痫的发生机制,为VPA药理机制研究提供数据支持,同时也为癫痫药物的研发提供新思路。
1 材料和方法
1.1 材料来源
VPA(美国Sigma公司);酰基辅酶A合成酶长链家族成员4(ACSL4)、溶质载体家族7成员11(SLC7a11)、微管相关蛋白2(MAP-2)以及谷胱甘肽过氧化物酶4(Gpx4)单克隆抗体(美国Abcom公司),β-actin抗体(美国Protein tech公司),谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)检测试剂盒、丙二醛(MDA)测定试剂盒(上海碧云天生物科技有限公司),铁离子比色分析试剂盒(美国Bio Vison公司),CCK-8检测试剂盒(苏州新赛美生物科技有限公司)。
1.2 实验方法
1.2.1原代海马神经元的培养与鉴定 选择以孕19~20 d的Sprague-Dawley(SD)大鼠的胎鼠为细胞源。引颈处死SD孕鼠后,取出胎鼠,剪断其大脑并取其海马组织,用Neurobasal培养基进行培养。调整细胞最终浓度为1×109个/L,接种于预先包被过的6孔培养板中培养,3 d半量换液一次。培养至第7天,用于后续实验。
原代海马神经元接种于装有盖玻片的6孔培养板中培养,7 d后进行鉴定。将培养在盖玻片上的细胞以40 g/L多聚甲醛固定10 min,以含体积分数0.003 Triton-100溶液破膜10 min,以含体积分数0.03牛血清白蛋白溶液封闭1 h。加入一抗MAP-2抗体(1∶500)于4 ℃孵育过夜,然后加二抗山羊抗体IgG抗体室温避光孵育1 h。用含DAPI染料的抗荧光衰减封片剂进行封片后,荧光显微镜下采集图像,检测原代海马神经元的形态,确定海马神经元的纯度、状态。
1.2.2癫痫细胞模型的制备与实验分组 原代海马神经元培养7 d后,随机分组。分别将培养液更换为1.5 mL的正常培养液(A组)、等量的无镁+0.5 mmol/L VPA溶液(B组)、等量的无镁细胞外液(C组),培养3 h后,立刻用于实验。
1.2.3CCK-8实验检测各组细胞的细胞活性 A~C组按上述方法处理后,分别加入配制好的CCK-8检测液,避光孵育3 h。用酶标仪测定波长450 nm处的吸光度后,根据吸光度按标准曲线计算出样品的细胞活性。
1.2.4比色法检测各组细胞中GSH含量 A~C组按上述方法处理后,去上清液,PBS洗1次,用1.5 mL离心管收集各组细胞。12 000 r/min离心15 min,去上清液,加入细胞体积3倍的蛋白去除试剂M溶液。每组均分成2部分:一部分样品加入GSH清除液用于GSSG检测,另一部分样品(不加入GSH清除液)用于总GSH检测。然后这两部分样品均加入总GSH检测工作液,室温孵育5 min。加入0.5 g/L NADPH溶液,室温孵育25 min,用酶标仪测定波长412 nm处的吸光度。根据吸光度按标准曲线计算出样品中总GSH和GSSG的含量,GSH的含量计算方法:GSH=总GSH-2×GSSG。
1.2.5比色法检测各组细胞中铁离子含量 A~C组细胞按上述方法处理后,去上清液。PBS洗1次,加入40 μL铁测定缓冲液5 min后收集细胞,以12 000 r/min离心15 min。取上清液,加入96孔板中,用铁测定缓冲液补齐体积至100 μL,再加入5 μL铁离子还原剂,于37 ℃孵育30 min。后加入100 μL铁离子探测液,37 ℃避光孵育60 min,用酶标仪测定波长593 nm处的吸光度。根据吸光度按标准曲线计算出样品中铁离子含量。
1.2.6比色法检测各组细胞中MDA含量 A~C组细胞按上述方法处理后,去上清液,加入150 μL PBS制作细胞匀浆液。取细胞匀浆液,BCA法检测A~C组蛋白浓度,以12 000 r/min离心15 min。弃上清液,加入MDA检测工作液,100 ℃金属浴加热30 min,冷却至室温。12 000 r/min离心15 min,取上清液200 μL加入96孔板中,以酶标仪测定波长532 nm处的吸光度。根据吸光度按标准曲线计算出样品中MDA含量。
1.2.7Western blot方法检测各组细胞中ACSL4、SLC7a11和Gpx4蛋白的表达 A~C组细胞按上述方法处理后,去上清液,加入150 μL PBS制作细胞匀浆液。取A~C组细胞的匀浆液,冰上提取蛋白,BCA法检测各组蛋白总浓度,调整蛋白浓度为1 g/L。取15 μg蛋白于120 g/L SDS-PAGE凝胶上电泳。取电泳条带,在200 mA电流下转移至聚乙二烯二氟化物(PDVF)膜中。使用50 g/L脱脂牛奶在37 ℃下封闭1 h,并分别置于anti-ACSL4(1∶5 000)、anti-SLC7a11(1∶1 000)、anti-Gpx4(1∶1 000)、anti-β-actin(1∶8 000)抗体中4 ℃孵育过夜。TBST洗膜3次,二抗室温孵育1 h,重复洗膜步骤,用显影液显色。Image J软件分析蛋白条带灰度值,目的蛋白相对表达量以目的蛋白的灰度值/内参蛋白的灰度值计算。
2 结 果
2.1 原代海马神经元的鉴定
原代海马神经元培养至第7天,荧光显微镜观察显示,MAP-2在神经元的细胞体和树突中表达(图1A、B),海马神经元胞体饱满,神经元突起延伸,相互交织形成复杂的细胞网络。DAPI在神经元细胞核中表达(图1C、D),海马神经元细胞核形态呈椭圆形。合图后根据细胞形态、MAP-2的表达,可鉴定该细胞为海马神经元,其形态正常、状态良好、纯度高,可用于后续实验(图1E、F)。
2.2 VPA对癫痫样放电海马神经元的细胞活性和铁死亡相关因子的影响
A~C组癫痫样放电海马神经元的细胞活性、GSH含量以及SLC7a11、Gpx4蛋白相对表达水平比较差异有显著性(F=9.844~262.900,P<0.05),其中C组上述指标较A组显著降低(q=5.992~19.480,P<0.05);B组上述指标较C组显著升高(q=4.610~32.190,P<0.05)。A~C组原代海马神经元ACSL4蛋白表达及MDA、铁离子含量比较差异均有显著意义(F=16.050~81.770,P<0.05);其中C组上述指标较A组显著升高(q=7.150~14.540,P<0.05);B组上述指标较C组显著降低(q=4.991~16.580,P<0.05)。见表1、图2。
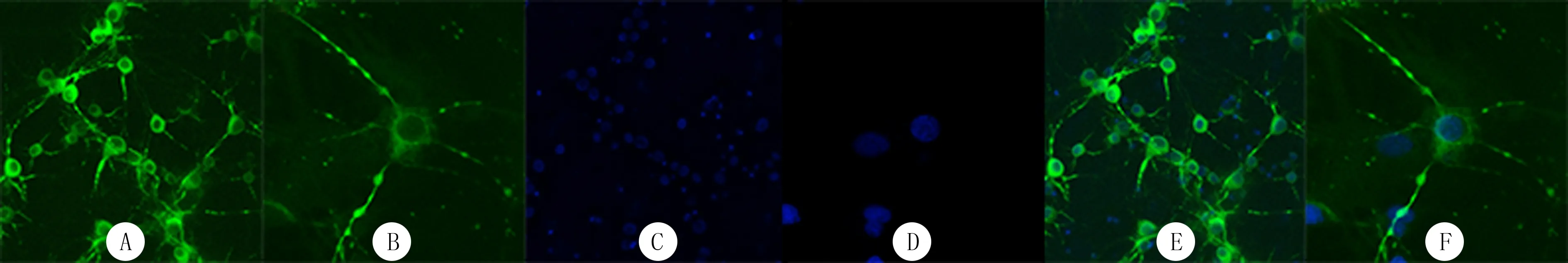
A:MAP-2免疫荧光标记神经元,100倍;B:MAP-2免疫荧光标记神经元,200倍;C:DAPI免疫荧光标记细胞核,100倍;D:DAPI免疫荧光标记细胞核,200倍;E:A和C的合图;F:B和D的合图图1 原代海马神经元的形态观察Fig.1 Morphology of primary hippocampal neurons
表1 VPA对癫痫样放电海马神经元细胞活性和铁死亡相关因子的影响Tab.1 The effect of VPA on cell viability and ferroptosis-related factors in hippocampal neurons with epileptiform discharge

A~C分别代表A~C组图2 各组海马神经元ACSL4、SLC7a11和Gpx4蛋白表达情况Fig.2 Protein expression of ACSL4, SLC7a11, and Gpx4 in each group of hippocampal neurons
3 讨 论
大脑中神经元兴奋性异常增加及过度同步化放电是癫痫发病的基础。神经元的异常放电会产生大量活性氧(ROS),触发氧化应激反应,导致神经元凋亡[13]。研究发现线粒体功能紊乱也参与了癫痫的病理过程[14-15],会导致ROS大量蓄积并造成神经元的氧化损伤和死亡[16],加重癫痫发作的严重程度和发作频率[3]。因此神经元的死亡在癫痫发展中起重要作用。
铁死亡是由DIXON等[5]于2012年首次命名的一种调节性细胞死亡形式,其发病机制主要与铁代谢紊乱和脂质过氧化物累积相关[17],细胞内铁超载可诱发芬顿反应[18],产生大量ROS,在ACSL4、脂氧合酶和环氧合酶(PIGS)的作用下将多聚不饱和脂肪酸氧化成氧化型磷脂酰乙醇胺[19-21],诱发铁死亡的发生。此外,Gpx4、GSH和胱氨酸/谷氨酸逆向转运蛋白(system Xc-)组成重要的抗氧化系统,清除体内脂质过氧化物,其作用机制是:system Xc-将胞外的胱氨酸输运到细胞内与谷氨酸反应生成GSH,与Gpx4共同将脂质过氧化氢还原为脂醇[17,22-25]。反之该系统失衡会进一步促进铁死亡。
许多神经疾病的病理生理过程均涉及铁死亡,包括癫痫等[25-29]。目前,相关动物实验已证实铁死亡与癫痫的发生密切相关。在戊四唑和匹罗卡品诱导的癫痫动物模型的海马组织中,PTGS2 mRNA表达升高,脂质过氧化物终产物MDA和4-羟基壬醛(4-HNE)含量增加,铁离子蓄积,Gpx4蛋白表达下降;而铁死亡抑制剂铁蛋白-1(Fer-1)可以有效减少铁、MDA和4-HNE的蓄积,降低PTGS2 mRNA的表达,提高Gpx4活性,进一步缓解癫痫的发作[9]。在海人酸致大鼠颞叶癫痫模型中,铁死亡抑制因子Gpx4以及GSH表达下降,过氧化脂质和铁蓄积;经Fer-1处理后,Gpx4和GSH水平升高,过氧化脂质和铁含量减少[30]。本研究构建了体外无镁癫痫细胞模型,探究铁死亡与无镁癫痫细胞的关系,结果显示,经无镁细胞外液处理的海马神经元的细胞活性显著降低,脂质过氧化抑制因子SLC7a11、Gpx4蛋白表达和GSH含量显著降低,铁离子含量、脂质过氧化诱导因子ACSL4蛋白表达和MDA含量明显升高,提示癫痫细胞模型发生铁死亡。
VPA是临床上最常使用的一线广谱抗癫痫药物,其抗癫痫机制复杂,主要与提高脑内GABA含量相关[31]。研究报道VPA可通过抑制氧化应激和脂质过氧化,在脊髓损伤、缺血性脑卒中、偏头痛等神经系统疾病中发挥神经保护作用[32]。LI等[32]研究证实,VPA可减轻硝酸甘油所致偏头痛大鼠脑组织损伤,恢复抗氧化因子水平,降低ROS的水平;研究显示,VPA单药治疗可显著降低儿童癫痫患者血清中MDA、H2O2、3-硝基酪氨酸氧化标志物水平,具有明显的抗氧化作用[10];动物实验结果显示,在GBR12909诱导的小鼠躁狂模型中,VPA阻断了纹状体和前额叶皮质的脂质过氧化,逆转了纹状体的GSH水平[33]。以上研究提示VPA对氧化应激和脂质过氧化有抑制作用,而铁死亡的核心标志是铁依赖的脂质过氧化,提示VPA可通过抑制氧化应激和脂质过氧化,阻断铁死亡,从而保护癫痫发作所致的神经元死亡,但目前尚没有研究证实抑制铁死亡亦是VPA抗癫痫的药理机制。本研究结果显示,经VPA干预后的无镁致癫痫样放电海马神经元ACSL4蛋白表达、铁离子含量以及MDA明显降低,同时细胞存活率、SLC7a11和Gpx4蛋白表达、GSH含量明显增高,提示VPA可通过调节脂质过氧化抑制铁死亡,在癫痫样放电海马神经元中发挥神经保护作用,但其抑制铁死亡的具体机制尚不明确。当前研究显示,VPA可以保护皮质神经元免受谷氨酸诱导的兴奋性毒性损伤,谷氨酸蓄积可以导致铁死亡[5,34]。本研究显示,VPA干预可提高海马神经元中SLC7a11蛋白的表达,提示VPA可以通过system Xc-通路抑制铁死亡。有研究显示,VPA可增加血脑屏障中的毛细血管内皮和周皮细胞中铁转运蛋白mRNA和蛋白的表达,铁转运蛋白是铁死亡的负向调节因子,可将细胞内铁外排,维持铁稳态,从而调控铁死亡[35]。本研究结果也显示,VPA干预后可降低海马神经元中铁离子蓄积,提示VPA也可通过铁代谢通路参与铁死亡的调控。
综上所述,本研究从细胞层面验证了铁死亡参与了癫痫的病理过程,VPA可通过抑制癫痫样放电海马神经元的铁死亡而发挥神经保护作用,有助于我们进一步解析癫痫的发病机制,为临床上通过靶向铁死亡来防治癫痫提供理论依据。同时后续应深入研究铁死亡参与癫痫发生的具体分子机制和作用途径,以期为靶向抑制铁死亡治疗癫痫提供新的研究方向。
利益冲突声明:所有作者声明不存在利益冲突。
ConflictsofInterest: All authors disclose no relevant conflicts of interest.
作者贡献:高静、阳勇、姚敏怡参与了研究设计;高静、姚敏怡、王明健、刘雪参与了论文的写作和修改。所有作者均阅读并同意发表该论文。
Contributions: The study was designed byGAOJing,YANGYong, andYAOMinyi. The manuscript was drafted and revised byGAOJing,YAOMinyi,WANGMingjian, andLIUXue. All the authors have read the last version of the paper and consented submission.

