绝经后骨质疏松症与氧化应激的相关性研究
邓若尘 房庆城 方 睿
广东省中西医结合医院 广东广州 528200
绝经后骨质疏松症 (postmenopausal osteoporosis,PMOP) 是一种常见的代谢性骨骼疾病,其特征是骨矿物质密度(bone mineral density,BMD)低和绝经后妇女骨折风险增加。PMOP 的发病机制尚不清楚,近年来,遗传因素与PMOP易感性之间的关联性得到了关注[1]。现探究绝经后骨质疏松症中雌激素水平与氧化应激在绝经后骨质疏松发生发展中的机制作用,选自2018年6月—2021年6月期间,在广东省中西医结合医院住院及门诊的患者进行研究,研究结果如下。
1 资料与方法
1.1 资料来源
选自2018年6月—2021年6月期间,在广东省中西医结合医院住院及门诊的患者作为研究对象。
绝经后骨质疏松症患者纳入标准:髋部或腰椎骨密度T值小于-2.5的45周岁以上绝经后妇女,基本资料、骨密度检查等资料完整。
排除标准:合并严重肝、肾疾病;合并甲状腺、甲状旁腺等内分泌系统疾病;合并糖尿病等代谢性疾病;长期应用雌激素或雄激素者;长期使用抗凝药物者,长期卧床者;严重畸形、残废;老年痴呆或精神病患者及其他不能配合者;不愿意参加本研究者。
非骨质疏松症患者纳入标准:髋部或腰椎骨密度T值大于-2.5的45周岁以上绝经后妇女,基本资料、骨密度检查等资料完整。
排除标准:合并严重肝、肾疾病;合并甲状腺、甲状旁腺等内分泌系统疾病;合并糖尿病等代谢性疾病;长期应用雌激素或雄激素者;长期使用抗凝药物者,长期卧床者;严重畸形、残废;老年痴呆或精神病患者及其他不能配合者;不愿意参加本研究者。
1.2 诊断标准
①骨质疏松症的诊断参照WHO骨质疏松症标准及中华医学会骨质疏松及《原发性骨质疏松症诊疗指南 (2017年)》[2]、《基层医疗机构骨质疏松症诊断和治疗专家共识(2021)》[3]。②骨密度用T-Score (T值) 表示,T= (测定值-骨峰值) /正常成人骨密度标准差。
1.3 调查内容
①调查研究对象的基本情况,包括年龄,绝经年龄,绝经年限,闭经情况。②进行体质量、身高测量,计算记录体质量指数 (BMI) 值。③调查患者既往病史、服药史、家族史。④记录患者的骨密度检查结果,包括髋部和腰椎骨密度。
1.4 ELISA法检测人血细胞线粒体8羟基脱氧鸟苷(8-OHdG)、血清雌二醇(E2)水平
①标准品加样:设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μL;②加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样品孔。在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL(样品最终稀释度为5倍)。加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀;③加酶:每孔加入酶标试剂100 μL,空白孔除外;④温育:用封板膜封板后置37 ℃温育60 min;⑤配液:将20倍浓缩洗涤液用蒸馏水20倍稀释后备用;⑥洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,拍干;⑦显色:每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻震荡混匀,37 ℃避光显色15 min;⑧终止:每孔加终止液50 μL,终止反应(此时蓝色立转黄色);⑨测定:以空白孔调零,450 nm波长依序测量各孔的吸光度(OD值),测定应在加终止液后15 min以内进行;⑩以标准物的浓度为横坐标,OD值为纵坐标,在坐标纸上绘出标准曲线,根据样品的OD值由标准曲线查出相应的浓度;再乘以稀释倍数;或用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
1.5 统计学分析
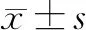
2 结果
2.1 一般情况比较
选自2018年6月—2021年6月期间,在广东省中西医结合医院住院及门诊的符合诊断标准、纳入标准和排除标准的绝经后骨质疏松症患者(PMOP组)68例,非骨质疏松症患者(非OP组)61例,平均年龄(51.40±3.46)岁,平均绝经年龄(46.96±1.88)岁,平均绝经年限(4.43±3.01)年。
非OP组与PMOP组的年龄相比没有明显差异,组间具有可比性。与非OP组相比,PMOP组的绝经年龄较小,骨密度T值减少,差异具有统计学意义(P<0.05);绝经年限上升,但差异没有统计学意义(P>0.05)。见表1。

表1 纳入患者总体情况表
2.2 绝经后骨质疏松症和非骨质疏松症患者BMI情况比较
纳入样本的平均BMI为(20.94±3.09) kg/m2;与非OP组相比,PMOP组的BMI明显降低(P<0.05)(见表2)。
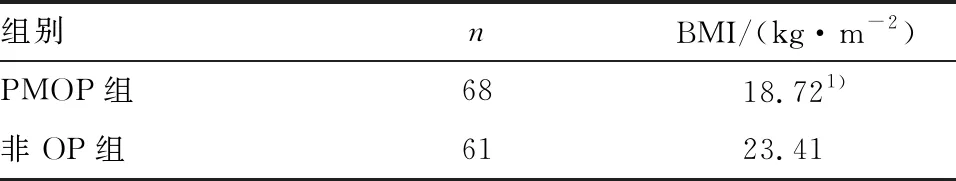
表2 绝经后骨质疏松症和非骨质疏松症患者BMI情况对比
2.3 血清E2、8-OHdG在绝经后骨质疏松症和非骨质疏松症患者体内的表达水平比较
与非OP组相比,PMOP组的8-OHdG明显降低(P<0.05)、E2有所降低,但没有统计学意义(P>0.05)(表2,图1、2)。

表3 E2、8-OHdG在绝经后骨质疏松症和非骨质疏松症患者体内的表达水平
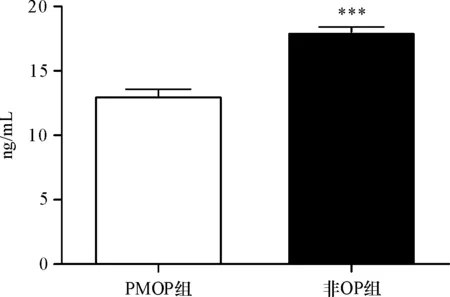
注:与非OP组相比,PMOP组的血细胞线粒体中8-OHdG水平显著降低(P<0.01)。

注:与非OP组相比,PMOP组的血清E2水平降低,但无统计学意义(P>0.05)。
3 讨论
妇女在围绝经期激素水平开始紊乱,绝经后雌激素水平迅速降低,这段时间内骨量快速丢失,研究表明[4],在绝经后骨量丢失的速度为平均每年1%。骨吸收增加90%,而骨形成只增加45%,骨重塑是骨吸收与新骨形成的过程,研究发现雌激素可以调控骨重塑率进而调节骨骼状态。绝经初期雌激素迅速减少,对成骨细胞和破骨细胞调控作用减弱,骨重塑失衡,进而发展为骨质疏松。实验结果显示,与非OP组相比,PMOP组的绝经年龄较小,骨密度T值减少,差异具有统计学意义(P<0.05),说明绝经年龄是影响骨质疏松发生发展的原因之一。有研究显示,随绝经年限的延长,骨质疏松患病率升高[5],目前较少针对绝经年龄与雌激素水平的相关性研究,暂未有充足的证据说明绝经年限的延长伴随着雌激素水平的下降,本实验中PMOP组的E2较非OP组低,PMOP组的绝经年限比非OP组延长,但均无统计学意义(P>0.05),分析可能是本次样本量不足或样本年龄段跨度过小所致。
体质量与身高决定BMI的值,体质量与体内肌肉、脂肪、骨密度等紧密相关,故骨密度下降,体质量指数亦会下降。值得注意的是,骨质疏松症患者常伴有身高缩短,调查[6]显示,身高降低幅度越大,骨密度指标越低,体质量过轻和肥胖都可能加剧绝经后妇女骨质疏松的发生[7];本次纳入样本的平均BMI为(20.94±3.09)kg/m2,与非OP组相比,PMOP组的BMI明显降低(P<0.05);这说明骨密度与BMI成正相关关系,但不排除身高降低为本次分析的混杂因素。
8-OHdG是核苷酸氧化应激反应的产物,代表机体代谢和修复能力下降的程度。作为内外源DNA氧化损伤的标志物,8-OHdG可阻滞细胞增殖,还可激活氧自由基或羟基自由基,诱导发生氧化应激反应,促使细胞线粒体受损,造成细胞凋亡。8-OHdG在体内集聚,成为病理损伤的诱发因子,其水平升高与多种疾病相关,其中包括癌症、动脉粥样硬化和糖尿病等[8-9],有研究表明[10],原发性骨质疏松症中,骨质疏松症组的8-OHdG浓度小于非骨质疏松组,8-OHdG浓度与腰椎平均骨密度呈负相关关系。实验结果显示,与非OP组相比,PMOP组的8-OHdG明显降低(P<0.05),与前人研究结果相符。
骨质疏松症是老年人的常见病和多发病,是当今全球仅次于心脑血管疾病的受害人群最多、最具危险性且尚未能治愈的慢性非传染性疾病[11-12]。早期患者往往无任何症状,严重的骨质疏松症可导致椎骨、髋骨、腕骨、肱骨、胫骨骨折,给个人和社会带来沉重的负担[13]。目前我国对骨质疏松症的防治大多以内科方法为主。由于内科治疗使用雌激素、钙剂、活性维生素D、降钙素和氟化物等药物[14-16]。研究表明,自我管理的健康管理方式对骨质疏松症高危人群疾病防治起重要作用[17-18]。西医防治PMOP的方法主要包括基础措施、药物干预及物理治疗。基础措施主要通过运动饮食疗法和改变不良生活习惯,提高骨密度,避免加剧骨质疏松。药物干预和物理治疗针对性强,根据作用效果或机制,选择相应的治疗药物[19-20]。
8-OHdG则属于活性氧族, 是导致DNA氧化损伤的产物之一,也是DNA突变的标志。当患者出现缺血、缺氧问题, 8-OHdG含量将出现一定程度的上升。而8-OHdG的产生主要依赖于患者体内的活性氧,当活性氧不断增加时,氧化应激过程所产生的ROS将会直接攻击mtDNA,并生成8-OHdG。此时,由于mtDNA自我修复能力较差,且缺乏组蛋白的保护,因此容易导致退行性疾病[21]。
综上所述,绝经后骨质疏松症的发生与氧化应激息息相关,其通过调节线粒体8羟基脱氧鸟苷(8-OHdG)和血清雌二醇(E2)水平有关。

