马尾松R2R3-MYB基因特征及进化和表达分析
孙爽 胡颖 陆晶宇 杨章旗 陈虎

摘要: MYB類转录因子在植物生长发育、代谢、应答生物胁迫和非生物胁迫的响应等生物过程发挥重要作用。为探究马尾松R2R3-MYB基因结构及功能,该研究以转录组数据为研究区域,从中筛选获得了17个马尾松R2R3-MYB基因,利用生物信息学对基因进行理化性质、系统进化树等分析,同时利用荧光定量PCR技术分析基因的组织特异性以及在花发育时期和非生物胁迫下的表达模式。结果表明:(1)17个PmMYBs亚细胞定位于细胞核,均无跨膜结构,且均含有Motif1、Motif2保守基序。系统发育进化树将马尾松PmMYBs划分为9个亚家族,且与火炬松、白云杉等裸子针叶植物关系较近。(2)17个基因均属于组成型表达,但在不同组织的表达量不同;所有基因均参与了花发育和非生物胁迫,不同基因在花发育不同时期的表达存在差异,有7个基因可能参与了雌雄性状转变;大部分基因响应非生物胁迫上调表达,但响应胁迫的时间存在差异;少数基因在胁迫中下调表达,尤其是PmMYB11基因在所有胁迫中均明显下调表达。该研究较系统地分析了马尾松R2R3-MYB基因的结构特征、系统进化及其在花发育时期和非生物胁迫下的表达模式,为深入探究马尾松R2R3-MYB基因的功能及逆境响应机制提供了参考。
关键词: 马尾松, R2R3-MYB, 生物信息学分析, 非生物胁迫, 基因表达
中图分类号: Q943文献标识码: A文章编号: 1000-3142(2022)04-0580-15
Characteristics, evolutionary and expression analysis of R2R3-MYB genes in Pinus massoniana
SUN Shuang HU Ying LU Jingyu YANG Zhangqi CHEN Hu
( 1. Engineering Research Center of Masson Pine of State Forestry Administration, Engineering Research Center of Masson Pine of Guangxi,
Guangxi Key Laboratory of Superior Timber Trees Resource Cultivation, Guangxi Forestry Research Institute, Nanning 530002,
China;
2. College of Life Sciences, Guangxi Normal University, Guilin 541006, Guangxi,
China;
3. Forestry College of Guangxi University, Nanning 530000, China )
Abstract: MYB transcription factors play important roles in plant growth and development,metabolism,responses to biotic and abiotic stresses. In order to explore the structure and function of R2R3-MYB genes in Pinus massoniana, we identified 17 R2R3-MYB genes based on the transcriptome dataset of P. massoniana, and then investigated their physical and chemical properties, phylogenetic relations, gene tissue specificity with qRT-PCR, and expression patterns of these genes in the development process of flower organs and under different abiotic stresses. The results were as follows: (1) Seventeen PmMYBs subcellular were predicted to locate in cell nucleus, without transmembrane structure. They all contained Motif1 and Motif2 conserved motifs. These 17 PmMYBs genes could be divided into nine subgroups according to phylogenetic analysis, which were closely related to gymnosperms such as Pinus taeda and Picea glauca. (2) The expression patterns of PmMYBs genes in different tissues and under salt stress, drought stress, lead stress and low temperature stress were validated by qRT-PCR. As a result, a total of 17 genes were constitutive expressed, but the expression levels were different in different tissues. All genes appeared to be involved in flower development. Seven MYB genes seemed to be involved in the transformation of male and female traits as they were differently expressed in different stages of flower development. Moreover, those genes may also be involved in abiotic stress responses, as most of the genes were up-regulated under abiotic stress. Their unique expression patterns may suggest that they function at different stages of stress. A few genes were down-regulated under stress, especially PmMYB11 gene. This study systematically analyzes the characteristics, evolutionary and expression patterns of R2R3-MYB genes in Pinus massoniana during flower development and abiotic stress, and provides a reference for further study on the function and stress response mechanism of R2R3-MYB gene in P. massoniana.
Key words: Pinus massoniana, R2R3-MYB, bioinformatics analysis, abiotic stress, gene expression
MYB类转录因子数量之多,是植物中最大的转录因子家族之一,该家族基因均含有一类特有保守结构域,MYB结构域由1~4个串联且非重复的R基序组成(牛义岭等,2016)。R基序是由50~53个氨基酸组成,折叠形成螺旋-转角-螺旋结构(Kranz et al.,2010)。根据其含有MYB结构域数量,可分为1R-MYB/MYB-related(1个R基序)、R2R3-MYB(2个R基序)、3R-MYB(3个R基序)、4R-MYB(4个R基序)四类(Dubos et al.,2010)。Wang等(2021)研究表明MYB类转录因子在植物生长发育过程中具有重要作用,参与植物应答生物胁迫和非生物胁迫的响应等生物过程。小麦MYB10-D基因通过调控类黄酮途径和增强ABA生物合成来延缓小麦发芽,从而提高发芽PHS(穗发芽 Pre-harvest sprouting)抗性(Lang et al.,2021);AtMYB14能提高拟南芥抗寒能力(Chen et al.,2013);苹果MdMYB121基因能提高转基因烟草对高盐、干旱和低温的抗逆性(曹忠慧,2013)。R2R3-MYB型是植物中存在最多的MYB转录因子亚型,目前已在拟南芥(Chen et al.,2006)、杨树( 冯波等,2017)等植物中鉴定出大量R2R3-MYB基因,其在植物激素响应、逆境响应等方面发挥调节作用。菠萝多个R2R3-MYB基因受乙烯利处理诱导表达(陈哲等,2019);穿心莲ApMYBs可能通过ABA调控干旱胁迫(李静宇等,2021);拟南芥AtMYB74基因主要受RdDM途径(RNA介导的DNA甲基化)的转录调控,应答盐胁迫(Xu et al.,2015)。
马尾松(Pinus massoniana)是我国重要的乡土速生用材树种,具有一定耐旱、抗瘠薄能力(杨章旗等,2009; 谭健晖等,2017)。目前,干旱等各种非生物胁迫因子对林木生长和发育造成了严重影响,制约着林业生产发展。在马尾松响应干旱胁迫(全文选和丁贵杰,2017)、磷胁迫(王庆竹等,2019)等非生物胁迫的抗逆生理机理、抗逆基因克隆等方面取得一定进展。在生理水平上,马尾松幼苗通过调整自身生长,减弱光合作用,同时调节抗氧化性酶活性、渗透调节物质及内源激素含量等,抵御干旱胁迫(胡晓健等,2020;张金凤等,2021);在铝胁迫下,马尾松幼苗通过调节自身保护酶的合成,积累脯氨酸等渗透调节物质,以抵御铝胁迫(张盛楠,2016)。在分子水平上,马尾松PmAOX基因与花发育过程及抗逆性有关(孙晓波等,2020),PmPAP1基因(吴艳等,2017)、PmMYB169基因(李慧平等,2018)、PmWRKY164基因(王庆竹等,2019)具有提高植株耐低磷胁迫能力。然而,对于马尾松MYB基因应答非生物胁迫响应机制的研究相对匮乏。因此,通过对马尾松MYB基因进行生物信息学、表达模式等分析,对阐明MYB基因的功能和调控机制具有重要意义。本研究以前期转录组测序数据为研究区域,依托生物信息学软件,采用荧光定量PCR分析方法,通过对PmMYBs基因的蛋白质理化性质、保守结构域、系统进化水平、表达模式等进行分析,拟探讨以下问题:(1)马尾松R2R3-MYB蛋白的理化性质、保守结构域等基因特征;(2)马尾松R2R3-MYB蛋白的系统进化;(3)马尾松R2R3-MYB基因在不同组织中的特异性表达水平;(4)马尾松R2R3-MYB基因在花发育时期和不同非生物胁迫下的表达模式。通过本研究以期为进一步深入解析马尾松R2R3-MYB基因功能及其在花发育和非生物胁迫过程中的响应机制提供参考,同时为马尾松抗性分子育种提供基因资源。
1材料与方法
1.1 实验材料
不同组织(根、茎、叶)和非生物胁迫处理材料来自半年生马尾松全同胞幼苗,不同发育时期花材料来自马尾松种质资源库(南宁市林科所国家马尾松良种基地,编号为桂GC105)的同一无性系。在雌雄球花现蕾期至成熟期阶段,分5次采集不同发育阶段的雌雄球花材料(编号为F1-F5、M1-M5)。雌球花样品中,F1-F5对应雌花发育初期(长2 mm)、前期(长 4 mm)、中期(长5 mm)、后期(长7 mm)、授粉期(长7 mm且已显深红色)5个阶段。雄花样品中,M1-M5对应雌花发育初期(长2 mm)、前期(长3 mm)、中期(长5 mm)、后期(长7 mm)、授粉期(长9 mm且已显深红色)5个阶段。雄花变异材料采集时间对应雌球花发育的第2至第5个样时期(编号为BT2-BT5)。
1.2 实验处理
以半年生馬尾松全同胞幼苗为材料,幼苗生长于8 cm直径的种植袋,培养基质为椰糠∶黄心土∶泥炭土(6∶3∶1)。筛选生长一致的幼苗置于人工气候箱中培养15 d适应环境后(温度27 ℃、相对湿度60%、光周期12 h),分别以300 mmol·L-1NaCl、30% PEG-6000和10 mmol·L-1Pb(NO3)2溶液对苗木进行盐胁迫、干旱胁迫、铅胁迫处理(姜国斌等,2007;刘菲等,2018;闫闪闪,2020;陈璇等,2021),低温胁迫将苗木移至4 ℃人工气候箱进行处理。根据预实验结果,由于在胁迫第7天时,马尾松幼苗存活率低,已到胁迫耐受末期,因此,本实验在开始处理的第1天、第4天和第7天采集同一部位针叶样本,以正常浇水处理作为对照,对照组每2 d浇1次水,每个处理30株苗,采集的所有样品置于液氮中保存备用。
1.3 RNA提取及逆转录
RNA提取按多酚多糖植物RNA提取试剂盒说明进行(天根公司,北京),逆转录采用M-MLV逆转录酶进行(宝生物公司,大连),具体步骤按说明书进行,最终将所有样品浓度调至50 ng·μL-1。
1.4 数据来源
马尾松序列来源于前期课题组马尾松三代全长转录组、抗虫转录组(Yang et al.,2016)、侧枝分化转录组(Chen et al.,2021)和花发育转录组(未发表);拟南芥、火炬松、白云杉的R2R3-MYB蛋白序列来源于PlantTFBD数据库和NCBI数据。
1.5 马尾松R2R3-MYB基因生物信息学分析
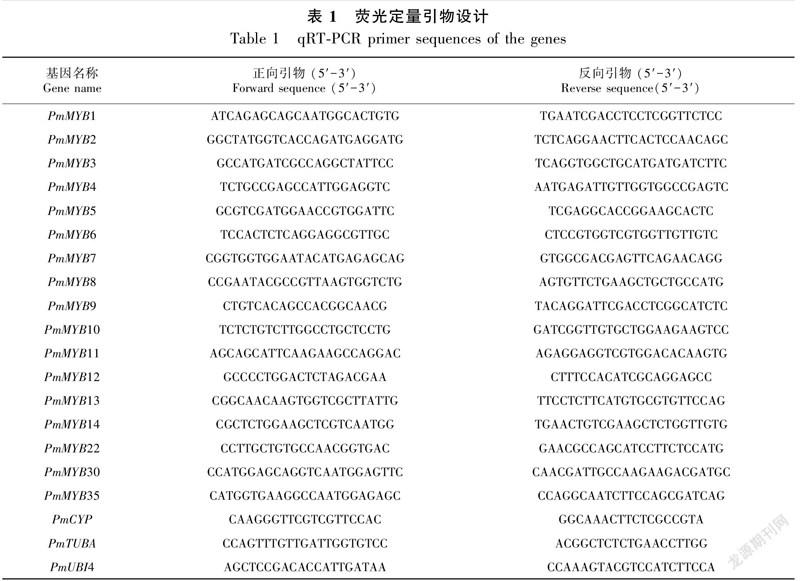
在以上转录组数据中,筛选R2R3-MYB基因,从Pfam数据库下载MYB基因结构域的隐马尔可夫模型(PF00249)后,使用HMMER软件鉴定MYB基因,去除冗余序列和非全长序列后,利用NCBI BLAST进行序列比对,同时以NCBI检索命名为依据,最终获得了完整的17条R2R3-MYB蛋白序列。利用ExPASy在线网站(https://web.expasy.org/)分析基因分子质量、等电点、蛋白质不稳定系数等理化性质;WoLF PSORT(https://psort.hgc.jp/)进行亚细胞定位分析;TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)分析蛋白跨膜结构;SOPMA预测蛋白质二级结构;NetPhos 3.1(http://www.cbs.dtu.dk/services /NetPhos/)分析磷酸化位点;MEGA 7软件的Neighbor-Joining (NJ)法构建系统发育进化树,并利用iTOL(https://itol.embl.de/)美化进化树;WebLogo(http://weblogo.berkeley.edu/logo.cgi)绘制保守区域特征图;MEME(https://meme-suite. org/meme/)分析基因保守基序,并利用TBtools(Chen et al.,2020)进行结果可视化。
1.6 实时荧光定量PCR
以上述处理所得植物样本,利用Primer Premier 5设计基因荧光定量PCR引物(表1),以PmUBI4、PmCYP、PmTUBA基因分别作为组织特异性、 非生物胁迫、 花发育的内参基因 (Chen et al.,2016)。QIAGEN的qRT-PCR检测试剂盒进行荧光定量分析,根据说明书配制反应体系。qRT-PCR反应程序:95 ℃ 2 min,1个循环;95 ℃ 5 s,60 ℃ 30 s,40个循环,每样品进行3次技术重复。使用2-ΔΔCt法计算基因相对表达量,利用SPSS软件进行方差分析,用GraphPad Prism 8软件作图。
2结果与分析
2.1 PmMYBs生物信息学分析
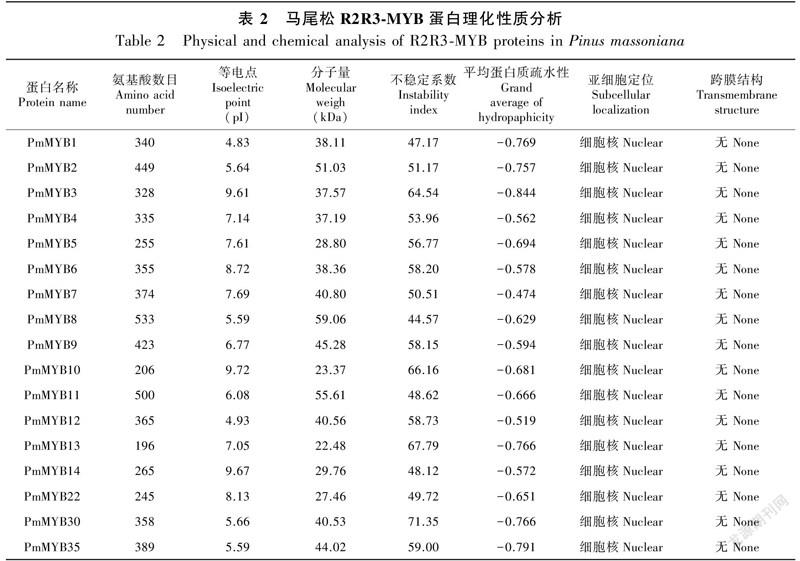
2.1.1 PmMYBs理化性質分析以前期转录组所得数据为基础,最终获得了17个马尾松R2R3-MYB基因,通过生物信息学软件预测蛋白长度、分子质量、等电点。表2结果显示,PmMYBs蛋白编码196(PmMYB13)~533(PmMYB8)个氨基酸;PmMYBs蛋白分子量在22.48(PmMYB13)~59.06(PmMYB8) kDa之间。PmMYBs蛋白理论等电点(pI)在4.83(PmMYB1)~9.72(PmMYB10)之间,平均pI为7.08,其中8个PmMYBs蛋白pI<7,为偏酸性;9个PmMYBs蛋白pI>7,为偏碱性。不稳定系数均大于40,属不稳定蛋白,17个PmMYBs蛋白中,仅PmMYB7平均疏水值>-0.5,为亲水蛋白,其余均<-0.5,为疏水蛋白。所有基因亚细胞定位于细胞核,均无跨膜结构(表2)。PmMYBs蛋白主要的二级结构为无规则卷曲,说明无规则卷曲是PmMYBs蛋白结构的主要组成部分,其次是α螺旋,而延伸链和β转角相对较少(表3)。利用NetPhos 3.1预测PmMYBs蛋白质磷酸化位点,结果表明,各基因均存在丝氨酸、苏氨酸、酪氨酸磷酸化位点,且磷酸化位点数为丝氨酸>苏氨酸>酪氨酸(表4)。
2.1.2 PmMYBs系统进化与功能预测从PlantTFBD数据库及NCBI数据库下载拟南芥(AtMYB,44条)、火炬松(PtMYB,7条)、白云杉(PgMYB,13条)R2R3-MYB蛋白序列进行比对并构建系统进化树(图1)。参考拟南芥MYB基因家族的分类方法(Dubos et al.,2010),最终将17个PmMYBs划分为9个亚家族,同一亚家族的基因具有较高的同源性,序列也具有相似性,且基因功能上可能存在相似性。进化树显示马尾松与同为裸子植物的火炬松、白云杉进化关系相比被子植物拟南芥更近。拟南芥作为模式植物,其MYB基因的功能研究相对充分,基于拟南芥各亚家族基因的功能(乔孟等,2009; 樊锦涛等,2014),对PmMYBs基因进行功能预测:S2亚家族的PmMYB12,S11亚家族的PmMYB11,S13亚家族的PmMYB1、PmMYB8及S22亚家族的PmMYB6、PmMYB7和PmMYB9,以上4个亚家族的基因可能与生物胁迫和非生物胁迫有关;S4亚家族成员的PmMYB5、PmMYB10、PmMYB13、PmMYB14、PmMYB22,S5亚家族的PmMYB30,S6亚族的PmMYB35及S16亚家族的PmMYB2、PmMYB4可能与初生和次生代谢如花青素的合成、类黄酮的合成有关;S21亚家族的PmMYB3可能与植株的生长发育过程有关,如细胞壁合成、腋生分生组织发育等。
2.1.3 PmMYBs蛋白保守基序分析利用MEGA7和WebLogo对17个马尾松R2R3-MYB分别进行多序列比对和保守区域特征图绘制(图2)。图2结果表明,R2结构包括3个极度保守的色氨酸(W),每两个色氨酸残基间隔19个氨基酸残基。R3结构包括2个极度保守的色氨酸(W),第一个色氨酸被苯丙氨酸(F)、异亮氨酸(I)及亮氨酸(L)取代,第2个色氨酸和第3个色氨酸残基间隔18个氨基酸残基。除保守色氨酸外,在R2、R3结构中还存在其他相对保守氨基酸,如R2结构存在保守甘氨酸(G)、谷氨酸(E)、天冬氨酸(D)、亮氨酸(L)、精氨酸(R)、赖氨酸(K)、丝氨酸(S)、半胱氨酸(C)、天冬酰胺(N)和脯氨酸(P)残基;R3结构存在保守谷氨酸(E)、组氨酸(H)、甘氨酸(G)、天冬酰胺(N)、异亮氨酸(I)、精氨酸(R)、苏氨酸(T)、天冬氨酸(D)和赖氨酸(K)。以上这些氨基酸残基与维持PmMYBs转录因子螺旋-转角-螺旋结构有关。
对保守基序分析发现,其中Motif1和Motif2为R2、R3结构域,与用WebLogo绘制的特征图一致(图3)。图3结果表明,6个保守基序中Motif5分布在N端, 仅Motif6分布在C端。各亚家族成员除都有Motif1、Motif2外,S4亚家族还含有Motif3、Motif4、Motif5;S6、S11、S13亚家族还含有Motif3、Motif4;S2、S5、S16亚家族还含有Motif4;Motif6是S22亚家族所独有的。同一亚家族成员保守基序基本一致,说明其功能上可能既具有相似性,也存在同一亚家族蛋白保守基序不一致,这可能是进化过程中结构发生变异所致。
2.2 PmMYBs基因表达分析
2.2.1 PmMYBs基因组织表达特异性分析利用荧光定量PCR技术对PmMYBs基因虽在根、茎、叶中表达进行分析(图4)。图4结果显示,PmMYBs各基因在不同组织中均被诱导表达,但表达水平存在差异,多数基因在根和茎中的表达水平最高,少数基因在叶中表达水平最高。其中,PmMYB2和PmMYB10均表现为叶中表达量最高,而茎和根中表达量较低;PmMYB4、PmMYB5、PmMYB9、PmMYB11、PmMYB12、PmMYB14、PmMYB22、PmMYB30和PmMYB35均表现为根中表达量显著高于叶和茎中的表达量;PmMYB1、PmMYB3、PmMYB6、PmMYB7、PmMYB8和PmMYB13均表现为茎中表达水平最高,而叶和根中的表达量较低。
2.2.2 PmMYBs基因在雌雄球花发育中的表达特征采用荧光定量PCR技术检测PmMYBs基因在雌雄球花发育中的表达特征,图5结果显示,在雄球花、雌球花及在雄花变异发育过程中,马尾松MYB基因的表达模式存在差异。在雄花发育过程中10个PmMYBs基因(PmMYB2/3/4/6/10/12/13/14/30/35)在M1或M2阶段(雄花发育初期)表达量最高,随着花的发育表达量整体呈现降低趋势;PmMYB8在M3阶段(雄花发育中期)达到表达量最高值,为M1阶段表达量的3.47倍,随后2个阶段逐渐下调;3个PmMYBs基因(PmMYB1/7/9)整体呈现先上调后下调的趋势,在M4阶段(雄花发育中后期)达到最高表达水平,PmMYB1和PmMYB9在雄球花M4阶段是表达量很高,分别比M1阶段上升16.1倍和5.9倍;3个PmMYBs基因(PmMYB5/11/22)在雄球花发育过程中呈现先上升后下降再上升,并在M5阶段(雄花发育后期)到达最高值。在雌球花发育过程的表达情况:6个PmMYBs基因(PmMYB1/2/6/9/10/35)在F1或F2阶段(雌花发育初期)表达水平最高,随后降低;PmMYB7和PmMYB30均先呈现缓慢上升并在F3阶段(雌花发育中期)表达量最高,随后降低;7个PmMYBs基因(PmMYB3/4/5/8/12/13/22)在F4阶段(雌花发育中后期)的表达量显著高于其他阶段。PmMYB11和PmMYB14到F5阶段(雌花发育后期)表达量最高。在雄花变异发育过程的表达情况:PmMYB1、 PmMYB13和PmMYB35在雄花变异BT2阶段(雄花变异发育初期)表达量最高,随后逐渐降低,并在BT5阶段上升;PmMYB5、PmMYB7、PmMYB11和PmMYB22在BT3阶段(雄花变异发育中期)有很高的表达量,为BT2阶段表达量的5.42倍、2.61倍、7.69倍、6.67倍,均显著高于雄球花和雌球花各发育阶段的表达水平;10个PmMYBs基因(PmMYB2/3/4/6/8/9/10/12/14/30)均在雄花变异BT5阶段(雄花变异发育后期)有较高的表达水平。可见,马尾松MYB基因在花发育過程中的表达模式存在差异性。
2.3 PmMYBs基因在非生物胁迫下的表达分析
对PmMYBs基因在盐胁迫、 干旱胁迫、铅胁迫和低温胁迫下表达模式进行研究,图6结果显示,PmMYBs基因在4种非生物胁迫处理下均被诱导表达,但不同基因在不同胁迫处理和胁迫时间下存在显著差异。在盐胁迫处理下,PmMYB1、PmMYB5和PmMYB22基因均在第1天表达量比对照明显上调表达,随后下调表达。PmMYB2、PmMYB3、PmMYB4、PmMYB6、PmMYB7、PmMYB9、PmMYB10、PmMYB30和PmMYB35基因均在胁迫第4天时表达量达到最高值,分别为对照的12.39倍、11.12倍、1.13倍、7.13倍、3.92倍、7倍、5.19倍、1.9倍和1.61倍,整体呈现先上调后下调趋势。PmMYB14基因在盐胁迫第7天表达水平最高,并显著高于对照及胁迫第1天和第4天的表达。以上13个基因对盐胁迫都有明显响应,而PmMYB8、PmMYB11、PmMYB12和PmMYB13基因在盐胁迫处理下,整个过程表达量均明显低于对照,呈现下调趋势。
在干旱胁迫处理下,PmMYB1、PmMYB5、PmMYB9、PmMYB10、PmMYB12、PmMYB13、PmMYB14、PmMYB30、PmMYB35基因在胁迫第1天相对表达量呈现明显上调趋势并到达最高值,随后下调表达。PmMYB2、PmMYB4、PmMYB6和PmMYB7基因在胁迫第4天表达量达到最高值,呈现显著增高趋势,分别为对照的14.38倍、2.73倍、7.02倍和4.99倍,整体呈现先上调后下调趋势。PmMYB3基因随胁迫处理的进行上调表达并在干旱胁迫第7天到达最高值。而PmMYB8、PmMYB11和PmMYB22基因在干旱胁迫处理下呈现明显下调表达。
在铅胁迫处理下,PmMYB3、PmMYB12和PmMYB14基因在胁迫第1天表达量到达最高值。PmMYB1、PmMYB2、PmMYB5、PmMYB6、PmMYB7、PmMYB8、PmMYB10和PmMYB35基因先上调表达并在铅胁迫第4天表达量达到最高值,随后表达水平降低。在胁迫第7天,PmMYB9和PmMYB30基因表达量达到最大值,以上基因在铅胁迫处理下均表现为上调表达。而PmMYB4、PmMYB11、PmMYB13和PmMYB22基因在铅胁迫处理过程中下调表达,其中PmMYB13基因在胁迫第1天下调表达,第4天上调表达到对照水平,随后又下调表达。
在低温胁迫处理下,PmMYB3、PmMYB4、PmMYB5、PmMYB6、PmMYB9、PmMYB12、PmMYB13、PmMYB14、PmMYB22、PmMYB30、PmMYB35基因在低温胁迫第1天表达量到达最高,随后下调表达。PmMYB2和PmMYB7基因在低温胁迫第4天表达量最高。PmMYB1和PmMYB10基因在胁迫过程中上调表达并在胁迫第7天表达量到达最高值。而PmMYB8和PmMYB11基因在整个过程为下调表达。
综上所述,17个马尾松R2R3-MYB基因在4种非生物胁迫处理下均被诱导表达,其中PmMYB2基因在各处理下均呈现明显上调表达,而PmMYB11基因在所有胁迫中均下调表达。由此推测,上述17个基因均可能参与马尾松应答盐胁迫、干旱胁迫、铅胁迫及低温胁迫。
3讨论与结论
本研究通过生物信息学分析获得了17个马尾松R2R3-MYB基因,并对其理化性质、保守结构域、系统进化等进行分析。理化性质分析显示,半数R2R3-MYB蛋白质偏酸性,均属于不稳定蛋白外,除PmMYB7为亲水蛋白外,其余均为疏水蛋白。亚细胞定位结果显示均位于细胞核,这与宋婉玲等(2021)研究结果一致,表明基因主要在细胞核内行使功能。17个R2R3-MYB蛋白含有R2和R3典型结构域,说明本研究基因均为R2R3-MYB类。构建系统进化树,将PmMYBs划分为9个亚家族,并发现PmMYBs基因与火炬松、白云杉关系较近,这与蔡琼等(2016)研究结果马尾松PmPIP1与挪威云杉亲缘关系最近一致,说明裸子植物亲缘关系较近。保守基序分析发现在同一亚家族基因所含有保守基序基本一致,这与越橘(Vaccinium corymbosum ‘Jersey)R2R3MYB类基因分析结果一致(宋杨等,2015),同时越橘S5和S4家族成员基因分别在越橘果实发育过程中表达模式基本一致。因此推测,同一亚家族基因功能具有相似性。
马尾松R2R3-MYB基因在不同组织和雌雄球花发育不同阶段的表达模式不同。大部分基因在根和茎中表达水平偏高,推测可能在根和茎发育中具有重要功能;同时发现同一亚家族基因在各组织中表达模式相同,这与杨梅MYB基因组织表达特异性结果基本一致(Cao et al.,2021),进一步表明同一亚家族成员可能具有相似的功能。李戌彦等(2021)研究发现不同MYB基因可能具有调控不同发育时期山楂花色的功能,本研究发现不同R2R3-MYB基因可能参与不同阶段雌雄球花发育过程。在雄球花发育过程中,10个基因在M1和M2阶段(发育初期)表达量最高,随后表达降低;在雌球花发育过程中分别有6个和7个基因在F1、F2和F3阶段(发育初中期)表达量最高,说明马尾松R2R3-MYB基因在花发育初期和中期以及花粉形成过程中发挥重要作用,这与亚洲百合(王雪倩等,2019)、山楂花(李戌彦等,2021)研究结果类似。在雄花变异发育过程中10个基因在最后一个阶段BT5(发育后期)表达量最高,7个基因在发育初期表达量最高,推测7个基因在雌雄性状变异过程中发挥作用,而后表达量高的10个基因行使了雌球花发育的功能。综上结果显示,同一亚家族的基因在花发育过程中表达模式会存在差异,表明不同马尾松R2R3-MYB基因在花的不同发育阶段中可能发挥不同的生理及调节作用。
马尾松R2R3-MYB基因在非生物胁迫下的表达分析结果显示,马尾松R2R3-MYB基因响应多种胁迫处理,大部分马尾松R2R3-MYB基因在胁迫第1天和第4天响应表达,在处理后期表达降低,表明这些基因为前期调控基因;而少数基因在胁迫第7天表达最高,因此推测不同基因在各胁迫过程中行使不同的功能。其中大部分基因对胁迫处理存在响应,这与草莓(Li et al.,2021),木麻黄(Wang et al.,2021)研究基本一致。本研究通过与拟南芥构建系统进化树发现,马尾松S21亚家族的PmMYB3与拟南芥S21亚族的AtMYB117和AtMYB52聚为一类,Park等(2011)研究表明AtMYB52基因過表达株系抗旱、耐盐且参与ABA应答,与此相同的是本研究结果显示PmMYB3在4个非生物胁迫下均会上调表达,因此认为PmMYB3正向调控4种非生物胁迫,且可能参与ABA信号通路转导。同理,本研究中马尾松S22亚家族的3个基因在胁迫下均呈现上调趋势,与车永梅等(2021)研究结果一致,表明S22亚家族基因参与生物胁迫和非生物胁迫,进一步表明同一亚家族成员可能具有相似功能。S13亚家族的PmMYB1、PmMYB8与拟南芥S13亚家族的AtMYB86和AtMYB50相近,因此认为PmMYB1、PmMYB8可能与抗旱、铅耐受等有关(任永兵,2010),在本研究中PmMYB1基因正向调控应答4种非生物学胁迫,而PmMYB8仅在铅胁迫中表达水平升高为正向调控,在其他3个胁迫下均表达量低于对照为负向调控,表明同一亚家族的2个基因表达模式有很大不同。在苹果研究中有类似结果,苹果S22亚家族的MdMYB155能被NaCl、PEG及低温胁迫所诱导,而同一家族的MdMYB185只能被PEG胁迫所诱导(曹忠慧,2013),说明同一亚家族的基因功能上可能存在差异性。在盐胁迫下拟南芥S11亚家族的AtMYB102基因被诱导表达(Mito et al.,2010),本研究中S11亚家族的PmMYB11在4个非生物胁迫处理中均下调表达,起负调控作用,这与AtMYB102基因表达模式相反,因此推测由于物种间差异较大,因此基因的功能可能存在差异。S5亚家族基因可能与类黄酮合成、根发育有关(刘忠丽等,2012),本研究结果显示PmMYB30基因在根中的表达量明显高于叶和茎中的表达,说明PmMYB30基因可能与根的发育有关,同时发现PmMYB30基因均正向调控4种胁迫,PmMYB30基因是否参与类黄酮的合成有待进一步研究。拟南芥AtMYB15基因负调控CBFS基因表达,使得植株抗寒性降低(Agarwal et al.,2006),本研究中S2亚家族的PmMYB12基因在低温胁迫下显著上调表达,推测PmMYB12基因在马尾松抵御冷胁迫过程中发挥重要作用。S6和S16亚家族的PmMYBs可能与花青素的合成有关( Huang et al.,2015; Velten et al.,2017),S4亚家族的PmMYBs可能参与木质素的合成(Kim,2016),结合本研究结果,这3个亚家族的多数基因正向响应非生物胁迫,而这些PmMYBs基因是否参与花青素和木质素的合成,有待进一步深入研究。综合上述结果,17个马尾松R2R3-MYB基因参与干旱等4种非生物胁迫,但在各胁迫处理过程中的表达水平、表达模式都各不相同,说明基因家族响应胁迫的调控网络复杂多样,多种模式相互作用,以抵御逆境。
目前,裸子植物的R2R3-MYB基因功能研究相对较少,关于马尾松R2R3-MYB基因在生长发育调控及应答非生物胁迫的响应机制还不清楚。本研究基于前期转录组获得马尾松R2R3-MYB基因,并对其进行了生物信息学及表达模式分析,为深入研究PmMYBs参与花发育和应答非生物胁迫的分子机制提供参考和理论基础。
参考文献:
AGARWAL M, HAO Y, KAPOOR A, et al., 2006. A R2R3 type MYB transcription factor is involved in the cold regulation of CBF genes and in acquired freezing tolerance [J]. J Biol Chem, 281(49): 37636-37645.
CAI Q, DING GJ, WEN XP, 2016. Cloning of the PmPIP1 gene from Pinus massoniana and its expression with drought stress [J]. J Zhejiang A & F Univ, 33(2): 191-200. [蔡琼, 丁贵杰, 文晓鹏, 2016. 马尾松水通道蛋白PmPIP1基因克隆及在干旱胁迫下的表达分析 [J]. 浙江农林大學学报, 33(2): 191-200.]
CAO YL, JIA H, XING MY, et al., 2021. Genome-Wide analysis of MYB gene family in Chinese bayberry (Morella rubra) and identification of members regulating flavonoid biosynthesis [J]. Front Plant Sci, 12: 691384.
CAO ZH, 2013. Genome-wide analysis of the apple MYB transcription factor allows the identification of MdMYB121 and MdSIMYB1 gene confering abiotic stress tolerance [D]. Taian: Shandong Agricultural University. [曹忠慧, 2013. 苹果MYB转录因子家族的生物信息学分析及MdMYB121和MdSIMYB1在非生物胁迫响应中的作用 [D]. 泰安: 山东农业大学.]
CHE YM, SUN YJ, LIU X, et al., 2021. AtMYB77 involves in lateral root development via regulating nitric oxide biosynthesis in Arabidopsis thaliana under drought stress [J]. Chin Bull Bot, 56(4): 404-413. [车永梅, 孙艳君, 刘新, 等, 2021. AtMYB77促进NO合成参与调控干旱胁迫下拟南芥侧根发育 [J]. 植物学报, 56(4): 404-413.]
CHEN CJ, CHEN H, ZHANG Y, et al., 2020. TBtools: an integrative toolkit developed for interactive analyses of big biological data [J]. Mol Plant, 13(8): 1194-1204.
CHEN H, TAN JH, LIANG XX, et al., 2021. Molecular mechanism of lateral bud differentiation of Pinus massoniana based on high-throughput sequencing [J]. Sci Rep, 11(1): 9033.
CHEN H, YANG ZQ, HU Y, et al., 2016. Reference genes selection for quantitative gene expression studies in Pinus massoniana L. [J]. Trees, 30(3): 685-696.
CHEN X, HU Y, SUN MS, et al., 2021. Effects of exogenous regulating substances on physiological characteristics of Erythrophleum fordii seedlings under lead stress [J]. Sci Silv Sin, 57(2): 39-48. [陈旋, 胡颖, 孙明升, 等, 2021. 外源调节物质对铅胁迫下格木幼苗生理特性的影响 [J]. 林业科学, 57(2): 39-48.]
CHEN Y, CHEN Z, KANG J, et al., 2013. AtMYB14 regulates cold tolerance in Arabidopsis [J]. Plant Mol Biol Rep, 31(1): 87-97.
CHEN YH, YANG XY, HE K, et al., 2006. The MYB transcription factor superfamily of Arabidopsis: expression analysis and phylogenetic comparison with the rice MYB family [J]. Plant Mol Biol, 60(1): 107-124.
CHEN Z, HU FC, RUAN CC, et al., 2019. Bioinformatics and gene expression analysis of pineapple R2R3-MYB gene family [J]. Chin J Trop Crops, 40(10): 1958-1971. [陈哲, 胡福初, 阮城城, 等, 2019. 菠萝R2R3-MYB基因家族鉴定与表达分析 [J]. 热带作物学报, 40(10): 1958-1971.]
DUBOS C, STRACKE R, GROTEWOLD E, et al., 2010. MYB transcription factors in Arabidopsis [J]. Trends Plant Sci, 15(10): 573-581.
FAN JT, JIANG CQ, XING JH, et al., 2014. Structure and function of the 22nd subfamily in Arabidopsis R2R3-MYB family [J]. Hereditas, 36(10): 985-994. [樊锦涛, 蒋琛茜, 邢继红, 等, 2014. 拟南芥R2R3-MYB家族第22亚族的结构与功能 [J]. 遗传, 36(10): 985-994.]
FENG B, ZHU TF, ZHANG C, et al., 2017. Expression characteristics of poplar MYB gene in response to abiotic stresses [J]. NE For Univ, 45(4): 19-22. [冯波, 朱腾飞, 张弛, 等, 2017. 杨树MYB基因应答非生物胁迫的表达特性 [J]. 东北林业大学学报, 45(4): 19-22.]
HU XJ, YANG CX, TAN SC, et al., 2020. Effects of drought stress on proline and endogenous hormones content in Pinus massoniana seedlings from different provenances [J]. S China For Sci, 48(6): 24-28. [胡晓健, 杨春霞, 谭世才, 等, 2020. 干旱胁迫对不同种源马尾松幼苗中脯氨酸及内源激素含量的影响 [J]. 南方林业科学, 48(6): 24-28.]
HUANG BH, PANG E, CHEN YW, et al., 2015. Positive selection and functional divergence of R2R3-MYB paralogous genes expressed in inflorescence buds of Scutellaria species (Labiatae) [J]. Int J Mol Sci, 16(3): 5900-5921.
JIANG GB, DING LN, JIN H, et al., 2007. Effects of salt stress on photosynthetic characteristics and chlorophyll fluorescence parameters in leaves of poplar seedlings [J]. J Liaoning For Sci Technol, (1): 20-23. [姜国斌, 丁丽娜, 金华, 等, 2007. 盐胁迫对杨树幼苗叶片光合特性及叶绿素荧光参数的影响 [J]. 辽宁林业科技, (1): 20-23.
KIM WC, 2016.AtMYB7 Acts as a repressor of lignin biosynthesis in Arabidopsis [J]. J Appl Biol Chem, 59(3): 215-220.
KRANZ HD, DENEKAMP M, GRECO R, et al., 2010. Towards functional characterisation of the members of the R2R3-MYB gene family from Arabidopsis thaliana [J]. Plant J, 16(2): 263-276.
LANG J, FU Y, ZHOU Y, et al., 2021. Myb10-D confers PHS-3D resistance to pre-harvest sprouting by regulating NCED in ABA biosynthesis pathway of wheat [J]. N Phytol, 230(5): 1940-1952.
LI HH, ZHOU YW, MA ZX, et al., 2021. Genome-wide identification and expression analysis of MYB transcription factors and their responses to abiotic stresses in woodland strawberry (Fragaria vesca) [J]. Hort-Amsterdam, 7(5): 97.
LI HP, WANG QZ, TANG WW, et al., 2018. Low phosphorus tolerance of transgenic Arabidopsis thaliana enhanced by overexpression of Pinus massoniana PmMYB169 gene [J]. Mol Plant Breed, 16(24): 8048-8055. [李慧平, 王慶竹, 汤纬玮, 等, 2018. 超表达马尾松PmMYB169基因提高转基因拟南芥耐低磷能力 [J]. 分子植物育种, 16(24): 8048-8055.]
LI JY, SUN MY, XU SQ, et al., 2022. Identification and expression analysis of R2R3-MYB gene family in Andrographis paniculata [J]. Chin J Chin Mat Med, 47(1): 72-84. [李靜宇, 孙铭阳, 徐世强, 等, 2022. 穿心莲R2R3-MYB基因家族的鉴定与表达分析 [J]. 中国中药杂志, 47(1): 72-84.]
LI XY, YANG ZY, JI W, et al., 2021. Excavation and comparative analysis of MYB family based on Hawthorn flowers with different colors [J]. J Nucl Agric Sci, 35(1): 49-59. [李戌彦, 杨忠义, 纪薇, 等, 2021. 基于不同颜色山楂花MYB家族的挖掘与比较分析 [J]. 核农学报, 35(1): 49-59.]
LIU F, ZHOU LT, JIANG Y, et al., 2018. Physiological response from different provenances of Keteleeria fortunei seedlings to drought stress [J]. J Centr S Univ For Technol, 38(11): 35-45. [刘菲, 周隆腾, 蒋燚, 等, 2018. 不同种源江南油杉幼苗对干旱胁迫的生理响应 [J]. 中南林业科技大学学报, 38(11): 35-45.]
LIU ZL, CONG YX, GOU WC,et al., 2012. ATMYB123 and ATKOR1 genes involve in the development of roots in Arabidopsis thaliana [J]. Acta Bot Boreal-Occident Sin, 32(1): 42-47. [刘忠丽, 丛悦玺, 苟维超, 等, 2012. ATMYB123和ATKOR1基因参与拟南芥根发育的调控 [J]. 西北植物学报, 32(1): 42-47.]
MITO T, SEKI M, SHINOZAKI K, et al., 2010. Generation of chimeric repressors that confer salt tolerance in Arabidopsis and rice [J]. Plant Biotechnol J, 9(7): 736-746.
NIU YL, JIANG XM, XU XY, 2016. Reaserch advances on transcription factor MYB gene family in plant [J]. Mol Plant Breed, 14(8): 2050-2059. [牛义岭, 姜秀明, 许向阳, 2016. 植物转录因子MYB基因家族的研究进展 [J]. 分子植物育种, 14(8): 2050-2059. ]
PARK MY, KANG J, KIM SY, 2011. Overexpression of AtMYB52 confers ABA hypersensitivity and drought tolerance [J]. Mol Cells, 31(5): 447-454.
QIAO M, YU YC, XIANG FN, 2009. The roles of the Arabidopsis R2R3-MYB transcription factors in the stress responses [J]. Chin Bull Life Sci, 21(1): 145-150. [乔孟, 于延冲, 向凤宁, 2009. 拟南芥R2R3-MYB类转录因子在环境胁迫中的作用 [J]. 生命科学, 21(1): 145-150.]
QUAN WX, DING GJ, 2017. Dynamic of volatiles and endogenous hormones in Pinus massoniana needles under drought stress [J]. Sci Silv Sin, 53(4): 49-55. [全文选, 丁贵杰, 2017. 干旱胁迫下马尾松幼苗针叶挥发性物质与内源激素的变化 [J]. 林业科学, 53(4): 49-55.]
REN YB, 2010. Functional analysis of AtMYB50 and AtMYB61 transcriptional factors which are implicated in the regulation of heavy metals, low phosphorus and osmotic response in Arabidopsis [D]. Hefei: Hefei University of Technology. [任永兵, 2010. 拟南芥AtMYB50和AtMYB61转录因子在重金属、低磷与渗透胁迫响应中的功能研究 [D]. 合肥: 合肥工业大学.]
SONG WL, XIANG GS, LU YC, et al., 2021. Dentification and expression profiling of R2R3-MYB transcription factors in Erigeron breviscapus [J]. Chin J Chin Mater Med, 46(23): 6149-6162. [宋婉玲, 向贵生, 卢迎春, 等, 2021. 灯盏花R2R3-MYB转录因子基因家族鉴定与表达分析 [J]. 中国中药杂志, 46(23): 6149-6162.]
SONG Y, LIU HD, ZHANG HJ, et al., 2015. Analysis of transcriptome and R2R3-MYB transcription factors in blueberry fruit [J]. Acta Hortic Sin, 42(12): 2383-2394. [宋楊, 刘红弟, 张红军, 等, 2015. 越橘果实转录组及R2R3-MYB转录因子分析 [J]. 园艺学报, 42(12): 2383-2394.]
SUN XB, CHEN PZ, WU XG, et al., 2020. The cloning and expression analysis of PmAOX gene from Pinus massoniana under different stress [J]. J Nanjing For Univ (Nat Sci Ed), 44(4): 70-78. [孙晓波, 陈佩珍, 吴晓刚, 等, 2020. 马尾松PmAOX基因克隆与不同逆境胁迫表达分析 [J]. 南京林业大学学报(自然科学版), 44(4): 70-78.]
TAN JH, TANG SS, CHEN H, 2017. Advances of drought resistance in Pinus massoniana [J]. Guangxi For Sci, 46(1): 1-7. [谭健晖, 唐生森, 陈虎, 2017. 马尾松抗旱性研究进展 [J]. 广西林业科学, 46(1): 1-7.]
VELTEN J, CAKIR C, YOUN E, et al., 2017. Transgene silencing and transgene-derived siRNA production in tobacco plants homozygous for an introduced AtMYB90 construct [J]. PLoS ONE, 7(2): e30141.
WANG QZ, SHANG XW, TANG WW, et al., 2019. Cloning and low phosphorus tolerance function analysis of PmWRKY164 from Pinus massoniana [J]. J Agric Biotechnol, 27(6): 1016-1024. [王庆竹, 尚先文, 汤纬玮, 等, 2019. 马尾松PmWRKY164基因的克隆及耐低磷功能分析 [J]. 农业生物技术学报, 27(6): 1016-1024.]
WANG XP, NIU YL, ZHENG Y, 2021. Multiple functions of MYB transcription factors in abiotic stress responses [J]. Int J Mol Sci, 22(11): 6125.
WANG XQ, YAN GZ, WU Z, et al., 2019. Identification of MYB transcription factors family and screening MYB genes associated with pollen abortion in Lilium Asiatic hybrids [J]. J Agric Biotechnol, 27(11): 1951-1961. [王雪倩, 袁国振, 吴泽, 等, 2019. 亚洲百合MYB转录因子家族的鉴定及调控花粉败育MYB基因的筛选 [J]. 农业生物技术学报, 27(11): 1951-1961.]
WANG YJ, ZHANG Y, FAN CJ, et al., 2021. Genome-wide analysis of MYB transcription factors and their responses to salt stress in Casuarina equisetifolia [J]. BMC Plant Biol, 21(1): 328.
WU Y, LIU XC, PENG L, et al., 2017. Genetic transformation of Masson Pine (Pinus massoniana) PAP1 in Tobacco (Nicotiana tabacum) and its functional analysis [J]. J Agric Biotechnol, 25(6): 1023-1032. [吴艳, 刘小翠, 彭磊, 等, 2017. 马尾松PAP1基因在烟草上的遗传转化及功能分析 [J]. 农业生物技术学报, 25(6): 1023-1032.]
XU R, WANG YH, ZHENG H, et al., 2015. Salt-induced transcription factor MYB74 is regulated by the RNA-directed DNA methylation pathway in Arabidopsis [J]. J Exp Bot, 66(19): 5997-6008.
YAN SS, 2020. Analysis of LoMYB8 expression pattern and study on genetic transformation [D]. Harbin: Northeast Forestry University. [闫闪闪, 2020. LoMYB8的表达模式分析及遗传转化的研究 [D]. 哈尔滨: 东北林业大学.]
YANG ZQ, CHEN H, JIA J, et al., 2016. De novo assembly and discovery of metabolic pathways and genes that are involved in defense against pests in Songyun Pinus massoniana Lamb. [J]. Bangladesh J Bot, 4(45): 855-863.
YANG ZQ, YAN PD, SHU WB, 2009. Relationships between dynamic changes of endogenous hormones and cold-resistance of improved provenance of Pinus massoniana [J]. Guangxi Sci, 16(1): 87-91. [杨章旗, 颜培栋, 舒文波, 2009. 内源激素动态变化与马尾松优良种源抗寒性的关系 [J]. 广西科学, 16(1): 87-91.]
ZHANG JF, CHEN PZ, SUN XB, et al., 2021. Effects on photosynthetic and resistant physiological characteristics of Pinus massoniana seedlings under drought stress [J]. Chin Agric Sci Bull, 37(1): 32-38. [张金凤, 陈佩珍, 孙晓波, 等, 2021. 干旱对马尾松幼苗光合作用及相關生理的影响 [J]. 中国农学通报, 37(1): 32-38.]
ZHANG SN, LIU YM, LIU YM, et al., 2016. Impacts of aluminum stress on the growth and physiological characteristics of Pinus massoniana seedlings [J]. Acta Bot Boreal-Occident Sin, 36(10): 2022-2029. [张盛楠, 刘亚敏, 刘玉民, 等, 2016. 马尾松幼苗生长及生理特性对铝胁迫的响应 [J]. 西北植物学报, 36(10): 2022-2029.]
(责任编辑蒋巧媛)

