大花蕙兰‘黄金小神童’胚性愈伤组织诱导及植株再生研究
席银凯 杨武德




摘要: 為解决大花蕙兰园艺品种‘黄金小神童’(Cymbidium Golden Elf ‘Sundust’)人工繁育周期长、系数低等问题,该研究以其侧芽茎尖为外植体,在1/2MS + 1.0 mg·L NAA + 50 g·L香蕉泥+ 15 g·L蔗糖中培养60 d后,以获得的愈伤组织与原球茎混合物为材料,通过L (3)正交与完全组合实验研究不同因素及组合对‘黄金小神童’胚性愈伤组织和原球茎发生及增殖的影响,进而建立‘黄金小神童’高效、稳定的丛芽增殖和植株再生体系。结果表明:(1)在MS + 2.0 mg·L 6-BA + 150 mL·L椰汁+ 20 g·L蔗糖中,培养70 d后增殖系数达8.13,同时可获得桑葚状原球茎团。(2)原球茎团在MS + 1.0 mg·L 6-BA + 1.0 mg·L NAA中培养70 d后,原球茎发育为幼芽,丛芽发生系数可达5.36;此时,将由原球茎诱导得到的簇状丛芽转接至MS + 1.0 mg·L 6-BA + 1.0 mg·L NAA中,以“芽繁芽”方式增殖,其增殖系数也达到4.28,此时可建立起稳定的增殖体系。(3)无菌苗生根则在MS + 1.0 mg·L NAA + 150 g·L香蕉泥中进行,培养60 d可得到具4~7片真叶、高度为8~10 cm的健壮生根苗,生根率达96.5%;再生苗经露苗后移栽到松树皮和山基土体积比为3∶2的基质中,成活率在85%以上。通过愈伤组织与原球茎-胚性愈伤组织与原球茎-原球茎-丛芽-再生植株途径最终建立了‘黄金小神童’高效、稳定的丛芽快速繁殖体系,该研究结果为进一步开展其人工繁育和遗传转化提供了实验依据,也为兰科其他物种的无性快速繁殖提供了参考。
关键词: ‘黄金小神童’, 胚性愈伤组织, 原球茎, 丛芽, 侧芽茎尖
中图分类号: Q943.1文献标识码: A文章编号: 1000-3142(2022)04-0682-09
Embryogenic callus induction and plant regeneration
of Cymbidium Golden Elf ‘Sundust’
XI Yinkai, YANG Wude
( Chemistry Department, Guizhou University of Traditional Chinese Medicine, Guiyang 550000, China )
Abstract: In order to solve the obstacle of a long artificial breeding cycle and low coefficient of Cymbidium Golden Elf ‘Sundust’, the stem tip of the lateral bud was used as the explant for the initial culture in 1/2MS with 1.0 mg·L NAA, 50 g·L banana puree and 15 g·L sucrose. After 60 d culture, the mixture of callus and protocorm was used as the materials for investigating the effects of different factors and combinations on the embryonic callus and protocorm occurrence, proliferation via L(3) orthogonal and complete combination experiments. Finally, an efficient and stable proliferation system of Cymbidium Golden Elf ‘Sundust’ was established in the present study. The results were as follows: (1) Proliferation coefficient was 8.13 and the protocorm masses similar to mulberry could be obtained on the MS medium containing 2.0 mg·L 6-BA, 150 mL·L coconut juice and 20 g·Lsucrose for 70 d. (2) The protocorm was cultured in MS medium containing 1.0 mg·L6-BA and 1.0 mg·L NAA for 70 d, the protocorm developed into shoots with a 5.36 bud proliferation coefficient; At this time, cluster buds induced from protocorm were transferred into MS medium with 1.0 mg·L 6-BA and 1.0 mg·L NAA to proliferate via the proliferation mode of bud to bud, and the proliferation coefficient reached 4.28, and the stable proliferation system could be established. (3) The rooting rate was up to 96.5% in MS medium equipped with 1.0 mg·L NAA and 150 g·L banana puree, and the healthy seedlings with 4-7 true leaves and a height of 8-10 cm could be obtained after 60 d culture; The survival rate of seedlings was more than 85% when they were transplanted into polyethylene basin with a volume ratio of pine bark to mountain soil of 3∶2. In this study, the efficient and rapid propagation system of cluster bud of Cymbidium Golden Elf ‘Sundust’ was established by the pathway of callus and protocorm to embryonic callus and protocorm to protocorm to cluster bud to regeneration plant, which provides an experimental basis for further artificial breeding and genetic transformation. Meanwhile, this protocol also provides the reference for asexual rapid propagation of other Orchidaceae species.
Key words: Cymbidium Golden Elf ‘Sundust’, embryonic callus, protocorm, cluster bud, the stem tip of the lateral bud
兰科是世界上最庞大的植物科之一,多达20 000~30 000种,大多具有极高观赏价值(Chugh et al., 2009)。‘黄金小神童’(Cymbidium Golden Elf ‘Sundust’) 为小花型品种,叶片尖挺,总状花序,着花十余朵;该品种一年四季均能开花,在珠三角地区多夏秋季开放,可人为控制花期,在花开之季,不仅能看到金光灿灿的花朵,还能闻到阵阵幽香(朱根发和徐晔春,2011;朱根发,2012)。但‘黄金小神童’归属何种存在较大的争议,据文献报道由于其开花物候和性状更接近于建兰(C. ensifolium)的生长特性,故把其归于建兰品种(王济红等,2014);但也有文献报道‘黄金小神童’为10多年前由我国台湾地区虎头兰和四季兰杂交(C. hybridium × C. ensifolium)而得(余洪,2005),因此一些研究者将‘黄金小神童’归于大花蕙兰品种(韩明等,2012;姚婧等,2015)。综合考虑前人的看法,该研究将‘黄金小神童’归为大花蕙兰品种。
大花蕙兰(C. hybridium)因其株型、花型大,花多,花期长且每年春节期间开放,故在中国兰花市场上独领风骚,其又名虎头兰、东亚兰和西姆比兰,为兰科(Orchidaceae)兰属(Cymbidium)多年生草本,是兰属部分附生性种类的杂交种,因与蕙兰(C. faberi)较相似且花朵硕大,故称大花蕙兰(刘园和王四清,2005)。大花蕙兰传统繁殖方式为分株繁殖和种子繁殖。分株繁殖尽管能够保持母本性状,但效率低,增殖倍数只有1~3倍,且周期较长,难以满足工厂化生产的需要(刘园和王四清,2005)。而大花蕙兰种子细小,缺乏胚乳且胚发育不完全,萌发率极低,即使萌發成功,生长速度也非常缓慢,从种子萌发成苗到能进行性状鉴定的开花植株一般需要4~5 a,甚至更久,且无法准确判断其品种特性保持与否(陈箐瑛和蓝贺胜,2004)。现代大花蕙兰繁殖方式多为组织培养,可对优良材料进行快速繁殖,比常规方法快数万到数十万倍,并能克服远缘杂交不亲和以及杂种胚发育不良的问题,不受地区、季节和气候限制(曹孜义和刘国民,2002)。
自Morel(1960)用大花蕙兰的茎尖在含有细胞分裂素的KC培养基上培养,首次获得了兰花无病毒植株后,兰花的组织培养逐渐兴起。目前,我国兰科植物的组培研究主要集中在兜兰属(Paphiopedilum)(龙波和龙春林,2006)、杜鹃兰属(Cremastra)(张明生等,2005)、独蒜兰属(Pleione)(李招文和陈文光,1988)、石斛属(Dendrobium)(吴志刚等,2005)和白及属(Bletilla)(张爱丽等,2018)等。不同学者对兰花组织培养的途径以及影响因素进行了大量研究,利用不同外植体再结合适宜的植物生长调节剂,人为创造适合兰花生长发育的小环境,可以实现不同品种兰花的植株再生,从而达到保护濒危兰花、保持杂交兰种性以及使一部分品种商品化的目的。‘黄金小神童’为杂交种,花色艳丽且气幽香,极具观赏价值,为了推广新品种,达到工厂化生产的目的,很有必要对其进行组织培养研究。因此,该研究以‘黄金小神童’侧芽茎尖为外植体,试图诱导愈伤组织,再诱导具有胚性而直接产生原球茎,进而通过原球茎萌发成苗,最终建立‘黄金小神童’高效、稳定的丛芽快速繁殖体系,为进一步开展其人工繁育和遗传转化提供实验依据,同时也可为兰科其他物种的无性快速繁殖提供参考。
1材料与方法
1.1 材料和消毒
5盆‘黄金小神童’植株由云南春之兰花卉有限公司赠送,植株经云南文山学院丁长春博士鉴定为Cymbidium Golden Elf ‘Sundust’。选取形态健康无病害植株的侧芽茎尖,轻轻刷去表皮污渍后,先用10%的洗衣粉溶液(质量比)浸泡10 min,再用流水冲洗30 min,然后置于超净工作台中,用75%的乙醇(体积比)表面消毒5 min,再用0.1%的HgCl2(质量比)消毒10 min,最后用无菌水漂洗6次,每次不少于3 min。植物生长调节剂6-苄氨基嘌呤(6-BA)、1-萘乙酸(NAA)、蔗糖和琼脂均为分析纯,购自北京鼎国昌盛生物技术有限责任公司;活性炭(AC)购自天津市风船化学试剂科技有限公司;天然附加物椰子和香蕉购自农贸市场。
1.2 方法
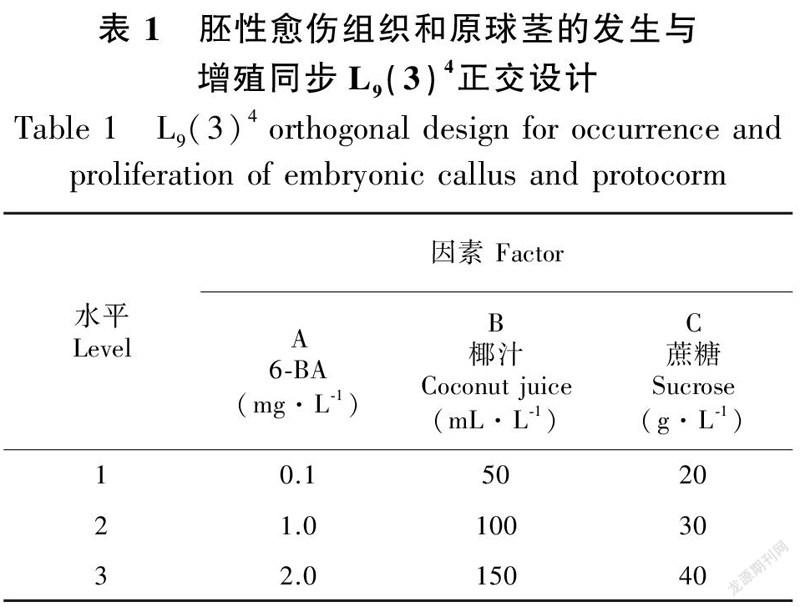
1.2.1 培养基基本培养基为1/2MS和MS,附加琼脂4.7 g·L,蔗糖除起始培养和正交试验培养基外,其他均为30 g·L;pH值5.4~5.8,培养基在122 ℃灭菌25 min备用。(1)起始培养基:根据课题组对兰科的研究经验,采用1/2MS + 1.0 mg·L NAA + 50 g·L香蕉泥+15 g·L蔗糖作为愈伤组织诱导培养基(未发表资料)。(2)胚性愈伤组织和原球茎的发生与增殖同步培养基:MS为基本培养基,添加不同质量和体积浓度的6-BA (0.1、1.0、2.0 mg·L)、椰汁(50、100、150 mL·L)和蔗糖(20、30、40 g·L),采用L(3)正交试验(表1)。培养70 d后,记录各组生长情况并统计增殖系数。(3)丛芽发生培养基:在MS中添加不同质量浓度的6-BA(0.1、1.0、2.0 mg·L)和NAA(0.1、0.5、1.0 mg·L)进行完全组合实验,探究不同激素组合对丛芽发生的影响。70 d后,记录各组生长情况并统计丛芽发生系数与增殖系数。(4)丛芽增殖与复壮培养基:根据上一步丛芽发生的情况,采用与之相同的培养基,以“芽繁芽”方式进行丛芽增殖与复壮培养。培养3代后计算芽的平均增殖系数。(5)生根培养基:在MS中添加不同质量的NAA(0.1、0.5、1.0 mg·L)和香蕉泥(50、100、150 g·L)进行完全组合实验,附加0.5 g·LAC。培养60 d后,记录各组生长情况并统计生根率。
1.2.2 培养条件与接种方法培养条件:培养室温度控制在(22 ± 1)℃,光照强度1 500~2 000 lx,光照时间10 h·d。接种方法:起始培养时将消毒处理好的侧芽茎尖接于培养基中,每瓶1个材料;胚性愈伤组织和原球茎的发生与增殖培养:将愈伤组织和少量原球茎混合物切割为0.5 cm × 0.5 cm大小转接入各正交组中,每组20瓶,每瓶15个材料;丛芽发生培养:将原球茎团块分割成1 cm × 1 cm大小接入完全组合实验组中, 每组20瓶, 每瓶15个材料; 丛芽增殖与复壮培养: 2~4棵幼苗为一丛,剪去叶片的2/3再接入新鲜培养基中,每瓶12丛,共30瓶;生根培养:选取生长健壮的单苗,剪去2/3叶片接入培养基,每组20瓶,每瓶12个材料。以上各实验组均重复3次,如出现污染则重新取材补足各组接种瓶数。
1.2.3 炼苗移栽待生根苗长至8~10 cm,根长2~4 cm时,将生根瓶置于室外适应环境3 d,小心取出生根苗,洗净根部残余的培养基,用质量比为0.1%的多菌灵溶液浸泡5 min,取出晾至根部微微发白,移栽至经高锰酸钾消毒的碎松树皮与山基土(体积比为3∶2)中保温(20~25 ℃)保湿(75%~95%)。60 d后统计成活率以及生长情况。
1.2.4 统计指标所得数据采用Excel软件和SPSS(19.0)软件处理分析。增殖系数=有效转接瓶数/原始接种瓶数;丛芽增殖系数=有效转接瓶数/原始接种瓶数;生根率(%)=(产生不定根的单苗数/接种材料总数)×100;成活率(%)=(成活苗数/移栽总苗数) × 100。
2结果与分析
2.1 起始培养
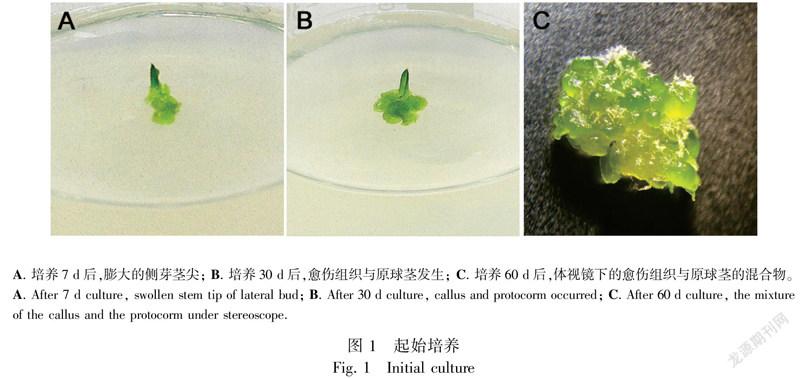
将‘黄金小神童’的侧芽茎尖接种于起始培养基上,7 d后与培养基接触部位开始膨大(图1:A);培养30 d后,可以看到茎尖被愈伤组织与原球茎所包围(图1:B);培养60 d后, 在体视显微镜下可观察到愈伤组织与原球茎的混合培养物(图1:C)。
2.2 胚性愈伤组织和原球茎的发生与增殖同步培养
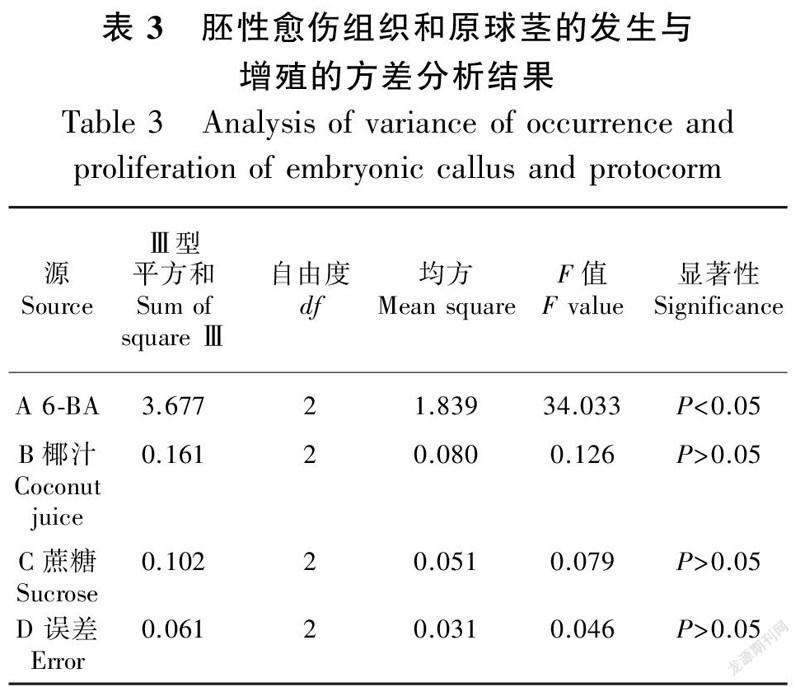
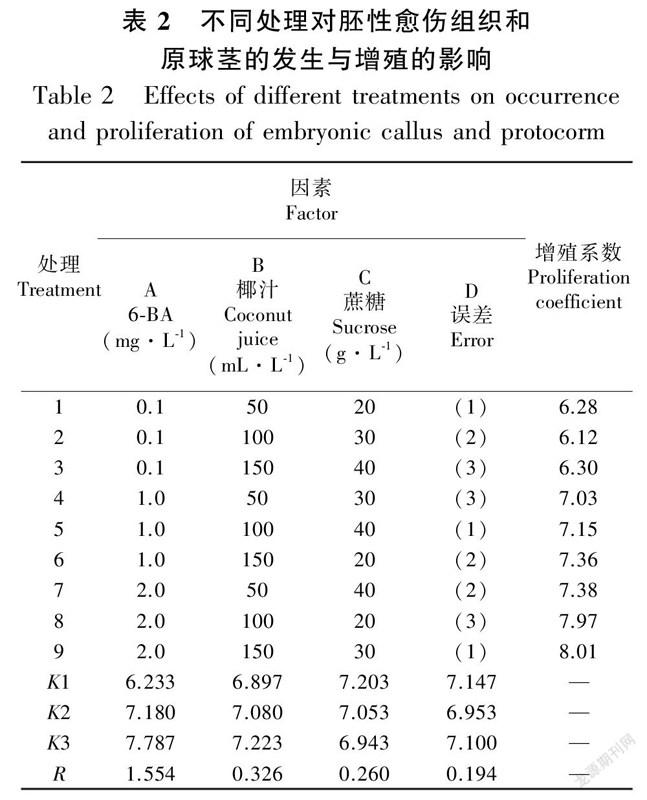
将培养60 d后的愈伤组织和少量原球茎混合物切割为0.5 cm × 0.5 cm大小转接入胚性愈伤组织和原球茎发生与增殖同步培养基中,培养结果见表2、表3与表4。由表2正交试验结果表明,各因数间极差按降序的方式排列为R6-BA (1.554)>R (0.326)>R (0.260)> R (0.194),这3种因素的R值均大于空白列,表明3种因素对胚性愈伤组织和原球茎发生与增殖的效应均是可靠的。由方差分析结果可知(表3),6-BA对胚性愈伤组织和原球茎发生与增殖有统计学意义(P<0.05),椰汁與蔗糖则无统计学意义(P>0.05)。对6-BA的3个水平进行Duncan检验(表4)可知,6-BA的水平3 (2.0 mg·L)对胚性愈伤组织和原球茎发生与增殖的效果较其他两个水平(0.1 mg·L与1.0 mg·L)显著。通过平均值分析,‘黄金小神童’胚性愈伤组织和原球茎的发生与增殖同步培养的最佳培养基为ABC (2.0 mg·L 6-BA + 150 mL·L椰汁+ 20 g·L蔗糖),在此培养基中,培养70 d后增殖系数达到8.13。
在此培养基中,培养15 d后,胚性愈伤组织与原球茎混合物的颜色由嫩绿逐渐转变为深绿(图2:A,B);培养45 d后,肉眼可见其体积逐渐增大,从体视镜下观察到其质地紧密,形成由原球茎组成的桑葚状团块(图2:C);培养70 d后,培养基表面基本被原球茎覆盖(图2:D),此时在进行下一阶段的转接中发现,原球茎下面还存在少量的胚性愈伤组织,为了保证丛芽发生的一致性,在下一阶段转接过程中,只转接表面的原球茎团块,尽量舍弃下面的胚性愈伤组织,故此阶段计算的增殖系数为原球茎增殖系数。
2.3 丛芽发生培养
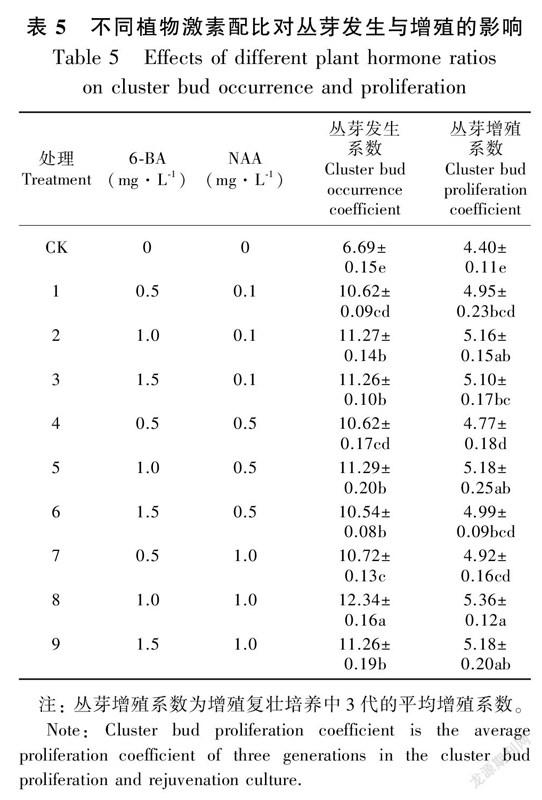
在胚性愈伤组织和原球茎发生与增殖的培养中,仅少数原球茎可以直接发育为幼苗,效果并不理想。因此,将原球茎团块进行丛芽发生培养,培养结果见表5。
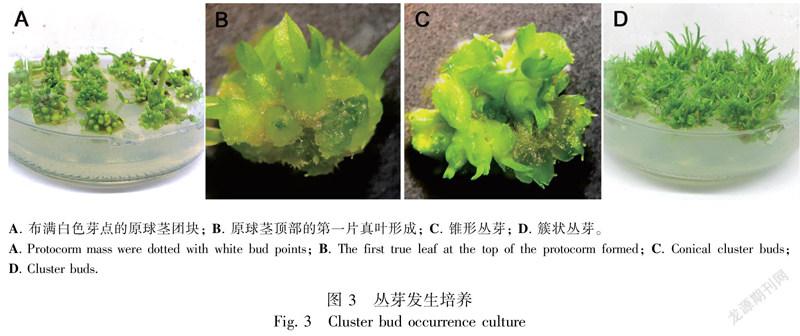
表5完全组合实验结果表明,在NAA浓度一定的情况下,丛芽发生系数和增殖系数与6-BA呈正相关;当6-BA为1.0 mg·L时,达到最大值;当6-BA浓度超过1.5 mg·L时呈负相关。在此阶段的各实验组中,虽然原球茎团块均能发育成幼芽,但丛芽发生系数与增殖系数上存在显著差异。其中,8号的丛芽长势相对较好,丛芽发生系数与增殖系数最高,分别为12.34和5.36;在其他组中,幼芽的生长较慢,且丛芽发生系数与增殖系数均低于8号培养基。因此,最佳的丛芽发生与增殖培养基为8号,即MS + 1.0 mg·L 6-BA + 1.0 mg·L NAA。在此培养基中,将1 cm × 1 cm大小原球茎团块转入8号培养基培养15 d后,原球茎团块表面有白色芽点出现(图3:A);培养25 d后,从体视镜下观察到原球茎顶端第一片真叶形成(图3:B);培养35 d后, 伴随原球茎团块增大的同时在体视镜下观察到锥形丛芽形成(图3:C);培养50 d后原球茎团块增殖速度逐渐减慢,大量丛芽发生(图3:D)。
从‘黄金小神童’的实际情况来看,培养至此阶段,发生的丛芽纤细且瘦弱,若直接进行生根培养,移栽成活率较低。故将生长60 d的幼苗再接入8号培养基中进行复壮培养(图4:A-C),连续培养3代后,不仅可以解决苗纤细、瘦弱、成活率低的问题,而且每代培养均可保持良好的增殖系数。
2.4 生根和移栽
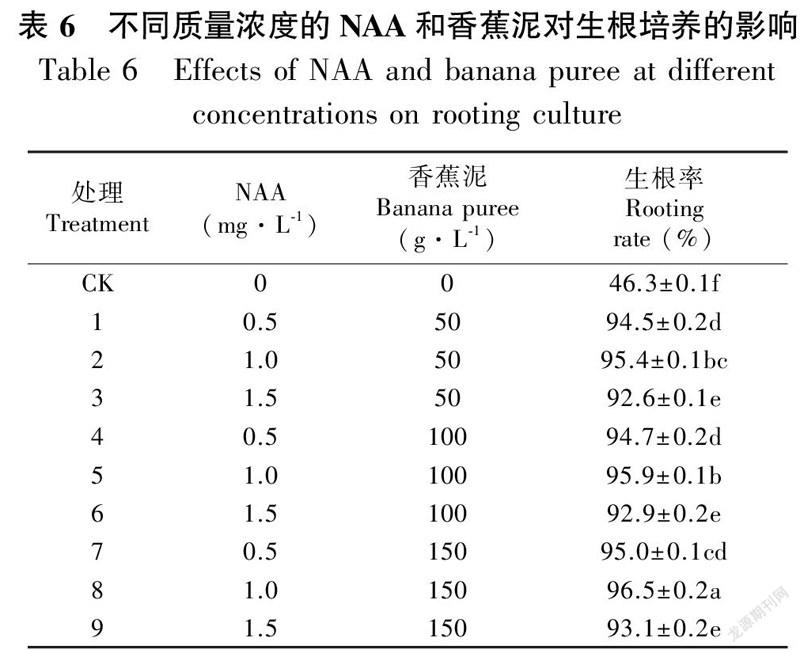
NAA和香蕉泥对‘黄金小神童’生根影响如表6所示,对于‘黄金小神童’生根诱导来说,在0.5和1.5 mg·L NAA时,同一浓度各组间生根率无显著性差异,而随香蕉泥浓度的增大,生根率有所升高;当NAA为1.0 mg·L、香蕉泥为150 g·L时,与其他两组有显著性差异,苗的整体生根率较其他处理组好,因此,本研究认为8号为‘黄金小神童’的最佳生根培养基,培养60 d后生根率达96.5%。单苗转入此培养基15 d后,新芽原基开始出现(图5:A, B);培养30 d后,生根瓶可见白色根尖(图5:C, D);培养45 d后,可以明显看到其茎增粗,根伸長(图5:E, F);培养65 d后根系发达(图5:G),将试管苗炼苗后移栽至消毒的碎松树皮和山基土(3∶2)中(图5:H),60 d后,成活率在85%以上。
3讨论与结论
3.1‘黄金小神童’人工快繁中的增殖途径
兰科植物由于自身的生物学特性,自然繁殖系数极低,利用组织培养技术是获得大量种苗的有效途径(Arditti, 2009)。原球茎的诱导与增殖则是兰科植物人工快繁的关键,也是这一特殊植物类群从有性生殖向无性生殖特征转变的必要步骤(Chen & Chang, 2001)。兰科植物通过原球茎繁殖有3种途径:(1)外植体-原球茎-丛芽-生根;(2)外植体-原球茎-次生原球茎-丛芽-生根;(3)外植体-愈伤组织-原球茎-丛芽-生根(Mahendran & Bai, 2012; Zeng et al., 2013)。在这3种方式中,大多按(1)和(2)形成特有的原球茎、类原球茎或肉质根状茎,极少产生愈伤组织或胚性愈伤组织(陈继敏等,2008;丁兰等,2014)。Sajise & Sagawa(1991)报道了蝴蝶兰胚性愈伤组织的形成,但没有详细描述愈伤组织诱导的方法。此外,Kobayashi等(1993)利用愈伤组织作为原生质体的来源,成功地从兰科植物原生质体中获得植株再生,但关于愈伤组织形成的详细信息尚不清楚。而‘黄金小神童’侧芽茎尖一旦诱导出愈伤组织,随即出现原球茎,愈伤组织增殖并不十分明显。随着原球茎的增殖,其结构上的两极性逐渐显现,顶端形成的叶原基处分化形成芽,基部拟根状结构发育为根,最后形成幼苗;由于原球茎数量较多,培养物在形态上呈现出丛芽的状态,这可能是因为培养基的不同所致,从这一现象来看, ‘黄金小神童’原球茎繁殖介于上述(2)和(3)之间。在兜兰 (Paphiopedilum maudiae) 中也有过类似现象的报道(周慧君, 2016)。‘黄金小神童’原球茎发育为幼苗后,其基部愈伤组织和原球茎混合物的生长明显受到抑制,推测为自身产生的生长素与外源激素产生拮抗作用,导致愈伤组织增殖受阻,而转变为以“芽繁芽”即形成丛生芽的方式来进行增殖。本研究结果表明,在‘黄金小神童’人工快繁早期,应以愈伤组织和原球茎混合物为主要增殖对象,该混合物亦是人工快繁和遗传转化的最佳材料;原球茎大量发育为幼苗时,则以“芽繁芽”方式为主,因此可以达到最有效的增殖目的。
3.2 外源性因素对‘黄金小神童’体外快繁的影响
外源激素种类及浓度在‘黄金小神童’体外快繁中起着重要作用。在胚性愈伤组织和原球茎发生与增殖过程中,6-BA起主要作用,对胚性愈伤组织和原球茎发生与增殖具有促进作用;在丛芽发生与增殖复壮过程中,6-BA单独使用效果明显优于空白对照,而远不如与NAA组合使用的效果。推测‘黄金小神童’在上述培养过程中强烈依赖于6-BA,而NAA对6-BA则有明显的协同作用,NAA和6-BA这种需求的差异可能反映了植物生长时内源性物质含量的差异。王育选等(2016)研究了不同激素与NAA的组合,最后认为6-BA与NAA组合,可实现大花蕙兰丛芽的高效增殖。Rodrigues等(2015)证明了生长素与细胞分裂素的比值对桑葚胚的体外繁殖有一定影响,在不添加或添加NAA的情况下,培养基中只要存在6-BA,都可促使桑葚胚发育成芽。而在‘黄金小神童’的预生根培养实验中,本课题组曾添加较低浓度的6-BA与NAA组合使用,结果显示试管苗发育的根长度较短甚至出现生根困难现象,导致移栽苗很难成活,推测可能是由于在胚性愈伤组织和原球茎发生、增殖与丛芽发生与增殖过程中,长时间培养于存在6-BA的培养基中,导致大量细胞分裂素积累,与外源6-BA产生拮抗作用。因此,在‘黄金小神童’的生根培养中,由于其具较高水平内源性细胞分裂素,所以单独使用外源生长素即可获得较好的生根效果。这与低浓度的NAA有利于大花蕙兰生根的观点一致(胡琳,2013)。
此外,糖类和AC在‘黄金小神童’体外快繁中也具有不可忽视的作用。据现有报道,有些植物在启动培养中,通过调节蔗糖代谢酶可以提高产量(Kaur et al., 2005)。该实验蔗糖的加入可能打破胚性愈伤组织与原球茎发生过程中各种糖类代谢的平衡,从而促进了胚性愈伤组织与原球茎的发生与增殖。在生根培养中,还加入了AC,AC有较强的吸附作用,可吸附培养基中的酚、醌等有害物质;根茎具有避光生长的特性,使用AC可创造根系生长所需的环境;此外,AC的存在可能提高了培养物体内可溶性蛋白和总糖的含量,从而促进根的发育(孙占育等,2010)。
3.3 天然附加产物在‘黄金小神童’体外快繁中的作用
近几十年来,在植物组织培养中经常加入天然附加产物,它们大多含有糖、氨基酸、酶、植物激素、维生素等物质,对细胞和组织的增殖有明显的促进作用。在兰科植物的人工快繁中,不同天然附加产物对诱导、增殖和分化、生根和壮苗等不同培养阶段有十分积极的作用(Arditti, 2009)。Arditti(1966)研究了不同天然附加产物对兰科植物生长情况的影响,表明椰子汁、香蕉泥、芋头泥等对培养物具有明显的促进作用。在‘黄金小神童’胚性愈伤组织与原球茎发生、增殖实验中发现,椰子汁对胚性愈伤组织与原球茎发生、增殖具有积极影响。有研究表明,椰子汁中含有激动素、GA3以及其他一些物质(Ge et al., 2005, 2007, 2008)。激动素作为细胞分裂素的一种,能促进细胞分化、分裂和生长;GA3主要用于促进植物的生长发育,提早成熟,打破休眠,促进萌发。目前椰子汁中的这些物质对于胚性愈伤组织和原球茎的发生与增殖的机制尚不明确。本研究推测椰子汁中的这些物质可能相互作用,从而促进胚性愈伤组织和原球茎的发生与增殖,或者其中的某些成分与6-BA和蔗糖存在某种协同作用,促进‘黄金小神童’这一过程的发生。而香蕉泥富含有机物,营养丰富,可使幼苗在适宜的弱酸性条件下生长,加速根的形成,从而进一步加快植株对营养物质的吸收,促进幼苗的生长,进而达到生根的目的(曾小龙,1998)。从本实验结果来看,香蕉泥在‘黄金小神童’的生根培养中亦具明显的促进作用。
参考文献:
ARDITTI J, 1966. The effect of tomato juice and its fractions on the germination of orchid seeds and on seeding growth [J]. Amer Ordhid Soc Bull, 35(20): 175-182.
ARDITTI J, 2009. Micropropagation of orchids [M]. 2nd ed. Oxford: Blackwell Publishing: 52-55.
CAO ZY, LIU GM, 2002. Textbook practical techniques on plant tissue culture [M]. Lanzhou: Gansu Science and Technology Press: 530. [曹孜义, 刘国民, 2002. 实用植物组织培养技术教程 [M]. 兰州: 甘肃科学技术出版社: 530.]
CHEN JM, GAO C, YANG ZM, et al., 2008. Explanation of the concepts of protocorm and somatic embryo in tissue culture of Orchidaceae plants [J]. Bull Agric Sci Technol, 36(10): 169-170. [陈继敏, 高铤, 杨镇明, 等, 2008. 兰科植物组织培养中原球茎与体胚概念的辨释 [J]. 农业科技通讯, 36(10): 169-170.]
CHEN JT, CHANG WC, 2001. Effect of auxins and cytokinins on direct somatic embryogeresis on leaf explants of Oncidium “Grower Ramsey” [J]. J Plant Growth Regul, 34(2): 229-232.
CHEN QY, LAN HS, 2004. Tissue culture and rapid propagation of orchids [M]. Beijing: China Agricultural Press: 82-84. [陈箐瑛, 蓝贺胜, 2004. 兰花组织培养与快速繁殖技术 [M]. 北京: 中国农业出版社: 82-84.]
CHUGH S, GUHA S, RAO IU, 2009. Micropropagation of orchids: a review on the potential of different explants [J]. Sci Hortic, 122(4): 507-520.
DING L, ZHANG L, GUO L, et al., 2014.Asymbiotic seed germination and rapid seedling regeneration of endangered Gymnadenia conopsea (L.) R. Br. [J]. Plant Physiol J, 50(1): 77-82. [丁兰, 张丽, 郭柳, 等, 2014. 濒危植物佛手参种子的非共生萌发及种苗的快速繁殖 [J]. 植物生理学报, 50(1): 77-82.]
GE L, YONG JWH, TAN SN, et al., 2008. Analyses of gibberellins in coconut (Cocos nucifera L.) water by partial filling-micellar electrokinetic chromatography-mass spectrometry with reversal of electroosmotic flow [J]. Electrophor, 29(10): 2126-2134.
GE L, PEH CYC, YONG JWH, et al., 2007. Analyses of gibberellins by capillary electrophoresis-mass spectrometry combined with solid-phase extraction [J]. J Chromatogr A, 1159(1/2): 242-249.
GE L, YONG JWH, GOH NK, et al., 2005. Identification of kinetin and kinetin riboside in coconut (Cocos nucifera L.) water using a combined approach of liquid chromatography-tandem mass spectrometry, high performance liquid chromatography and capillary electrophoresis [J]. J Chromatogr B, 829(1/2): 26-34.
HAN M, LI YP, PAN XF, 2012. In vitro propagation of Cymbidium via clustered shoot [J]. J Trop Org, 3(3): 261-266. [韓明, 李晏萍, 潘学峰, 2012. 利用丛生芽增殖途径对大花蕙兰进行离体快繁 [J]. 热带生物学报, 3(3): 261-266.]
HU L, 2013. Effect of different factors on seedlings and rooting of Cymbidium hybridum [J]. N Hortic, 17(10): 114-117. [胡琳, 2013. 不同因素对大花蕙兰壮苗生根的影响 [J]. 北方园艺, 17(10): 114-117.]
KAUR S, GUPTA AK, KAUR N, 2005. Seed priming increases crop yield possibly by modulating enzymes of sucrose metabolism in chickpea [J]. J Agron Crop Sci, 191(2): 81-87.
KOBAYASHI S, KAMEYA T, ICHIHASHI S, 1993. Plant regeneration from protoplasts derived from callus of Phalaenopsis [J]. Plant Tiss Cult Lett, 10(3): 267-270.
LIU Y, WANG SQ, 2005. Advances of Cymbidium hybridum [J]. Acta Hortic Sin, 32(4): 748-752. [刘园, 王四清, 2005. 大花蕙兰(Cymbidium hybridum)的研究动向 [J]. 园艺学报, 32(4): 748-752.]
LI ZW, CHEN WG, 1988. A preliminary study on the resources and tissue culture of Pleione [J]. Fujian Fruits, 4(8): 35-38. [李招文, 陈文光, 1988. 独蒜兰属的资源和它的组织培养初探 [J]. 福建果树, 4(8): 35-38.]
LONG B, LONG CL, 2006. Amazing Paphiopedilum and its research stats [J]. Chin J Nat, 28(6): 341-344. [龙波, 龙春林, 2006. 兜兰属植物及其研究现状 [J]. 自然杂志, 28(6): 341-344.]
MAHENDRAN G, BAI VN, 2012. Direct somatic embryogenesis and plant regeneration from seed derived protocorms of Cymbidium bicolor Lindl [J]. Sci Hortic, 135(24): 40-44.
MOREL G, 1960. Producing virus-free Cymbidium [J]. Am Orchid Soc Bull, 29(7): 495-497.
RODRIGUES LA, PAIVA NV, BOARETTO AG, et al., 2015. In vitro propagation of Cyrtopodium saintlegerianum rchb. f. (Orchidaceae), a native orchid of the Brazilian savannah [J]. Crop Breed Appl Biotechnol, 15(1): 10-17.
SAJISE JU, SAGAWA Y, 1991. Regeneration of plantlets from callus and protoplasts of Phalaenopsis sp. [J]. Malays Orchid Bull, 5(4): 23-28.
SUN ZY, SUN ZQ, CAO B, 2010. Effect of activated charcoal in rooting process of plant tissue culture [J]. Hunan Agric Sci, 39(7): 3-5. [孙占育, 孙志强, 曹斌, 2010. 活性炭在促进组培苗植物生根中的作用 [J]. 湖南农业科学, 39(7): 3-5.]
WANG JH, LIU Y, QI X, et al., 2014. Optimization of integrated technology for tissue culture of Cymbidium Golden elf Sundust [J]. SW Chin J Agric Sci, 27(5): 2135-2140. [王濟红, 刘燕, 祁翔, 等, 2014. 建兰新品种‘黄金小神童’组培育苗集成技术的优化 [J]. 西南农业学报, 27(5): 2135-2140.]
WANG YX, REN JH, WANG PL, et al., 2016. Effect of phytohormone on the proliferation and growth of clustered shoots in Cymbidium hybridium [J]. J Shanxi Agric Univ (Nat Sci Ed), 36(9): 628-632. [王育选, 任建宏, 王鹏丽, 等, 2016. 植物激素对大花蕙兰丛生芽增殖与生长的影响 [J]. 山西农业大学学报(自然科学版), 36(9): 628-632.]
WU ZG, LIU XW, ZHANG SW, 2005. Progress in tissue culture of Dendrobium [J]. Res Inf Trad Chin Med, 7(11): 23-25. [吴志刚, 刘贤旺, 张寿文, 2005. 石斛属植物组织培养研究进展 [J]. 中药研究与信息, 7(11): 23-25.]
YAO J, QIN BX, LIU F, et al., 2015. Ornamental evaluation of Cymbidium dayanum × Cymbidium‘Golden Elf’ [J]. Chin J Trop Crops, 36(7): 1201-1206. [姚婧, 覃宝祥, 刘帆, 等, 2015. 冬凤兰与‘黄金小神童’大花蕙兰杂交后代的观赏性评价 [J]. 热带作物学报, 36(7): 1201-1206.]
YU H, 2005. Cymbidium Golden Elf ‘Sundust’ [J]. Zhongguo Huahui Penjing, 12(2): 12-13. [余洪, 2005. 黄金小神童 [J]. 中国花卉盆景, 12(2): 12-13.]
ZENG SJ, WANG J, WU KL, et al., 2013. In vitro propagation of Paphiopedilum hangianum Perner & Gruss [J]. Sci Hortic, 151(28): 147-156.
ZENG XL, 1998. Effects of different mediums on the differentiation of protocorm-like body of Cymbidium [J]. Guangdong Agric Sci, 48(5): 21-22. [曾小龙, 1998. 不同培养基对虎头兰类原球茎器官分化的影响 [J]. 广东农业科学, 48(5): 21-22.]
ZHANG AL, WANG YZ, HUANG HY, et al., 2018. The study of effective proliferative protocol in artificial propagation of Bletilla striata test-tube [J]. J Chin Med Mat, 41(2): 275-280. [张爱丽, 王元忠, 黄衡宇, 等, 2018. 白及人工快繁中有效增殖途径的研究 [J]. 中药材, 41(2): 275-280.]
ZHANG MS, QI JL, LIU Z, et al., 2005. Tissue culture and rapid propagation of Rhododendron officinalis, medicinal orchid [J]. Seed, 24(8): 82. [张明生, 戚金亮, 刘志, 等, 2005. 药用兰科植物杜鹃兰的组织培养与快速繁殖 [J]. 种子, 24(8): 82.]
ZHOU HJ, 2016. Study on the tissue culture of Paphiopedilum Maudiae type [D]. Guangzhou: South China Agricultural University. [周慧君, 2016. 魔帝类兜兰的组织培养研究(D). 广州: 华南农业大学.]
ZHU GF, 2012.Huahui miaomu zaipei shiyong jineng [M]. Guangzhou: Sun Yat-Sen University Press: 46-47. [朱根发, 2012. 花卉苗木栽培实用技能 [M]. 广州: 中山大学出版社: 46-47.]
ZHU GF, XU YC, 2011. The encyclopedia of orchid [M]. Changchun: Jilin Science and Technology Press: 60. [朱根發, 徐晔春, 2011. 名品兰花鉴赏金典 [M]. 长春: 吉林科学技术出版社: 60.]
(责任编辑周翠鸣)

