菠萝离体再生研究进展
孙婧朗,周慧晶,郑珂媛,戴锡玲,朱木兰*
(1. 中国科学院分子植物科学卓越创新中心,上海 200032;2. 上海辰山植物园 / 中国科学院上海辰山植物科学研究中心 / 上海市资源植物功能基因组学重点实验室,上海 201602;3. 上海师范大学生命科学学院,上海 200234)
菠萝(Ananas comosus)又名黄梨、凤梨,原产于美洲热带地区,是热带亚热带四大名果之一,世界范围内约有90个国家种植,中国菠萝年产量居全球第六位,其中84%以上的菠萝种植面积集中在广东及海南两省[1—2]。菠萝维生素种类较多[3—5],药用价值高,菠萝汁可改善肥胖及相关心血管功能障碍等疾病[6—7]。因而菠萝新品种培育和优质种苗繁育备受关注。但菠萝为异花授粉植物,存在花期不同步、杂交种子获取困难[8]、萌发率低[9]、品种较单一[10]、基因丰余度高[11]、种质稳定性差[12—13]等问题,遗传保守性种苗规模化繁育体系亦有待建立。组织培养技术可以快速量化繁育菠萝芽苗,加速菠萝育种进程[14—15]。因此,菠萝高效离体再生技术体系研究十分重要。
本文对近年来菠萝离体再生研究进行总结,包括外植体选择、外植体消毒、基本培养基确定、直接不定芽发生、间接不定芽发生、体细胞胚胎发生、不定根诱导及炼苗移栽等七个方面,并展望未来研究方向,以期为完善菠萝繁育体系及菠萝种质资源的创新提供参考。
1 外植体选择
外植体直接影响植物离体再生频率,进而影响遗传转化及基因编辑效率,富含干细胞的外植体再生频率相对较高。菠萝离体再生通常选用芽、幼叶和茎段等组织器官作为外植体,不同外植体再生频率差异显著。郑加协等[16]选取蜜宝菠萝的冠芽、裔芽、吸芽和块茎芽开展不定芽诱导频率研究,结果表明,冠芽再生诱导率最高(达 37.5%),裔芽、吸芽、块茎芽相对较差,且诱导率裔芽>吸芽>块茎芽。李霞等[17]以茎段、茎薄片、叶鞘、叶片等为外植体,开展不定芽诱导速度研究,茎薄片不定芽诱导时间最短,仅需20~30 d,茎段需35 d,叶鞘需60 d以上,叶片未见不定芽。许早时等[18]以杂交品种粉菠萝的冠芽、幼叶为外植体进行不定芽遗传稳定性诱导研究,得到与实生苗基因型、表型一致的再生植株。因此,从诱导时间上来看,茎薄片的直接不定芽诱导所需时间最短;从再生频率上来看,芽的诱导率最高,茎、叶其次;叶片是高度分化的组织器官,需经由脱分化、再分化等环节,再生过程相对复杂,不定芽诱导难度高。
2 外植体消毒
无菌材料的获得是离体再生体系建立的第一步,消毒处理至关重要。就菠萝消毒而言,消毒剂一般选用氯化汞(HgCl2)[19]。许燕[20]使用酒精、0.1% HgCl2溶液及数滴吐温对巴厘、神湾等菠萝品种的冠芽、吸芽消毒,结果表明,75%酒精消毒90 s,0.1% HgCl2溶液10 min(加数滴吐温)消毒效果最佳,污染率可降至33.3%,不定芽诱导率可达46.7%。杨冬业等[21]同样发现 0.1% HgCl2溶液10 min(加数滴吐温)对茎段消毒效果最理想,污染率为60%,成活率达53.3%。少数研究采用其他消毒方法,如Al-Saif等[22]用 20% NaClO溶液消毒 25 min;Sripaoraya等[23]用20% domestos漂白剂消毒40 min后,10% domestos漂白剂消毒10 min,均可获得无菌材料。作为重金属盐类,HgCl2对细菌真菌的杀菌性极强,Hg2+可与蛋白结合,使蛋白变性失活[24]。可见,对于菠萝不同品种、不同外植体而言,消毒步骤基本相同,即首先用洗洁精和自来水将外植体表面清洗干净,75%酒精 30~120 s,0.1% HgCl2溶液 8~12 min(数滴吐温),无菌水冲洗。HgCl2消毒能力最强,NaClO次之,其他市售漂白剂更弱。因此,采用适当的消毒方案,可将菠萝外植体污染率降至较低水平,同时保持良好的材料活力。
3 基本培养基及培养方法
培养基是植物高效离体再生的根本,不同基本培养基下,菠萝离体培养组织生长情况差异较大。Atawia等[25]以 MS、B5、WPM 及相应的减少量培养基(1/4、1/2、3/4的 MS、B5、WPM)为基本培养基开展了菠萝生长势研究,发现正常盐浓度的 MS培养基中菠萝生长最佳。MS培养基中加入维生素可有效促进试管苗出芽分化[26]。Fichet[27]采用 MT培养基诱导愈伤分化,MT培养基中维生素和硝酸钾浓度较高,有利于愈伤出芽。Kiss等[28]发现,N6培养基可使黄化的嫩枝变绿。菠萝离体再生的最适基本培养基为 MS,可能因为菠萝属草本植物,器官生长发育快,营养供给需求高,对钾和氮的需求量相对多,而MS培养基的硝酸钾和硝酸铵等氮素营养成分含量较多,能保证菠萝组织生长所需。
培养方法对再生效率也有所影响。一些研究表明,MS液体培养基优于MS固体培养基。沈清景[29]研究剥粒菠萝快繁技术时,发现液体培养基和半固体培养基诱导芽苗的增殖倍数是固体培养基的 2倍。郑加协等[16]发现,液体振动培养最利于芽苗吸收养分,芽的增殖倍数最高,液体浅层静止培养其次,固体培养最低。洪燕萍等增殖培养基采用固体培养基和液体培养基转换的方式,发现固体培养基培养后转入液体培养基增殖倍数最高[30]。培养基均添加蔗糖 20~40 g·L-1,琼脂粉 5~8 g·L-1,调节培养基 pH为 5.6~6.0。培养条件均为 20~25 ℃,光照强度2000~3000 lx,光照时间12 h·d-1[31]。可见,对于诱导菠萝芽苗再生,液体培养基增殖倍数更高,优于固体培养基。液体培养基营养物质分布均匀,既可增大培养基与植物材料的接触面积,又有利于溶解植物体的有害代谢产物。长时间的固体培养,易使菠萝自身代谢产物增多,最终导致芽苗黄化死亡。
4 直接不定芽发生
直接不定芽发生,即组织器官在植物激素的作用下不经愈伤组织诱导阶段或进程,直接产生不定芽的离体再生途径。该途径历时周期短,不定芽遗传保守性强。
4.1 直接不定芽诱导
菠萝直接不定芽诱导培养基大多以MS为基本培养基,添加生长素和细胞分裂素作为生长调节剂。生长素可调节植物生长发育,加快代谢,提高抗逆能力。细胞分裂素促进细胞分裂,是腋芽生长最直接有效的激活剂[32]。生长调节剂主要有6-BA、NAA、2,4-D、ZT,其中ZT可用于预防菠萝常见病害——水心病[33],高水平的ZT有利于菠萝花器官形成[34]。研究发现,培养基 MS + 27 μmol·L-1NAA +1 μmol·L-16-BA 诱 导 卡 因 类 菠 萝 以 及 MS +5.0 mg·L-16-BA诱导‘Maspine’菠萝时,不定芽诱导率最高,可达 86%[35—36]。可见,6-BA 是刺激菠萝直接不定芽产生最有效的细胞分裂素,选用1.0~5.0 mg·L-16-BA 和 0.1~1.0 mg·L-1NAA 组合使用,可显著增加不定芽的诱导率(表1)。
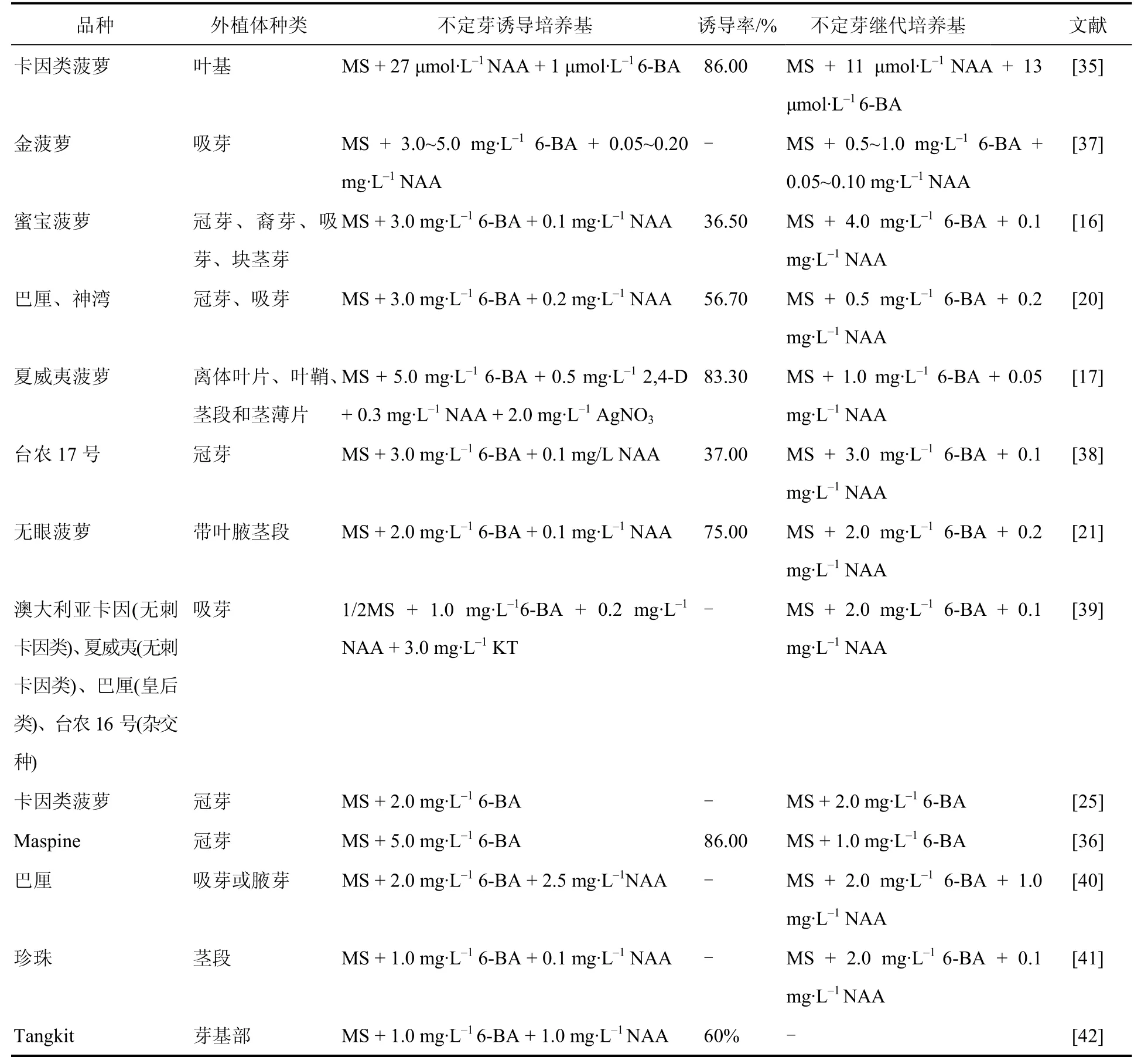
表1 不同菠萝品种、外植体的不定芽诱导和继代培养基Table 1 Adventitious bud induction and subculture media of different pineapple varieties and explants
4.2 直接不定芽继代
菠萝直接不定芽继代培养主要是以MS为基本培养基,6-BA和NAA组合有利于芽的分化,合适的浓度配比可使芽的生长状态达到最佳(表1)。
因此,菠萝直接不定芽发生体系较成熟,采用的菠萝品种丰富,外植体种类多样,诱导率高,直接不定芽发生所需时间短于间接不定芽发生和体胚发生途径,遗传稳定性更高。
5 间接不定芽发生
间接不定芽发生途径是菠萝组织培养的重要途径之一,即外植体经由愈伤组织诱导分化出不定芽,继而形成完整植株。
5.1 愈伤组织诱导
愈伤诱导是间接不定芽发生的关键步骤,愈伤诱导率直接影响植株的再生效率。菠萝愈伤组织诱导大多以MS为基本培养基,少数以N6为基本培养基,添加6-BA和NAA或是6-BA和2,4-D生长调节剂组合,少数添加 IBA、TDZ。林文秋等[40]采用菠萝叶基为外植体,用 MS + 3 mg·L-16-BA +2 mg·L-1NAA进行愈伤诱导,出愈率最高可达60%。因此,较高浓度的细胞分裂素与生长素组合有利于愈伤诱导(表2)。
5.2 愈伤组织分化与芽苗伸长
菠萝愈伤组织分化以 MS基本培养基添加生长调节剂6-BA和NAA为主,少数添加2,4-D和IBA。Sripaoraya 等[23]用 MS + 2.0 mg·L-16-BA +0.5 mg·L-12,4-D诱导愈伤分化不定芽,不定芽分化率高达83.30%。此外,6-BA和IBA同时使用可提高菠萝扦插枝条的成活和发芽率[43]。可见,高浓度细胞分裂素配合低浓度生长素有助于愈伤分化(表 2)。
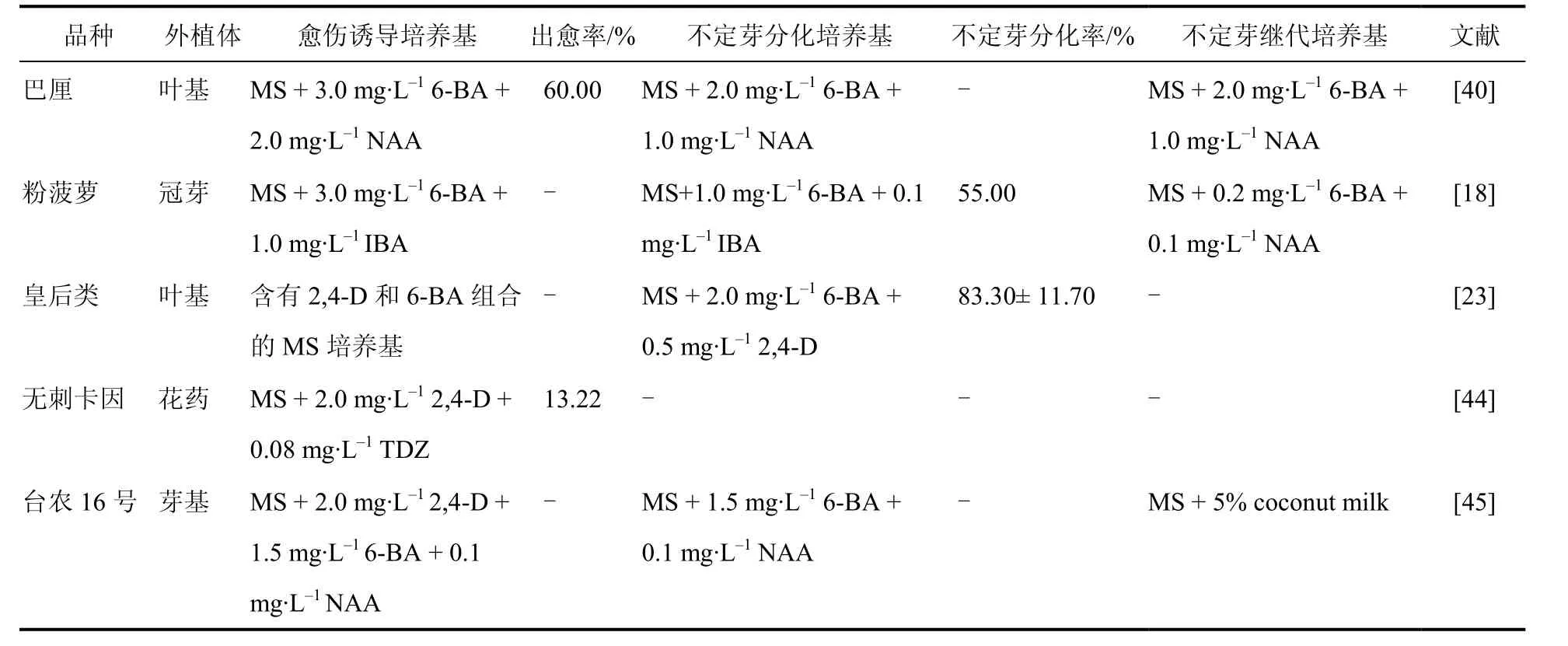
表2 不同菠萝品种、外植体的愈伤组织诱导培养基Table 2 Callus induction medium of different pineapple varieties and explants
6 体细胞胚胎发生
体细胞胚胎发生途径简称体胚发生,即植物细胞通过脱分化诱导成体细胞胚,再发育成完整植株的过程。体细胞胚胎发生途径较其他组织器官发生途径而言,遗传相对稳定,是较为理想的再生途径。一般采用愈伤组织诱导体细胞胚胎发生,从体细胞向胚胎细胞的转变是体胚发生的核心,是限制植物再生效率的关键步骤[46]。
来源于菠萝愈伤组织的体细胞胚胎发生位于愈伤组织内部和表层。Ma等[47]在2,4-D体细胞诱导实验中,发现少数薄壁细胞可以转化为感受态细胞,感受态细胞通过原胚突起、原胚和早期球状胚形成球状胚胎,从而完成再生过程。何业华等[48]取叶基愈伤组织细胞用 MS + 0.01 mg·L-1TDZ + 5 mg·L-12,4-D培养基诱导体细胞胚,诱导率高达97%,但这种体细胞胚很难继续增殖、萌发。而后对从非胚性细胞至球状胚的形成进行了组织细胞学观察和探讨,以提高体胚发生率[49]。Sripaoraya等[23]用MS +3 mg·L-1picloram诱导体胚,发生率达58%;Soneji等[50]用 MS + 41 μmol·L-1picloram + 9 μmol·L-1TDZ诱导体胚,诱导率 55%;Yapo等[51]用 MSB(含 B5维生素的MS盐) + 3 mg·L-1picloram诱导,胚性愈伤组织诱导频率最高仅为 37.6%。梁雪莲等[52]发现通过培养薄细胞层切片的方法,可不经过愈伤阶段,直接诱导体胚形成,获得再生植株,有效地避免嵌合体的形成;Rao等[53]还对杂交胚进行间接分化诱导,获得了完整植株;Firoozabady等[54]通过体胚再生途径对菠萝遗传转化进行研究,获得了抗病抗虫转基因菠萝。
可见,菠萝体细胞胚胎诱导采用 MS +0.01 mg·L-1TDZ + 5 mg·L-12,4-D 配方效果较好,但体胚不萌发,体系有待进一步优化、完善。
7 生根培养与炼苗移栽
7.1 不定根诱导
不定根是吸收外界水和营养的主要器官。大多数生根诱导以MS和1/2MS基本培养基为主,添加生长调节剂主要是IBA,生根率可达90%~100%(表3)。

表3 不同菠萝品种、外植体的生根诱导培养基Table 3 Rooting induction medium of different pineapple varieties and different explants
生长素对根系发育的作用主要表现在调控不定根的发生和生长[55]。Jie等[56]认为,当培养基中存在生长素时,组织培养中就会有根形成,推测可能与生长素参与细胞间期、分裂和分化的调控有关。郑加协等[16]发现,MS 培养基加入NAA 0.5 mg·L-1,IBA 1.0~5.0 mg·L-1时,培养30 d后生根率皆为100%。其中IBA浓度为3 mg·L-1时,根最粗壮。他提出用食用白糖和自来水代替化学纯蔗糖和蒸馏水诱导生根,诱导生根效果无明显差异,为简化培养、降低成本提供新思路。
7.2 炼苗与移栽
试管苗的炼苗与移栽是组织培养成功的关键,影响菠萝组培技术在实际生产中大规模应用的主要问题在于组培苗移栽成功率低。以往研究中,采用合适的炼苗移栽方法,成活率可达90%及以上。
许燕[20]在菠萝根生长至约3~4 cm时,为使菠萝苗适应空气湿度、温度等外界条件,共进行炼苗5~6 d,放入1000倍的多菌灵溶液中,浸泡2 h左右。选择椰糠:河砂:表土的比例为5:3:2的移栽基质,30 d后统计移栽成活率高达99.3%以上。杨冬业等[21]采用泥炭:椰糠:珍珠岩:黄泥为 4:1:1:2的营养土比例,移栽成活率可达90%以上。
8 结语
国内外开展了许多菠萝离体再生体系技术的探索,主要集中于直接不定芽发生途径、间接不定芽发生途径、体细胞胚胎发生途径等。相对而言,菠萝直接不定芽再生途径研究较多,再生体系较完善;间接不定芽发生遗传稳定性较差,可能因为诱导愈伤过程中 DNA甲基化容易导致体细胞克隆变异[57—58]的缘故。体细胞胚胎发生途径的研究相对较少,再生体系很不成熟。
菠萝离体再生研究的困难在于不同品种植株离体再生体系的差异性较大,再生体系适用范围小,可尝试不同种类基本培养基与激素配比,建立普适性再生体系;再生植株同源性较高[59],离体再生技术与外源基因转化整合研究较少,应着重创建抗旱性、耐寒性等抗逆性强的新品种,从而实现热带植物北移,扩大菠萝的适生范围。
本文对国内外菠萝离体再生体系的研究现状进行了综述,讨论了目前菠萝离体再生存在的问题,以期为菠萝的遗传转化和基因编辑提供技术参考。

