母胎界面的蛋白质泛素化修饰及其与病理妊娠相关性的研究进展
蒋寒宇,顾文文,王健,2
(1.复旦大学药学院,上海 201203;2.上海市生物医药技术研究院,上海 200032)
泛素是一种由76个氨基酸残基组成的蛋白质,具有紧凑的β-折叠结构和松散的羧基端尾部,最重要的特征是位于其氨基端的甲硫氨酸残基和7个赖氨酸残基(K6、K11、K27、K29、K33、K48和K63),这些氨基酸残基均可在不同泛素分子间进行连接,从而行使功能。泛素化过程由泛素激活酶E1、泛素结合酶E2和泛素连接酶E3组成的三级酶联反应催化完成。首先,泛素激活酶E1通过其自身活性位点上的半胱氨酸残基与泛素羧基端甘氨酸残基以硫酯键结合;之后,与泛素连接的泛素激活酶E1可招募泛素结合酶E2,并经泛素结合酶E2催化后,泛素由泛素激活酶E1转移到泛素结合酶E2的半胱氨酸残基上,同样以硫酯键结合;再后,在具有蛋白质识别功能的泛素连接酶E3催化下,结合了泛素结合酶E2的泛素甘氨酸残基与靶蛋白的赖氨酸残基以异肽键共价连接,靶蛋白被泛素化修饰。泛素、泛素激活酶E1、泛素结合酶E2、泛素连接酶E3、26S蛋白酶体和去泛素化酶,共同构成了真核细胞内泛素-蛋白酶体系统(UPS)的主体[1-2]。泛素化作为一种重要的蛋白质翻译后修饰方式,可通过影响细胞内蛋白水平或活性而广泛参与细胞功能的调控(图1)。UPS在妊娠建立和维持过程涉及母胎界面胚胎滋养层细胞、蜕膜基质细胞、蜕膜免疫细胞的增殖、凋亡、迁移、侵袭、分化等生理活动中,以及分泌和吞噬等功能的精细调控过程中都发挥着重要的作用。以下就蛋白质泛素化修饰在母胎界面的调控作用及其与病理妊娠的相关性进行综述,以期为生殖基础医学研究提供参考。
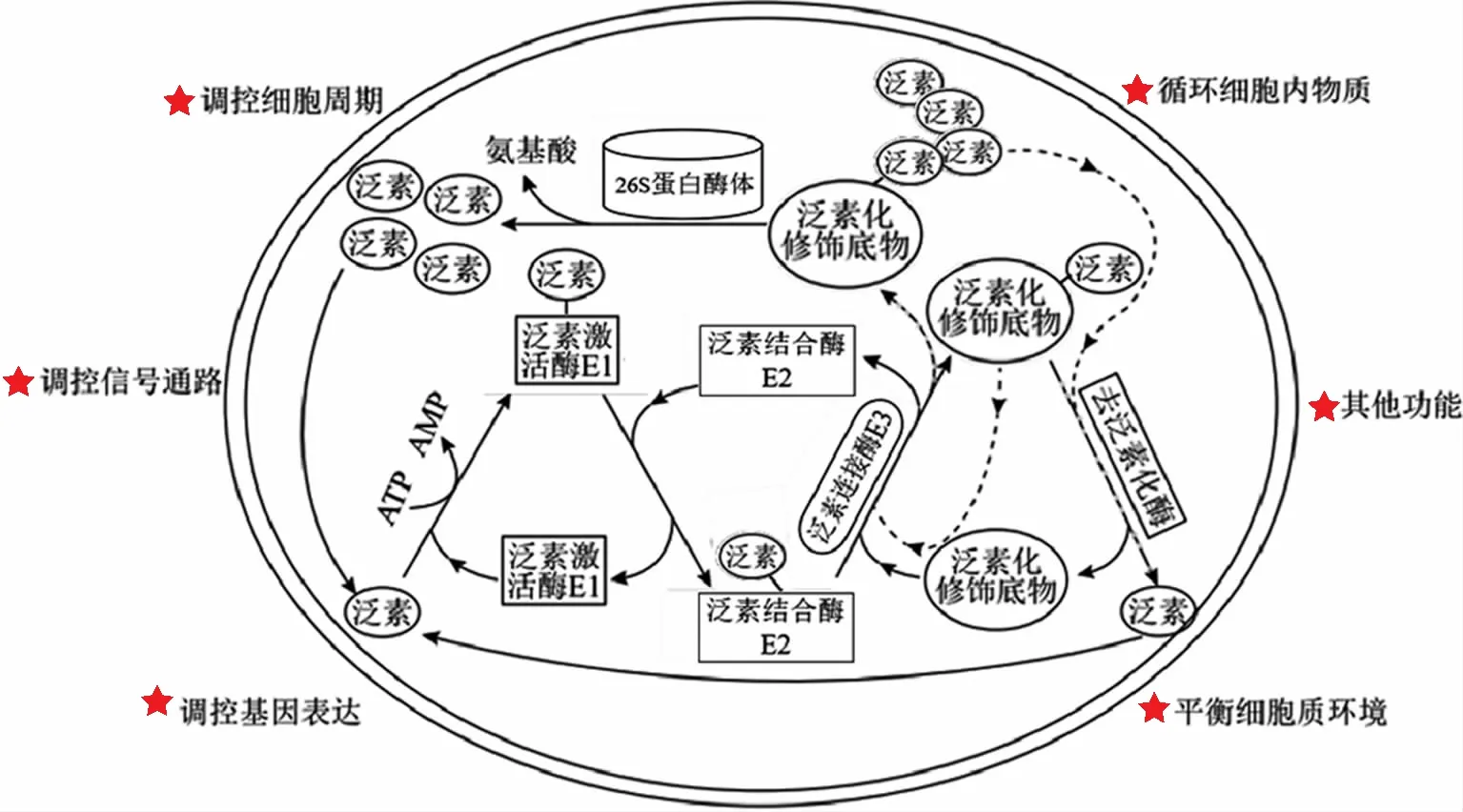
图1 UPS对底物蛋白的作用过程及其对细胞功能的调控
一、蛋白质泛素化修饰对滋养层细胞生理活性的调控作用
1.蛋白质泛素化修饰调控滋养层细胞的增殖与分化:胎盘是母体和胚胎间独特的交换器官,它的形成对人类成功妊娠和胎儿健康至关重要。滋养层细胞是胎盘的实质细胞,其增殖与分化是胎盘发育过程中的重要环节[3]。胚胎植入后,其最外层细胞高度增殖,产生大量的滋养层细胞[4],这是胎盘形成的基石。研究发现,有两大类泛素连接酶E3复合物参与调控滋养层细胞的增殖与分化,其中一类泛素连接酶E3复合物是Skp1-Cullin-F-box蛋白复合物(SCF),其参与调控细胞周期调节因子,进而影响细胞周期。有研究发现,缺乏Cullin 1(简称Cul1)会导致小鼠滋养层巨细胞中的细胞周期蛋白E水平异常升高,滋养层巨细胞体积异常增大[5]。结合有F盒(F-box)和富含亮氨酸重复结构域的蛋白12(简称Fbxl12)是胎盘特异性的泛素连接酶E3,其可在滋养细胞干细胞中通过对乙醛脱氢酶3(ALDH3)泛素化,降低ALDH3的活性,从而在胎盘发育中启动滋养层细胞的分化[6]。结合有F-box和WD重复结构域的蛋白8(简称Fbxw8)可使滋养细胞周期蛋白依赖激酶(CDK)1、CDK2、Cyclin A和Cyclin B1的表达升高,P27蛋白的表达降低,并在有丝分裂G2/M期影响细胞增殖[7]。另一类泛素连接酶E3复合物是细胞周期后期促进复合物(APC/C),其主要通过调节细胞双能蛋白(Geminin)来调控滋养层细胞的增殖或分化。有研究表明,Cdh1(也称FZR1)是APC/C的重要辅因子,有助于维持滋养细胞基因组稳定性以及增殖效率,Cdh1缺陷则会导致胎盘功能障碍[8]。Geminin是一种重要的细胞周期蛋白,对DNA复制具有双重稳定功能。APC/C-Cdh1介导的Geminin泛素化,可调节多能干细胞周期,诱导其分化为滋养层细胞[9]。此外,在滋养层细胞中,APC/C介导Geminin的泛素化降解,促进核内复制并分化为滋养层巨细胞[10]。Pal等[11]报道,APC/C与SCF也存在相互作用,它们之间的相互调控机制可能有助于细胞周期调控的稳定性,这为研究其在滋养层细胞周期调控中的作用提供了新的视角。
2.蛋白质泛素化修饰调控滋养层细胞的侵袭与迁移:绒毛外细胞滋养层细胞在经历上皮-间质转化(EMT)后,获得高度侵袭性,侵入子宫内膜以锚定胎盘,并穿透子宫螺旋动脉内膜以建立胎儿-母体循环[3,12]。在真核生物中发现的数百种泛素连接酶E3主要被分为4型:HECT型、U-box型、PHD指型和RING型[13],其中RING型中的Cul1家族成员是参与调控滋养层细胞侵袭与迁移活性的重要分子,Cul1通过维持基质金属蛋白酶活性而促进滋养层细胞侵袭与迁移[12],而Cul7则通过减少Pleckstrin同源样结构域家族B成员2(也被称为LL5β)的积累而抑制滋养层细胞的迁移[14]。缺氧是影响胎盘发育的一个关键信号[3],而缺氧诱导因子-1(HIF-1)是细胞对缺氧反应的关键分子,HIF-1α亚基在胎盘发育早期定位于滋养层细胞,羟基化后可被UPS降解而导致滋养层细胞侵袭能力减弱;在缺氧环境中,脯氨酸羟化酶被抑制,HIF-1α降解减少,滋养层细胞侵袭性增强[15]。由此可以看出,UPS参与调控滋养层细胞侵袭活性的方式是多样的,既体现了不同泛素连接酶E3的特有调节方式,也反映了母胎界面建立过程中局部缺氧的组织特征。
3.蛋白质泛素化修饰调控滋养层细胞的凋亡:作为一个发育中的器官,胎盘需要经历不断的组织重塑,其特征就是作为胎盘主要细胞成分的滋养层细胞在增殖、分化成特定的细胞亚型后,衰老细胞被选择性去除,以保持微环境的相对稳定。随着妊娠的进行,正常胎盘中的滋养层细胞凋亡增加[16]。已有研究发现,髓系细胞白血病因子1(Mcl-1)泛素连接酶E3(MULE)能对Mcl-1和肿瘤抑制因子p53进行蛋白酶体降解。病理妊娠中,MULE对Mcl-1与p53的靶向降解优先级不同,导致不同凋亡相关蛋白积累而影响其凋亡活性[17]。早期滋养层细胞高表达的X连锁凋亡抑制蛋白(XIAP)可以保护细胞免于细胞凋亡信号受体FAS介导的凋亡,而PIK3/AKT通路能通过磷酸化XIAP阻止XIAP的泛素化和降解,进而降低早期滋养层细胞对FAS介导的凋亡敏感性[18]。以上研究说明,UPS对凋亡相关蛋白质的处置过程是滋养层细胞凋亡调控的重要方式,不同蛋白质的降解次序,泛素化与磷酸化这两种蛋白质修饰的内在关系,提示我们UPS调节滋养层细胞凋亡的多样性。
二、蛋白质泛素化修饰对蜕膜化过程的调控作用
蜕膜是与胎盘最密切相关的母体组织,并作为内分泌和免疫器官发挥重要的妊娠调节作用。蜕膜化是子宫内膜组织经广泛重塑而形成蜕膜的过程,子宫内膜蜕膜化后会发生显著的结构和功能变化,为胚胎发育奠定基础。囊胚附着于子宫内膜上皮后,在雌激素、孕激素的诱导下,子宫内膜基质细胞(ESCs)大量增殖和分化,增强子宫内膜容受性,以支持胚胎植入和胎盘发育[19]。泛素化修饰可通过调节子宫内膜细胞中雌激素、孕激素受体的水平而参与调控蜕膜化过程。UPS可增强雌激素受体α(ERα)的降解而减弱子宫上皮细胞和基质细胞对雌激素的敏感性,从而促进孕酮的合成及子宫内膜蜕膜化,有利于胚胎植入[20]。在小鼠子宫内膜组织中,泛素特异性蛋白酶(USP)22可调控孕激素受体的水平,USP22的表达也在一定条件下受孕酮调节,而孕酮介导的蜕膜化又依赖于USP22的调节[21],但目前这方面的研究还主要停留在实验动物层面。
蜕膜化涉及的一些信号通路与泛素化修饰密切相关。Wnt信号通路不仅参与调控囊胚激活与植入,在子宫发育和蜕膜化过程中也发挥着重要作用。多种Wnt配体可通过β-catenin依赖性或非依赖性途径,调控小鼠子宫发育和腺体形成过程[22],而β-catenin受到UPS的直接或间接调控[23-24]。TGFβ信号通路影响着小鼠蜕膜组织的完整性[25],在蜕膜化过程中,通过调控ESCs中TGFβ信号通路受体Endoglin的表达而增强子宫内膜容受性[26]。此外,对血管内皮细胞的研究发现,内皮糖蛋白可通过干扰Smad泛素化调节因子2使得TGFβ信号通路中的Smads泛素化,从而减少Smads的降解[27],但这一分子途径是否也参与调控蜕膜化过程尚需进一步研究。
三、泛素化修饰对免疫细胞的调控以及对母胎界面免疫微环境的潜在影响
在妊娠期间母体特殊的生理条件下,母胎界面存在着复杂的免疫反应,相关免疫细胞与细胞因子等形成了独特的免疫微环境。泛素化修饰对免疫细胞功能具有调节作用,但蜕膜免疫细胞中的泛素化修饰与妊娠关系的研究还相对欠缺,下面仅就几种具有代表性的免疫细胞进行探讨。
1.泛素化修饰对蜕膜自然杀伤细胞(dNK)的调控:dNK是数量最多的蜕膜免疫细胞,约占70%,主要参与血管重铸和免疫调节。dNK分泌的干扰素-γ(IFN-γ)是螺旋动脉重铸中的重要细胞因子[28],而UPS参与调控小鼠dNK中IFN-γ的生成[29],提示UPS可能通过调控dNK中IFN-γ的分泌而参与调控血管重铸。母胎界面胎儿内皮细胞和侵袭性滋养层细胞表达的主要组织相容性复合体(MHC)-I类分子人白细胞抗原-G(HLA-G)可通过阻断Syk/MEK/ERK信号通路的激活而抑制自然杀伤细胞(NK)毒性[30]。而Syk是NK中一种重要的蛋白酪氨酸激酶,可在CD16刺激NK后被UPS降解[31]。因此,NK中Syk的泛素化很可能影响dNK细胞毒性而介导母胎界面免疫耐受状态的形成。目前,在泛素化对外周NK的调控、dNK对母胎界面的调控方面都有不少研究报道,但外周NK与dNK在这些机制上是否一致还缺少直接的实验证据。
2.泛素化修饰对蜕膜巨噬细胞(dMφ)的调控:巨噬细胞(Mφ)属于固有免疫系统,由单核细胞进入组织器官分化而来。其极化后又可分为促炎性的M1型和抗炎性的M2型[32]。dMφ是人类蜕膜组织中数量第2多的免疫细胞,约占20%[33]。dMφ的极化特性关系到母胎界面免疫环境的平衡,而这一过程可能涉及多种蛋白质的泛素化修饰。对Mφ的研究表明,泛素连接酶E3中的Myc结合蛋白2可通过刺激调节M2型Mφ标志物CD206的表达[34];而泛素连接酶E3中的Praja2介导恶性纤维组织细胞瘤扩增序列-1的泛素化,正向调节TLR2介导的JNK/p38通路并促进Mφ向M1型极化[35]。USP19可抑制NOD样受体家族蛋白NLRP3的降解,而NLRP3通过与干扰素调节因子-4相互作用促进Mφ极化为M2型,将NLRP3的促炎功能转变为抗炎功能[36]。需要说明的是,由于Mφ的多样极化与复杂表型,并不适合直接将Mφ的某种泛素化调控机制套用在dMφ上。此外,在螺旋动脉重铸过程中,需要及时清理已凋亡的细胞,dMφ的吞噬活性就显得尤为重要[33]。自然杀伤溶酶相关分子是Mφ中表达的泛素连接酶E3,通过参与吞噬小体蛋白的泛素化修饰而促进吞噬小体成熟[37],这可能是UPS对母胎界面dMφ功能调控的另一种方式。
3.泛素化修饰对蜕膜树突细胞(dDC)与T细胞的调控:树突细胞(DC)是功能强大的抗原递呈细胞,但在母胎界面处,其最明显的特征是稀缺性(人类妊娠早期蜕膜切片中往往只有数个dDC/mm2),这有助于母体降低对母胎界面处的免疫检测,增强子宫容受性,以便胚胎顺利着床并维持妊娠[28]。另外,dDC的共刺激分子CD86和MHCⅡ类分子表达相对较低,这也有利于妊娠免疫耐受的建立[38]。膜相关环CH型指1(MARCH1)是一种膜结合的泛素连接酶E3,可介导DC表面MHCⅡ类分子和CD86的泛素依赖性受体内化以及溶酶体降解,从而负调控DC在T细胞激活中的功能[39]。T细胞也是母胎界面免疫调节的重要成分,包括调节性T细胞(Treg)、CD4+辅助性T细胞和CD8+细胞毒性T细胞(Tc)等[40]。一种名为Ubc13的泛素结合酶E2在母体的精子特异性Treg细胞表达下降会促进Treg向效应T细胞转化,使得母胎界面免疫失衡并导致妊娠疾病发生[41]。另外,有研究表明,UPS对Tc细胞毒性物质的产生不可或缺[42],而在母胎界面处,雌激素和孕激素分别通过直接和间接的方式下调Tc细胞中穿孔素和颗粒酶的表达,减弱其细胞毒活性以利于胚胎植入与妊娠[43]。Tc细胞内雌激素、孕激素对UPS的相关调控值得进一步探究。
四、蛋白质泛素化修饰在妊娠疾病中的作用
1.蛋白质泛素化修饰与复发性自然流产(RSA):RSA病因复杂,涉及滋养层细胞、蜕膜基质细胞、免疫细胞等多方面,但已有研究表明,RSA与UPS功能异常有关。现已发现,USP25在RSA患者胎盘绒毛组织中表达显著降低,且体外研究表明,下调USP25后抑制了滋养细胞EMT,从而引起滋养层细胞侵袭能力不足[44]。肺腺癌转移相关转录因子1(MALAT1)可以通过招募泛素连接酶E3来影响隐花色素2蛋白的稳定性,促进滋养层细胞迁移和侵袭。RSA患者胎盘绒毛组织中MALAT1的表达水平显著降低,这可能是引起RSA患者滋养层细胞侵袭能力不足的原因之一[45]。SCF复合物关键成分Skp2的表达下调会导致蜕膜化受损,使个体更易发生RSA[46]。泛素结合酶E2中的Ubc13负调控Treg细胞向效应T细胞转化,该酶在RSA患者的精子特异性Treg细胞中表达下降,引起RSA发生[41]。
2.蛋白质泛素化修饰与先兆子痫(PE):PE病理特征主要表现为蜕膜和肌层螺旋动脉的滋养层细胞被异常侵犯,导致其不能向胎盘供给足够的血流量[47]。与PE相关的泛素化研究较多关注其对滋养层细胞生物学功能的调控。例如,过表达的MULE优先降解p53蛋白而使Mcl-1的促凋亡亚型在滋养层细胞积累[17];低水平的Cul1使得滋养层细胞前体细胞在向高侵袭性滋养层细胞分化过程出现障碍[12]。滋养层细胞侵袭不足、螺旋动脉重铸不足以及胎盘缺氧等问题的出现又常常与UPS对HIF-1的调节有关[3]。母胎界面微环境失调也是PE的致病因素,PE患者胎盘组织中的USP14显著过表达,这使得NF-κB通路被过度激活,导致了大量促炎细胞因子的产生[47]。此外,26S蛋白酶体活性也值得关注。有研究发现,与正常胎盘组织相比,PE患者胎盘组织中蛋白酶体活性显著降低,这使组织产生以大分子量泛素化蛋白聚集为特征的PE胎盘早衰现象[48]。上述研究结果说明,泛素化、去泛素化修饰以及蛋白酶体自身活性等分子水平异常与组织病变之间的紧密关系,开发这些UPS相关分子的靶向药物,可能有助于PE防治技术的提高。
3.蛋白质泛素化修饰与胎儿宫内生长受限(IUGR):IUGR病因较多,可由感染、母体疾病和染色体疾病等引起,但更常见的原因是妊娠早期的胎盘发育缺陷,其与PE的发生具有一定相似性,也与UPS异常存在关联[17]。然而,IUGR和PE的泛素化修饰的分子机制不同,PE和IUGR患者胎盘中的UPS成分MULE均过表达,在PE中MULE优先靶向降解p53蛋白,积累促凋亡的Mcl-1亚型;然而,在IUGR中MULE靶向降解Mcl-1促存活亚型,积累p53蛋白并发挥其凋亡功能[17]。简单地根据细胞、组织特征进行归因往往会忽视此类差异,也说明泛素化修饰差异很可能是我们进一步认识妊娠相关疾病的突破点。此外,胎儿营养物质供应不足也会引起IUGR,在IUGR患者中胎盘的一些氨基酸转运体出现异常。雷帕霉素靶蛋白(mTOR)信号通路可通过调节钠偶联中性氨基酸转运载体2(SNAT-2)的泛素化和质膜转运,调控系统A型氨基酸转运体的活性。mTOR活性降低会降低系统A型氨基酸转运体活性,阻碍胎儿氨基酸摄取[49]。神经前体细胞表达发育抑制蛋白4-2(NEDD4-2)是一种泛素连接酶E3,其介导的泛素化作用可降低SNAT-2和系统L型氨基酸转运体-1的质膜表达,导致滋养层细胞氨基酸摄取减少,并最终影响胎儿生长发育[50],这从母胎之间物质交换的角度解释了蛋白质泛素化与IUGR的关系。
五、总结与展望
母体与胎儿之间联系纽带的建立有赖于母胎界面滋养层细胞、ESCs以及包括dNK、dMφ等在内的免疫细胞功能的正常发挥。UPS通过调控细胞内蛋白质水平及活性,在滋养层细胞及ESCs的生理活动调节过程中发挥重要作用。此外,本文还从UPS对机体免疫细胞的影响出发,分析免疫细胞对母胎界面的作用,对UPS、免疫细胞和母胎界面之间一些已有的与潜在的调控关系进行探讨发现,一些妊娠相关疾病的发生发展与UPS异常相关。对母胎界面相关泛素化修饰的研究,可能为揭示生命孕育与诞生的奥秘提供更多的线索。

