内脏痛实验动物模型的研究进展*
王纹纹 雷 静 尤浩军
(延安大学感觉与运动疾病转化医学研究中心,延安 716000)

SD大鼠(Sprague-Dawley rats,Rattus norvegicus)生长发育快,繁殖能力和抗疾病能力强,主要用于多系统,包括神经系统、消化系统、生殖系统及内分泌系统等疾病的动物模型构建及机制研究。同时,该类动物也被广泛用于药物研发及筛选中的药理和毒理实验。
疼痛是一种令人不愉快的感觉经历。疼痛按照产生的部位可分为躯体痛和内脏痛,二者具有不同的伤害感受特点,且在神经机制方面存在显著差异。内脏痛是由内脏器官接受机械性牵拉、痉挛、缺血和炎症等刺激所致,是一种临床上常见的病症。目前,全球超过20%的人口患有慢性内脏痛症状[1]。内脏痛不仅严重影响患者的日常生活,也给社会造成了极大的负担。内脏痛由于其特殊的疼痛性质和独特的特点,使其基础研究较躯体痛相对滞后。内脏痛的动物模型多样,机制复杂。其复杂机制涉及中枢和外周多种离子通道/受体数目及功能改变、外周传入神经元可塑性改变及中枢敏化等。对于深入研究内脏痛复杂机制这一重大难题,正确选择和建立符合临床内脏疾病病理生理学特征的实验动物模型是解决问题的前提条件。本文对近年来各种内脏痛动物模型的制备进行了总结,并分析了其特点和不足之处,以期为研究者选择合适的内脏痛动物模型提供参考。
1 内脏痛的特点
内脏器官中感觉神经元分布较少,痛觉传入纤维在外周互有交叉,传入路径多样、复杂,但在高级中枢出现广泛汇聚。其有以下几个特征[2]:a.疼痛部位定位不明确,且传入途径弥散,如患者发生腹痛时,往往无法明确地表述疼痛产生的具体位置,是最主要的特点;b.产生牵涉痛,即在远离内脏病变区域的躯体或其他部位出现疼痛,如患者患有胆囊炎时,右肩区出现疼痛;c.不是所有的内脏器官都有疼痛产生,且每种器官产生的疼痛程度不同,可能是由于内脏器官痛觉感受器的分布不同;d.常伴有运动和(或)自主神经反射,如恶心、呕吐等;e.并非都与内脏损伤有关。
2 内脏痛实验动物模型
适宜的内脏痛实验动物模型是研究内脏痛的前提条件。基于解剖学和神经生物学基础研究的不断深入,众多学者已成功建立了多种内脏痛实验动物模型,为后续开展内脏痛的基础和临床研究奠定了基础。内脏痛动物模型应具备与临床内脏疾病尽可能相似的病理生理学特征,并且还应考虑其重复性、易操作性和经济性等问题。目前内脏痛实验动物模型尚无权威分类方法,主要按照造模刺激方式进行分类,分为炎性内脏痛模型、机械扩张性内脏痛模型、缺血性内脏痛模型及电刺激性内脏痛模型等。本文对这几类动物模型总结如下。
2.1 炎性内脏痛模型
2.1.1 扭体实验(writhing test)
实验者将乙酸、缓激肽及硫酸镁等化学刺激性物质注入动物腹腔,实验动物所表现出的间歇发作运动反应,即臀部位置不正、腹部明显收缩及一侧后肢外伸等特殊姿势,此行为反应定义为扭体反应(图1)。该实验适用于多种动物,其中大鼠和小鼠应用较广泛、效果较好。实验中最常用的化学刺激性物质是乙酸,大鼠腹腔内注射1%乙酸后大约5~10 min出现扭体反应,且在30 min左右扭体反应频率最高。Schmauss 等[3]提出经典的行为学评分标准可对扭体行为进行量化。动物的扭体行为分为4 个等级(A:正常姿势无异常变化记为0 分;B:身体倾斜向一边记为1 分;C:后肢过度向后伸展,且频繁后摆记为2 分;D:腹部肌肉明显收缩,后肢外伸记为3 分),计算内脏痛指数(visceral pain index,VPI)[3]。VPI为各个等级扭体行为出现次数与相应分值乘积后的总和,即VPI=B+2C+3D。该模型可避免麻醉药物对动物的影响,且其行为反应出现快、变化明显,具备易操作和重复性好等优点,因此常被用于筛选和评估镇痛药物(如甲芬那酸、布洛芬衍生物)[4-5]。缺点是化学刺激性物质注入动物腹腔后的扩散程度及扩散速度不可控制,动物的行为反应和神经生理反应存在差异;且化学刺激性物质可能在一定程度上影响腹膜壁层,造成腹膜炎,产生躯体痛。
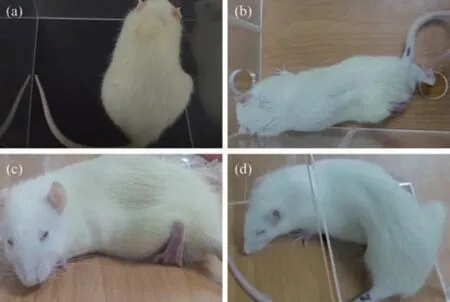
Fig.1 Writhing test图1 扭体实验
2.1.2 心包炎模型
心包炎模型是将一个环形硅导管插入大鼠心包5 d 后,在大鼠清醒状态下,将缓激肽、组胺和前列腺素E2 混合液或辣椒素通过环形硅导管灌入心包内,动物出现厌恶反应、炎症及血压变化[6]。心包内注入刺激性物质后产生炎症,且伴有由于炎症使心包内压力升高而引起的压力性刺激[7]。该模型建模成功后,动物行为反应变化明显,可模拟临床上常见的心包炎,但不足之处是涉及的手术操作环节较为复杂,且在心包内注射刺激性物质后可致动物严重心律失常及死亡,因此建模成功率较低。
2.1.3 急性胰腺炎(acute pancreatitis,AP)
Aho 等[8]在1983 年首次提出的胰胆管逆行牛磺胆酸钠(sodium taurocholate,ST)注射法是诱导急性胰腺炎最常用的造模方法之一,即通过手术在十二指肠乳头开口处放置套管后,胰胆管壶腹部逆行注射牛磺胆酸钠。该方法手术创伤较大,操作复杂,易造成动物死亡。此造模方法经改良后,由十二指肠穿刺置管代替十二指肠切开,改良后的方法虽然降低了手术创伤,但很难准确的找到并穿刺胰胆管[9]。随后研究者对该方法进行了进一步优化,提出胰腺被膜下注射法,即通过手术暴露并明确找到胰腺部位,由胰尾部开始在被膜下均匀点状注射ST[10]。该模型主要用于模拟胆总管下段梗阻,但操作复杂、死亡率高、创伤大,可能会引起一系列并发症。
2.1.4 乙状结肠痛模型
大鼠呼吸麻醉后,用生理盐水冲洗出直肠内粪便,然后在距肛门35 mm 的乙状结肠壁黏膜下处注射0.1 ml 5%甲醛,大鼠快速表现出舔腹或外阴区、肢体过度伸展、腹部肌肉收缩及弓背等行为,且45 min内行为学变化明显,30 min左右疼痛程度最高[11-12]。该模型建模成功后,行为反应变化明显,且仅在乙状结肠壁产生炎性反应。与扭体实验相比,此模型避免了腹腔广泛的炎性反应,且炎症可在1周后自愈,主要用于疼痛药物筛选和治疗措施的自身对照实验。
2.1.5 溃疡性结肠炎模型
溃疡性结肠炎动物模型适用于多种动物,基础研究中以使用大鼠和小鼠居多,其造模方法多样,如免疫法、复合法、化学法、基因模型法及中医病证结合模型法等,其中化学法和复合法是较成熟且常用的方法。化学法常用的刺激性物质主要有乙酸(acetic acid,AA)、恶唑酮(oxazolone,OXZ)、角叉菜胶及葡聚糖硫酸钠(dextran sulfate sodium,DSS)等,基础和临床研究中大多采用乙酸和DSS自由饮。复合法有2,4,6-三硝基苯磺酸/乙醇诱导、二硝基氯苯/乙酸诱导及乙酸复合刺激法等,其中2,4,6-三硝基苯磺酸/乙醇诱导较为常见。
a.DSS 自由饮:动物自由饮用3%~5%DSS 溶液7 d后,表现为状态不佳、体重下降、稀便、粪便带血、结肠长度缩短及黏膜损伤等[13]。该造模方法易操作、重复率高、造模成功率高、与临床症状高度相似,可用于溃疡性结肠炎治疗药物的筛选。不足之处是每只实验动物饮入的DSS 量无法控制,导致其发病程度有很大差异。
b. 2,4,6-三硝基苯磺酸/乙醇诱导:大鼠造模前禁食24 h,腹腔麻醉后外径约2 mm 的聚乙烯导管插入至距肛门约8 cm 直肠内,50%乙醇和5%2,4,6-三硝基苯磺酸混合物经此管进行直肠给药,大鼠保持倒立3 min便于药液停留在直肠内被充分吸收[14]。造模后约3 d大鼠出现活动减少、精神不振、皮毛粗糙、体重下降、稀便、血便及肠道溃烂等症状。该造模方法成功率高、造模时间短、操作简单、易重复及耐受性好等,可模拟临床上溃疡性结肠炎,且在基础研究中主要用于溃疡性结肠炎机制的研究以及相关药物筛选。两种方法建立的溃疡性结肠炎动物模型皆与临床上溃疡性结肠炎患者的症状相似,但在病程发展、组织病理损伤及肠道菌群等方面存在明显差异[15]。
2.1.6 新生期伤害性刺激模型(化学性刺激)
大鼠在新生期接受伤害性刺激可致成年后内脏痛敏,常见的伤害性刺激有机械扩张性刺激(结直肠扩张刺激)和化学性刺激(如乙酸、芥子油)。大鼠在出生后第8~21 天连续14 d 在结肠内注射0.2 ml 5%芥子油,可致结肠炎症,5周龄后炎症消失,但大鼠对结直肠扩张(colorectal distension,CRD)敏感性增强[16]。动物出现痛阈降低、痛反应增强。
2.1.7 新生期结直肠炎症模型
10 日龄大鼠距肛门2 cm 处结肠内注入0.2 ml 0.5%稀乙酸后可致幼鼠肠道炎症及内脏痛敏,并在成年后表现出明显的内脏超敏反应[17]。此造模方法可对幼鼠的结直肠产生轻微的炎症或损伤,同时会产生明显的内脏痛敏反应并持续至成年。该模型的特征与临床上肠易激综合征患者的慢性内脏痛症状相似,与多次注射化学刺激性物质的造模方法相比,该造模方法一次性注入炎性物质对结直肠的损伤较小,是一种操作简单、造模成功率高的内脏痛实验动物模型。
2.1.8 急性膀胱炎模型
炎性刺激性物质(如乙酸、芥子油、丙烯醛等)经导管注入至实验动物的膀胱内,动物的膀胱产生炎症和充盈,此时排尿感和疼痛共存,动物表现出嘶叫、摇头、撕咬、腹部收缩及后肢伸展等行为学变化[18]。
该模型易操作、行为变化明显,但缺乏较为合理、肯定的评分标准。
2.1.9 间质性膀胱炎模型
间质性膀胱炎模型的造模方法主要有:膀胱内途径、膀胱外途径及联合途径。膀胱内途径是通过在尿道膀胱置管后注射化学刺激性物质,如硫酸鱼精蛋白/脂多糖、透明质酸酶(hyaluronidase,HA)、盐酸及乙酸等,诱导间质性膀胱炎,动物出现膀胱上皮组织损伤、肥大细胞活化、排尿频率增加、排尿间隔时间缩短等行为及病理性特征[19-22]。该造模方法通过药物直接作用于膀胱,减小了其他器官组织损伤,是目前间质性膀胱炎相关基础研究中应用较广泛的模型之一。但对于小鼠,该操作复杂,易引起尿道损伤。膀胱外途径主要通过物质代谢或免疫方式间接作用于泌尿系统,诱导间质性膀胱炎,如皮下注射尿溶蛋白II或腹腔注射环磷酰胺(cyclophosphamide,CYP)等[22-23]。大鼠出现膀胱水肿、黏膜溃疡及炎性细胞浸润等特征。该模型操作简单、更接近间质性膀胱炎自然发病机制,主要用于其病因及发病机制的基础研究。联合途径是膀胱内途径和膀胱外途径联合作用诱导间质性膀胱炎。膀胱内注入硫酸鱼精蛋白/脂多糖联合腹腔注射CYP 是目前联合途径较为经典的造模方法,其更接近间质性膀胱炎的病理生理性特征[24]。
2.2 机械扩张性内脏痛模型
2.2.1 胃十二指肠扩张模型
手术将一带有可扩张气囊的导管插入至胃内或十二指肠,给予充气或充水,扩张气囊,产生机械扩张性刺激,动物出现明显的行为学变化,如磨牙、肢体伸展、抖动、背部拱起及身体旋转等[25]。该刺激方法作用于胃时,可模拟胃壁扩张;作用于十二直肠时,可致十二指肠梗阻。该模型行为反应变化明显,但手术操作复杂、有创伤,目前应用较少。
2.2.2 结直肠扩张模型
结直肠扩张是将一带有长约6~8 cm 气囊的导管从实验动物的肛门插入至降结肠内,随后给予充气,扩张球囊,以达到机械性刺激目的,动物出现腹部收缩、背部隆起、骨盆或睾丸抬起等行为,多用于结直肠内脏痛基础研究[26]。目前多种动物可用于CRD 建模,其中较常用的是大鼠。CRD 行为学变化次数较少,学者进一步提出了炎症性CRD模型,即在炎性内脏痛的基础上进行机械性扩张,可致厌恶行为、血流动力学及自主神经等改变的频率升高[27]。该模型具有易操作、重复性好和行为变化明显的优点。缺点是球囊压力一旦超出一定范围,会导致肠道损伤或破裂。
2.2.3 新生期伤害性刺激模型(机械刺激)
持续、反复的CRD 作用于新生期大鼠的结直肠,可作为一种伤害性刺激,造成幼年期或成年期大鼠内脏痛敏。大鼠在出生后第8~21 天每天用气囊对结直肠进行机械性扩张刺激,每次气囊压力控制在60 mmHg,持续1 min,2 次/d,5 周龄后大鼠对CRD的敏感性增强,内脏敏感性升高[28]。该模型操作复杂,易对肠道造成损伤。
2.3 缺血性内脏痛模型
缺血性内脏痛主要是通过阻塞血管(如动脉),产生病理性痛。冠状动脉阻塞是较成熟的缺血性内脏痛模型之一。实验者通过手术阻塞冠状动脉,造成心肌缺血,诱发动物行为反应发生变化[29]。但冠状动脉对心肌供血往往有变异性,由此导致动物行为学的变化可能存在很大差异。目前,该模型主要用于定性,而非定量研究。
2.4 电刺激性内脏痛模型
在内脏痛研究中,动物的内脏神经传入纤维接受伤害性电刺激可产生疼痛反应。对于胸腔器官常用电刺激心下神经模拟心绞痛,而腹腔器官则采用电刺激内脏大神经,盆腔器官可采用电刺激腹下神经和盆神经[30]。该模型优点是重复率高、刺激强度可控制,但由于电刺激是非生理性刺激,故应用并不广泛。
2.5 其他内脏痛模型
2.5.1 新生期母婴分离模型
新生期母婴分离模型通常选用啮齿类动物,其中大鼠较广泛应用。实验者将幼鼠从出生后的第2~15天,与母鼠每天固定时间分离3 h,幼鼠成年后表现为内脏痛觉过敏、学习和记忆能力下降、焦虑及抑郁行为和应激反应增强等,且雌性较易患病[31-35]。新生期是中枢神经系统神经元发育的关键时期,新生期母婴分离代表一种早期不良生活事件,可致大鼠下丘脑-垂体-肾上腺轴功能紊乱、内分泌改变、肠道黏膜损伤及内脏高敏感(visceral hypersensitivity,VH),通常用于模拟临床上慢性内脏痛肠易激综合征。该模型简单、易操作,但造模周期较长。
2.5.2 急性应激模型
目前成年大鼠急性应激形式有避水应激(water avoidance stressor,WAS)、冷 束 缚 应 激(cold and restrained stressor,CRS)以及强迫游泳应激(forced swimming stressor,FSS)等。避水应激模式:将大鼠置于一略高于水面的小平台上2 h,动物表现出对周围环境的厌恶和恐惧,对CRD 的敏感性增强,模拟心理应激引起的大鼠肠易激综合征[36]。冷束缚应激是将大鼠部分身体(如前肢、胸部躯干)进行束缚和限制活动2 h,可致内脏高敏感反应[37]。此外强迫游泳应激也可引起大鼠内脏痛敏,即将大鼠置于盛有干净自来水的圆柱形水槽中,进行强迫游泳6 min,大鼠对结直肠扩张反应增强[38]。该模型主要用于模拟心理压力引起的内脏痛觉过敏,但在造模时要考虑动物对环境的适应问题。
2.5.3 慢性轻度应激模型
日常慢性轻度应激重复累积作用于大鼠,严重影响大鼠内脏痛的程度及持续时间。WAS 是最先适合动物内脏痛敏研究的慢性应激方式之一。大鼠每天接受1 h WAS,连续10 d,表现出对CRD反应高敏,且自应激结束后起30 d,仍保持内脏高敏感[39]。该模型可模拟成年长期心理压力引起的内脏高敏反应。
2.5.4 间隙性异源型应激模型
间隙性异源型应激模型是WAS(60 min)、4℃CRS(45 min)及FSS(20 min)3种应激源随机排列,大鼠每天固定时间段随机接受一种应激(1~2 次),持续9 d,可致大鼠对结直肠扩张反应增强、内脏高敏感且持续时间长[40]。该模型可模拟日常生活中的多种复杂应激事件所引起的内脏痛敏,且可避免单一应激诱发的耐受现象。
2.5.5 环境恐惧诱导的应激模型
大鼠接受同种动物或天敌攻击,或一个短暂冲击来建立模型,表现出持久的条件性恐惧反应及对新的刺激敏感且随时间推移而加剧[41]。此外,研究发现经历或目睹创伤性事件(如战争、环境灾难)可能引起创伤后应激障碍,且胃肠道的患病率增加[41]。该模型临床上可模拟创伤后应激障碍引起的肠易激综合征。
3 总结与展望
内脏痛是疼痛研究领域的焦点和难点之一,为研究其相关内脏疾病的发病机制及筛选治疗药物,设计和建立实验动物模型是重中之重。目前常用的内脏痛实验动物模型多样,可模拟临床上各种内脏疾病的生理病理性特征,但每种模型都有其特点及优缺点(表1),因此在基础研究过程中需要根据研究方向选择合适的模型。各种模型的不足限制了其应用,因此需要进一步设计和制备更理想的动物模型,推动内脏痛研究领域的发展。

Table 1 Summary of characteristics,applications,advantages and disadvantages of visceral pain model表1 内脏痛模型特点、应用及优缺点总结

续表1

