褐藻聚糖硫酸酯降解酶菌Sinomicrobium sp.Fuc19的产酶优化及其降解产物化学组成
国晶晶,刘诗萌,韩梓琪,宋悦凡,2,刘舒,2,周慧,2,汪秋宽,2*
(1.大连海洋大学 食品科学与工程学院,辽宁水产品加工及综合利用重点实验室,辽宁 大连 116023; 2.国家海藻加工技术研发分中心(大连),辽宁 大连 116023)
褐藻聚糖硫酸酯(fucoidan)是一种连接硫酸基团的杂环活性多糖,主要从褐藻细胞和棘皮动物体壁提取,因其结构复杂多样,不同种间、不同收获季节和不同提取方法得到的褐藻聚糖硫酸酯的结构各不相同。褐藻聚糖硫酸酯的主要组成成分是岩藻糖和硫酸基团,另外还含有一定量的葡萄糖、半乳糖、甘露糖、木糖、鼠李糖、葡萄糖醛酸和甘露糖醛酸等,有些还含有少量的蛋白质和乙酰基[1-2]。褐藻聚糖硫酸酯具有抗氧化、降血压、降血脂和抗血栓[3-6]等多种生物活性,但因分子量较大限制了其应用范围。而低分子量的褐藻聚糖硫酸酯易被人体吸收,特别是对体弱人群能更好地发挥其活性,且褐藻聚糖硫酸酯具有安全性高、无毒等优势,因此,将其高分子物质降解为低分子量低聚糖后,在食品、医药等方面具有巨大的应用潜力。
目前,低分子量褐藻聚糖硫酸酯的制备方法主要有酶解法、酸解法和高压降解法,其中,酶解法具有反应温和、专一性强的优点。根据其作用方式,褐藻聚糖硫酸酯降解酶大致分为3类:①α-L-岩藻糖苷酶(α-L-fucosidases)(EC3.2.1.51),为外切酶,其作用方式主要是切断多糖非还原末端α-L-糖苷键,可用于测定糖基的连接顺序;②另两类统称为褐藻聚糖硫酸酯酶(fucoidananse,FUCase)(EC3.2.1.51),为内切酶,其中一种是在多糖链中间某处将糖链切割,可用于制备寡糖或低分子量的降解产物,另一种是在末端不断地释放寡糖链,可用于降解产物的结构分析[7]。因使用范围不同,可根据不同需求选取不同种类的酶,但目前仍无商品化的褐藻聚糖硫酸酯降解酶,且对酶的作用机制和方式也缺乏深入的了解。因此,亟待筛选新型产褐藻聚糖硫酸酯降解酶的菌株,为高效、安全地降解褐藻聚糖硫酸酯提供新酶源。
本研究中,选取大连旅顺柏岚子沿海海水和泥沙,以褐藻聚糖硫酸酯作为唯一碳源,经过富集与纯化筛选获得一株产褐藻聚糖硫酸酯降解酶菌株,通过分析其16S rRNA基因序列对该菌株进行鉴定,优化其产酶条件,并对粗酶及降解产物进行分析,以期为褐藻聚糖硫酸酯降解酶的分离纯化和作用方式研究提供科学参考。
1 材料与方法
1.1 材料
试验用海水、泥沙采集于大连旅顺柏岚子沿海周边。
大连笼目海带Kjellmanniellacrassifolia褐藻聚糖硫酸酯(FUC)由国家海藻加工技术研究分中心(大连)提供;PCR扩增试剂盒由生工生物工程(上海)股份有限公司提供,扩增16S rDNA基因引物由该公司合成;聚合酶链式反应(PCR)仪为德国Eppendorf公司生产;高效液相色谱仪为安捷伦1260。岩藻糖、半乳糖等单糖标准品由Sigma公司提供,其他化学试剂均为国产分析纯。
1.2 方法
1.2.1 产酶菌株的筛选
富集培养基的制备:将FUC 2 g、NaNO33 g、NaCl 20 g、MgSO4·7H2O 0.2 g、CaCl20.1 g和FeSO4·7H2O 0.01 g溶于1 000 mL蒸馏水中,于115 ℃加热灭菌30 min后待用。
选择性培养基的制备:在富集培养基里添加20 g琼脂,于115 ℃加热灭菌30 min后待用。
液体发酵培养基的制备:将FUC 2 g、蛋白胨3 g、NaCl 20 g、MgSO4·7H2O 0.2 g、CaCl20.1 g和FeSO4·7H2O 0.01 g溶于1 000 mL蒸馏水中,于115 ℃加热灭菌30 min后待用。
初筛菌株的分离:称取海水和泥沙样品2 g,放入盛有15 mL富集培养基的三角瓶中,在25 ℃、150 r/min摇床中培养3 d。培养液按照梯度稀释,取0.1 mL涂布于选择性培养基平板,倒置在25 ℃电热恒温培养箱中培养3 d。将平板中不同形态的单菌落进行3次平板划线纯化,得到初筛菌株。
菌株酶液的制备:将分离的初筛菌株接种于盛有50 mL液体发酵培养基的三角瓶中,在25 ℃、150 r/min摇床中培养3 d,取发酵液在4 ℃下以10 000 r/min离心10 min,上清液即为菌株酶液。
1.2.2 分离菌株酶活力的测定 取菌株酶液样品0.25 mL与等体积质量分数0.2%的FUC混合,在30 ℃、150 r/min的水浴恒温振荡器中反应2 h后,沸水浴灭酶10 min。待溶液冷却后加入0.5 mL铁氰化钾摇匀,在80 ℃水浴中反应15 min,冷却至室温后加入2 mL蒸馏水震荡混匀,取1 mL溶液在4 ℃以下10 000 r/min离心10 min,取0.2 mL上清液在420 nm处测定吸光值。对照组是将菌株酶液样品在沸水浴中灭酶15 min后与FUC混合,其他步骤同上,每组设置3个平行。
1.2.3 总糖含量测定 采用苯酚硫酸法测定总糖含量[8]。以L-岩藻糖、D-半乳糖(质量比为3∶1)为标准糖绘制标准曲线。按照标准方法在490 nm处测定吸光度并计算总糖含量。
1.2.4 褐藻聚糖硫酸酯硫酸根含量测定 采用明胶-氯化钡法测定硫酸根含量[9]。配制K2SO4标准工作液并绘制标准曲线。按照标准方法在470 nm处测定吸光度,并计算硫酸根含量。
1.2.5 菌体生物量测定 菌体经液体发酵培养基培养后,以未接菌的摇瓶发酵培养基的发酵液作为空白对照,采用比浊法测定吸光度值(OD600 nm)。
1.2.6 菌种鉴定 取目标菌株的一个单菌落,接入装有0.1 mL无菌超纯水的1.5 mL离心管中振荡混匀,在100 ℃沸水浴中加热10 min;冷却至室温后,以6 000 r/min离心10 min,所得上清液即为DNA模板。
利用16S rRNA通用引物27F(5′AGAGTTTGATCCTGGCTCAG 3′)、1492R(5′GGTTACCTTGTTACGACTT 3′)进行PCR扩增,并将扩增片段进行测序。将测序结果的基因序列输入NCBI核酸数据库进行BLAST分析,选取同源性较高的16S rRNA序列,采用邻接法(Neighbor-Joining)构建菌株系统发育树,以鉴定菌种。
1.2.7 菌株产酶优化
1)初始培养条件。挑取斜面培养的单个菌株接入装有15 mL富集培养基的锥形瓶中,在25 ℃、150 r/min摇床中培养24 h,将培养后的菌液按体积分数2%的接种量接入装有50 mL液体发酵培养基的锥形瓶中,在25 ℃、150 r/min摇床中进行扩大产酶培养,取发酵液测定酶活力和生物量。
2)菌株培养基成分单因素优化试验。在培养基中加入不同质量浓度的FUC(0、1、2、4、8、12 g/L),其余成分同液体发酵培养基,以优化碳源质量浓度;在培养基中添加质量浓度为3 g/L的不同种类源物质(硫酸铵、硝酸钠、蛋白胨、酵母粉和无氮源的对照),其余成分同液体发酵培养基,以优化氮源种类;向培养液中加入不同质量浓度的酵母粉(1、3、6、9、12、14 g/L),其余成分同液体培养基,以优化酵母粉培养液质量浓度;向培养基中加入不同质量浓度的NaCl(0、20、30、40、50 g/L),其余成分同液体发酵培养基,以优化NaCl质量浓度。
3)菌株发酵培养单因素优化试验。以优化的液体发酵培养基为基础,将初始培养条件设定为温度30 ℃、pH 8、接种量5%和装液量100 mL,以菌株繁殖生物量和产酶酶活力为指标,通过改变单个因素进行培养条件的优化试验,即培养基初始pH为5、6、7、8、9时对菌株产酶发酵的影响;培养温度为20、25、30、35、40 ℃时对菌株产酶发酵的影响;接种量为2%、5%、10%、15%时对菌株产酶发酵的影响;装液量为25、50、75、100 mL时对菌株产酶发酵的影响。
菌株培养基成分和发酵培养单因素优化试验每组分别设置3个平行。根据单因素试验结果,综合考虑碳源浓度、初始pH、氮源浓度、NaCl浓度、接种量、温度和装液量7个因素对菌株生物量和酶活力的综合影响,进行7因素3水平的L18(37)正交试验。
1.2.8 粗酶的制备及酶学性质分析 利用丙酮沉淀法制备粗酶。取制备的发酵液在4 ℃下以10 000 r/min离心10 min,所得上清液用提前预冷的丙酮(4 ℃)按照体积比1∶2缓慢混合,在4 ℃层析柜静置沉淀1 h后离心10 min,所得沉淀用缓冲溶液复溶,再次离心所得上清液即为粗酶液。然后分析粗酶的最适反应温度、pH及其稳定性,以及不同金属离子对酶活力的影响。
1.2.9 酶降解寡糖的制备及其组成分析 按照10 U/mg的酶添加量将质量分数为0.2%的FUC与粗酶混合,在最适反应温度、pH条件下酶解反应24 h,反应结束后,沸水浴加热15 min终止酶解反应,室温冷却后以10 000 r/min离心10 min,所得上清液即为酶解产物,冷冻干燥保存。
分别称取0.005 g相对分子质量分别为1 000、5 000、10 000的葡聚糖标准品,溶于2 mL蒸馏水中,通过Sephacryl S-100凝胶柱洗脱,采用苯酚硫酸法测定各组分的总糖含量,以标准品分子量的对数值(lgM)为纵坐标、对应的保留体积(Kav)为横坐标绘制标准曲线。将酶解产物通过Sephacryl S-100凝胶柱(1.6 cm×100 cm)进行分离纯化,并通过标准曲线拟合公式估算其分子量,用高效液相色谱法测定酶解产物的单糖组成。
1.3 数据处理
试验结果均以平均值±标准差(mean±S.D.)表示,采用SPSS 25软件单因素方差分析(one-way ANOVA),采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 褐藻聚糖硫酸酯成分含量
首先对试验用笼目海带褐藻聚糖硫酸酯的组成成分进行测定,结果显示,其总糖含量为71.68%±2.06%,硫酸根含量为20.04%±0.18%,纯度为91.72%,纯度较高,说明其中褐藻胶的干扰物质较少,由此确定,该褐藻聚糖硫酸酯可以作为菌株培养发酵的唯一碳源进行后续试验。
2.2 菌株筛选及鉴定
经过富集、分离及纯化,共筛选出30株以褐藻聚糖硫酸酯为唯一碳源生长的菌株。将筛选获得的菌株进行发酵培养、复筛,并对多糖利用率和产酶能力进行比较。结果显示,Fuc19菌株的发酵液酶活力最高,粗酶酶活力为95.23 U/mL,该菌株经过10次传代稳定性培养后,产酶能力仍较稳定,可作为后续研究菌株。
PCR扩增及测序结果显示,菌株Fuc19的基因序列长度为1 425 bp,经BLAST比对,与该菌株一致性高于99%的菌属为大洋中华微藻Sinomicrobiumoceani。利用Mega软件构建菌株系统发育树,该菌株与Sinomicrobiumoceani聚为一个分支,亲缘关系最近,故将其鉴定为Sinomicrobiumsp.,命名为Sinomicrobiumsp.Fuc19(简记为Fuc19)(图1)。

图1 基于16S rRNA基因序列构建的菌株Fuc19系统发育树
2.3 Sinomicrobium sp.Fuc19菌株的产酶优化
2.3.1 Fuc19菌株培养基成分的优化 从图2(a)可见,随着FUC浓度的增加,Fuc19菌株的生长和产酶能力均呈先升后降的趋势,当FUC质量浓度达到2 g/L时,其酶活力和生物量均达到最大值,随后酶活力和生物量迅速降低,说明FUC的最佳质量浓度为2 g/L。当褐藻聚糖硫酸酯的质量浓度高于2 g/L时会影响菌株的生长,这可能是由于FUC浓度增加,其酶溶液的黏度也随之增加,酶与底物间的反应受到影响。
从图2(b)可见,在无氮源、硝酸钠、硫酸铵环境下Fuc19菌株的生物量和酶活力均较低,而在有机氮源蛋白胨和酵母粉中繁殖较快,其中添加酵母粉的菌株生物量和产酶能力最高。
从图2(c)可见,随着酵母粉浓度的增加,Fuc19菌株的生物量和产酶能力也逐渐增加,当酵母粉质量浓度为12 g/L时,生物量和酶活力达到最大值,说明酵母粉的添加可促进菌株生长繁殖。
从图2(d)可见,随着NaCl浓度的增加,菌株生物量和酶活力呈先上升后下降的趋势,当NaCl质量浓度为20 g/L时,生物量和酶活力均为最大值。这是因为该菌株来源于海洋环境,具有一定的耐盐性,故在培养基中添加NaCl菌株均可生长,但NaCl浓度过高时会影响菌株的产酶能力。
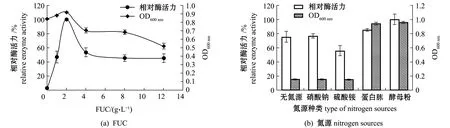
图2 培养基成分对Sinomicrobium sp.Fuc19生物量和产酶的影响
2.3.2 Fuc19菌株培养条件的优化 在Fuc19培养基成分优选的基础上,对其培养条件进行优化。从图3(a)可见,不同初始pH对该菌株生长和产酶能力影响较小,在pH为5~9时,Fuc19菌株的相对酶活力均在80%以上,其中pH为7时相对酶活力最高,对应的生物量也较高,因此,后续选择7作为最佳初始pH。从图3(b)可见,随着温度的升高,Fuc19菌株的生长和产酶能力随之降低,因此,后续选择20 ℃作为最佳培养温度。从图3(c)可见,随着装液量的增加,Fuc19菌株的相对酶活力呈先上升后下降的趋势,当装液量为75 mL时相对酶活力最高,因此,后续选择75 mL作为最佳装液量。从图3(d)可见,随着接种量的增加,Fuc19菌株的生物量和相对酶活力均呈下降趋势,当接种量为2%时生物量和酶活力均为最大,这可能是因为过高的初始接种量需要培养基提供更多的营养成分,因此,后续选择2%作为最佳接种量。

图3 发酵液成分对Sinomicrobium sp.Fuc19生物量和酶活力的影响
2.4 产酶优化的正交试验设计与结果
根据Fuc19培养的单因素试验结果,本研究中以酶活力和生物量为指标,设计7因素3水平的L18(37)正交试验(表1),进一步优化Fuc19菌株的培养条件,试验结果如表2所示。

表1 产酶优化正交试验因素水平表
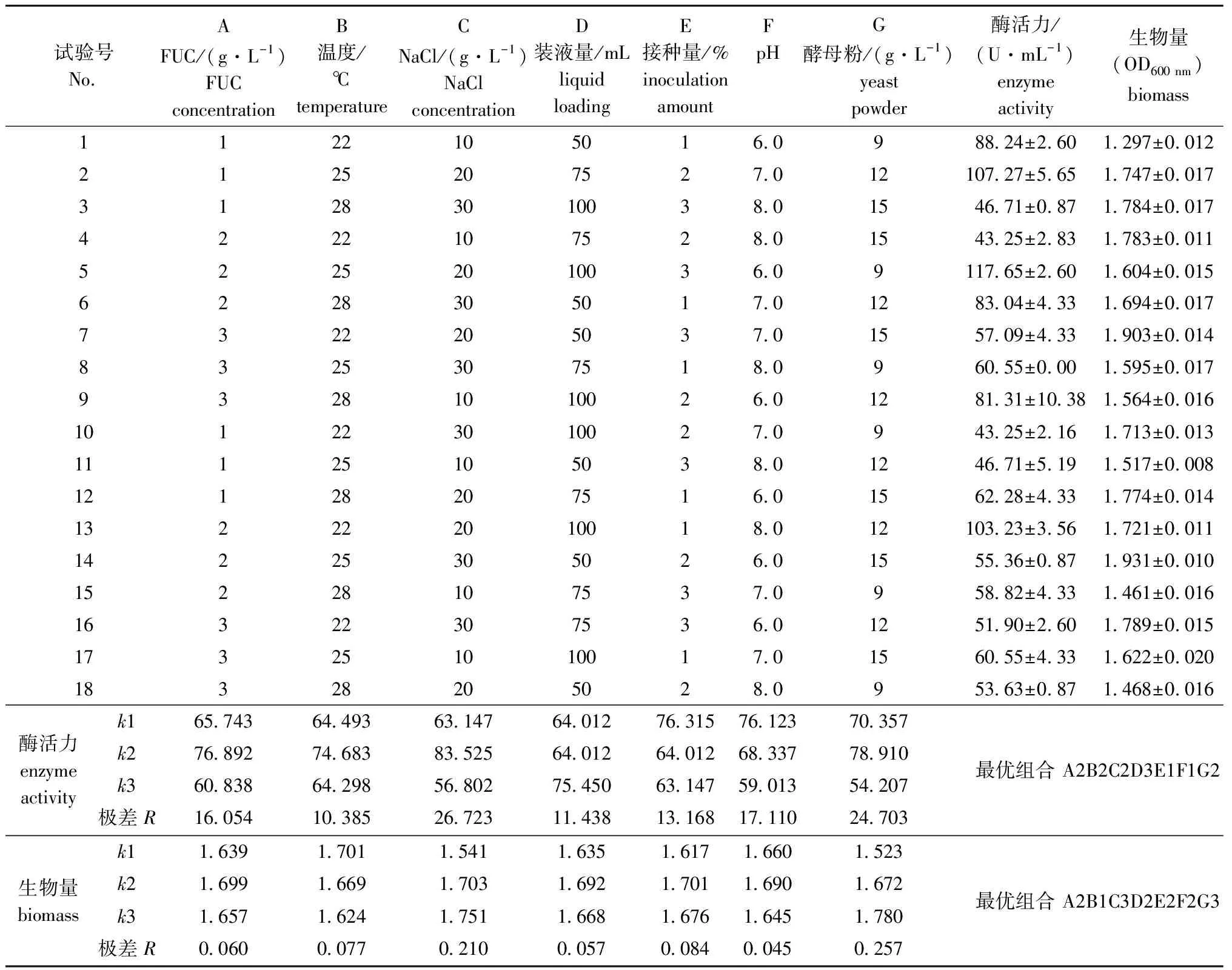
表2 正交试验设计方案及试验结果
极差分析结果表明:影响Fuc19菌株产酶活力高低的因素依次为NaCl浓度>酵母粉浓度>pH>FUC浓度>接种量>装液量>温度,理论最优化组合为A2B2C2D3E1F1G2,而酶活力正交试验表中,第5组试验结果最优;影响Fuc19菌株生物量高低的因素依次为酵母粉浓度>NaCl浓度>接种量>温度>FUC浓度>装液量>pH,理论最优组合为A2B1C3D2E2F2G3,生物量正交试验表中,第14组试验结果最优。将这4组进行验证试验(表3),结果表明,理论最优组合A2B2C2D3E1F1G2的Fuc19酶活力最高,为143.60 U/mL,OD600 nm值为1.666,相比优化前(95.23 U/mL)提高了50.8%。因此,确定Fuc19菌株最佳发酵培养基成分为FUC质量浓度2 g/L、酵母粉质量浓度12 g/L、NaCl质量浓度20 g/L和初始pH 6,最佳培养条件为温度25 ℃、装液量100 mL和接种量1%。

表3 验证试验
2.5 粗酶的酶学性质分析
2.5.1 酶最适反应温度及其稳定性 从表4可见:在20~30 ℃时酶活力变化不大,当温度为35 ℃时酶活力达到最大,之后随着温度的升高,酶活力降低至原来水平;分别在上述各温度中保温4 h后测定酶活力,随着温度的升高,酶活力整体呈下降趋势,当温度达到40 ℃时,其酶活力只有原酶活力的57.53%,说明该粗酶热稳定性较差。

表4 酶最适反应温度及其稳定性
2.5.2 酶最适pH及稳定性 从表5可见:当pH为8时,其酶活力达到最大,这可能与Fuc19来源于海洋环境(pH 7.8~8.0)弱碱性有关,菌株发酵后发酵液的pH为8;将粗酶液按照不同的pH进行复溶,在4 ℃条件下保温4 h后测定酶活力,菌株在pH为7时酶活力最高,在pH分别为6、8时,相对酶活力仍保持在60%左右,说明稳定性良好。
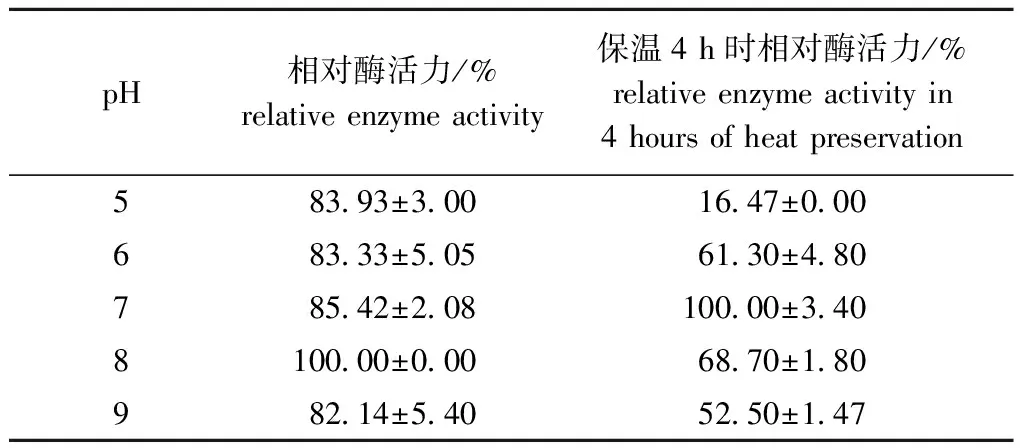
表5 酶最适反应pH及其稳定性

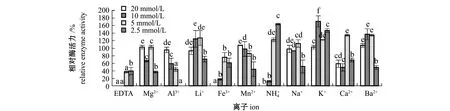
标有不同字母者表示同一浓度下不同离子组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
2.6 酶解产物的化学组成
将未酶解FUC样品和酶解后的产物经Sephacryl S-100洗脱分离。从图5可见,酶解液在洗脱体积136.5 mL后仍有洗脱峰,由此推断,此部分小分子物质是酶降解后的产物,说明Fuc19菌株所产的酶可将FUC大分子物质降解为小分子物质。分别收集F1(相对分子质量为10 000以上)、F2(相对分子质量为5 000~10 000)和F3(相对分子质量为1 000~5 000)3个组分。分析3个组分F1、F2、F3的总糖含量和单糖组成,结果如表6所示,组分F3的总糖含量较低,分析原因可能是在酶解物中存在有金属离子等杂质的干扰;FUC中葡萄糖和木糖的含量均在20%以上,经酶解后,各组分中的葡萄糖和木糖含量降低,岩藻糖和半乳糖含量增加,说明酶解产物主要由岩藻糖和半乳糖组成,其他单糖含量较低。
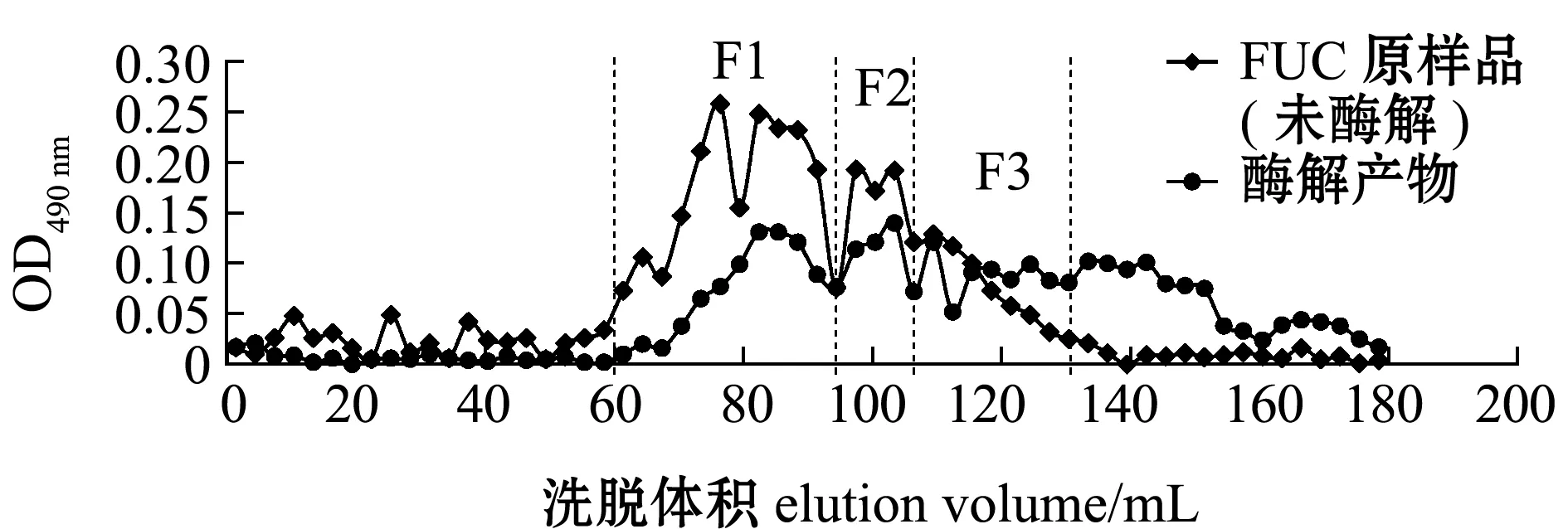
图5 酶解产物洗脱曲线
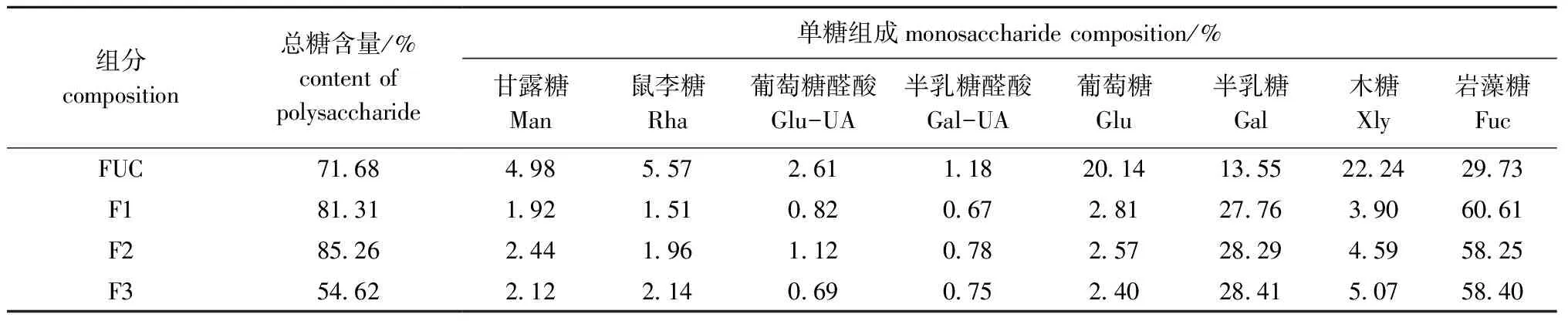
表6 酶解产物化学组成分析
3 讨论
3.1 产褐藻聚糖硫酸酯降解酶菌株的鉴定及产酶优化条件分析
褐藻聚糖硫酸酯酶的制备途径主要有两种,一方面来源于食用褐藻的海洋生物的肝胰腺,另一方面来源于海洋产酶微生物[10-13]。本研究中,从大连旅顺沿海海域的海水和泥沙中筛选出一株全新的菌株,经16S rDNA基因序列及系统发育分析显示,该菌株与大洋中华微菌属的相似度极高,其中,与之相似度最高的是SinomicrobiumoceaniALGLP8,一致性在99%以上,由此,鉴定该菌株属于大洋中华微菌属Sinomicrobium。该菌株在NaCl质量浓度为20 g/L、初始pH为6、培养温度为25 ℃、装液量为100 mL和接种量为1%条件下生长繁殖最佳。Xu等[14]从南海南沙群岛海洋沉积物样品中分离出能降解褐藻聚糖硫酸酯的海洋细菌,命名为SinomicrobiumoceaniSCSIO 03483T菌株,经鉴定属黄杆菌科Flavobacteriaceae,在温度为28~37.6 ℃、pH为7.0和NaCl为40 g/L条件下菌株生长最佳,本研究中发现的Sinomicrobiumsp.Fuc19的培养温度明显低于该菌株培养温度。Liu等[15]从北极土壤里发现的SinomibiumsoliN-1-3-6T菌株,与本研究中的Sinomicrobiumsp.Fuc19同属中华微菌属,对褐藻聚糖硫酸酯均具有降解作用。
单瑞芬[16]从浙江苍南海域采集的样品中筛选出一株能降解褐藻聚糖硫酸酯的菌株PseudidiomarinahomiensisZJCN121,该菌株的产酶优化发酵条件为初始温度20 ℃、pH 6.5、接种量2%和装液量100 mL,优化后产酶酶活力仅为1.19 U/mL,虽其发酵条件与本研究中的Sinomicrobiumsp.Fuc19类似,但Sinomicrobiumsp.Fuc19的酶活力具有明显优势;同样,王莹等[17]从青岛麦岛海域海水中筛选出一株能降解褐藻聚糖硫酸酯的菌株MD3,优化发酵条件为初始温度25 ℃、pH 8、装液量50 mL,优化后产酶能力由2.1 U/mL升至4.0 U/mL,同样与本研究中的Sinomicrobiumsp.Fuc19产酶酶活力相差较大。由此可见,产酶菌Sinomicrobiumsp.Fuc19的发现极具研究开发潜力,本研究中Sinomicrobiumsp.Fuc19发酵培养条件优化后产酶酶活力高达143.60 U/mL,相比优化前提高了50.8%,这为褐藻聚糖硫酸酯酶解制备低分子聚糖提供了较佳条件。
3.2 褐藻聚糖硫酸酯降解酶的酶学性质分析
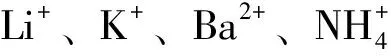
3.3 酶解褐藻聚糖硫酸酯低分子聚糖的单糖组成分析
有关褐藻聚糖硫酸酯的单糖组成分析报道较多,不同褐藻种类、不同制备方法得到的低分子聚糖组分和含量均有差异。寡糖的单糖组成分析报道主要集中在化学法和物理法制备的组分,至今未见酶解法制备褐藻聚糖硫酸酯低分子聚糖的单糖组成分析报道。本研究中,通过Sephacryl S-100将Fuc19粗酶酶解的笼目海带褐藻聚糖硫酸酯低分子聚糖分离纯化,单糖组成分析表明,低分子聚糖组分以岩藻糖和半乳糖为主。钟思燕等[22]利用酸降解法将羊栖菜褐藻聚糖硫酸酯降解成不同分子量的寡糖,单糖组成分析表明,MMWF1以岩藻糖、半乳糖和葡萄糖为主,LMWF2组分以岩藻糖和半乳糖为主,由此可见,2个组分均以岩藻糖和半乳糖为主。赵雪[23]通过酸水解法、超滤得到低分子量海带褐藻聚糖硫酸酯低硫组分F-A和高硫组分F-B,单糖组成分析表明,低硫组分主要由岩藻糖和半乳糖组成,高硫组分的岩藻糖含量略高于低硫组分,但半乳糖含量升高,说明酸解过程中有部分寡糖的单糖结构发生了变化。李芳等[24]采用自由基氧化结合超滤技术制备低分子量海带褐藻聚糖硫酸酯,并对其单糖组成进行分析,得到两个组分Fa3(相对分子质量为7 680)和Fb3(相对分子质量为3 890),其中,Fa3主要由岩藻糖和半乳糖组成,含量分别为64.25%和30.74%,Fb3与Fa3相比岩藻糖含量下降,半乳糖含量升高,研究同样表明,自由基氧化法制备寡糖会导致单糖结构变化。Liu等[25]分析了笼目海带褐藻聚糖硫酸酯粗糖(未降解)的4个纯化组分KF1~KF4,其中,KF1、KF3和KF4的单糖主要组成成分是岩藻糖,且KF4中岩藻糖含量高达91.44%,KF2的主要单糖组成成分为岩藻糖和甘露糖。显然,由Sinomicrobiumsp.Fuc19产酶酶解制备的低分子聚糖还是以岩藻糖和半乳糖为主,糖组成成分变化不大,且与上述化学法、物理法相比,酶解法制备低分子寡糖反应条件温和,未有或较少破坏单糖组成结构。
4 结论
1)以褐藻聚糖硫酸酯为唯一碳源,在大连旅顺沿海海水和泥沙中筛选获得一株产褐藻聚糖硫酸酯降解酶菌株Sinomicrobiumsp.Fuc19,拓宽了褐藻聚糖硫酸酯降解酶的种类,具有应用推广潜力。
2)通过正交试验优化确定产酶菌株最佳培养基成分为FUC质量浓度2 g/L、酵母粉质量浓度12 g/L、NaCl质量浓度20 g/L、初始pH 6,最佳培养条件为温度25 ℃、装液量100 mL和接种量1%,优化后产酶能力较优化前提高了50.8%。Sinomicrobiumsp.Fuc19在35 ℃、pH 8最适酶反应条件下,降解褐藻聚糖硫酸酯的能力最强。
3)对粗酶酶解的褐藻聚糖硫酸酯酶解产物分离纯化,得到一定量的低分子聚糖,说明Sinomicrobiumsp.Fuc19所产的酶具有较强的降解能力,可将褐藻聚糖硫酸酯大分子物质降解为小分子物质,这为制备低分子量低分子聚糖提供了一种新酶源。

