麻杏二陈止咳颗粒质量标准研究
崔健 谢广源 韦家欢 莫婷婷 王满福 杨力龙 周雨晴 马家宝 杨正腾














摘要 目的:建立麻杏二陳止咳颗粒(麻黄,陈皮,甘草)的质量标准并进行颗粒剂型的常规检查。方法:对麻杏二陈止咳颗粒进行粒度、水分、干燥失重、溶化性、装量差异、微生物限度检查。薄层色谱法(TLC)对陈皮和甘草进行定性鉴别;高效液相色谱法(HPLC)对马兜铃酸Ⅰ(CHNO)进行限量检查,对盐酸麻黄碱、盐酸伪麻黄碱进行含量测定。结果:麻杏二陈止咳颗粒的粒度、水分、干燥失重、溶化性、装量差异、微生物限度检查均符合《中华人民共和国药典》2015年版的相关规定;确定每克该颗粒中马兜铃酸Ⅰ(CHNO)不得超过0.66 μg;陈皮和甘草的TLC斑点清晰,阴性无干扰;HPLC色谱中阴性对照无干扰;盐酸麻黄碱、盐酸伪麻黄碱分别在10.04~100.4 μg、5.14~61.68 μg/mL范围内线性关系良好(r=0.999 9),平均加样回收率分别为101.50%(RSD=1.15%)、100.68%(RSD=1.97%)。结论:该方法准确、稳定、可行,可用于麻杏二陈止咳颗粒的质量控制。
关键词 麻杏二陈止咳颗粒;质量标准控制;薄层色谱法;高效液相色谱法;马兜铃酸Ⅰ;盐酸麻黄碱;盐酸伪麻黄碱
Study on the Quality Standard for Maxing Erchen Zhike Granules
CUI Jian,XIE Guanyuan,WEI Jiahuan,MO Tingting,WANG Manfu,YANG Lilong,ZHOU Yuqing,MA Jiabao,YANG Zhengteng
(The First Affiliated Hospital of Guangxi University of Chinese Medicine,Nanning 530023,China)
Abstract Objective:To establish the quality standard of Maxing Erchen Granules(Ephedra,Citrus Peel,Licorice)and carry out routine inspection.Methods:The granularity,moisture,weight loss,solubility,loading difference and microbial limit of Maxing Erchen Granules were examined.Thin Layer Chromatography(TLC)was used to qualitatively identify Pericarpium Citri Reticulatae and Radix Glycyrrhizae; High Performance Liquid Chromatography(HPLC)was used for limited inspection of aristolochic acid Ⅰ(CHNO).The ephedrine hydrochloride and pseudoephedrine hydrochloride were determined.Results:The particle size,moisture content,drying weight loss,solubility,loading difference and microbial limit test of Maxing Erchen granules all conform to the relevant provisions of the 2015 edition of the Chinese Pharmacopoeia.It was determined that the content of aristolochic acid Ⅰ(CHNO)in the granule should not exceed 0.66μg/g.The TLC spots of Pericarpium Citri Reticulatae and Radix Glycyrrhizae were clear,the negative reference were without interference.HPLC chromatograms revealed no interference due to negative reference.Ephedrine hydrochloride and pseudoephedrine hydrochloride showed good linear relationship(r=0.999 9)in the range of 10.04~100.4 μg and 5.14~61.68 μg/ml,respectively.The average recoveries of ephedrine hydrochloride and pseudoephedrine hydrochloride were 101.50%(RSD=1.15%)and 100.68%(RSD=1.97%)respectively.Conclusion:This accurate,stable and feasible method can be used for the quality control of Maxing Erchen Granules.
Keywords Maxing Erchen Granules; Quality standard control; Thin layer chromatography; High Performance Liquid Chromatography; Ephedrine hydrochloride I; Aristolochic acid; Pseudoephedrine hydrochloride
中图分类号:R289.5;R284文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.06.001
麻杏二陈止咳颗粒是在麻杏二陈汤基础上加减研发制备的顆粒剂型。麻杏二陈止咳原汤剂是广西中医药大学第一附属医院全国名中医王力宁教授的经验方,由炙麻黄、杏仁、细辛、射干、僵蚕、半夏、陈皮、茯苓、莱菔子和甘草十味药组成,该方根据小儿特禀质咳嗽(痰湿质咳嗽)的特点,辨证论治,在治疗小儿特禀质咳嗽方面效果奇佳[1-5]。方中炙麻黄、杏仁宣降肺气,细辛宣肺散寒,射干、僵蚕解痉祛风,半夏、陈皮,茯苓燥湿化痰健脾行水,莱菔子化痰降逆,甘草和中调和诸药。诸药合用,标本兼顾,共奏逐寒化痰止咳之效。由于近年来药材价格的上升和汤剂使用的局限性,因此考虑将该处方由汤剂开发成颗粒剂,既可保留原处方的有效性,又符合小儿服药特点,还便于携带与保存,同时提高制剂稳定性。目前,关于麻杏二陈止咳颗粒的报道主要以制备工艺的研究为主,包括杨正腾等[6]通过正交试验优选出了麻杏二陈止咳颗粒的提取工艺,并采用高效液相色谱法(High Performance Liquid Chromatography,HPLC)建立了方中橙皮苷含量测定的方法;叶信等[7]通过正交试验设计,以挥发油与β-环糊精比例、包合温度、包合时间作为考察因素,以挥发油利用率和包合物得率的综合评分为评价指标,优选出了β-环糊精包合麻杏二陈止咳颗粒中陈皮、细辛挥发油的最佳包合工艺条件等。但未见麻杏二陈止咳颗粒完整的质量标准方面的报道。
1 材料与方法
1.1 材料
1.1.1 仪器与试剂 高效液相色谱仪(安捷伦公司,美国,型号:1260),Agilent ZORBAX C SB-Aq分析色谱柱(安捷伦公司,美国,型号:4.6×250 mm型);水纯化系统(Millipore公司,美国,型号:Milli-QIntergral),分析天平[赛多利斯科学仪器(北京)有限公司,型号:SQP],电热恒温水浴锅(上海齐欣科学仪器有限公司,型号:HWS-26)。橙皮苷对照品(中国食品药品检定研究院,批号:110721-200512);甘草对照药材(中国食品药品检定研究院,批号:120904-201015)。硅胶G(青岛海洋化工厂,批号:20180603);甲醇色谱纯(飞世尔科学世界公司,美国,批号:201606)、乙腈色谱纯(飞世尔科学世界公司,美国,批号:201701),麻杏二陈止咳颗粒(广西中医药大学第一附属医院,批号:20190901、20181001、20181201、20181202、20181203)。
1.2 方法
1.2.1 检查方法
各检查项按《中华人民共和国药典》2015年版四部通则0104“颗粒剂”项下的有关规定进行检验。检查项目有:粒度、水分、溶化性、装量差异、微生物限度[8]。
1.2.1.1 粒度 按《中华人民共和国药典》2015年版四部通则0104“颗粒剂”项下“粒度”检查了3批样品(批号:20181201、20181202、20181203),按照粒度和粒度分布测定法(通则0982第二法双筛分法)测定,不能通过一号筛与能通过五号筛的总和不得超过15%。结果均符合规定。见表1。
1.2.1.2 水分 按照《中华人民共和国药典》2015年版四部通则0832“水分测定法”检查了3批样品(批号:20181201、20181202、20181203),水分不得超过8.0%。结果均符合规定。见表2。
1.2.1.3 溶化性 取供试品1袋,加热水200 mL,搅拌5 min,立即观察。检查了3批样品(批号:20181201、20181202、20181203),结果3批颗粒均全部溶化,有轻微浑浊,未见焦屑等异物。
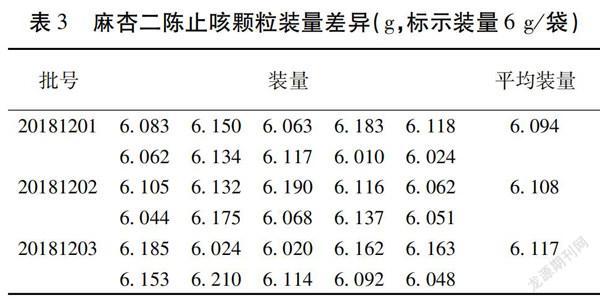
1.2.1.4 装量差异 按照《中华人民共和国药典》2015年版四部通则0104“颗粒剂”项下“装量差异”检查了3批样品(批号:20181201、20181202、20181203)。取供试品10袋,除去包装,分别精密称定每袋内容物的重量,求出每袋内容物的装量与平均装量。装量差异限度为标示装量的±7%(5.58~6.42 g),每袋装量与标示装量比较,超出装量差异限度的颗粒剂不得多于2袋,并不得有1袋超出装量差异限度1倍。结果均符合规定。见表3。
1.2.1.5 微生物限度 按照《中华人民共和国药典》2015年版四部通则“1105、1106非无菌产品微生物限度检查法”有关规定,对中试3批样品进行了检查,结果均符合规定。见表4。
1.2.2 马兜铃酸Ⅰ的限量检查[9-12]
1.2.2.1 溶液的制备 对照品溶液的制备:精密称取马兜铃酸Ⅰ对照品10.26 mg,置100 mL量瓶中,加甲醇使溶解并稀释至刻度,摇匀(102.6 μg/mL);精密量取0.2 mL置100 mL量瓶中,加甲醇稀释至刻度,摇匀,制成1 mL中含0.205 2 μg的溶液,即得。
供试品溶液的制备:取本品,研细,取5 g,精密称定,置具塞锥形瓶中,加甲醇50 mL,超声处理(500 W,40 kHz)30 min,放冷,滤过,取续滤液25 mL蒸干,残渣加0.1 mol/L氢氧化钠溶液25 mL使溶解,溶液转移至分液漏斗中,加三氯甲烷提取2次,25 mL/次,弃去三氯甲烷液,加盐酸调节pH值至1~2,用三氯甲烷提取3次,25 mL/次,合并三氯甲烷液,水浴蒸干,残渣加甲醇使溶解,并转移至10 mL量瓶中,用甲醇稀释至刻度,摇匀,即得。
阴性样品溶液的制备:阴性样品溶液是按处方比例称取除细辛外的其余味药,按制法制成细辛阴性样品,再取此阴性样品按上述“供试品溶液的制备”方法制备缺细辛的阴性样品溶液。
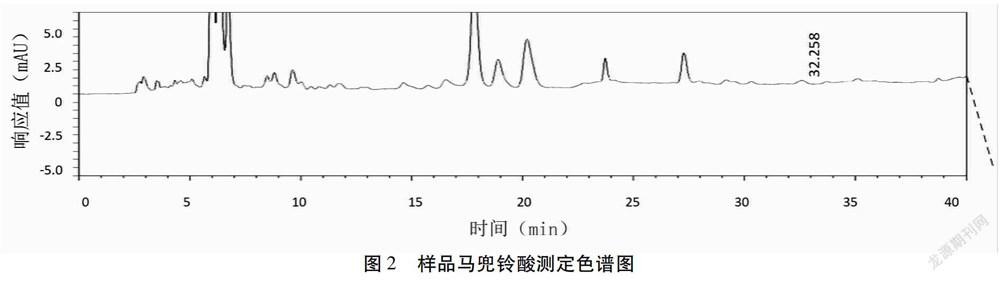
1.2.2.2 色谱条件与系统适用性试验 色谱柱:十八烷基键合硅胶为填充剂(Agilent ZORBAX C SB-Aq 4.6 mm×250 mm);以乙腈为流动相A,以0.05%磷酸溶液为流动相B,按表5中的規定进行梯度洗脱;检测波长为319 nm。色谱见图1~3。
1.2.2.3 限度的确定 根据《中华人民共和国药典》2015年版一部230页细辛马兜铃酸Ⅰ(CHNO)限量项下规定,按干燥品计算,含马兜铃酸Ⅰ(CHNO)不得过0.001%;经计算,本品每克含细辛药材0.066 7 g,按药材限量和完全转移计算,本品理论含量为每克含马兜铃酸Ⅰ(CHNO)为0.667 μg,本次测定马兜铃酸Ⅰ含量为0.184 μg/g。因此,按照药典要求,可暂定本品中马兜铃酸Ⅰ限度为:本品每克含马兜铃酸Ⅰ(CHNO)不得过0.66 μg。
1.2.3 定性鉴别[13-14]
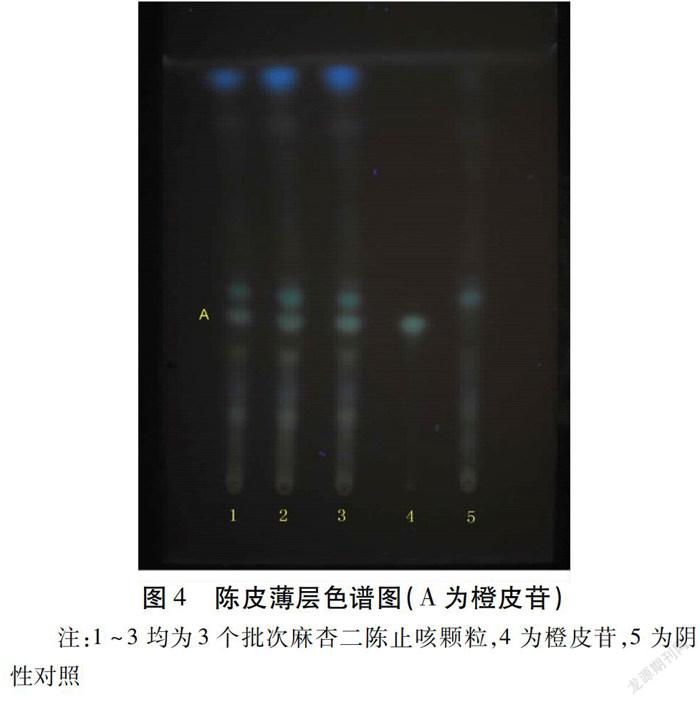
1.2.3.1 陈皮薄层色谱法(Thin Layer Chromatography,TLC)鉴别 取麻杏二陈止咳颗粒4 g,研细,加70%乙醇30 mL,加热回流1 h,放冷,滤过,滤液蒸干,残渣加水20 mL使溶解,用正丁醇提取2次,15 mL/次,合并正丁醇液,蒸干,残渣加甲醇1 mL使溶解,作为供试品溶液。另取橙皮苷对照品,加甲醇制成饱和溶液。照薄层色谱法(《中华人民共和国药典》2015年版四部通则0502)试验,吸取供试品溶液和对照品溶液各5 μL,分别点于同一用1%氢氧化钠溶液制备的硅胶G薄层板上,以乙酸乙酯-甲醇-水(100∶17∶13)为展开剂展开,取出晾干,喷以三氯化铝试液,置紫外光灯(365 nm)下检视。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光斑点。见图4。
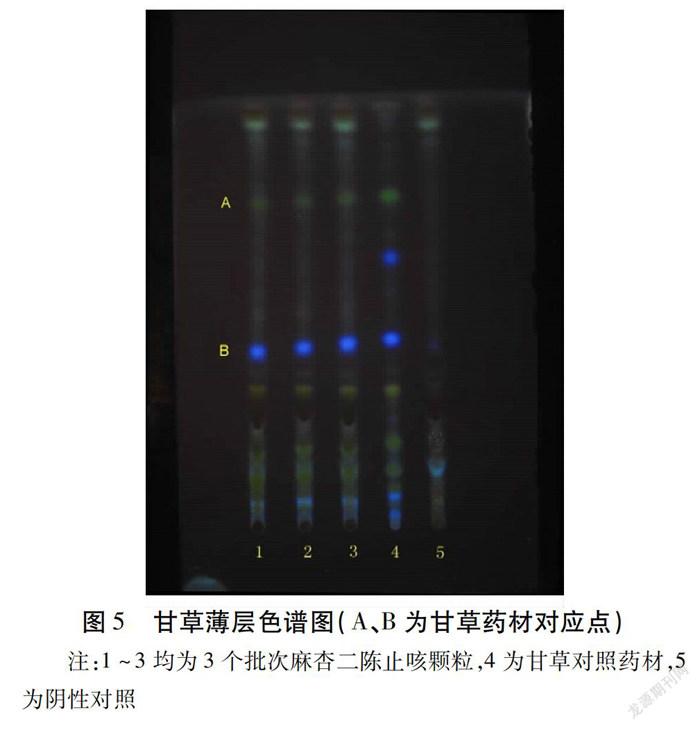
1.2.3.2 甘草薄层色谱鉴别 取甘草对照药材1 g,加70%乙醇30 mL,加热回流1 h,放冷,滤过,滤液蒸干,残渣加水20 mL使溶解,用正丁醇提取2次,15 mL/次,合并正丁醇液,蒸干,残渣加甲醇1 mL使溶解,作为对照药材溶液。照薄层色谱法(《中华人民共和国药典》2015年版四部通则0502)试验,吸取“1.2.3.1”项下的供试品溶液及上述对照药材溶液各5~10 μL,分别点于同一硅胶G薄层板上,以乙酸乙酯-无水乙醇-丙酮-浓氨试液(10∶1∶5∶2)为展开剂展开,取出晾干,依次喷以三氯化铝试液和10%硫酸乙醇溶液,105 ℃加热至斑点显色清晰,置紫外光灯(365 nm)下检视。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点。见图5。
1.2.4 HPLC含量测定
1.2.4.1 色谱条件及系统适应性试验 菲罗门Synergi Polar-RP 80A 4.6×250 mm,4 μm,流动相:以甲醇(A)-0.092%磷酸溶液(B)(含0.04%三乙胺和0.02%二正丁胺)为流动相,等度洗脱1.5∶98.5;流速:1 mL/min,柱温:30 ℃;检测波长:210 nm;进样量为10 μL。理论塔板数按盐酸麻黄碱峰计算大于3 000[15-16]。
1.2.4.2 对照品溶液的制备 取盐酸麻黄碱对照品约10 mg,精密称定为10.04 mg,置10 mL量瓶中,加水使溶解并稀释至刻度,摇匀(1.004 mg/mL);取盐酸伪麻黄碱对照品约10 mg,精密称定为10.28 mg,置10 mL量瓶中,加甲醇使溶解并稀释至刻度,摇匀(1.028 mg/mL);精密量取盐酸麻黄碱对照品溶液0.4 mL,盐酸伪麻黄碱对照品溶液0.15 mL置同一10 mL量瓶,加水稀释至刻度,摇匀,即得(盐酸麻黄碱:40.16 μg/mL,盐酸伪麻黄碱:15.42 μg/mL)[15-16]。
1.2.4.3 供试品溶液的制备 将本品研细,精密称取3批次样品各5 g,置500 mL圆底烧瓶中,加氯化钠20 g、8%氢氧化钠溶液150 mL,混匀,蒸馏(流速1 mL/min),用盛有1 mol/L盐酸10 mL的100 mL量瓶接收馏出液至约95 mL,加水稀释至刻度,摇匀,超声10 min,即得[15-16]。
1.2.4.4 阴性样品溶液的制备 按处方比例精密称取除蜜麻黄外的其余味药,按制法制成蜜麻黄阴性样品,再取此阴性样品按“1.2.4.3”项下方法制备,即得缺蜜麻黄的阴性样品溶液。
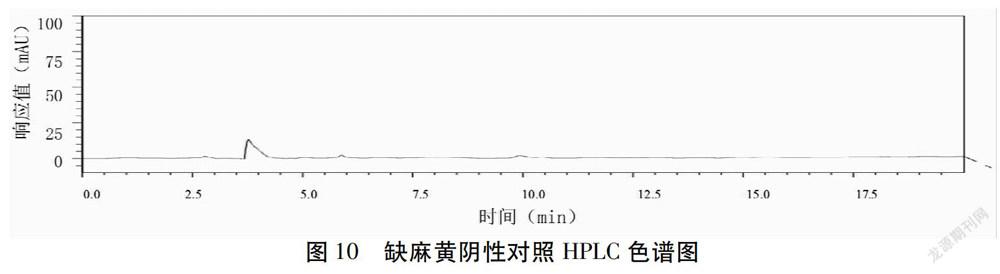
1.2.4.5 专属性试验 取“1.2.4.2”-“1.2.4.4”项下溶液各10 μL,在“1.2.4.1项”色谱条件进样测定。结果见图6~10。由图可知,对照品色谱峰分离度良好,阴性无干扰。
1.2.4.6 检测限、定量限考察 取“1.2.4.2”项下对照品适量,将2种溶液成倍稀释,以S/N=3为检测限,S/N=10为定量限。结果,盐酸麻黄碱检测限和定量限分别为2.10 ng、8.10 ng,盐酸伪麻黄碱分别为2.21 ng、8.05 ng[17-18]。
1.2.4.7 标准曲线的制备 精密移取“1.2.4.2”项下盐酸麻黄碱对照品溶液(浓度:1.004 mg/mL)0.1 mL、0.2 mL、0.4 mL、0.8 mL、1 mL,精密量取盐酸伪麻黄碱对照品溶液(浓度:1.028 mg/mL)0.05 mL、0.1 mL、0.15 mL、0.3 mL、0.6 mL,分别置同一10 mL量瓶中,加水稀释至刻度,摇匀,制成1 mL含盐酸麻黄碱10.04 μg、20.08 μg、40.16 μg、80.32 μg、100.4 μg及盐酸伪麻黄碱5.14 μg、10.28 μg、15.42 μg、30.84 μg、61.68 μg的系列浓度的混合对照品溶液。按“1.2.4.1”项下色谱条件,分别进样10 μL,测定,以峰面积积分A对盐酸麻黄碱和盐酸伪麻黄碱的进样量C(μg)进行线性回归分析,得线性回归方程:盐酸麻黄碱:A=1.48×10C-1.17×10(n=5),r=0.999 9;盐酸伪麻黄碱:A=1.55×10C+2.46×10(n=5),r=0.999 9。表明盐酸麻黄碱进样量在0.100 4~1.004 μg范围内线性关系良好,并且直线通过原点,可用单点外标法进行测定和计算;盐酸伪麻黄碱进样量在0.051 4~0.616 8 μg范围内线性关系良好,并且直线通过原点,可用单点外标法进行测定和计算。
1.2.4.8 精密度试验 取盐酸麻黄碱(40.16 μg/mL)及盐酸伪麻黄碱(15.42 μg/mL)混合对照品溶液,按上述色谱条件,依法测定,重复进样6次,计算盐酸麻黄碱和盐酸伪麻黄碱峰面积A的相对标准偏差。结果盐酸麻黄碱和盐酸伪麻黄碱的平均峰面积分别为594705,242929,RSD值分别为0.06%,0.18%,表明仪器精密度良好。
1.2.4.9 对照品纯度检查 取盐酸麻黄碱对照品溶液(浓度:1.004 mg/mL)和盐酸伪麻黄碱对照品溶液(浓度:1.028 mg/mL),按上述色谱条件,分别进样10 μL,测定,用峰面积归一化法计算,盐酸麻黄碱纯度为98.75%,盐酸伪麻黄碱纯度为98.53%,符合含量测定要求,计算时按100%计算。
1.2.4.10 稳定性试验 取供试品(批号:20181001),按“1.2.4.3项”供试品溶液的制备方法进行,分别在放置0、2、4、6、8及24 h后,依法测定盐酸麻黄碱和盐酸伪麻黄碱的峰面积A,计算相对标准偏差,结果盐酸麻黄碱和盐酸伪麻黄碱的平均峰面积分别为531 255,191 225,RSD值分别为0.97%,0.78%,表明供試品溶液在24 h内稳定性较好。
1.2.4.11 重复性试验 取同一样品(批号:20181001),按“1.2.4.3项”供试品溶液的制备方法进行,制备6份供试品溶液,依法测定,计算盐酸麻黄碱和盐酸伪麻黄碱的含量及相对标准偏差,结果,供试品中盐酸麻黄碱和盐酸伪麻黄碱的平均含量分别为0.711 mg/g,0.247 mg/g,RSD值分别为0.37%,1.88%,表明该方法重复性良好。
1.2.4.12 加样回收率试验 精密称取已测知含量的样品(批号:20181001,盐酸麻黄碱含量0.711 mg/g,盐酸伪麻黄碱含量0.247 mg/g)约2.5 g,精密称定,置500 mL圆底烧瓶中,再分别精密加入1.993 mg/mL的盐酸麻黄碱对照品溶液(精密称取盐酸麻黄碱对照品19.93 mg,置10 mL量瓶中,加水使溶解并稀释至刻度,摇匀)1 mL,1.072 mg/mL的盐酸伪麻黄碱对照品溶液(精密称取盐酸伪麻黄碱对照品10.72 mg,置10 mL量瓶中,加水使溶解并稀释至刻度,摇匀)0.6 mL,加氯化钠20 g、8%氢氧化钠溶液150 mL,混匀,照“供试品溶液制备方法”试验,平行6份,依法测定,计算回收率,结果表明方法回收率较好。见表6、表7。
2 结果
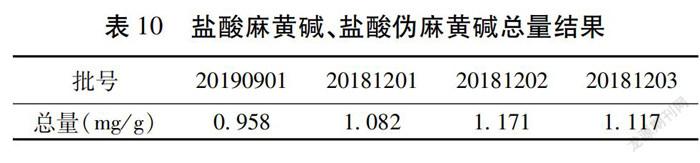
2.1 样品含量测定 取4个不同批号的麻杏二陈止咳颗粒(n=4),按“1.2.4.3项”下供试品制备方法进行,以峰面积外标法品中盐酸麻黄碱和盐酸伪麻黄碱的含量。结果表明颗粒剂有效成分盐酸麻黄碱和盐酸伪麻黄碱测定结果稳定,根据《中华人民共和国药典》2015年版一部320页。见表8~10。麻黄项下规定,按干燥品计算,含盐酸麻黄碱(CHNO·HCl)和盐酸伪麻黄碱(CHNO·HCl)的总量不得少于0.80%,本品每克含蜜麻黄药材0.167 g,盐酸麻黄碱和盐酸伪麻黄碱为水溶性成分,按药材含量低限和转移率40%计算,本品理论含量为每克含盐酸麻黄碱(CHNO·HCl)和盐酸伪麻黄碱(CHNO·HCl)0.53 mg,因此,暂定本品含量限度为:本品每克以盐酸麻黄碱(CHNO·HCl)和盐酸伪麻黄(CHNO·HCl)的总量计不得少于0.53 mg。
3 讨论
本颗粒剂中含有细辛中药材,虽用量较少,但是出于用药安全性的考虑,对其含有的毒性成分进行了限量测定。在马兜铃酸类化合物中,主要的毒性成分为马兜铃酸Ⅰ和马兜铃酸Ⅱ,在硝基还原酶的催化下,一部分马兜铃酸Ⅰ被还原为马兜铃内酰胺,另一部分在还原过程中进一步与DNA作用,形成加合物。其中马兜铃酸Ⅰ是马兜铃属植物中毒性最强的成分。另有研究发现,不但马兜铃酸具有很强的肾毒性,其代谢产物马兜铃内酰胺同样具有肾毒性。又通过对马兜铃酸代谢过程及代谢酶的研究证实,马兜铃酸致突变和致癌毒性是由其代谢的中间产物马兜铃内酰胺氮离子引起的,因为它具有很强的亲电能力,能与DNA碱基环外氨基亲电结合,生成相应的加合产物,使RAS基因和P53基因发生突变,进而诱发肿瘤。为了本品安全可控,我们须对本品中马兜铃酸Ⅰ含量进行控制,建立其限量检查的方法[19]。
《中华人民共和国药典》[20](2015年版)收载麻黄为麻黄科植物草麻黄、中麻黄或木贼麻黄的干燥草质茎,主要药用成分为左旋麻黄碱、右旋伪麻黄碱、左旋甲基麻黄碱、右旋甲基伪麻黄碱、左旋去甲基伪麻黄碱、右旋去甲基伪麻黄碱等生物碱以及挥发油类、鞣质类、黄酮类、糊粉、菊粉、果胶、纤维素、葡萄糖等多糖类、草酸、柠檬酸和苹果酸等有机酸类[21]。本颗粒剂型中,麻黄作为君药,起到宣肺平喘之效。其作为平喘和止咳之要药,多种中成药制剂种均含有。本研究也将其含有的麻黄碱和伪麻黄碱成分作为质量标准中含量测定的首选。试验研究过程中,考虑更好地发挥君药的功效,采取了水提和乙醇回流的方式进行了麻黄药材的提取工作,以麻黄碱的含量和小鼠的止咳药效学2个指标进行了观察,发现虽然乙醇回流提取的方式麻黄碱的含量较高,但是在止咳药效方面,水提取的麻黄镇咳效果更加明显,这与孟硕等[22]研究麻荆颗粒中麻黄提取的方法优化论述一致,原因可能是水提物成分更多、更复杂,在镇咳方面发挥了综合的作用,而乙醇提取物成分经过纯化,虽保留了较高的活性成分,但是缺乏了多种物质之间的相互作用,这也恰恰体现了中医药在治疗疾病方面的整体思想和针对某些病症治标又治本的综合优势。
参考文献
[1]邓玉芝,王力宁,黄美芬,等.王力宁治疗小儿咳嗽经验[J].湖南中医杂志,2017,33(2):37-39.
[2]王力宁,冯春辉,陈金月,等.麻杏二陈汤煮散治疗小儿特禀质咳嗽的临床研究[J].中医儿科杂志,2012,8(5):32-35.
[3]王力宁.王力宁教授治疗小儿特禀质咳嗽的经验介绍[C].第二十九次全国中医儿科学术大会暨“小儿感染性疾病的中医药预防”培训班论文汇编.北京:中华中医药学会儿科分会,2012.
[4]王力宁.麻杏二陈汤加减治疗小儿咳嗽变异性哮喘的近期疗效观察[J].广西医科大学学报,2005,22(5):797.
[5]陈金月,王力宁,李海英,等.麻杏二陈汤煮散与饮片止咳祛痰作用的比较[J].中医药导报,2015,21(17):39-41.
[6]楊正腾,叶信,马家宝,等.麻杏二陈特禀咳颗粒的提取工艺优选及含量测定研究[J].广西中医药,2016,39(5):72-75.
[7]叶信,杨正腾,陈勇,等.麻杏二陈特禀咳颗粒中挥发油的β-环糊精包合优选工艺[J].中国民族民间医药,2017,26(9):14-15,19.
[8]国家药典委员会.中华人民共和国药典(四部)[M].北京:中国医药科技出版社,2015:7.
[9]孙婉瑾,金实,姜楠,等.理气消瘿片中马兜铃酸A的限量检查及急性毒性试验[J].湖北大学学报:自然科学版,2019,41(5):501-505.
[10]吕情花.追风透骨胶囊中马兜铃酸A的限量检查[J].中国现代药物应用,2015,9(15):285-286.
[11]侯帅红,李晶晶,韩林涛,等.细辛不同药用部位马兜铃酸的含量测定[J].湖北中医药大学学报,2018,20(6):42-44.
[12]刘新,林於.细辛中马兜铃酸的HPLC限量测定方法探讨[J].中成药,2008,30(6):896-899.
[13]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:86,191.
[14]麦荣国,郭晓銮,招丽娟,等.麻黄汤不同配伍对苦杏仁和甘草有效成分的影响[J].世界中医药,2018,13(3):735-738.
[15]罗奕,姚文丽,吴琳琳,等.HPLC法同时测定咳速停胶囊中4种成分[J].中成药,2017,39(1):102-106.
[16]张蓓,罗旭明,李默影,等.芪仙地花颗粒质量标准的研究[J].中成药,2019,41(3):521-525.
[17]余新华,周虹,邵永生,等.基于指纹图谱评价麻黄汤中药物的成分分析研究[J].世界中医药,2017,12(7):1656-1659.
[18]周雪红,李志浩,陈银华,等.SPE-HPLC法测定麻黄止嗽丸中马兜铃酸A的含量[J].中医药导报,2015,21(14):44-46.
[19]侯改灵,黄岩杰,杨晓青,等.从临床表现和致病机制再认识马兜铃酸类中药的肾毒性[J].中药药理与临床,2019,35(2):162-166.
[20]国家药典委员会.中华人民共和国药典[M].北京:人民卫生出版社,2015:322-323.
[21]陈光玮,田彦芳,万海同,等.麻黄汤有效组分对发热大鼠的解热作用及与药动学相关性研究[J].中国中药杂志,2020,45(3):655-663.
[22]孟硕,张鹏,葛争艳,等.结合药效学优选麻荆颗粒中麻黄提取方法[J].中药新药与临床药理,2016,27(1):118-121.
(2020-02-11收稿 本文编辑:张雄杰)
基金项目:广西科技厅重点研发项目(AB19110003)——医院制剂壮药毒结清丸的研发;广西中医药大学第一附属医院院级科研项目(2017ZJ006)——麻杏二陈特禀咳颗粒药效及毒性探究
作者简介:崔健(1987.09—),女,硕士,主管药师,研究方向:中药及其制剂质量分析,E-mail:18776728630@163.com
通信作者:杨正腾(1970.09—),男,硕士,主任药师,研究方向:中药及其制剂质量分析,E-mail:674632459@qq.com

