不同激素对蝴蝶兰叶片类原球茎诱导的影响
朱飞雪 程玉江 寇艳玲 齐阳阳 郭丽

摘要:为提高蝴蝶兰叶片类原球茎的诱导率,以蝴蝶兰杂交品种01、02、03、04、05、06、07和08增殖阶段组培苗顶部幼嫩叶片为实验材料,采用1/2MS为基本培养基,添加不同激素种类并设置不同浓度梯度,以探讨6-苄基腺嘌呤(6-BA)、腺嘌呤(Ad)、萘乙酸( NAA)、噻苯隆(TDZ)及其组合对蝴蝶兰叶片类原球茎诱导的影响。结果表明:单独使用6-BA类原球茎诱导率较低,TDZ的刺激作用强于6-BA;细胞分裂素和生长素的配合使用效果较好,且不同品种所需激素配比具有差异。其中,01、07品种最佳的诱导培养基为1/2MS+TD20.5mg.L-1,诱导率分别为75.3%、82%; 02品种最佳的诱导培养基为1/2MS+TD20.5mg.L-1'+NAAO.1mg.L-1,其诱导率为24%; 04、05、08品种最佳的培养基为1/2MS+TD22mg.L-1+NAAO.1mg.L-1,诱导率分别为75.7%、60.7%、73.3%;03、06品种最佳的培养基为1/2MS+6-BA5mg.L一1+NAAlmg.L一1+Ad3mg.L一1,诱导率分别为440/、50.7%。
关键词:蝴蝶兰;激素;叶片;类原球茎;诱导率
蝴蝶兰是单子叶植物纲天门冬目兰科蝴蝶兰属多年生附生植物,主要分布在泰国、菲律宾、马来西亚、印度尼西亚及中国台湾等地。其花形奇特,花姿高雅,色泽艳丽,花期持久,有“兰中皇后”的美譽[1],在国内外花卉市场中,蝴蝶兰因其花大色艳备受欢迎。因此,蝴蝶兰已成为兰科中栽培最广泛、产业化技术最成熟和最受欢迎的花卉之一,具有广阔的市场前景[2],随着人们欣赏水平的提高,人们对花型、花色提出了更高的要求,这就要求蝴蝶兰育种家能在短时间内选育出符合市场需求的新品种[3]。
蝴蝶兰多以杂交育种为主,但后代花色变异过大,育种周期又过长[4];而转基因育种目标性强[5],育种周期短[6],已开始在蝴蝶兰新品种选育中广泛应用[7-8]。在转基因育种中合适目标基因选择、高效遗传转化体系是获得蝴蝶兰转基因植物的前提条件[9]。兰科转基因植物成功的关键在于促进细胞组织再生为植株。研究发现,由蝴蝶兰种子[10]、叶片[11]、花梗、腋芽[12]甚至是根部诱导而得到的球形细胞,类似于幼胚发育成的体细胞——类原球茎,在合适的条件下可以再生为完整的植株。因此,在蝴蝶兰转基因的研究当中,类原球茎最常被选为受体材料。而原球茎的诱导率是决定转基因成功的关键,很多学者选择利用蝴蝶兰叶片诱导出类原球茎。黄磊等[13]、马生健等[14]、乔永旭等[15]利用蝴蝶兰叶片来诱导类原球茎,但是类原球茎的诱导率均不高。可见,类原球茎诱导的难度仍然很大,建立一个高效、稳定的类原球茎诱导体系是亟需的,也在蝴蝶兰组培快繁体系中始终占有重要地位[16]。为此,本实验以蝴蝶兰杂交品种01、02、03、04、05、06、07、08增殖阶段组培苗顶部幼嫩叶片为实验材料,以1/2MS为基本培养基,添加不同种类的激素,以期探究适合蝴蝶兰叶片诱导原球茎的激素种类、浓度以及配比组合,为蝴蝶兰原球茎诱导高频再生体系的建立及转基因育种提供依据。
一、材料与方法
(一)实验材料
实验材料为蝴蝶兰8个栽培品种,代号分别为01(黄花红心)、02(小黄花)、03(黄花)、04(小白花)、05(白底红点)、06(四季红)、07(红玫瑰)、08(黑花)共八个品种。
(二)实验方法
切取幼嫩叶片基部0.5 - 1.0cm,正面朝上,接种于以1/2 MS为基本培养基,添加不同浓度的6- BA、TDZ、NAA、Ad,共15种处理,见表1。并附加20%的椰子汁,琼脂5.0g.L-l,糖20g.L-,pH值5.8。每个处理设三个重复,每个重复接种50个叶片。培养温度26+1℃,光照强度500 - 600lx散射光,光照时间16h/d,培养50d后统计结果。
(三)数据分析
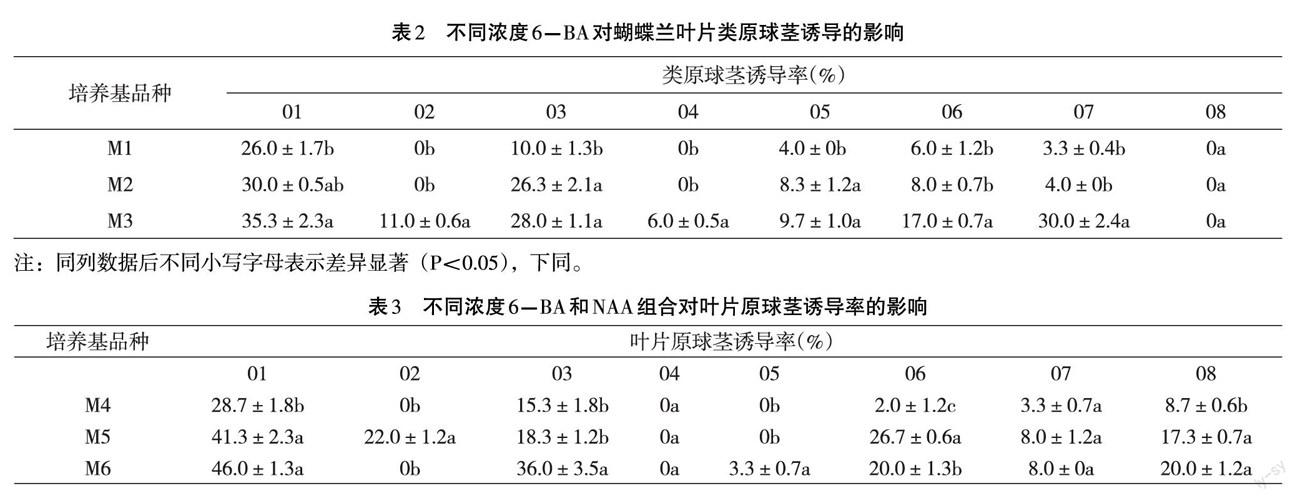
培养50d后,统计每瓶叶片诱导出的类原球茎、叶片发黄死亡的数量,计算出其类原球茎诱导率以及叶片黄化死亡率(文中简称黄死率)。诱导率(%)及黄化死亡率(%)的计算公式如下。 诱导率(%)=类原球茎数/外植体数X100% 黄化死亡率(%)=黄化死亡数/外植体数X100% 实验统计数据采用Excel和SPSS16.0软件处理分析。 二、结果与分析 (一)不同浓度6-BA对叶片类原球茎诱导的影响 不同浓度6-BA处理下,不同品种的叶片类原球茎的诱导率不同,结果见表2。由表2可以看出,01-07品种随着6-BA浓度的增加,类原球茎的诱导率也逐渐增加。8个品种中,01、07品种在6-BA浓度为8mg.L-1时,类原球茎诱导率最高,分别为35.3%和30.0%。尤其07号品种,经方差分析,其诱导率显著高于其它两个处理。02、04、08品种的诱导率最低,在6-BA浓度(mg.L-1)为3、5时,诱导率均为o;当升至8mg.L-时,02、04品种的诱导率分别增加至11%和6%,08品种的诱导率仍然是0。从实验结果可以得出,高浓度的6-BA有利于诱导出叶片原球茎。但是,从表2中可以看出,01品种在3个浓度上较高的原球茎诱导率为35.3%、30.0%、26.0%,其它几个品种则更低,均不超过20.0%。表明单独使用6-BA诱导出的叶片原球茎数量较少。
由表2还能看出,除了6-BA浓度会影响叶片原球茎的诱导之外,品种之间的差异也较大,尤其是08品种,即使6-BA浓度增加至8mg.L-1,其诱导率仍然是0。
(二)6-BA与NAA组合对叶片原球茎诱导的影响
在添加3、5、8 (mg.1-1) 6-BA的基础上,添加Img.L-1的NAA处理下的叶片原球茎的诱导率不同,结果见表3。
从表3可以看出,01、03、08品种,在NAA浓度为Img.L-1时,其叶片原球茎诱导率随着6-BA浓度的增加而增加,最高的诱导率为01号品种,当6-BA浓度为8mg.L-1时,其诱导率为46.0%;其次为03品种,其最高诱导率为36.0%。04、05、07品种,在3个处理上的叶片原球茎诱导率都很低,尤其是04、05品种,其诱导率均为0。
由此可见,除了6-BA、NAA会影响叶片原球茎的诱导之外,品种之间的差异对诱导率影响也较大,不同品种,叶片原球茎诱导所需激素种类及配比也不同,这和第一个实验结果一致。
(三)6-BA、NAA和Ad组合对叶片原球茎诱导的影响
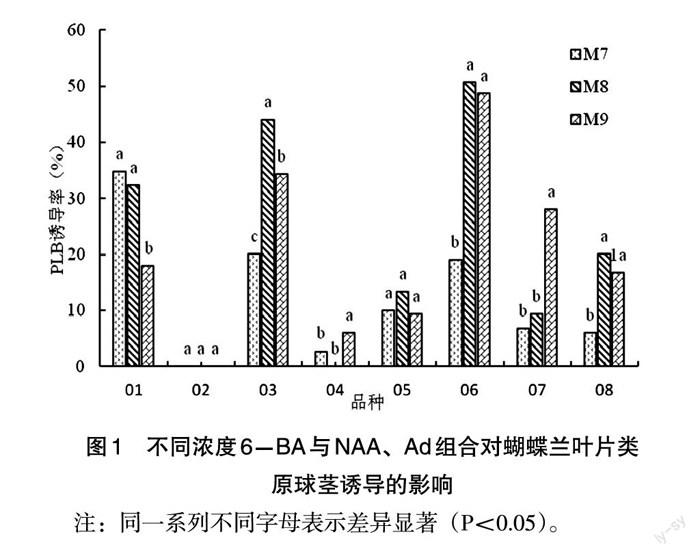
6-BA与NAA、Ad配合使用时,蝴蝶兰叶片类原球茎的诱导率不同,见图l。由图1可以看出,03、04、05、06、07、08品种,三种激素协同作用较明显,其中03、05、06品种在6-BA5mg.L-1+NAAlmg.L-1+Ad 3mg.L“时,类原球茎诱导率分别由使用6-BA和NAA组合的36.0%、3.3%、26.7%提高到44.0%,13.0%、50.7%;04、07、08品种,其诱导率随着6-BA浓度增加而逐渐增加;01品种三者协同作用不明显,随着6-BA浓度的增加,其诱导率逐渐降低,且诱导率低于其他处理;02品种三者协同作用较差,在三个处理上,其诱导率均为0。
(四)TDZ、NAA对叶片诱导的影响
TDZ对蝴蝶兰叶片类原球茎诱导具有显著作用,其与NAA的配合使用表现较强的协同效应,结果见表4。除01、07品种在单独使用TDZ 0.5 mg.L-1时,达到最大诱导率75.3%、82.0%外,其他品种均在TDZ、NAA配合使用时有最大诱导率。经方差分析,07品种在单独使用TDZ 0.5 mg.L-l時,其叶片类原球茎诱导率显著高于其他几个处理。04、05、08品种,在TDZ2 mg.L-l+NAA 0.1mg.L-1时,类原球茎诱导率最高,分别为76.7%、60.7%、72.7%,方差分析表明,这三个品种在这个处理上的叶片类原球茎诱导率显著高于其他几个处理。02、03、06品种在TDZ 0.5 mg.L-l+NAA 0.1mg.L-1时类原球茎诱导率最高,分别为24.0%、28.0%、26.0%,从表4中可以看出,这三个品种在这6种培养基上,其诱导率均较低,从而说明除激素种类、浓度影响类原球茎诱导率外,品种之间的差异对其影响也较大。
实验过程中观察发现,品种不同,叶片黄化死亡率不同(见表5)。由表5可以看出,在M11处理上,其叶片黄化死亡率最低,最高的为03品种,其黄化死亡率为17.0%,其他几个品种均为0。由表5还可以看出,品种之间差异较大,01、02、06在几个处理中其黄化死亡率均为0,03品种的黄化死亡率较高,其他几个品种在不同处理上黄化死亡率不同。
在这6个处理中,从接种到结果统计观察发现,接种外植体的外观表现无明显差异,一般是接种1-2周后,叶片切口变黄或变黑,未见褐化;2-3周后,无明显变化或个别叶片有黄化、褐化;3-4周后,黄化、褐化叶片增多,生成物出现;4-6周,生成物数逐渐增多,褐化、黄化叶片也增多。50d后叶片诱导生成物明显出现类原球茎。
三、讨论
对不同植物种类而言,能否诱导类原球茎的发生,主要取决于植物自身基因型和诱导条件两个方面。培养基种类、激素种类与配比、糖分比例及光照等都是需要考虑的诱导条件,其中,激素种类与配比对诱导效果影响最大。在蝴蝶兰[17-18]、石斛兰[19-20]、大花蕙兰[21-22]和文心兰[23-24]等兰花类原球茎诱导过程中,细胞分裂素(6-BA、Ad或KT)与生长素(2,4-D、NAA、IBA)组合有不同诱导效果。
本实验中使用6-BA、6-BA与NAA组合、6-BA与NAA和Ad组合诱导蝴蝶兰叶片原球茎,单独使用6-BA,在8个品种中,01-07号品种随着浓度的增加,原球茎的诱导率也在增加,其中01、07品种在6-BA浓度为8mg.L-1时,类原球茎诱导率最高,分别为35.3%和30.0%。02、04、08品种的诱导率最低,在6-BA浓度(mg.L-1)为3、5时,诱导率均为0;当6-BA浓度为8mg.L-l时,02、04品种的诱导率分别增加至11.0%和6.0%,08品种的诱导率仍然是0。从实验结果可以得出,高浓度的6-BA有利于诱导出叶片类原球茎,这和乔永旭等[25]、张玉等[26]的研究结果一致。
TDZ因其极高的生物活性,被广泛应用于植物类原球茎的诱导[27],也被认为是在兰科植物类原球茎诱导过程中最有效的激素,付双彬等[28]在诱导虎头兰原球茎时,单独加入3mg.L-1,在30d时即可使80%的组培苗诱导产生类原球茎,而在90d后则可使其达到100%。在本实验中,单独使用TDZ和使用TDZ与NAA组合两种处理,实验结果发现,TDZ对蝴蝶兰叶片诱导具有显著作用,其与NAA的配合使用,表现较强的协同效应。这与李娜等[29]的结果一致。除01、07品种在单独使用TDZ 0.5 mg.L-1时,达到最大诱导率外,其诱导率分别为75.3%、82%,其他品种均在TDZ、NAA配合使用时有最大诱导率。其中04、05、08品种,在TD22 mg.L-l+NAA O.lmg.L-1时,原球茎诱导率最高,分别为76.7%、60.7%、73.3%;02、03、06品种在TDZ 0.5mg.L-+NAA O.lmg.L-1时原球茎诱导率最高,分别为24.0%、28.0%、26.0%。品种不同,诱导率差异也较大,因此,除了激素种类、浓度会影响原球茎诱导率外,品种不同叶片诱导所需激素种类及配比也不同。
参考文献:
[1]韩思仪,崔永一,蝴蝶兰原球茎组织防褐化研究[J].江苏农业科学,2019,47(13):67-71.
[2]谢利,刘芳,易懋升,等.蝴蝶兰倍性与叶部和花部性状的相关性[J].华南农业大学学报,2014,35(05):82-87.
[3]杨录军,王俊,赵玉安,等.蝴蝶兰叶片离体培养胚胎组织的发生[J].陕西农业科学,2013f06):7-10.
[4]顾德峰,赵春莉,宋彦君,等,蝴蝶兰无性快繁规模化生产的研究[J].园艺学报,2007,34(01):193-196.
[5]庄东红,曲莹,徐大熊,等.蝴蝶兰若干品种(系)的染色体数和形态分析[J].园艺学报,2007,34(05):1257-1262.
[6]刘学庆,王秀峰,朴永吉,蝴蝶兰不同品种耐冷特性的报告[J].园艺学报,2007,34(02):425-430.
[7]许传俊,周文灵,陈冬茵,等,蝴蝶兰多酚氧化酶基因克隆及其序列分析[J].同艺学报,2009,36(12):1799-1804.
[8]许传俊,孙叙卓,李玲,等.蝴蝶兰抗坏血酸过氧化物酶基因克隆及其表达研究[J].园艺学报,2012,39(04):769-776.
[9]高壮壮.蝴蝶兰再生体系建立及转蓝色形成基因研究[D].咸阳:西北农林科技大学,2020.
[10]张和臣,董晓宇,王利民,等,以蝴蝶兰种子萌发的原球茎为受体的遗传转化体系构建[J]河南农业科学,2016,45(08):107-111+124.
[11]卜朝阳,蒋慧萍,满若君.蝴蝶兰花梗离体培养及叶片诱导类原球茎研究[J].江苏农业科学,2008(03):147-150.
[12]张彦妮,边红琳,陈立新,蝴蝶兰幼嫩花梗组织培养和快速繁殖[J].草业科学,201 1,28(04):590-596.
[13]黄磊,陈之林,吴坤林,等,切割方式和外植体大小对蝴蝶兰叶片诱导类原球茎的影响[J].热带亚热带植物学报,2009,17(03):261-266.
[14]马生健,杨艳梅,不同激素对蝴蝶兰幼叶诱导原球茎的影响[J].广东农业科学,201 1,38(10):36-37.
[15]乔永旭,张永平,陈超,等,蝴蝶兰组培苗类原球茎的诱导与分化[J]北方园艺,2010(04):13 8-141.
[16]于旋.蝴蝶兰类原球茎农杆菌介导的转基因体系构建[D].杭州:浙江农林大学,2015.
[17]崔广荣,侯喜林,张子学,等,蝴蝶兰叶片离体培养胚状体的发生及组织学观察[J].园艺学报,2007,34(02):431-436.
[18]聂菁,刘丽凤,任海虹,等,蝴蝶兰类原球茎诱导、增殖及植株再生条件初步研究[J]山西大学学报(自然科学版),2016,39(02):318-324.
[19]陆顺教,易双双,冷青云,等.秋石斛原球茎途径再生体系的建立[J].分子植物育种,2017,15(03):1014-1021.
[20]任海虹,王景雪,聂菁.铁皮石斛原球茎高效再生体系的研究[J].中草药,2017,48(19):4057-4061.
[21]袁芳,宋凯杰,杨泽东,等,铁皮石斛茎段类原球茎的诱导及植株再生[J]东北农业科学,2019,44(04):66-71.
[22]吳开云,黄敏仁,王明庥.大花蕙兰幼苗叶片诱导类原球茎[J]分子植物育种,2007,5(03):341-346.
[23]徐萌,郭绍霞,孙丽,等,大花蕙兰原球茎诱导、增殖与分化影响因素研究[J].北方园艺,2016,(16):108-110.
[24]陈晓旋,李洪波,叶春海,等,文心兰类原球茎的诱导与增殖技术的优化[J]热带作物学报,2010,31(09):1464-1468,
[25]乔永旭.蝴蝶兰类原球茎的诱导[J]东北林业大学学报,201 1,39(03):34-36.
[26]张玉,李艳敏,张和臣,等,蝴蝶兰叶片诱导类原球茎初探[J].河南农业科学.2012,41(02):126-128+135.
[27]姜福星,刘凤栾,赵梁军,植物类原球茎的研究与应用[J].核农学报,2012.26(03):0478-0483.
[28]付双彬,池梦薇,杨燕萍,等,虎头兰类原球茎诱导、增殖及保存[J]北方园艺,2020(10):71-77.
[29]李娜,杨蕾蕾,陈朋,等,蜻蜓石斛类原球茎的诱导与植株再生系统建立[J].植物生理学报,2021,57(12):166-171.
基金项目:2020年河南省科技厅科技攻关重点研发与推广专项“野生薄皮快繁体系及工厂化育苗关键技术的研究”,项目编号:212102110188;2021年河南农业职业学院自然科学基金项目“大岩桐花粉活力检测及贮藏关键技术研发与应用”,项目编号:HNACKY-2021-03;2021年河南农业职业学院科研创新人才项目“新优景观植物蓝花丹快繁体系及工厂化育苗的研究”,项目编号:HNACSRHR-2021-04。
作者简介:朱飞雪(1979-),女,河南平顶山人,硕士,讲师,研究方向:园林植物种质资源与育种。
(责任编辑曹雯梅)

