常见甘味中药抗糖尿病作用机制研究进展
李丛宇,曹世杰,邱 峰,齐学洁,康 宁, 3*
常见甘味中药抗糖尿病作用机制研究进展
李丛宇1, 2,曹世杰2,邱 峰1, 2,齐学洁1,康 宁2, 3*
1. 天津中医药大学中药学院,天津 301617 2. 天津中医药大学 组分中药国家重点实验室,天津 301617 3. 天津中医药大学中西医结合学院,天津 301617
糖尿病,中医称为消渴病,研究发现五味中药中甘味中药治疗糖尿病的应用频率最高。在中药五味理论中,甘味药具有补益和中的功效,符合“滋阴”“健脾”的糖尿病中医治则。综合近5年来国内外相关文献,对甘味中药治疗糖尿病的药理机制进行归纳总结,主要与调节糖脂代谢、保护胰岛组织、改善胰岛素抵抗、抑制机体炎症因子、提升机体抗氧化能力及调节肠道菌群等有关,以期丰富甘味中药治疗糖尿病的科学内涵,为今后开展相关研究提供理论依据。
糖尿病;消渴病;甘味中药;糖脂代谢;胰岛素信号通路;炎症;氧化应激;肠道菌群
糖尿病是一种因胰岛素作用障碍或合并分泌缺陷引起的慢性代谢性疾病[1],目前全球患病人数已超4.63亿[2]。治愈难、并发症多使得糖尿病已成为世界范围内的健康难题。目前糖尿病的治疗方法主要以药物控制血糖为主,但低血糖、体质量增加、肾毒性等不良反应[3]的出现使现有抗糖尿病药物已无法完全满足治疗需要,因此寻找低毒高效的抗糖尿病药物迫在眉睫。糖尿病在中医药理论中被称为消渴病,中药在治疗糖尿病方面历史悠久,疗效显著且不良反应较小,成为当前抗糖尿病药物研发的焦点。五味理论是中药药性理论的重要组成部分,五味主要指酸、苦、甘、辛、咸,是对药物真实滋味和功效特点的高度概括。这5味主要分别作用于肝、心、脾、肺、肾脏,通过多途径发挥治疗疾病的作用。甘味中药主入脾脏,“能补、能和、能缓”,具有补益和中、缓急止痛的功效[4],在糖尿病的治疗过程中被广泛应用。如消渴要药天花粉即属甘味;《中国药典》2020年版所载的26味可治疗消渴病的中药中有18味属甘味;消渴方、玉女煎、二冬汤、玉液汤等治疗消渴病经典方剂的组成药物半数以上为甘味中药。不仅如此,多项数据挖掘研究结果也揭示了甘味中药(如麦冬、甘草、地黄等)和甘味药对(如地黄-黄芪、黄芪-山药、麦冬-地黄等)在治疗消渴病时被高频次应用的现象[5-6]。由此可见甘味中药在治疗糖尿病过程中发挥了重要作用。
中医多将糖尿病的病机归结为阴虚燥热,清热滋阴为中医治疗糖尿病的重要治则,该治则旨在清内热、补阴津、养脏腑。此外,随着认识的加深,脾虚致糖尿病的说法也逐渐被接受[7-8]。脾脏在中医理论中是代谢的枢纽,脾虚则营养物质难被代谢,从而导致糖尿病,所以健脾亦被视为糖尿病的治则之一。甘味药滋阴、健脾的作用与糖尿病的中医治则部分相符,这是甘味药虽含较高糖分但仍被大量应用于糖尿病治疗的理论基础之一。虽然有一定中医学基础,但甘味中药治疗糖尿病的现代药理机制目前尚不完全清楚,仍有待进一步的深入研究。本文综合近5年来国内外的相关文献,对常见甘味单味中药抗糖尿病的机制进行系统归纳,综述甘味中药被大量用于糖尿病治疗的机制,为今后相关研究的顺利开展提供理论基础和依据。在糖尿病患者中,2型糖尿病(type 2 diabetes mellitus,T2DM)患病人数超90%,严重威胁人类健康。既往研究表明,甘味中药在治疗T2DM方面疗效确切,机制主要与调节糖脂代谢、保护胰岛组织、改善胰岛素抵抗、抑制机体炎症因子、提升机体抗氧化能力及调节肠道菌群等有关。
1 调节糖代谢
1.1 抑制α-糖苷酶和钠依赖性葡萄糖转运体1(sodium-dependent glucose transporter,SGLT1),减少糖类分解与吸收
饮食糖类的消化与吸收是血糖的主要来源。α-糖苷酶位于小肠黏膜,是催化饮食多糖水解为葡萄糖的重要酶。研究发现多种甘味中药含有抑制α-糖苷酶的成分,如玉竹皂苷[9]等,部分活性成分抑制α-糖苷酶的作用甚至优于阳性对照药阿卡波糖,如甘草总黄酮[10]、灵芝三萜类成分[11]等。除了抑制酶的活性外,甘味中药的活性成分还能干预α-糖苷酶的氨基酸残基和底物。如葛根素既能与α-糖苷酶的底物竞争结合位点,又可作用于其氨基酸残基,从而减少多糖在肠道的分解,因此达到与阿卡波糖相似的降糖效果[12]。另一方面,SGLT1表达于小肠黏膜刷状缘,负责肠道细胞对葡萄糖的主动吸收。研究发现枸杞多糖在下调SGLT1表达的同时还能与葡萄糖竞争SGLT1,抑制肠道对葡萄糖的吸收,进而降低血糖浓度[13]。上述研究结果表明,通过多途径减少膳食多糖在肠道的分解与吸收是甘味中药缓解高血糖的重要途径之一。
1.2 增加葡萄糖转运体(glucose transporter,GLUT)的表达或转位,促进葡萄糖摄取
细胞摄取葡萄糖是降低血糖浓度的主要方式,但葡萄糖无法自由穿过细胞膜,从胞浆转位至胞膜的GLUT是细胞摄取葡萄糖的重要载体。T2DM状态下,肝脏、骨骼肌和脂肪等组织的糖摄取会发生明显障碍,而甘味中药活性成分主要靶向肝脏和骨骼肌GLUT发挥治疗T2DM的作用,具体体现为促进肝脏和骨骼肌中不同类型GLUT的表达及膜转位,提高血糖利用率。如甘草黄酮通过促进糖尿病小鼠骨骼肌GLUT4膜转位,增加糖摄取[14],泽泻三萜[15]、枸杞多糖[16]和黄精总皂苷[17]则是通过上调骨骼肌GLUT4的蛋白表达从而加速糖摄取。同样是促进血糖的利用,但作用的靶器官和靶蛋白却有所区别。不同于上述活性成分,人参皂苷[18]通过上调糖尿病大鼠肝脏GLUT2的表达,促进肝脏葡萄糖摄取,而黄芪黄酮[19]、枸杞多糖[20]、石斛宁碱[21]等则通过上调肝脏GLUT4的表达,进而发挥降血糖的作用。对比肝脏和骨骼肌而言,甘味中药调节脂肪组织GLUT改善T2DM的相关报道较少。目前仅发现茯苓酸[22]和灵芝多糖[23]等的降血糖作用与上调脂肪细胞或脂肪组织中GLUT4的表达有关。这些研究结果提示GLUT是甘味中药降血糖、抗糖尿病的靶点之一,肝脏和肌肉组织可能是主要靶器官。
1.3 抑制糖异生,促进糖原合成,平衡血糖浓度
糖异生与糖原代谢是调节血糖稳态的2个重要过程。T2DM时糖异生的增加和糖原合成的减少导致血糖浓度异常升高。研究显示,一方面甘味中药活性成分可作用于不同的转录因子来抑制糖异生。肝细胞核因子4α(hepatocyte nuclear factor 4α,HNF4α)是上调糖异生关键酶磷酸烯醇式丙酮酸羧基酶(phosphoenolpyruvate carboxykinase,)和葡萄糖6磷酸酶(glucose-6-phosphatase,)基因表达的转录因子之一。甘草酸可与HNF4α形成氢键,降低HNF4α对和基因的转录激活作用,进而抑制糖异生[24]。叉头盒蛋白O1(fork-head box O1,FoxO1)是调控糖异生限速酶表达的又一关键转录因子,人参皂苷Rk3[25]、葛根异黄酮[26]、黄芪甲苷[27]、山药总皂苷[28]均能通过调节FoxO1抑制糖异生,但具体机制不同:人参皂苷Rk3和葛根异黄酮通过促进FoxO1磷酸化使其失活;黄芪甲苷不仅能降低肝脏FoxO1的活性,还能抑制其蛋白表达;而山药总皂苷则是通过减少mRNA的表达来发挥抑制糖异生作用。另一方面,糖原合成酶激酶3β(glycogen-synthasekinase-3β,GSK3β)是糖原合成的关键酶,红景天多糖[29]和当归醇提物[30]能通过促进其磷酸化来推动肝糖原的合成。而铁皮石斛多糖[31]除了促进肝糖原合成外,还能稳定肝糖原的结构并阻止其降解。可见,抑制糖异生与促进糖原合成也是甘味中药抗糖尿病的重要机制。
2 调节脂代谢
脂代谢紊乱在T2DM患者中的发病率为72%~85%[32]。血脂异常是T2DM并发的脂代谢紊乱的典型表现,同时也是T2DM并发心血管疾病的风险因素。研究证实,多数甘味中药的抗糖尿病活性成分均对T2DM所致的血脂异常具有调节作用,如甘草酸[33]、麦冬寡糖[34]、黄芪多糖[35]、当归多糖[36]、玉竹多糖[37]、天花粉凝集素[38]等均能降低血清中过高的三酰甘油、总胆固醇、低密度脂蛋白水平,升高过低的高密度脂蛋白水平。另外,肝脏脂肪分解会因胰岛素抵抗的存在而减少,加上脂肪合成的增加,所以T2DM时肝脏常发生脂肪沉积甚至产生空泡样脂肪变性,部分甘味中药活性成分能够有效缓解这种病理变化。如甘草黄酮[39]和灵芝孢子粉末[40]能抑制T2DM动物肝脏脂肪合成,加速脂肪酸分解,减轻肝脏脂质沉积,山药总皂苷[27]和红景天苷[41]能够显著减少T2DM导致的肝脏空泡样脂肪变性。可见甘味中药对T2DM状态下脂代谢紊乱的治疗作用主要体现在调节血脂和减轻肝脏脂质蓄积2个方面。
3 减轻胰岛损伤,促进胰岛素分泌
胰岛素是体内唯一的降血糖激素,主要由胰岛β细胞分泌,T2DM时胰岛组织的损伤会影响胰岛素分泌。甘味中药活性成分促胰岛素分泌作用主要与其保护受损的胰岛组织有关,如麦冬多糖[42]、黄精多糖[43]等能部分恢复T2DM时胰岛形态的损伤;黄芪多糖[44-45]、枸杞总黄酮[46]、石斛宁碱[21]以及红景天苷[47]处理后T2DM小鼠胰岛β细胞数量显著增加,进一步研究发现其作用机制与抑制内质网应激、减少胰岛细胞凋亡和促进胰岛β细胞增殖有关。除了保护胰岛组织而促进胰岛素分泌外,也有研究从单味甘味中药中发现了能直接促进胰岛素分泌的成分,如黄芪中含有多种能在体外显著促进胰岛素分泌的活性成分,其中毛蕊异黄酮-7--β--葡萄糖苷(calycosin-7--β--glucoside)和刺芒柄花素(formononetin)的促进作用与阳性药格列齐特的作用相似[48]。可见,保护胰岛组织、促进胰岛素分泌也是甘味中药抗糖尿病的重要机制之一。
4 提高胰岛素敏感性,改善胰岛素抵抗
胰岛素抵抗是T2DM的主要病理基础,胰岛素受体(insulin receptor,InsR)及胰岛素受体底物(insulin receptor substrate,IRS)的表达或磷酸化异常将阻碍胰岛素信号传递,产生胰岛素抵抗。肝脏、骨骼肌和脂肪组织是最容易发生胰岛素抵抗的组织。研究证实甘味中药活性成分治疗T2DM时对上述3种组织中InsR和IRS的表达和磷酸化均有调节作用。如麦冬多糖[49]、灵芝醇提物[50]以及红参水提物[51]分别能促进肝细胞、脂肪细胞以及肌细胞中InsR的表达,增强胰岛素敏感性,改善胰岛素抵抗;梓醇[52]和黄精多糖[53]能分别上调T2DM小鼠肝脏IRS1和IRS2的表达,促进胰岛素信号转导,缓解胰岛素抵抗。此外,部分甘味中药降糖活性成分还能对IRS的磷酸化位点进行调节。如人参皂苷Rb2能抑制脂肪细胞中IRS1丝氨酸307位点的异常磷酸化,促进酪氨酸位点的正常磷酸化,减轻脂肪细胞胰岛素抵抗[54]。蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B,PTP1B)可使InsR和IRS酪氨酸残基去磷酸化从而导致胰岛素抵抗。甘草总黄酮改善T2DM大鼠胰岛素抵抗的机制与其抑制PTP1B的活性进而提高胰岛素敏感性有关[55];灵芝蛋白聚糖改善胰岛素抵抗及抗ob/ob小鼠高血糖的机制也与抑制骨骼肌PTP1B的蛋白表达、恢复IRS1酪氨酸磷酸化有关[56]。上述研究提示,改善胰岛素抵抗也是甘味中药治疗T2DM的主要机制。
5 抑制氧化应激
T2DM引起的高血糖、高血脂是诱发机体氧化应激的重要原因。氧化应激不仅会损伤胰岛β细胞的结构和功能完整性,还会影响InsR及IRS的正常磷酸化,阻碍胰岛素信号转导[57],诱发胰岛素抵抗。因此,具有抗氧化作用的药物也能够对T2DM产生治疗作用。目前对机体脂质过氧化产物丙二醛(malonaldehyde,MDA)以及超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等主要抗氧化酶含量的检测是判断甘味中药活性成分是否具有抗氧化作用的主要方法。研究发现,黄芪甲苷[58]、党参多糖[59]、当归多糖[60]、甘草黄酮[39]等能显著减少T2DM动物血清或肝组织中氧化应激标志物MDA含量,增加抗氧化酶SOD、CAT、GSH-Px等的水平,缓解氧化应激带来的损伤,改善胰岛素抵抗。上述研究说明甘味中药能够作为抗氧化剂用于糖尿病的治疗。
6 抑制炎症反应
近年来T2DM逐渐被认为是一种慢性炎症状态下的疾病,这不仅因为炎症是T2DM的发病机制之一,更因为T2DM时肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)等炎症因子的分泌也会增多。泽泻[61]、枸杞[20]等甘味中药用于糖尿病治疗的原因可部分归结于其活性成分能直接降低血清炎症因子的水平。此外,部分甘味中药也含有抑制炎症信号通路的活性成分,如人参皂苷Rb1[62]可通过抑制c-Jun氨基末端激酶信号通路减少糖尿病大鼠血清炎症因子水平,抑制炎症反应;人参皂苷Rg1[63]通过抑制核因子-κB(nuclear factor-κB,)mRNA的表达及核转位而降低炎症因子水平;NF-κB抑制蛋白(inhibitor of NF-κB,IκB)是NF-κB的抑制因子,通过与NF-κB结合的方式阻止后者入核发挥转录调节作用,当归多糖[60]能以减少肝脏IκB与NF-κB解离的方式来降低炎症因子的水平。所以,甘味中药抗糖尿病的机制可以部分解释为其可抑制炎症反应。
7 调节肠道菌群
肠道菌群是存在于肠道内的微观生态系统,对机体健康具有重要调节作用。正常情况下这些菌群与肠道微环境存在动态平衡,当后者变化时,菌群发生失调,严重可致病。高脂高糖饮食可通过影响肠道菌群导致T2DM。研究发现,甘味中药活性成分对T2DM状态下肠道菌群的丰富度、多样性及比例都有显著的调节作用。石斛水提物[64-65]及桑葚多糖[66]能够增加链脲佐菌素诱导糖尿病小鼠和db/db小鼠肠道菌群的种类和数量,通过重塑肠道菌群部分发挥抗糖尿病作用;玉竹皂苷[9]能增加T2DM小鼠肠道益生菌丰度,减少有害菌丰度;而人参皂苷Rg5[67]和人参皂苷T19[68]的降血糖作用均与降低糖尿病小鼠肠道中厚壁菌门(Firmicutes)与拟杆菌门(Bacteroidetes)的比例有关。
常见甘味中药抗糖尿病的主要机制见图1。
8 结语与展望
目前糖尿病特别是T2DM的治疗药物仍存在缺陷,中药在治疗糖尿病方面历史悠久,疗效显著,特别是甘味中药在治疗过程中被大量应用,但其相关作用机制尚不完全清楚。本文通过归纳近5年来相关研究,发现对糖尿病有治疗作用的常见甘味中药主要属补益类(如甘草、地黄、麦冬等),兼有解表类(如葛根等)、清热类(如天花粉等)和利水渗湿类(如茯苓、泽泻等),它们的作用机制主要包括:(1)减少糖类的分解与肠道吸收,促进血糖摄取与利用;(2)加速脂代谢,调节血脂,改善肝脏脂肪异常堆积;(3)保护胰岛组织,促进胰岛素分泌;(4)改善胰岛素抵抗;(5)作为抗炎和抗氧化剂,减轻炎症反应,抑制氧化应激;(6)调节肠道菌群,重塑肠道微环境(图1)。
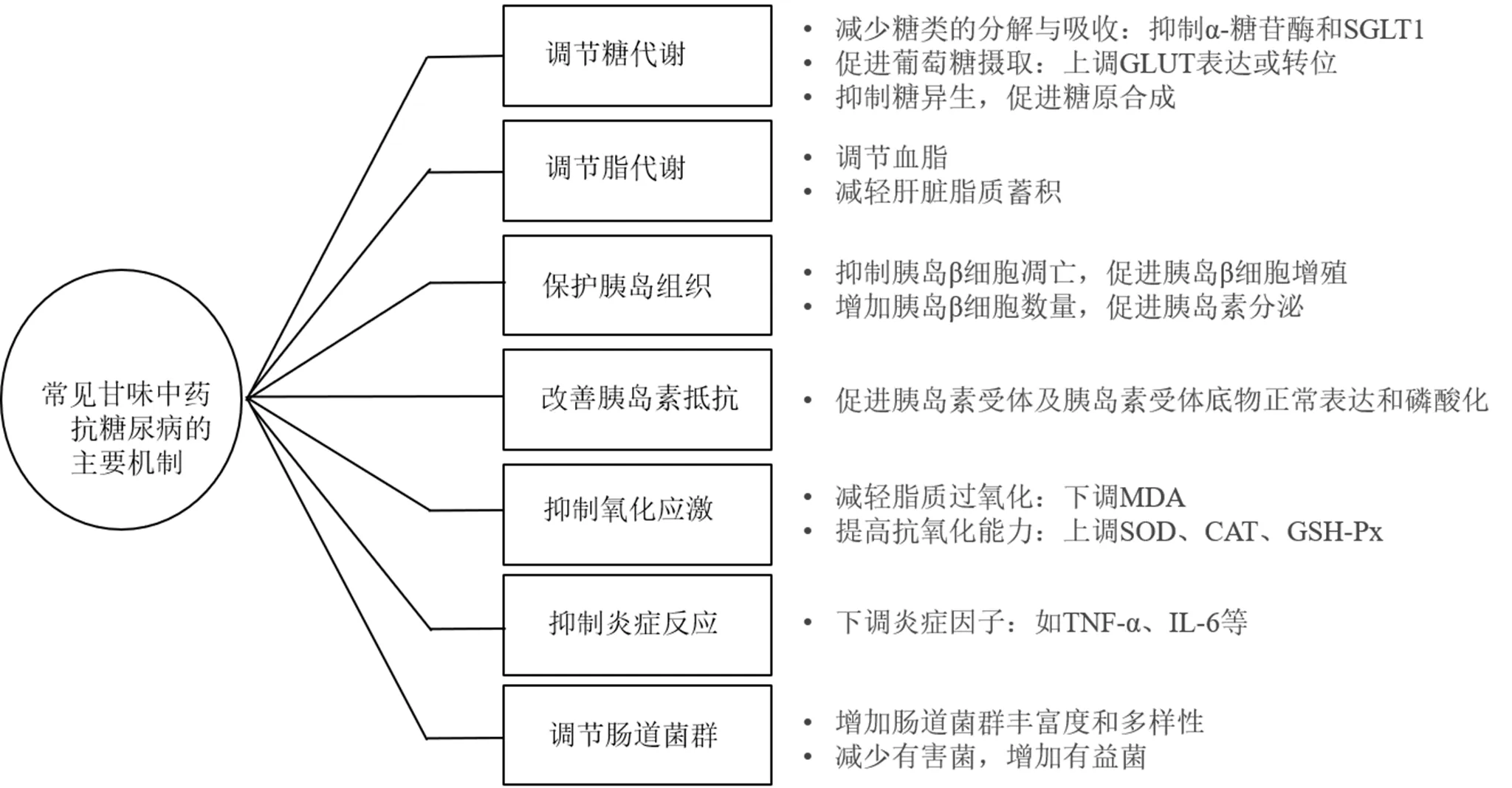
图1 常见甘味中药抗糖尿病的主要机制
现代研究表明,糖类、蛋白质、氨基酸、维生素、脂肪、甾醇、皂苷类等是甘味中药的主要化学成分[69],其中糖类成分的存在或许与糖尿病治疗原则相悖,但本文通过归纳发现与甘味药中其他化学成分相比,目前关于其中多糖类成分抗糖尿病报道居多,机制涉及上述各个方面,说明这类成分作为甘味中药的主要化学成分,是其抗糖尿病的主要活性成分,这不仅证实了甘味中药被高频次应用的合理性,也说明以多糖类活性成分发挥主要作用是甘味药在治疗糖尿病方面有别于酸、苦、辛、咸4味药的可能原因之一。
在明确药理机制的同时,也应该意识到甘味中药的多糖类成分的生物利用度问题,将中药药剂学和化学修饰的方法与现有研究结合起来或许能为该问题的解决提供便利。此外,目前大量研究停留在甘味中药抗糖尿病活性成分的筛选与初步机制研究上,虽然部分甘味中药化学成分的抗糖尿病作用已经明确,但仍有大量的活性成分及作用机制有待发现,对降糖分子靶点的寻找与深入研究仍需要开展,以便全面解释甘味中药通过多成分、多途径发挥抗糖尿病作用的优势所在。
利益冲突 所有作者均声明不存在利益冲突
[1] 钱荣立. 关于糖尿病的新诊断标准与分型 [J]. 中国糖尿病杂志, 2000, 8(1): 5-6.
[2] Saeedi P, Petersohn I, Salpea P,. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045: Results from the International Diabetes Federation Diabetes Atlas, 9th edition [J]., 2019, 157: 107843.
[3] Razavi-Nematollahi L, Ismail-Beigi F. Adverse effects of glycemia-lowering medications in type 2 diabetes [J]., 2019, 19(11): 132.
[4] 陈蔚文. 中药学 [M]. 第2版. 北京: 人民卫生出版社, 2012: 18.
[5] 范文娜, 魏伟, 钱丽君. 基于数据挖掘分析治疗消渴古方的用药规律[J]. 实用中医内科杂志, 2021, 35(1): 86-89.
[6] 刘鑫, 曲超, 王姝婷, 等. 基于数据挖掘的中药治疗2型糖尿病用药规律分析[J]. 中华中医药学刊, 2020, 38(5): 74-78.
[7] 徐鹏, 石岩. 从脾虚探讨糖尿病(消渴)的病因病机 [J]. 辽宁中医杂志, 2018, 45(9): 1841-1844.
[8] 马青, 龚轩. 甘味药从脾论治糖尿病探讨 [J]. 医学争鸣, 2019, 10(6): 22-25.
[9] Luo J Y, Chai Y Y, Zhao M,. Hypoglycemic effects and modulation of gut microbiota of diabetic mice by saponin from[J]., 2020, 11(5): 4327-4338.
[10] Guo Z H, Niu X L, Xiao T,. Chemical profile and inhibition of α-glycosidase and protein tyrosine phosphatase 1B (PTP1B) activities by flavonoids from licorice (Fisch) [J]., 2015, 14: 324-336.
[11] 杨玉. 灵芝中三萜类成分及α-葡萄糖苷酶抑制活性研究 [D]. 大连: 大连医科大学, 2015.
[12] 徐婷, 褚江洪, 丁萍英, 等. 葛根素对α-葡萄糖苷酶抑制作用机理的探讨 [J]. 中国生化药物杂志, 2015, 35(1): 43-45.
[13] Cai H Z, Yang X H, Cai Q,.L. polysaccharide (LBP) reduces glucose uptake via down-regulation of SGLT-1 in Caco2 cell [J]., 2017, 22(2): E341.
[14] Yamashita Y, Kishida H, Nakagawa K,. Liquorice flavonoid oil suppresses hyperglycaemia accompanied by skeletal muscle myocellular GLUT4 recruitment to the plasma membrane in KK-A y mice [J]., 2019, 70(3): 294-302.
[15] Jia X K, Huang J F, Huang X Q,. Alismatis rhizoma triterpenes alleviate high-fat diet-induced insulin resistance in skeletal muscle of mice [J]., 2021, 2021: 8857687.
[16] 白桂荣, 罗丽, 谢晓敏, 等. 枸杞多糖对2型糖尿病大鼠胰岛素抵抗及其骨骼肌中GLUT4表达的影响 [J]. 宁夏医科大学学报, 2020, 42(5): 528-531.
[17] Lu J M, Wang Y F, Yan H L,. Antidiabetic effect of total saponins fromin streptozotocin-induced daibetic rats [J]., 2016, 179: 291-300.
[18] Abdelazim A, Khater S, Ali H,.improves glucose metabolism in streptozotocin-induced diabetic rats through 5′-adenosine monophosphate kinase up-regulation [J]., 2019, 26(7): 1436-1441.
[19] 李艳敏, 范颖, 刘烨, 等. 黄芪黄酮与葛根黄酮配伍对肝脏糖脂代谢的影响 [J]. 中国实验方剂学杂志, 2015, 21(10): 109-112.
[20] 夏惠, 唐华丽, 潘佳琪, 等. 枸杞多糖防治2型糖尿病的机制研究进展 [J]. 食品科学, 2016, 37(9): 232-236.
[21] Li X W, Huang M X, Lo K,. Anti-diabetic effect of a shihunine-rich extract ofon 3T3-L1 cells and db/db mice by up-regulating AMPK-GLUT4-PPARα [J]., 2019, 24(14): 2673.
[22] 黄斯, 潘雨薇, 蓝海, 等. 茯苓酸药理学研究进展 [J]. 中成药, 2015, 37(12): 2719-2721.
[23] Xiao C, Wu Q P, Zhang J M,. Antidiabetic activity ofpolysaccharides F31 down-regulated hepatic glucose regulatory enzymes in diabetic mice [J]., 2017, 196: 47-57.
[24] Yang M, Zhang M Y, Liu Q L,. 18β-Glycyrrhetinic acid acts through hepatocyte nuclear factor 4 alpha to modulate lipid and carbohydrate metabolism [J]., 2020, 157: 104840.
[25] Liu Y, Deng J J, Fan D D. Ginsenoside Rk3ameliorates high-fat-diet/streptozocin induced type 2 diabetes mellitus in mice via the AMPK/Akt signaling pathway [J]., 2019, 10(5): 2538-2551.
[26] Liu Y H, Qiu Y, Chen Q G,. Puerarin suppresses the hepatic gluconeogenesis via activation of PI3K/Akt signaling pathway in diabetic rats and HepG2 cells [J]., 2021, 137: 111325.
[27] 季天娇, 王中元, 朱云峰, 等. 黄芪甲苷调节PI3K/Akt/FoxO1通路抑制糖尿病大鼠肝糖异生 [J]. 中国实验方剂学杂志, 2020, 26(1): 78-86.
[28] Yu H, Zheng L L, Xu L N,. Potent effects of the total saponins fromMakino against streptozotocin-induced type 2 diabetes mellitus in rats [J]., 2015, 29(2): 228-240.
[29] 凌叶盛, 余舒杰, 周彬, 等. 红景天多糖对糖尿病模型小鼠肝脏信号通路PI3K/AKT/GSK3β影响的实验研究 [J]. 中国中医药科技, 2018, 25(6): 812-814.
[30] Bae U J, Choi E K, Oh M R,.ameliorates hyperglycemia and hepatic steatosis in C57BL/KsJ-db/db mice via activation of AMP-activated protein kinase signaling pathway [J]., 2016, 44(8): 1627-1638.
[31] Liu Y G, Yang L L, Zhang Y,.polysaccharide ameliorates diabetic hepatic glucose metabolism via glucagon-mediated signaling pathways and modifying liver-glycogen structure [J]., 2020, 248: 112308.
[32] Athyros V G, Doumas M, Imprialos K P,. Diabetes and lipid metabolism [J]., 2018, 17(1): 61-67.
[33] Zhang W, Li T, Zhang X J,. Hypoglycemic effect of glycyrrhizic acid, a natural non-carbohydrate sweetener, on streptozotocin-induced diabetic mice [J]., 2020, 11(5): 4160-4170.
[34] 吴万征, 苏薇薇, 王永刚, 等. 麦冬寡糖对自发性2型糖尿病db/db小鼠降血糖的作用 [J]. 中山大学学报: 自然科学版, 2017, 56(6): 128-133.
[35] 计莉强, 姚晓霖, 许广艳. 黄芪多糖对2型糖尿病ZDF大鼠血糖及肝脏脂代谢影响 [J]. 中国现代医生, 2017, 55(27): 30-34.
[36] Wang K P, Cao P, Shui W Z,.polysaccharide regulates glucose and lipid metabolism disorder in prediabetic and streptozotocin-induced diabetic mice through the elevation of glycogen levels and reduction of inflammatory factors [J]., 2015, 6(3): 902-909.
[37] 韩艺凡. 玉竹多糖对ZDF大鼠肝脏AMPK-ACC信号通路的影响 [D]. 北京: 北京中医药大学, 2019.
[38] 李琼, 张鹏, 郭晨, 等. 天花粉凝集素对2型KK-Ay糖尿病小鼠血糖、血脂的调节作用 [J]. 西南大学学报: 自然科学版, 2016, 38(2): 182-188.
[39] 冯亚娟, 胡滨青, 周建华. 甘草黄酮对糖尿病大鼠血糖、血脂水平及抗氧化能力的影响 [J]. 山东医药, 2016, 56(3): 23-25.
[40] Wang F, Zhou Z K, Ren X C,. Effect ofspores intervention on glucose and lipid metabolism gene expression profiles in type 2 diabetic rats [J]., 2015, 14: 49.
[41] Zheng T, Yang X Y, Wu D,. Salidroside ameliorates insulin resistance through activation of a mitochondria-associated AMPK/PI3K/Akt/GSK3β pathway [J]., 2015, 172(13): 3284-3301.
[42] 曹爽, 付绍智, 王永多, 等. 麦冬多糖药理作用研究进展 [J]. 安徽农业科学, 2015, 43(28): 63.
[43] 王艺, 彭国庆, 江新泉, 等. 黄精多糖对糖尿病大鼠模型的保护机制研究 [J]. 中医药导报, 2017, 23(2): 8-16.
[44] 唐思梦, 杨泽民, 陈伟强, 等. 黄芪多糖保护胰岛β细胞改善大鼠2型糖尿病 [J]. 第二军医大学学报, 2017, 38(4): 482-487.
[45] 周海燕. 黄芪多糖对2型糖尿病大鼠胰岛内质网应激及Bcl-2和Bax表达影响的研究 [D]. 合肥: 安徽中医药大学, 2015.
[46] 王伟, 尚佳, 廖国玲, 等. 枸杞总黄酮提取物对2型糖尿病大鼠血糖、血脂的影响 [J]. 中国医院药学杂志, 2017, 37(1): 17-20.
[47] 鞠霖杰. 红景天苷保护β细胞生存及功能的机制研究 [D]. 合肥: 安徽中医药大学, 2017.
[48] Lee D, Lee D H, Choi S,. Identification and isolation of active compounds fromthat improve insulin secretion by regulating pancreatic β-cell metabolism [J]., 2019, 9(10): E618.
[49] Gong Y J, Zhang J, Gao F,. Structure features andhypoglycemic activities of polysaccharides from different species of Maidong [J]., 2017, 173: 215-222.
[50] Lee H A, Cho J H, Afinanisa Q,.extract reduces insulin resistance by enhancing AMPK activation in high-fat diet-induced obese mice [J]., 2020, 12(11): E3338.
[51] Cheon J M, Kim D I, Kim K S. Insulin sensitivity improvement of fermented Korean Red Ginseng () mediated by insulin resistance hallmarks in old-aged ob/ob mice [J]., 2015, 39(4): 331-337.
[52] Liu J, Zhang H R, Hou Y B,. Global gene expression analysis in liver of db/db mice treated with catalpol [J]., 2018, 16(8): 590-598.
[53] 贾璐, 石洁, 段志倩, 等. 黄精多糖对高脂饲料诱发糖尿病小鼠糖代谢功能的影响 [J]. 中国医药导报, 2017, 14(8): 24-28.
[54] Dai S S, Hong Y L, Xu J,. Ginsenoside Rb2promotes glucose metabolism and attenuates fat accumulation via AKT-dependent mechanisms [J]., 2018, 100: 93-100.
[55] 张明发, 沈雅琴. 甘草及其有效成分的抗糖尿病药理作用的研究进展 [J]. 抗感染药学, 2015, 12(1): 1-5.
[56] Yang Z, Wu F, He Y M,. A novel PTP1B inhibitor extracted fromameliorates insulin resistance by regulating IRS1-GLUT4 cascades in the insulin signaling pathway [J]., 2018, 9(1): 397-406.
[57] Yaribeygi H, Sathyapalan T, Atkin S L,. Molecular mechanisms linking oxidative stress and diabetes mellitus [J]., 2020, 2020: 8609213.
[58] 韩冬. 黄芪甲苷对实验性糖尿病大鼠降糖、调脂和抗氧化作用的研究 [J]. 现代中西医结合杂志, 2016, 25(4): 360-364.
[59] Zhang Y D, Wang H L, Zhang L,.polysaccharide CLPS alleviates high fat/high sucrose diet-induced insulin resistance via anti-oxidative stress [J]., 2020, 145: 944-949.
[60] 汤卓红. 当归多糖对2型糖尿病小鼠肝脏和胰岛损伤的保护作用及机制研究 [D]. 武汉: 华中科技大学, 2018.
[61] 操兰洁, 诸夔妞, 蒋翠花, 等. 泽泻提取物对STZ糖尿病大鼠的干预作用 [J]. 中国药科大学学报, 2017, 48(5): 601-608.
[62] 曹萌. 人参皂苷Rb1通过抑制JNK信号通路改善糖尿病大鼠肝脏糖脂代谢异常 [J]. 中国免疫学杂志, 2018, 34(4): 531-536.
[63] Fan X M, Zhang C, Niu S W,. Ginsenoside Rg1attenuates hepatic insulin resistance induced by high-fat and high-sugar by inhibiting inflammation [J]., 2019, 854: 247-255.
[64] 周琪. 铁皮石斛水提物对糖尿病小鼠血糖和肠道菌群的影响 [D]. 大连: 大连医科大学, 2017.
[65] 姚尧, 赵路, 李军珂. 铁皮石斛水提取物对糖尿病小鼠肠道微生物及脂类代谢的影响 [J]. 中医药信息, 2019, 36(2): 44-49.
[66] Chen C, You L J, Huang Q,. Modulation of gut microbiota by mulberry fruit polysaccharide treatment of obese diabetic db/db mice [J]., 2018, 9(7): 3732-3742.
[67] Wei Y G, Yang H X, Zhu C H,. Hypoglycemic effect of ginsenoside Rg5mediated partly by modulating gut microbiota dysbiosis in diabetic db/db mice [J]., 2020, 68(18): 5107-5117.
[68] Xu J, Li T, Xia X Y,. Dietary ginsenoside T19 supplementation regulates glucose and lipid metabolism via AMPK and PI3K pathways and its effect on intestinal microbiota [J]., 2020, 68(49): 14452-14462.
[69] 叶琴, 杨洋, 周雅琴, 等. 中药甘味成分的研究进展 [J]. 湖南中医杂志, 2015, 31(11): 205-207.
Research progress on anti-diabetic mechanism of common sweet-taste herbs
LI Cong-yu1, 2, CAO Shi-jie2, QIU Feng1, 2, QI Xue-jie1, KANG Ning2, 3
1. School of Chinese Materia Medica, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China 2. State Key Laboratory of Component-based Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China 3. School of Integrative Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
Diabetes is called Xiaoke disease in the theory of traditional Chinese medicine. Studies have found that among the five flavors of traditional Chinese medicines, sweet-taste herbs were the most frequently used in treatment of diabetes. According to the theory of five flavors of traditional Chinese medicine, sweet-taste herbs have the effect of tonifying and mediating that is in line with the principles of “nourishing yin” and “invigorating spleen” for diabetes. Pharmacological mechanism of sweet-taste herbs in treatment of diabetes was summarized in this paper based on relevant literatures at home and abroad in recent five years. It was mainly related to regulating glucose and lipid metabolism, protecting islet tissue, improving insulin resistance, inhibiting inflammatory factors, enhancing antioxidant capacity and regulating gut microbiota, in order to enrich the scientific connotation of treating diabetes with sweet-taste herbs and provide a theoretical basis for related research in the future.
diabetes; Xiaoke disease; sweet-taste herbs; glucose and lipid metabolism; insulin signal pathway; inflammation; oxidative stress; gut microbiota
R282.710.5
A
0253 - 2670(2022)11 - 3531 - 07
10.7501/j.issn.0253-2670.2022.11.031
2021-12-30
国家自然科学基金资助项目(81430095);国家自然科学基金资助项目(82030116)
李丛宇(1997—),女,硕士研究生,研究方向为中药药效物质基础。E-mail: 15369329171@163.com
康 宁(1972—),女,教授,博士生导师,研究方向为中西医结合抗代谢性疾病基础研究。E-mail: kangndd@163.com
[责任编辑 崔艳丽]

