食品中沙门氏菌缓冲蛋白胨水培养基的优化
王乐 陈佳 秦丽


摘 要:目的:优化食品中沙门氏菌缓冲蛋白胨水培养基的配比,缩短检验周期,使食品安全预警时间点前移。方法:通过吸光度法和平板计数法同时测定不同优化条件下缓冲蛋白胨水培养基中沙门氏菌的生长曲线,对结果进行处理分析,确定最优方案,并采用实时荧光PCR法进行菌种验证。结果:吸光度法和平板计数法曲线变化基本一致,随着缓冲蛋白胨水培养基中酵母添加量的增加,沙门氏菌的调整期缩短,对数期斜率和稳定期数值呈增大的趋势。当改良缓冲蛋白胨水中酵母浸膏的添加量为9 g/L时,食品中沙门氏菌的前增菌时间缩短到8~10 h。通过实时荧光PCR法的验证,确定改良缓冲蛋白胨水培养基特异性良好。结论:根据实际情况选择缓冲蛋白胨水培养基中酵母的添加量,优化后的缓冲蛋白胨水培养基检测时间短、特异性强,可用于食品中沙门氏菌的快速检测,为商品化缓冲蛋白胨水培养基的生产提供參考依据。
关键词:食品;沙门氏菌;缓冲蛋白胨水培养基;优化
Optimization of Buffered Peptone Water Medium for Salmonella in Food
WANG Le1, CHEN Jia2, QIN Li3*
(1.Zhangjiakou Food and Drug Inspection Center, Zhangjiakou 075000, China; 2.College of Chemical Technology, Shijiazhuang University, Shijiazhuang 050035, China; 3.Hebei Intellectual Property Protection Center, Shijiazhuang 050000, China)
Abstract: Objective: By optimizing the ratio of buffered peptone water medium for Salmonella in food, the detection period is shortened and the time point of food safety warning is moved forward. Method: The growth curve of Salmonella in buffered peptone water medium under different optimized conditions was determined by absorbance method and plate counting method simultaneously. The results were processed and analyzed to determine the optimal plan, and the real-time fluorescent PCR method was used to verify the strains. Result: The curve changes of absorbance method and plate counting method were basically the same. With the increase of yeast addition in buffered peptone water medium, the adjustment period of Salmonella was shortened, and the slope of logarithmic phase and the value of stable phase increased. When the addition amount of yeast extract in modified buffered peptone water was 9 g/L, the pre-enrichment time of Salmonella in food was shortened to 8~10 h. The specificity of the modified buffered peptone water medium was confirmed by real-time fluorescence PCR method. Conclusion: The amount of yeast added in the buffered peptone water medium should be selected according to the actual situation. The optimized buffered peptone water medium has a short detection time and strong specificity, and can be used for the rapid detection of Salmonella in food. This study can provide a reference for the production of commercial buffered peptone water medium.
Keywords: food; Salmonella; buffered peptone water medium; optimization
沙门氏菌(Salmonella)是一种最常见的、能引起人畜共患病的食源性致病菌,在人和动物体中有广泛的寄主[1]。我国由沙门氏菌引起的食源性疾病居细菌性食源性疾病的首位[2]。在消费者食用被沙门氏菌污染的食物后,会出现腹泻、肠胃炎、发热和败血症等一系列症状[3]。
近年来,随着生活水平的提高,人们对食品安全问题的重视日益增加。食品中富含各种营养物质,是食源性致病菌生长、繁殖的良好基质,而且食品在加工、包装、配送及储存等过程中也极易受到食源性致病菌污染[4]。因此,加强对食品中食源性致病菌的检测就显得十分重要。据世界卫生组织统计,沙门氏菌在食源性致病菌中排名第一,世界各国对于食品中沙门氏菌的检测要求都十分严格,沙门氏菌污染一直是食品行业检测的重要指标之一[5]。
目前,沙门氏菌的检测方法主要有传统培养方法、免疫学方法和PCR法[6-8]。随着科学技术的发展,多重PCR法、实时荧光PCR法、侧向流动检测法等一系列新方法也逐步开始应用于食品中沙门氏菌的检验[9-11]。但传统培养方法和现代检测技术都必须以目标菌的富集为前提,从而进行后续的检测[12]。前增菌过程可以实现目标菌的富集,是缩短增菌时间、降低背景干扰的有效手段[13]。沙门氏菌现行国家标准方法的前增菌是采用缓冲蛋白胨水培养基使样品中菌体恢复并大量增殖的过程,此步骤对后续检出率的影响至关重要,但其所需的检测时间较长[14]。因此,本研究以缓冲蛋白胨水培养基为基础,通过酵母添加量的优化,以期得到一种快速、特异性强的培养基,从而缩短前增菌时间,为我国食品安全的风险监测提供技术支持。
1 材料与方法
1.1 菌株来源
實验所用的鼠伤寒沙门氏菌(CMCC50976)购于中国医学细菌保藏管理中心。
1.2 试剂与仪器设备
酵母浸膏(Becton,Dickinson and Company);磷酸盐缓冲液、营养琼脂、缓冲蛋白胨水、平板计数琼脂(北京路桥技术股份有限公司);细菌基因组DNA提取试剂盒、2×PCR Master Mix(天根生化科技北京有限公司);引物及探针(生工生物工程上海股份有限公司)。
二级生物安全柜;多功能酶标仪(Synergy HTX);恒温培养箱(PHCbi);电子天平(ME4002E);Sigma 3K15冷冻离心机(德国Sigma公司);LightCycler 480II实时荧光定量PCR仪(德国罗氏诊断有限公司)。
1.3 实验方法
1.3.1 菌悬液的制备
把-80 ℃保存的鼠伤寒沙门氏菌CMCC50976加入到无菌磷酸盐缓冲液中,挑取菌悬液在营养琼脂平板上划线,36 ℃培养24 h,重复一次。挑取活化好的单菌落接种于磷酸盐缓冲液中,振荡均匀,将菌悬液的麦氏浊度控制在0.5~0.6。对上述菌悬液进行10倍梯度稀释,吸取100 µL菌悬液接种于平板计数琼脂上,36 ℃培养48 h后计数。菌悬液的浓度为7.7×106 CFU/mL。
1.3.2 酵母浸膏添加量的筛选
以缓冲蛋白胨水为基础,分别添加终浓度为
0 g/L、3 g/L、5 g/L、7 g/L、9 g/L和11 g/L的酵母浸膏,每瓶分装100 mL,高压灭菌。对添加不同浓度酵母浸膏(0 g/L、3 g/L、5 g/L、7 g/L、9 g/L和11 g/L)的改良缓冲蛋白胨水培养基接种1 mL 1.3.1中浓度为7.7×10-6 CFU/mL的鼠伤寒沙门氏菌。空白培养基作为对照,与接种后的培养基同时放入36 ℃培养箱培养。
1.3.3 沙门氏菌OD550值的测定
沙门氏菌菌悬液培养2 h、4 h、6 h、8 h、10 h、12 h、14 h、16 h、18 h、20 h、22 h和24 h后,分别用酶标仪测量550 nm波长下空白培养基和菌悬液的OD550值。以OD550值的大小衡量沙门氏菌生物量的多少,筛选出最佳酵母浸膏的添加量。
1.3.4 沙门氏菌平板计数法的验证
同时吸取1 mL菌悬液,10倍梯度稀释后接种在平板计数琼脂上,36 ℃培养48 h后计数。
1.3.5 实时荧光PCR法的特异性验证
采用试剂盒法对培养10 h后酵母浸膏浓度为9 g/L的改良缓冲蛋白胨水菌悬液进行DNA模板的提取,采用实时荧光PCR法验证其特异性。试验重复3次,设置阳性对照(沙门氏菌菌悬液基因组DNA),阴性对照(其他菌菌悬液基因组DNA)和空白对照(添加无菌水)。
实时荧光PCR法引物序列为P1:5'-CTCACCAGGAGATTACAACATGG-3';P2:5'AGCTCAGACCAAAAGTGACCATC-3'。实时荧光PCR法探针序列为“FAM-CACCGACGGCGAGACCGACTTT-TAMARA”。最终反应体系为2×PCR Master Mix 12.5 µL;上下游引物各0.5 µL;探针0.5 µL;DNA模板5 µL;双蒸水补足25 µL。反应程序为:预变性95 ℃,10 min;95 ℃,15 s;65 ℃,30 s;40个循环。
2 结果与分析
2.1 生长曲线测定结果
由图1可知,沙门氏菌菌悬液OD550值随生长时间增加呈现上升的趋势,18 h后进入稳定期,培养24 h前没有出现衰亡期。添加酵母浸膏的改良缓冲蛋白胨水菌悬液,培养2 h后均结束调整期,进入对数增长期;缓冲蛋白胨水菌悬液,培养4 h后,才结束调整期,进入对数增长期。从整体趋势分析,改良缓冲蛋白胨水的增菌速度明显高于缓冲蛋白胨水,沙门氏菌在添加酵母浸膏的培养基中能够更快地恢复活性。随着缓冲蛋白胨水培养基中酵母添加量的增加,对数期斜率和稳定期数值基本呈增大的趋势。
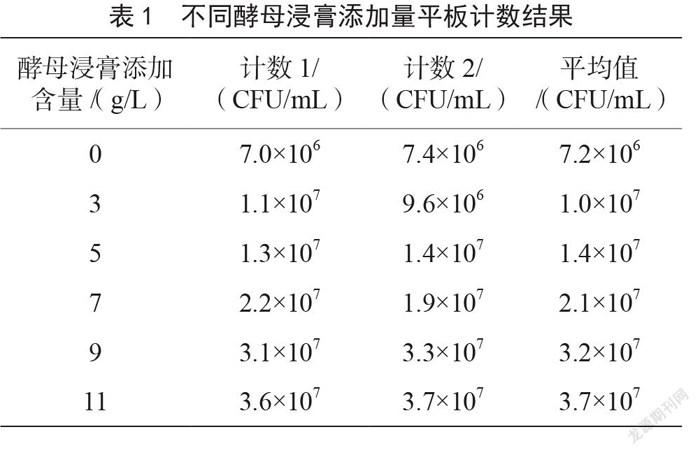
2.2 平板计数测定的验证结果
由表1可知,不同酵母浸膏添加量的缓冲蛋白胨水菌悬液平板计数测定结果与OD550值的变化趋势基本相同,沙门氏菌的数量随时间增加呈现上升的趋势,与2.1中OD550值的变化趋势一致。
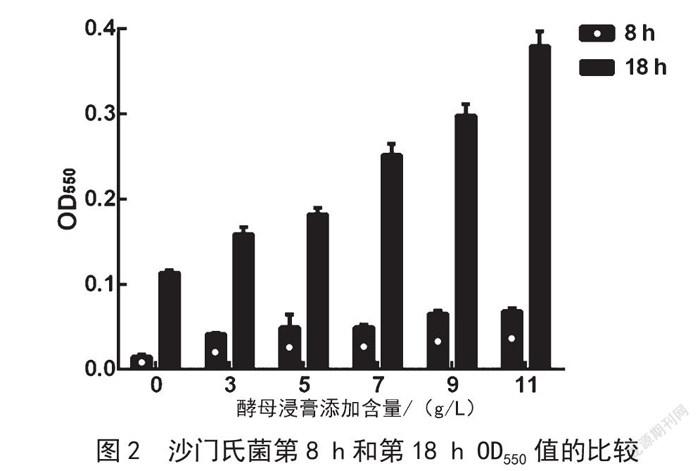
2.3 沙门氏菌第8 h和第18 h OD550值的比较
由图2可知,在第8 h,缓冲蛋白胨水菌悬液的OD550值最低,酵母浸膏添加量为3 g/L的改良缓冲蛋白胨水菌悬液的OD550值是其3倍。说明酵母浸膏的添加可以促进沙门氏菌的生长。随着缓冲蛋白胨水培养基中酵母浸膏添加量的增加,菌悬液的OD550值呈缓慢增长趋势,不同酵母浸膏添加量的改良缓冲蛋白胨水菌悬液的OD550值没有显著差异。在第18 h,缓冲蛋白胨水菌悬液的OD550值最低,随着缓冲蛋白胨水培养基中酵母浸膏添加量的增加,菌悬液的OD550值逐步增加,差异显著。酵母浸膏添加量为11 g/L的改良缓冲蛋白胨水菌悬液的OD550值达到0.38。《食品安全国家标准 食品微生物学检验 沙门氏菌检验》(GB 4789.4—2016)规定的预增菌时间为8~18 h。因此,增加缓冲蛋白胨水培养基中酵母浸膏的添加量可以使菌悬液提前达到所需的OD550值,从而缩短前增菌时间。
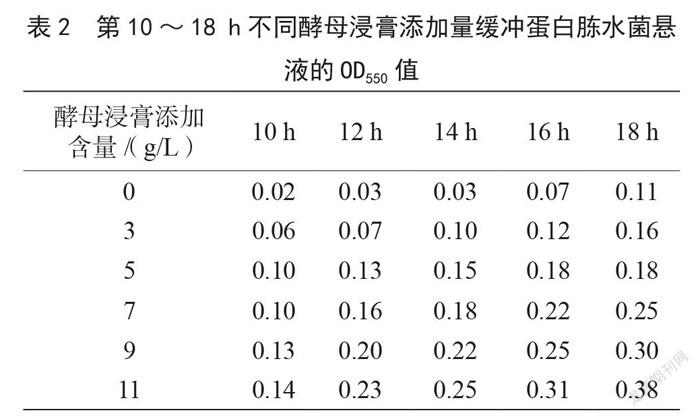
2.4 緩冲蛋白胨水培养基中酵母浸膏添加量的筛选结果
由于在第8 h不同酵母浸膏添加量的改良缓冲蛋白胨水菌悬液的OD550值没有显著差异,而在第18 h不同酵母浸膏添加量的改良缓冲蛋白胨水菌悬液的OD550值差异显著。因此,根据第18 h菌悬液的OD550值筛选缓冲蛋白胨水培养基中酵母浸膏的添加量。由表2可知,第18 h缓冲蛋白胨水菌悬液的OD550值为0.11。酵母浸膏添加量为3 g/L的改良缓冲蛋白胨水菌悬液的OD550值在第16 h可超过此OD550值;酵母浸膏添加量为5 g/L和7 g/L的改良缓冲蛋白胨水菌悬液的OD550值在第12 h可超过此OD550值;酵母浸膏添加量为9 g/L和11 g/L的改良缓冲蛋白胨水菌悬液的OD550值在第10 h可超过此OD550值。从经济成本考虑,酵母浸膏的添加量为9 g/L是最佳培养基配比。该改良培养基能充分提供食品中沙门氏菌恢复、生长所需要的营养物质,使沙门氏菌的前增菌时间缩短到8~10 h。
2.5 实时荧光PCR法的特异性验证结果
如图3所示,酵母浸膏添加量为9 g/L的改良缓冲蛋白胨水对食品中沙门氏菌特异性良好,可以实现食品中沙门氏菌的快速检测。
3 结论与讨论
食源性致病菌的检测是食品安全监管的重要环节。沙门氏菌污染造成的食品安全事件时有发生,通常在感染沙门氏菌后12~72 h内出现临床症状,主要包括恶心、头痛、呕吐、发烧、腹痛和腹泻等[15-16]。因此,从食品生产、加工、运输等各个环节加强对食源性致病菌的检测显得至关重要。
培养基为微生物生长提供了适合的环境条件和所需的营养物质,微生物前增菌是影响微生物检测的重要因素[17]。目前,国内外许多学者已对培养基的优化开展了多种研究[18]。本研究以缓冲蛋白胨水培养基为基础,通过添加酵母浸膏促进沙门氏菌的恢复和生长。研究表明,随着缓冲蛋白胨水培养基中酵母添加量的增加,沙门氏菌的调整期缩短,对数期斜率和稳定期数值呈增大的趋势。调整期缩短表示沙门氏菌在添加酵母浸膏情况下恢复能力增强,可以更快地适应环境;对数期斜率增大表示沙门氏菌的生物量的增速加大,该培养基的配比适合沙门氏菌的生长。吸光度法测定沙门氏菌的生长曲线没有出现下降的趋势,因为吸光度法只能测出细菌总数,而不是活菌数量。因此,本研究通过平板计数法与之对比,结果表明吸光度法和平板计数法测定的生长曲线基本一致,这说明培养基中营养比较丰富,沙门氏菌没有达到衰亡期。食品中沙门氏菌在酵母浸膏添加量为9 g/L的改良缓冲蛋白胨培养基中培养10 h后,菌悬液的OD550值达到0.13,超过其在缓冲蛋白胨培养基中培养18 h后达到的OD550值,改良缓冲蛋白胨水培养基的前增菌时间缩短了8 h。通过实时荧光PCR法的验证,确定该改良缓冲蛋白胨水培养基特异性良好,可以满足目标菌的检测要求。因此,食品中沙门氏菌的前增菌时间可以缩短到8~10 h。
本研究优化了食品中沙门氏菌缓冲蛋白胨水培养基的配比,通过添加酵母浸膏缩短了前增菌所需的检验时间,满足了快速检测的需求,为我国食品检验工作提供了参考。在加工过程中,食品中的微生物可能会受到高温或低温的损伤,处于难培养或活的非可培养状态(Viable but Non-Culturable,VBNC)[19]。当食源性致病菌进入这一状态后,将无法采用传统培养方法进行检验,但该致病菌仍能存活,这种现象会对食品安全构成潜在的威胁。因此,本研究下一步的研究方向将会探索培养基对微生物菌体损伤的修复能力,为食源性致病菌的检测提供更可靠的依据。
参考文献
[1]RICHARDSON K E,COSBY D E,BERRANG M E,et al.
Evaluation of the tris phosphate carbonate pre-enrichment medium for poultry feed and feed ingredients[J].Journal of Applied Poultry Research,2020,30(4):100104.
[2]章小洪,范蕾,邹小龙,等.食品沙门氏菌环介导等温扩增技术应用研究进展[J].食品安全质量检测学报,2021,12(24):9408-9414.
[3]KARABASANAVAR N,MADHAVAPRASAD C,GOPALAKRISHNA S,et al.Prevalence of Salmonella serotypes S. Enteritidis and S. Typhimurium in poultry and poultry products[J].Journal of Food Safety,2020,3:12852.
[4]LIU R,ZHANG Y,Ali S,et al.Development of a fluorescence aptasensor for rapid and sensitive detection of Listeria monocytogenes in food[J].Food Control,2021,122:107808.
[5]XIAO X,WANG W,ZHANG J,et al.A quantitative risk assessment model of Salmonella contamination for the yellow-feathered broiler chicken supply chain in China[J].Food ControL,2021,121(6):107612.
[6]CHEN S Y,WANG F,BEAULIEU J C,et al.Rapid detection of viable Salmonellae in produce by coupling propidium monoazide with loop-mediated isothermal amplification[J].American Society for Microbiology,2011,77(12):4008-4016.
[7]CAI Q,WANG R,QIAO Z,et al.Single-digit Salmonella detection with the naked eye using bio-barcode immunoassay coupled with recombinase polymerase amplification and a CRISPR-Cas12a system[J].Analyst,2021,146: 5271-5279.
[8]SHANG Y T,YE Q H,WU Q P,et al.PCR identification of Salmonella serovars for the E serogroup based on novel specific targets obtained by pan-genome analysis[J].LWT,2021,145:110535.
[9]DU J,WU S J,NIU L Y,et al.A gold nanoparticles-assisted multiplex PCR assay for simultaneous detection of Salmonella typhimurium, Listeria monocytogenes and Escherichia coli O157:H7[J].Analytical Methods,2020(2):212-217.
[10]HUANG C X,MAHBOUBAT B Y,DING Y F,et al.
Development of a rapid Salmonella detection method via phage-conjugated magnetic bead separation coupled with real-time PCR quantification[J].LWT, 2021,142:111075.
[11]BU T,YAO X L,HUANG L J,et al.Dual recognition strategy and magnetic enrichment based lateral flow assay toward Salmonella enteritidis detection[J].Talanta,2020,206:120204.
[12]RICHARDSON K E,COSBY D E,BERRANG M E,et al.Evaluation of the tris phosphate carbonate Salmonella pre-enrichment medium for poultry feed and feed ingredients[J].Journal of Applied Poultry Research,2020,30(1):100104.
[13]RASAMSETTI S,BERRANG M E,COX N A,et al.
Selective pre-enrichment method to lessen time needed to recover Salmonella from commercial poultry processing samples[J].Food Microbiology,2021,99(1):103818.
[14]COX N A,COSBY D E,BERRANG M E,et al.
The effect of environmental poultry samples on the pH of typical Salmonella pre-enrichment and enrichment media following incubation[J].The Journal of Applied Poultry Research,2018,27(1):112-115.
[15]YE Q H,SHANG Y T,CHEN M T,et al.Identification of Novel Sensitive and Reliable Serovar-Specific Targets for PCR Detection of Salmonella Serovars Hadar and Albany by Pan-Genome Analysis[J].Front Microbiol,2021, 12:605984.
[16]WANG L J,YE C L,XU H Y,et al.Development of an SD-PMA-mPCR assay with internal amplification control for rapid and sensitive detection of viable Salmonella spp. Shigella spp. and Staphylococcus aureus in food products[J].Food Control,2015,57:314-320.
[17]RíOS-CASTILLO A G,RIPOLLES-AVILA C,RODRÍGUEZ-JEREZ J J.Detection of Salmonella Typhimurium and Listeria monocytogenes biofilm cells exposed to different drying and pre-enrichment times using conventional and rapid methods[J].International Journal of Food Microbiology,2020,324:108611.
[18]BABU U S,HARRISON L M,PATEL I R,et al.
Development and validation of an improved method for the detection of Salmonella in cinnamon bark and oregano leaves using the adsorbent beta zeolite in the pre-enrichment media[J].Food Microbiol,2021,100:103852.
[19]WANG S,LIU N,ZHENG L,et al.A lab-on-chip device for sample-in-result-out detection of viable Salmonella using loop-mediated isothermal amplification and real-time turbidity monitoring[J].Lab on a Chip,2020(13):2296-2305.

