枸杞红瘿蚊和枸杞白瘿蚊所致虫瘿形态结构差异
高琼琼 杨孟可 徐常青 陈君 乔海莉 刘赛 陆鹏飞


摘要 枸杞红瘿蚊是宁夏枸杞上重要成灾害虫之一。枸杞白瘿蚊是继枸杞红瘿蚊后在宁夏枸杞上新发现的另一种瘿蚊科害虫。两种瘿蚊均以幼虫为害宁夏枸杞幼嫩花蕾使其不能正常发育,但形成的虫瘿结构差异明显。本文通过外部形态观察、石蜡切片等方法对两种虫瘿发育过程中的外部形态特征、内部组织结构进行了对比。结果表明,两种瘿蚊幼虫的取食不会引起花部结构的增加或缺失,但均影响花部结构发育,使其无法正常开花结果。枸杞红瘿蚊主要造成子房细胞数量增多形成虫瘿,枸杞白瘿蚊主要造成花冠细胞体积增大形成虫瘿。此外两种虫瘿在花柱、花丝、蜜腺、花药、花柄等处均存在一定差异。
关键词 宁夏枸杞;瘿蚊;虫瘿;虫瘿结构
中图分类号: S435.671
文献标识码: A
DOI: 10.16688/j.zwbh.2021187
Abstract Gephyraulus lycantha (wolfberry red gall midge, WRGM) is one of the most important pests of Lycium barbarum, and Contarinia sp. (wolfberry white gall midge, WWGM) is another newly found flower gall midge. These two midges can both induce flower bud galls that cannot develop normally, but the gall structures induced by the two species of gall midges are obviously different. Here, the external morphology and internal tissue structure of the two kinds of flower galls during development were compared by means of external morphological and paraffin section observations. The results showed that the feeding by larvae of the two gall midge species did not cause any increase or loss in floral structure, but both affected the development of floral structure and prevented them from flowering and fruiting normally. WRGM mainly induced an increase in the number of ovary cells leading to an enlarged appearance of galls, while WWGM mainly induced an increase in the size of corolla cells leading to an enlarged appearance of galls. There were also some differences in the style, filament, nectary, anther, and stalk.
Key words Lycium barbarum;gall midge;gall;gall structure
寧夏枸杞Lycium barbarum L.为茄科Solanaceae枸杞属Lycium多年生落叶灌木,是我国西北地区的重要经济作物[1]。其干燥成熟果实枸杞子为我国大宗常用中药材[2]。宁夏枸杞花果同期,营养丰富,易滋生病虫害。据调查有60多种害虫为害宁夏枸杞,其中成灾害虫10多种[3]。枸杞红瘿蚊,即枸杞花桥瘿蚊Gephyraulus lycantha Jiao & Kolesik是宁夏枸杞生产中普遍发生的重要害虫[4]。该虫以幼虫为害枸杞花蕾,使其形成畸形虫瘿而不能开花结实[5]。枸杞红瘿蚊最早于1970年在野生宁夏枸杞上发现[6],此后一直被认为是形成枸杞花蕾虫瘿的唯一害虫[7]。已发表的文章中对枸杞花蕾虫瘿的描述主要围绕其外观形状[6,8],如“灯笼状畸形虫瘿”[9]等,极少关注虫瘿内部结构。然而,作者在解剖大量枸杞花蕾虫瘿时发现另一种截然不同的虫瘿结构,其外观与枸杞红瘿蚊虫瘿极为相似,但致瘿膨大部位存在明显差异。该瘿蚊幼虫和雌雄成虫体色均为白色,与枸杞红瘿蚊有明显区别,经天津农学院焦克龙副教授鉴定暂命名为“枸杞白瘿蚊”Contarinia sp.。
枸杞红瘿蚊和枸杞白瘿蚊均隶属于双翅目Diptera瘿蚊科Cecidomyiidae。二者均为害宁夏枸杞幼蕾,致其不能正常开放,形成畸形花蕾即虫瘿[8]。虫瘿是植物与昆虫互作、协同进化的高级产物[10-11]。虫瘿的形成具有高度专一性,一种致瘿昆虫通常只为害同种或同属植物的某一部位,不同致瘿昆虫致瘿部位不一致。依据为害部位,虫瘿可分为芽瘿、花瘿、叶瘿、枝条瘿、根瘿和果瘿等[12-15],其中在花器官成瘿的致瘿生物很少[16-17]。简单的虫瘿结构是叶片卷曲或隆起,复杂的虫瘿结构一般包括虫瘿外表皮、虫室、维管束、营养层等[10]。目前国内对虫瘿的研究大多是叶瘿形态的简单描述[18-19],对花瘿外部形态及其内部组织结构研究较少。
宁夏枸杞被枸杞红瘿蚊或枸杞白瘿蚊为害后形成的虫瘿属于典型的花瘿。自然界中两种瘿蚊为害同种植物同一器官,且形成具有明显形态差别虫瘿的现象十分少见。而如何准确识别与区分两种瘿蚊虫瘿,对这两种害虫的监测与防控有重要意义。同时,研究两种瘿蚊致瘿差异是了解致瘿昆虫与寄主植物互作及协同进化的重要依据。本试验采用外部形态观察、石蜡切片等方法研究两种虫瘿的发育特征、外部形态及内部解剖结构差异,以期为进一步研究枸杞红瘿蚊和枸杞白瘿蚊致瘿机理提供参考,为后期田间识别及防治提供基础。
1 材料与方法
1.1 材料
不同发育阶段的宁夏枸杞正常花、枸杞红瘿蚊虫瘿和枸杞白瘿蚊虫瘿于2018年5月采自甘肃省民勤县西渠镇的一个枸杞园内(38°59′N;103°34′E)。田间调查发现两种害虫在该地区时常共同发生(图1)。
1.2 主要仪器
解剖镜Leica M205C、显微镜Leica DM2500、浸蜡机Leica ASP2005、包埋机Leica EG1150H、冷台Leica EG1130、切片机Leica RM2245、染色机Leica ST5020、展片机Leica HI1210、烤片机Leica HI1220,德国莱卡仪器有限公司;全景组织细胞定量分析仪Tissue FAXS Plus,奥地利 Tissue Gnostics 公司。
1.3 方法
1.3.1 外部形态观察
从田间采集带虫瘿的宁夏枸杞枝条,快速放入装有冰袋的泡沫箱中带回室内,观察和记录不同时期新鲜虫瘿的形态。1)外观形态比较:对比不同发育时期虫瘿与正常花,并使用Nikon D90 + 85 mm f/3.5G ED VR拍照记录。2)纵截面观察:使用干净解剖刀从虫瘿中部纵切,比较不同发育时期虫瘿纵切面,并使用Canon EOS 60D + MP-E 65 mm f/2.8 1-5X拍照记录。3)花器官观察:将不同时期虫瘿内各花器官剥离分开,在Leica M205C显微镜下观察花器官结构在不同时期的发育情况,并拍照记录。
1.3.2 石蜡切片解剖观察
从田间采集不同发育时期的正常花和虫瘿,用蒸馏水清洗干净后置于FAA固定液(50%乙醇90 mL +冰醋酸5 mL+甲醛5 mL)中保存备用。样品经梯度乙醇脱水(50%乙醇1 h,60%乙醇1 h,70%乙醇1 h,80%乙醇1 h,90%乙醇1 h,100%乙醇30 min,100%乙醇30 min),二甲苯透明、石蜡包埋后,采用常规石蜡切片技术切片,切片厚度10 μm,以番红-固绿染色,再经脱水透明后制成永久玻片。将玻片置于Tissue Gnostics载物台上,用Zeiss Axio Imager Z2显微镜观察,Tissue FAXS Plus软件拍摄拼接并保存。
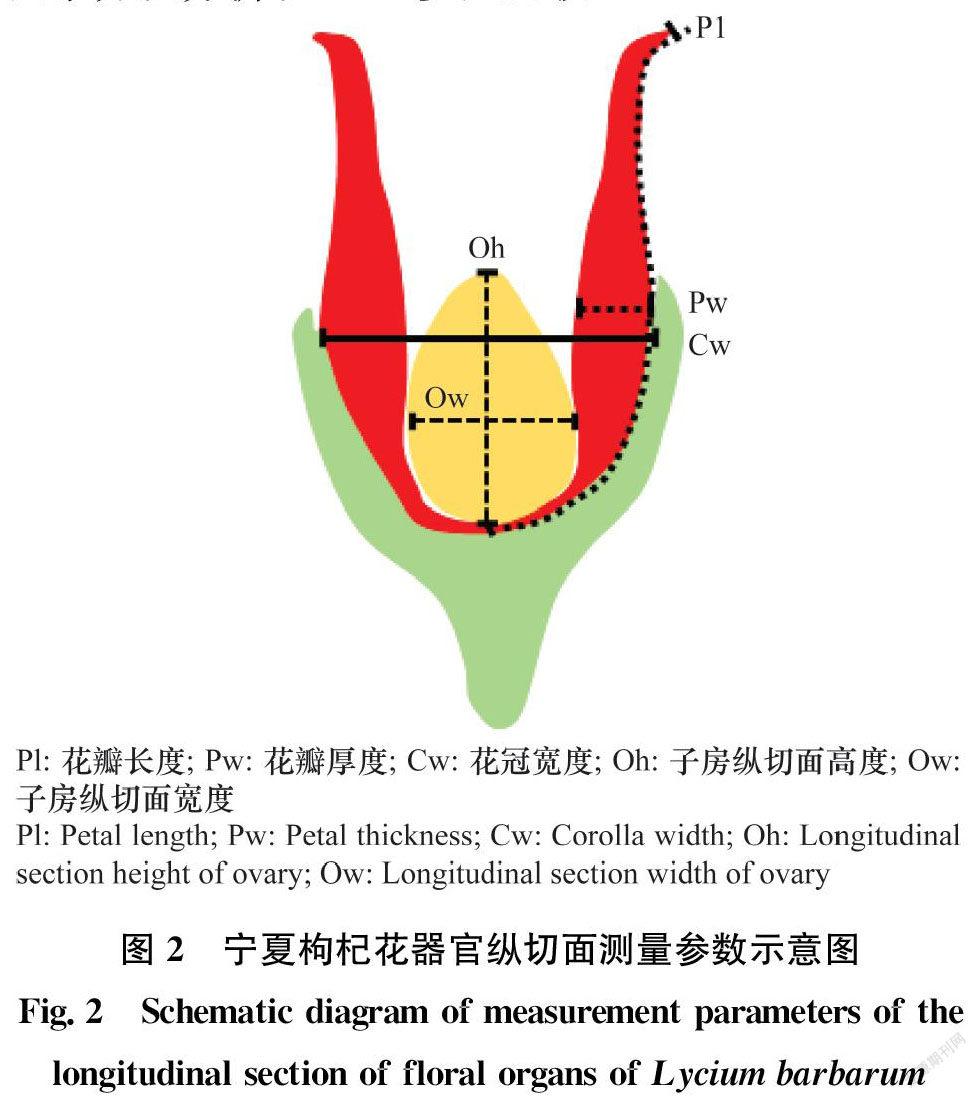
1.3.3 花器官参数的测量
1)每组6个花/虫瘿。选取花冠、子房2个部位,使用Digimizer软件测量虫瘿宽度(花冠宽度)(Cw)、花瓣长度(Pl)、花瓣厚度(Pw)、子房纵切面宽度(Ow)、子房纵切面高度(Oh)共5个参数(单位:mm)。2)基于以上样本观察子房及花冠细胞,各随机选取10个视野观察测量,每个视野测定5个细胞,分析计算子房和花冠细胞面积(单位:μm2)。3)统计方法:采用SPSS 21进行数据分析,计算平均值和标准误(SE),对同一时期的不同处理组进行单因素方差分析和LSD多重比较。
2 结果与分析
2.1 两种瘿蚊虫瘿外部形态差异
两种瘿蚊虫瘿均为畸形发育的花,虫瘿外部绿色,整个发育期间虫瘿闭合。根据花和虫瘿发育过程中外部形态特征,将正常枸杞花(CK,图3a)、枸杞红瘿蚊虫瘿(GG,图3b)和枸杞白瘿蚊虫瘿(CG,图3c)的发育分为6个时期。
第1时期:幼虫侵入期。此时正常花处于幼蕾期,外部平滑。两种瘿蚊成虫在枸杞幼嫩花蕾顶部产卵,外观上正常花和被瘿蚊侵染的花不易区分,仅能通过在花蕾上产卵后死去的成虫进行区分。卵在花蕾中原位孵化,孵化后瘿蚊幼虫即开始取食,幼虫从花蕾顶部往子房处边移动边取食,最终大多数枸杞红瘿蚊幼虫停留在子房基部,而大多数枸杞白瘿蚊幼虫停留在子房顶部。
第2~4时期:幼虫取食,虫瘿形成期。此时正常花处于露冠期。两种虫瘿形态可区分。两种瘿蚊幼虫均开始在固定部位为害,造成取食点附近的组织细胞不能正常生长发育,从而形成不同结构的虫瘿。枸杞红瘿蚊形成的虫瘿基部(主要为子房)开始膨大而顶部尖,虫瘿外形似“水滴”,而后虫瘿不断发育,子房膨大致使花萼开始开裂,此时虫瘿形似“球形”,虫瘿顶部露出近白色花冠,花萼边缘干枯成棕色(图3b)。枸杞白瘿蚊形成的虫瘿花冠基部开始膨大,形成囊状结构,而后花冠中部快速生长,虫瘿外形似“灯笼”,有明显的沟纹均匀分布在虫瘿上,大多数虫瘿沟纹为5条,与宁夏枸杞正常花冠数量一致。随着虫瘿不断发育,虫瘿顶端开始露出近白色花冠(圖3c)。
第5~6时期:幼虫老熟入土,虫瘿成熟期。此时正常花进入盛花期。两种虫瘿形态可明显区分。此时虫瘿内两种瘿蚊幼虫老熟,在虫瘿外可见老熟幼虫钻出并弹跳入土,进入下一发育期,幼虫离开虫瘿后,虫瘿逐渐干枯掉落,偶有虫瘿早落情况发生。成熟的枸杞红瘿蚊虫瘿实心、硬实,花药萎缩,花冠纤薄,子房膨大,虫瘿顶部可见子房,有些类似成熟宁夏枸杞果实而显红色。成熟的枸杞白瘿蚊虫瘿中空、松软,花药膨大,花冠基部膨大,子房萎缩。
2.2 两种瘿蚊虫瘿内部结构差异
正常枸杞花、枸杞红瘿蚊虫瘿和枸杞白瘿蚊虫瘿内部结构如图4所示。
枸杞红瘿蚊形成的虫瘿(GG):花冠薄,浅绿色,中上部膨大,子房和花冠易与花萼、花柄分离(图4GG-b, c)。花药萎缩呈褐色,花丝长度比CK短,比枸杞白瘿蚊虫瘿(CG)长,花丝扁平弯曲,紧贴子房,不易观察(图4GG-d)。枸杞红瘿蚊虫瘿(GG)子房膨大,在子房下部及周围花冠基部组织可见枸杞红瘿蚊幼虫取食痕迹(图4GG-e-①),子房上花柱缩短,柱头萎缩,基部无黏液(图4GG-e)。
枸杞白瘿蚊形成的虫瘿(CG):花冠厚,深绿色,中下部膨大,子房和花冠不易与花萼、花柄分离(图4CG-b, c),花萼开裂,在成熟虫瘿中,有接近1/2的花冠未被花萼包裹(图4CG-a)。花药膨大不开裂,花丝极度缩短(图4CG-d)。枸杞白瘿蚊虫瘿(CG)子房大小变化不大,在子房上部及花柱基部可见枸杞白瘿蚊幼虫取食痕迹(图4CG-e-②),花柱弯曲,无明显伸长,柱头膨大,基部有明显黏液(图4CG-e)。
2.3 两种瘿蚊所致虫瘿组织结构差异
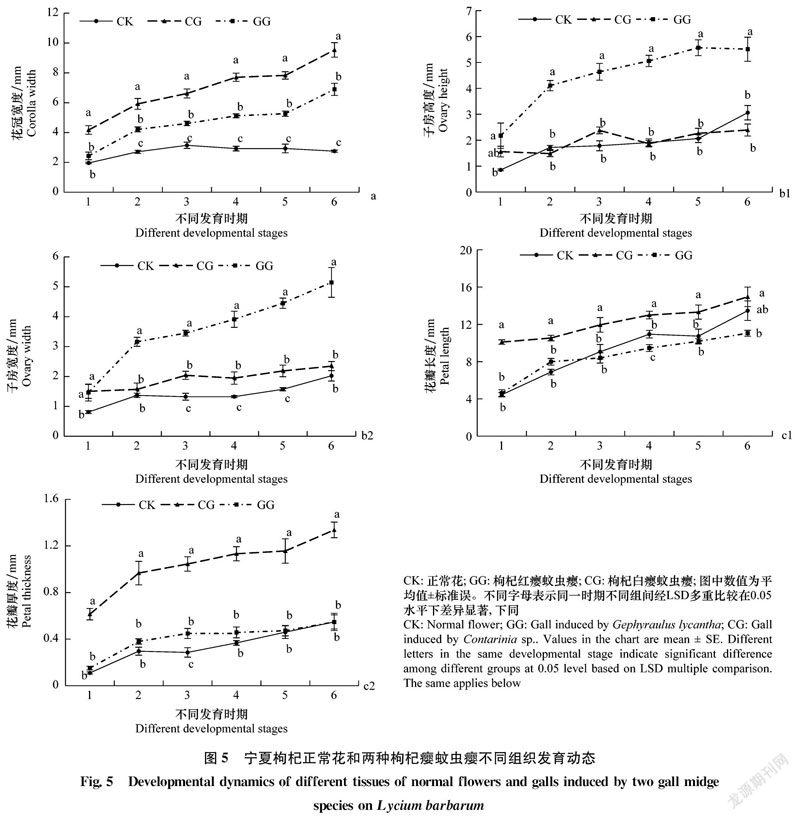
两种瘿蚊造成宁夏枸杞花成畸形虫瘿,两种瘿蚊虫瘿宽度、子房大小及花冠大小与对照存在显著差异,花部各组织不同时期发育动态如图5所示。
花冠:CK花冠宽度在不同时期波动较小,两种瘿蚊所致虫瘿的宽度持续增长,在1~2时期和5~6时期宽度增长幅度较大(图5a)。枸杞白瘿蚊虫瘿(CG)宽度在各时期均大于CK和枸杞红瘿蚊虫瘿(GG),枸杞红瘿蚊虫瘿(GG)花冠宽度居于CK和枸杞白瘿蚊虫瘿(CG)之间,CK花冠宽度最小。至第6时期,枸杞白瘿蚊虫瘿(CG)宽度达到9.54 mm,为CK的3.47倍,为枸杞红癭蚊虫瘿(GG)的1.38倍。除第1时期外,其他时期3者间均存在显著差异(P<0.05)。
子房:CK子房高度和宽度总体呈上升趋势,在1~2时期和5~6时期增长幅度较大。枸杞红瘿蚊虫瘿(GG)子房高度(图5b1)和子房宽度(图5b2)在整个发育时期内总体呈上升趋势,除第1时期外,其他时期均显著高于CK和枸杞白瘿蚊虫瘿(CG)(图5b,P<0.05),至第6时期,枸杞红瘿蚊虫瘿(GG)子房宽度达到5.15 mm,高度达到5.51 mm,分别为枸杞白瘿蚊虫瘿(CG)的2.19倍和2.30倍,为CK的2.54倍和1.80倍。枸杞白瘿蚊虫瘿(CG)与CK在子房高度上无显著差异,但二者的子房宽度在3~5时期有显著差异(图5b2,P<0.05)。枸杞白瘿蚊虫瘿(CG)子房高度和宽度变化无明显规律,但第6时期高于第1时期。
花瓣:枸杞红瘿蚊虫瘿(GG)、枸杞白瘿蚊虫瘿(CG)和CK的花瓣长度和厚度总体呈增长趋势。CK花瓣长度除在4~5时期略有波动,整体增速较快。发育末期,CK花瓣长度(图5c1)和厚度(图5c2)居于枸杞白瘿蚊虫瘿(CG)和枸杞红瘿蚊虫瘿(GG)之间。枸杞白瘿蚊虫瘿(CG)花瓣长度和厚度均高于枸杞红瘿蚊虫瘿(GG)和CK,花瓣厚度在1~2时期和5~6时期增长幅度较大。至第6时期,枸杞白瘿蚊虫瘿(CG)花瓣长度和花瓣厚度显著高于枸杞红瘿蚊虫瘿(GG)(图5c,P < 0.05),分别为枸杞红瘿蚊虫瘿的1.35倍和2.44倍;枸杞白瘿蚊虫瘿(CG)仅在花瓣厚度上与CK存在显著差异,为CK的2.44倍。CK与枸杞红瘿蚊虫瘿(GG)在花瓣长度、厚度上均无显著差异。2.4 两种瘿蚊所致虫瘿组织细胞形态及大小差异
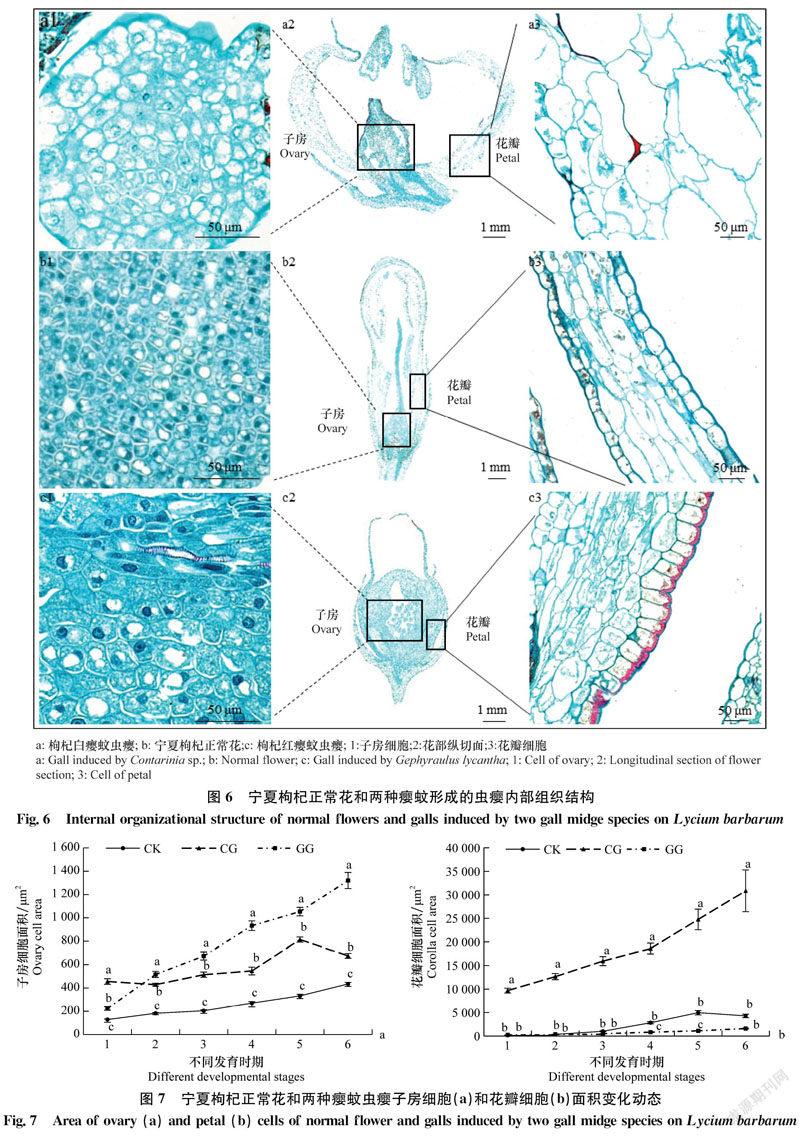
2.4.1 子房细胞
发育初期,CK、枸杞红瘿蚊虫瘿和枸杞白瘿蚊虫瘿子房纵切面细胞差别不大,均紧密排列。CK子房外壁细胞完整,整体细胞呈方形,较小。在整个发育时期CK子房细胞缓慢增大,但细胞面积显著小于形成虫瘿的子房细胞(图6b1,图7a)。枸杞白瘿蚊虫瘿子房顶部外壁细胞有明显被取食痕迹,多数细胞形状不完整,子房内部细胞排列规则,细胞多为方形,面积显著大于CK(图6a1,图7a)。枸杞红瘿蚊虫瘿子房基部外壁细胞可见明显被取食痕迹,被取食后细胞皱缩无完整形态,其子房内部细胞初期与CK相似呈方形,而后逐渐增大。在子房部位观察到导管结构,细胞仍紧密排列,但细胞排列方式及形状逐渐变为无规则(图6c1),细胞面积随虫瘿的发育持续增大,各时期均显著高于CK,2~6时期显著高于枸杞白瘿蚊虫瘿。在第6时期枸杞红瘿蚊虫瘿子房细胞面积达到最大,为1 320.73 μm2,是CK的3.04倍,枸杞白瘿蚊虫瘿的1.96倍(图7a)。各时期各组之间细胞面积存在显著差异(P<0.05)。枸杞红瘿蚊虫瘿子房细胞不仅面积大于CK和枸杞白瘿蚊虫瘿,而且整体数量也明显多于枸杞白瘿蚊虫瘿(图6c2)。
2.4.2 花瓣细胞
发育初期CK的花瓣细胞近正方形。发育后期,中部细胞纵向生长成长方形并紧密排列,花瓣内外表皮细胞近方形,规则排列在一起(图6b3)。枸杞白瘿蚊虫瘿发育初期,花瓣内、外层细胞均为方形,紧密排列,花瓣内层细胞无明显增大,有被取食痕迹,中层细胞不断膨大,细胞形状疏松无规则排列(图6a3);花瓣细胞面积不断增长,至第6时期,细胞面积最大,为30 848.22 μm2,显著高于CK和枸杞红瘿蚊虫瘿(P<0.05),是CK的7.22倍,枸杞红瘿蚊虫瘿的19.43倍。枸杞红瘿蚊虫瘿发育初期花瓣细胞排列紧密,形状多为长方形,中层可见许多导管。内层细胞可见取食痕迹,大小不一,形状不规则,排列紧密无序,外层细胞大小不一,但仍有序排列。大部分中层细胞狭长,紧密排列(图6c3)。枸杞红瘿蚊虫瘿和CK花瓣细胞面积变化总体趋势相似,1~3时期细胞面积增长平缓,3~4时期增幅提升,二者各时期细胞面积均无显著差异(P>0.05),但均显著低于枸杞白瘿蚊虫瘿(图7b)。
3 讨论
枸杞红瘿蚊和枸杞白瘿蚊幼虫取食诱导形成的两种虫瘿在外部形态和内部结构上与正常花部结构存在明显差异,其中,以子房和花冠两个部位差异较大。枸杞红瘿蚊幼虫取食为害主要导致子房部位膨大,枸杞白瘿蚊取食主要导致花冠部位膨大,表明枸杞红瘿蚊幼虫取食促进子房细胞的分裂,而枸杞白瘿蚊幼虫取食则促进花冠细胞的膨大。两种瘿蚊幼虫取食并不会引起花部结构的增加和缺失,但导致花部结构畸形发育,无法正常开花结实。此外,雌蕊、雄蕊等结构也存在差异。
依据本研究结果可快速鉴别两种瘿蚊所致虫瘿,虫瘿的外在表型会因成虫产卵时期不同而有细微不同,但内部结构差异不大。在枸杞红瘿蚊虫瘿中,一个虫瘿内会出现两批不同龄期的幼虫,表明枸杞红瘿蚊成虫会在同一花蕾内重复产卵。在田间调查中还发现两种瘿蚊会共同为害同一花蕾,形成另一种新结构虫瘿,两者共同为害的虫瘿外观与枸杞白瘿蚊虫瘿相似,花冠膨大,但解剖发现内部子房也同时膨大。共同为害的虫瘿以子房膨大为主还是以花冠膨大为主可能与两种瘿蚊幼虫数量有关。
虫瘿是植物和昆虫互作产物,是自然界普遍存在的现象,植物的光合产物及营养会优先供给幼嫩部位,因此致瘿昆虫通常会为害植物幼嫩部位[20],以保证其正常的生长发育。目前,致瘿昆虫形成虫瘿特异形态的过程和机制还不清楚,普遍认为致瘿昆虫在取食、产卵时的机械刺激或唾液等各种分泌物可影响植物营养分配[21],使植物细胞按特定方向有规律地分裂和增长。本研究中的两种瘿蚊属于同一科,口器及取食方式一致,猜测两种幼虫对营养的需求也基本一致,两种瘿蚊取食部位虽稍有差别,但物理刺激相似,因而推断物理刺激并非导致虫瘿结构出现差异的主要原因,产生差异的原因可能是分泌的致瘿刺激物质不同,改变了植物体内部分激素的含量及分布[17],从而导致各花器官(尤其是花冠和子房)在生长过程中出现了非正常变化,最终形成不同虫瘿结构。在整个虫瘿的形成过程中并无新的生理过程和代谢通路发生[22-23],也无新的结构产生,然而正常生理过程会以非正常时间和生长速率进行,从而致使正常组织形成虫瘿[24]。推测是由于两种瘿蚊幼虫的取食会诱导植物产生不同种类的植物激素,改变了植物激素间的相关关系[25],尤其是生长素和细胞分裂素[26-27],而且枸杞红瘿蚊可能主要调控细胞分裂素,枸杞白瘿蚊主要调控生长素。一般而言,虫瘿中酶的种类和活性,以及植物激素的含量和个别激素比例都有所变化[23,28]。在本文的研究中尚不能确定幼虫取食与虫瘿发育存在怎样的关系。虫瘿发育是否需要虫瘿的持续取食?幼虫取食如何调控花蕾形成虫瘿?两种瘿蚊单独致瘿的主要物质及机制和两种瘿蚊共同致瘿的机理是什么?这些问题仍需开展进一步研究。
自然界中,在花器官上致瘿的昆虫较少,因而对此展开的研究十分匮乏。宁夏枸杞两种瘿蚊在幼嫩花蕾产卵及幼虫取食为害导致宁夏枸杞产生花瘿。本文描述了两种花瘿在不同发育时期下的外部形态和内部组织结构的特征及差异,一方面丰富了虫瘿种类,完善了对虫瘿结构的描述;另一方面,两种虫瘿外部形态及内部结构研究为田间快速识别和防治提供理论指导,为进一步研究枸杞红瘿蚊和枸杞白瘿蚊致瘿机理提供参考。
参考文献
[1] 徐常青, 刘赛, 徐荣, 等. 我国枸杞主产区生产现状调研及建议[J]. 中国中药杂志, 2014, 11(39): 1979-1984.
[2] 国家药典委员会. 中华人民共和国药典[M]. 北京:中国医药科技出版社, 2020.
[3] 李建领, 刘赛, 徐常青, 等. 宁夏枸杞主要害虫发生规律与防治策略[J]. 中国现代中药, 2017, 16(11): 1599-1604.
[4] JIAO Kelong, ZHOU Xiaoyi, QIAO Haili, et al. A new species of gall midge (Diptera: Cecidomyiidae) damaging flower buds of goji berry Lycium barbarum (Solanaceae) [J]. Journal of Asia-Pacific Entomology, 2020, 23(4): 930-934.
[5] 刘赛, 雷捷惟, 陈君, 等. 宁夏回族自治区中宁县枸杞红瘿蚊生物学特性及发生规律[J]. 植物保护学报, 2020, 47(2): 446-454.
[6] 吴福桢, 高兆宁, 郭予元. 宁夏农业昆虫图志第二集[M]. 银川:宁夏人民出版社, 1982.
[7] 张宗山, 赵怡红. 枸杞瘿蚊年世代发育与温度关系的初步研究[J]. 植物保护, 1990, 16(S1): 42.
[8] 刘美珍, 赵怡红, 张宗山. 枸杞红瘿蚊研究初报[J]. 宁夏农林科技, 1987(4): 25-28.
[9] 李建领, 徐常青, 乔鲁芹, 等. 宁夏枸杞红瘿蚊的发生特点与防治策略[J]. 中国现代中药, 2015, 17(8): 840-843.
[10]STONE G N, SCHNROGGE K. The adaptive significance of insect gall morphology [J]. Trends in Ecology & Evolution, 2003, 18(10): 512-522.
[11]邵淑霞, 阮楨媛, 杨子祥, 等. 虫瘿―昆虫与植物互作的奇特产物[J]. 环境昆虫学报, 2012, 34(3): 363-369.
[12]刘胜萍, 王正跃. 柑桔花蕾蛆危害与柑桔总落花的相关研究[J]. 植物保护, 1989, 15(6): 26.
[13]吴秀花, 杨荣, 刘丽英, 等. 白枸杞瘤螨的虫瘿特点、分布及对枸杞的危害[J]. 植物保护, 2017, 43(1): 135-139.
[14]FERNANDES G W, DUARTE H, LUTTGE U. Hypersensitivity of Fagus sylvatica L. against leaf galling insects [J]. Trees-Structure and Function, 2003, 17(5): 407-411.
[15]陆沁, 杨子祥, 吴海霞, 等. 角倍蚜虫瘿的组织学结构与功能解析[J]. 环境昆虫学报, 2018, 40(1): 1-10.
[16]STUART J J, CHEN M S, SHUKLE R, et al. Gall midges (Hessian Flies) as plant pathogens [J]. Annual Review of Phytopathology, 2012, 50(1): 339-357.
[17]MANI M S. Ecology of plant galls [M]. Dordrecht: Springer, 1964.
[18]刘世彪, 李勇, 龙华, 等. 油茶叶肿病子房瘿体和叶片瘿体的形态结构特征观察[J]. 西北植物学报, 2012, 32(9): 1752-1757.
[19]王光钺. 栗瘿蜂致瘿生物学及其对寄主植物生长发育的影响[D]. 杭州: 浙江农林大学, 2010: 58.
[20]ALLISON S D, SCHULTZ J C. Biochemical responses of chestnut oak to a galling cynipid [J]. Journal of Chemical Ecology, 2005, 31(1): 151-166.
[21]RAMAN A. Morphogenesis of insect-induced plant galls: facts and questions [J]. Functional Ecology of Plants, 2011, 206(6): 517-533.
[22]ROHFRITSCH O, SHORTHOUSE J D. 5-insect galls [M]∥KAHL G, SCHELL J S. Molecular biology of plant tumors. New York: Academic Press, 1982: 131-152.
[23]CHOUDHARY R, KUMAR S. Quantitative estimation of some metabolites and enzymes in insect induced leaf galls of Pongamia pinnata (L.) [J]. Journal of Chemical & Pharmaceutical Research, 2012, 4(9): 4192-4197.
[24]BAILEY S, PERCY D M, HEFER C A, et al. The transcriptional landscape of insect galls: psyllid (Hemiptera) gall formation in Hawaiian Metrosideros polymorpha (Myrtaceae) [J/OL]. BMC Genomics, 2015, 16: 943. DOI:10.1186/s12864-015-2109-9.
[25]BYERS J A, BREWER J W, DENNA W D. Plant growth hormones in pinyon insect galls [J]. Marcelia, 1976, 39: 125-134.
[26]MAPES C C, DAVIES P J. Indole-3-acetic acid and ball gall development on Solidago altissima [J]. New Phytologist, 2001, 151(1): 195-202.
[27]KNYPL J S, CHYLINSKA K M, BRZESKI M W. Increased level of chlorogenic acid and inhibitors of indolyl -3- acetic acid oxidase in roots of carrot infested with the northern root-knot nematode [J]. Physiological Plant Pathology, 1975, 6(1): 51-64.
[28]YAMAGUCHI H, TANAKA H, HASEGAWA M, et al. Phytohormones and willow gall induction by a gall-inducing sawfly [J]. New Phytologist, 2012, 196(2): 586-595.
(責任编辑:杨明丽)

