SOD、MDA和IL-6在Hp相关性胃病患者血清中的表达
祁子楠,王桂君
(锦州医科大学附属第一医院,辽宁 锦州 121000)
幽门螺杆菌(Hp)是一种寄生于胃黏膜上皮内的革兰阴性杆菌[1],全球人群感染率达到50%,我国人群Hp感染率约为 50%~90%[2]。Hp感染可以导致消化道溃疡、萎缩性胃炎等消化系统疾病,是胃癌的主要致病因素[3],被世卫组织列为I类致癌因子[4]。Hp可通过分泌多种毒力因子,如空泡毒素A(vacuolating cytotoxin A,VacA)、细胞毒素相关基因A(cytotoxin associated gene A,CagA)等损伤上皮细胞,导致胃黏膜细胞增生与凋亡的失衡,促进胃癌的发生发展[5-6]但其具体发病机制目前尚不十分清楚。
幽门螺杆菌诱导的胃病涉及多种机制,目前氧化应激与炎症反应在Hp致病机制中的作用被人们日益重视。研究表明Hp感染会引发炎性反应,分泌多种炎症因子和细胞因子,如 白细胞介素-1β、白细胞介素-2、白细胞介素-6、白细胞介素-8、肿瘤坏死因子-α等,炎症因子和细胞因子会进一步加重胃部炎症程度[7]。同时感染后会使机体大量中性粒细胞聚集、活化,可进一步引起机体氧化应激水平增高,从而导致大量活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)产生,诱导氧化应激产物和抗氧化物质生成,如丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase)等,进而导致胃上皮细胞损伤,导致胃粘膜炎症加重,甚至引发胃癌[8-9]。
但是目前有关Hp与氧化应激相关性的研究还较少,氧化应激及炎症反应与Hp相关性胃病的关系目前尚未详尽阐述。本研究通过观察非萎缩性胃炎、萎缩性胃炎、胃溃疡、早期胃癌及进展期胃癌患者中Hp的感染情况及血清中SOD、MDA及IL-6表达水平的相应变化,探讨氧化应激及炎症反应在Hp感染中的作用,并进一步观察血清SOD、MDA及IL-6在Hp相关性胃病中的表达,从而探讨氧化应激及炎症反应在Hp相关性胃病中的作用,为Hp相关性胃病的临床诊疗提供理论依据。
1 对象与方法
1.1 研究对象
选取2019年10月至2021年8月锦州医科大学附属第一医院门诊就诊及住院部收治的患者共225人,依据内镜及病理检查结果分为:非萎缩性胃炎43人为非萎缩组,萎缩性胃炎47人为萎缩组,胃溃疡48人为溃疡组,早期胃癌46人为早癌组,进展期胃癌41人为进展组。
纳入标准:(1)所有的患者均经胃镜及内镜下组织病理学检查明确诊断;(2)所有研究对象均同意完善Hp检查及血清学SOD、MDA和IL-6检查,知晓本次研究目的并签署知情同意书。排除标准:(1)近1个月内接受过质子泵抑制剂治疗或行放射治疗及化学药物治疗的患者;(2)近期接受过输血治疗,或者近期曾服用鸦片类、类固醇、抗氧化等药物的患者;(3)患有高血压、糖尿病、肝肾疾病、高脂血症、心脑血管疾病、溃疡性结肠炎、结核、感染以及自身免疫性疾病等疾病的患者;(4)既往患有其他恶性肿瘤疾病患者。本项研究经过我院医学伦理委员会审核批准(批件号:202129)。
1.2 检测方法
Hp检测:所有患者在空腹状态下,或者在禁食、禁饮2 h后接受13C呼气试验检测,嘱患者于测试前漱口,口服尿素13C胶囊,静坐30 min后,再向样气袋内吹满气体,最后对气体进行检测,13C呼气试验检测值≥4判定为Hp阳性。
血清SOD、MDA及IL-6检测:采集标本:叮嘱患者空腹,使用真空采血管抽取 5 mL外周静脉血,室温下静置 30 min,确保2 h内以3000 r/min 速度离心 20 min,分离血清2~3 mL,并保存于-20 ℃的冰箱中待用。通过NBT核黄素比色法测定5组患者血清中SOD活性水平,酶联免疫吸附测定法(enzyme-linked immunosorbent assay)测定五组患者血清中MDA和IL-6水平。
1.3 统计学方法
采用 SPSS 23.0 统计软件进行数据分析,计数资料以例数(百分比)表示,采用χ2检验。计量资料经检验服从正态分布,以均数±标准差进行表示,两组间比较采用独立样本t检验,多组间差异比较采用单因素方差分析,两两比较采用LSD-t检验。统计结果以P<0.05为差异有统计学意义。
2 结 果
2.1 患者一般资料比较
选取2019年10月至2021年8月锦州医科大学附属第一医院门诊就诊及住院部收治的患者共225人,依据内镜及病理检查结果分为:非萎缩性胃炎43人为非萎缩组,男19例、女24例,平均年龄为(43.60±7.48)岁;萎缩性胃炎47人为萎缩组,男27例、女20例,平均年龄为(44.09±7.76)岁;胃溃疡48人为溃疡组,男25例、女23例,平均年龄为(43.79±8.06)岁;早期胃癌46人为早癌组,男20例、女26例,平均年龄为(43.22±7.81)岁;进展期胃癌41人为进展组,男23例、女18例,平均年龄为(45.41±9.27)岁。5组研究对象的性别、年龄比较无统计学差异(P>0.05),见表1。
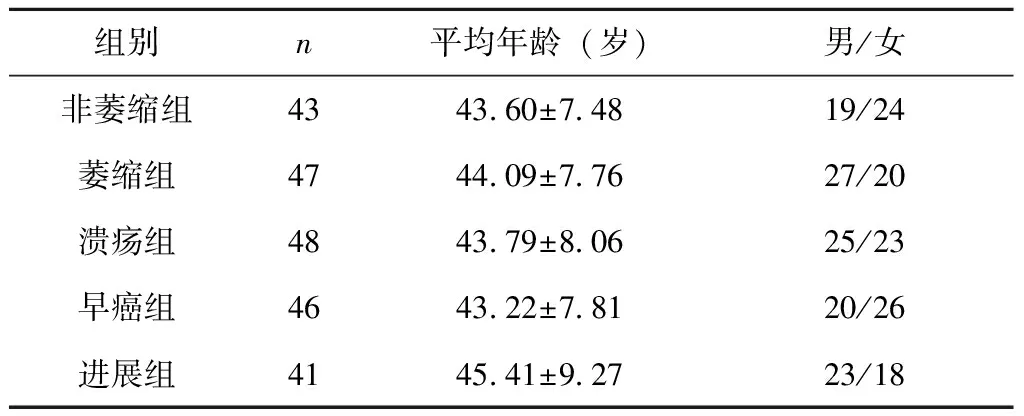
表1 患者一般资料比较
2.2 各组患者Hp感染情况的观察
非萎缩组Hp阳性8例,阴性35例,阳性率18.60%;萎缩组Hp阳性18例,阴性29例,阳性率38.30%;溃疡组Hp阳性29例,阴性19例,阳性率60.42%;早癌组Hp阳性38例,阴性8例,阳性率82.61%;进展组Hp阳性38例,阴性3例,阳性率95.12%。
5组患者间Hp感染阳性率进行比较:与非萎缩组相比:萎缩组(χ2=4.239)、溃疡组(χ2=16.435)、早癌组(χ2=36.459)及进展组(χ2=46.491)的Hp阳性率均明显升高,差异有统计学意义(P<0.05);与萎缩组相比:溃疡组(χ2=3.873)、早癌组(χ2=17.448)及进展组(χ2=26.214)的Hp阳性率均升高,差异有统计学意义(P<0.05);与溃疡组相比:早癌组(χ2=5.650)和进展组(χ2=12.371)的Hp阳性率均升高,差异有统计学意义(P<0.05);与早癌组相比进展组(χ2=1.992)的Hp阳性率升高,差异有统计学意义(P<0.05),见表2。
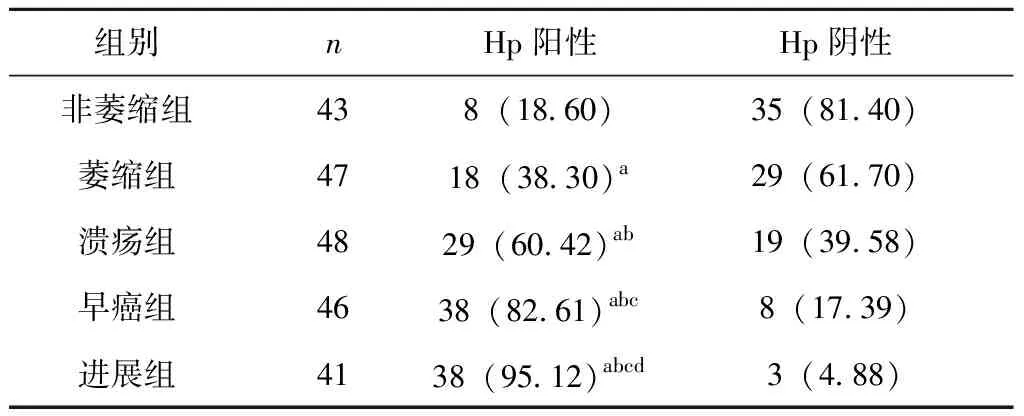
表2 各组患者Hp感染情况[n(%)]
2.3 各组中Hp阳性与阴性患者血清SOD表达水平比较
非萎缩组Hp阳性SOD水平(10.6±2.64),Hp阴性SOD水平(8.6±1.65),两者比较差异有统计学意义(P<0.05);萎缩组Hp阳性SOD水平(13.20±2.93),Hp阴性SOD水平(11.52±2.42),两者比较差异有统计学意义(P<0.05);溃疡组Hp阳性SOD水平(13.87±2.56),Hp阴性SOD水平(12.03±1.24),两者比较差异有统计学意义(P<0.05);早癌组Hp阳性SOD水平(17.40±2.57),Hp阴性SOD水平(15.46±0.62),两者比较差异有统计学意义(P<0.05);进展组Hp阳性SOD水平(20.94±3.06),Hp阴性SOD水平(18.77±0.15),两者比较差异有统计学意义(P<0.05),见表3。
2.4 各组中Hp阳性与阴性患者血清MDA表达水平比较
非萎缩组Hp阳性MDA水平(4.73±1.00),Hp阴性MDA水平(3.56±0.80),两者比较差异有统计学意义(P<0.05);萎缩组Hp阳性MDA水平(5.89±1.41),Hp阴性MDA水平(4.92±1.13),两者比较差异有统计学意义(P<0.05);溃疡组Hp阳性MDA水平(5.72±1.61),Hp阴性MDA水平(4.62±0.80),两者比较差异有统计学意义(P<0.05);早癌组Hp阳性MDA水平(9.08±1.20),Hp阴性MDA水平(8.10±0.29),两者比较差异有统计学意义(P<0.05);进展组Hp阳性MDA水平(12.28±1.42),Hp阴性MDA水平(10.83±0.23),两者比较差异有统计学意义(P<0.05),见表4。
2.5 各组中Hp阳性与阴性患者血清IL-6表达水平比较
非萎缩组Hp阳性IL-6水平(16.64±6.10),Hp阴性IL-6水平(11.64±5.33),两者比较差异有统计学意义(P<0.05);萎缩组Hp阳性IL-6水平(39.23±5.43),Hp阴性IL-6水平(35.55±4.51),两者比较差异有统计学意义(P<0.05);溃疡组Hp阳性IL-6水平(38.72±6.10),Hp阴性IL-6水平(34.34±3.46),两者比较差异有统计学意义(P<0.05);早癌组Hp阳性IL-6水平(49.26±8.02),Hp阴性IL-6水平(42.21±2.32),两者比较差异有统计学意义(P<0.05);进展组Hp阳性IL-6水平(69.58±7.31),Hp阴性IL-6水平(68.72±0.12),两者比较差异有统计学意义(P<0.05),见表5。
2.6 各组间Hp阳性者血清SOD、MDA及IL-6的表达水平比较
各组患者Hp阳性者组间比较患者血清SOD、MDA及IL-6的表达:与非萎缩组相比,萎缩组、溃疡组、早癌组、进展组血清SOD、MDA及IL-6的表达均明显升高,差异具有统计学意义(P<0.05);萎缩组及溃疡组相比无统计学差异(P>0.05);早癌及进展组与其余各组相比血清SOD、MDA及IL-6的表达均明显升高,且升高程度为进展组>早癌组,差异具有统计学意义(P<0.05),见表6。
表3 各组中Hp阳性与阴性患者血清SOD的表达水平比较
表4 各组中Hp阳性与阴性患者血清MDA的表达水平比较
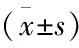
表5 各组中Hp阳性与阴性患者血清IL-6的表达水平比较
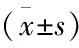
表6 各组间Hp感染者血清SOD、MDA及IL-6表达水平比较
3 讨 论
胃癌的病因学研究已成为当下研究热点,幽门螺杆菌(Hp)感染与慢性胃炎、消化性溃疡以及胃癌等疾病密切相关[4]1034-1041,而且幽门螺杆菌相关性胃炎是胃癌的主要危险因素之一[3]3486-3489。
20世纪初,Hp的致病机制受到人们的关注,研究证实Hp分泌的CagA、VacA等多种毒力因子具有致癌潜力[10];Hp通过将尿酸分解成氨气,在胃部形成有利于其生存的中性环境,使其可在胃上皮细胞大量繁殖,引发多种毒素和炎性因子的形成,进一步破坏胃上皮细胞,导致胃粘膜发生病理变化,从而引发多种胃粘膜病变,甚至导致胃癌的发生[2,8,11]101-104,782-786。
本研究结果显示,非萎缩组、萎缩组、溃疡组、早癌组及进展组5组患者随着疾病严重程度增加Hp感染率逐渐增加,分别为非萎缩组48.84%,萎缩组53.19%,溃疡组60.42%,早癌组82.61%,进展组95.12%,差异具有统计学意义(P<0.05)。各组胃病患者中Hp阳性患者较阴性患者血清SOD、MDA及IL-6的表达均明显升高,差异均有统计学意义(P<0.05),提示Hp感染可导致SOD、MDA及IL-6表达明显升高,提示Hp感染可能与氧化应激及炎症反应有关。
进一步比较各组Hp阳性患者之间血清SOD、MDA及IL-6的表达,结果表明:与非萎缩组相比,萎缩组、溃疡组、早癌组、进展组血清SOD、MDA及IL-6的表达均明显升高(P<0.05);萎缩组及溃疡组相比差异无统计学意义(P>0.05);早癌及进展组与其余各组相比血清SOD、MDA及IL-6的表达均明显升高,且升高程度为进展组>早癌组,差异具有统计学意义(P<0.05)。提示随着疾病严重程度增加,血清SOD、MDA及IL-6的表达增加更明显,表明非萎缩性胃炎、胃溃疡、早期胃癌及进展期胃癌患者的氧化应激及炎症反应程度逐级升高。

相关临床研究[16]表明Hp可以诱导SOD的分泌,SOD活性水平在Hp阳性患者中明显高于Hp阴性患者,且SOD活性水平随着Hp密度和Hp阳性率的增加而显著升高。赵伟[17]等人的研究表明随着患者胃部黏膜病损程度的增加,其组织中IL-8及IL-6的水平也在随之增加,这些均与本研究结果相一致。
研究发现[18-20],Hp感染持续存在会导致慢性炎症状态,先天和获得性炎症反应被激活,中性粒细胞活化,促使ROS和RNS产生,使得组织内的氧化应激持续存在,从而诱导MDA和SOD产生,同时刺激IL-6的产生和释放,进一步导致胃上皮细胞损伤,导致胃粘膜炎症加重,长期的炎症和氧化应激状态可能导致胃癌的发生。
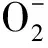
综上所述,我们的研究发现Hp感染与氧化应激指标及炎症介质同趋势变化,并且随着病变严重程度进展,胃炎(非萎缩性、萎缩性)、胃溃疡、早期胃癌及进展期胃癌患者的Hp感染率明显增加,血清中SOD、MDA与IL-6的表达升高程度也明显增加,提示氧化应激及炎症反应可能在Hp感染及其相关性胃病的发生发展中具有重要作用。我们推测血清SOD、MDA及IL-6水平的变化可用于评估Hp相关性胃病的严重程度,氧化应激的评估和抗氧化防御系统的增强可能对Hp相关性胃病的预防和治疗至关重要,为其临床诊疗提供理论依据。但其深入的机制尚待进一步探讨研究。

