miR-145对血管平滑肌细胞生物活性及SM22α mRNA表达的作用*
曾丁邻 吴兴森 查庆春 李景辉△ 丘智煌
(1 漳州正兴医院心血管内科,漳州 363000;2 福建医科大学附属第一医院,福州 350005)
血管平滑肌细胞(vascular smooth muscle cells,VSMC)与血管正常功能联系密切,具有较强的可塑性、可收缩及分泌功能。VSMC在正常情况下,表现为收缩型,只有在血管受到损伤或受到一些生物刺激时会转化为合成表型,VSMC增殖和迁移[1-4],并分泌细胞外基质,导致血管壁增厚。高血压等增殖性血管疾病中均存在VSMC的表型转换。miR-145是一种小RNA分子[5]。研究表明miR-145与VSMC表型转换联系甚密[6]。VSMC增殖会使细胞外的分泌物增加,肌动蛋白减少[7]。另外,miR-145表达量的增多或减少可使VSMC发生分化或凋亡[8]。在血管壁,miR-145主要集中于VSMC中,在成纤维细胞中的表达极少[9]。SM22α又称转凝蛋白,为VSMC的特异性蛋白,是细胞衰老的标志物,在VSMC中发挥重要的作用[10-11]。目前,miR-145对VSMC、SM22α的作用研究较少,因此,本研究探讨miR-145对VSMC生物活性的影响以及对SM22α表达的作用。
1 材料和方法
1.1 实验分组
VSMC来自湖南丰辉公司,实验分为3组,增殖VSMC组(增殖组)、增殖VSMC+转染miR-145-NC组(空载体组)和增殖VSMC+转染miR-145模拟物组(增殖转染组)。
1.2 实验试剂与器材
胎牛血清购自郑州德宁生物公司;RPMI 1640培养液购自海门市春博实验器材公司;MTT溶液购自上海樊克生物公司;流式细胞仪购自上海实维试验器材公司;酶标仪购自南京德铁实验器材公司;胰蛋白酶购自济南允诚生物公司;Primer 5.0 软件购自广州伯信生物科技公司。
1.3 细胞的培养及增殖
RPMI 1640培养液(含10%胎牛血清)于37.2℃,5%CO2条件下培养,常规传代,取第3代细胞进行实验,然后将其调整为浓度1×108个/L接种于培养瓶(52 mL)中,RPMI 1640培养液培养24 h,换含100 μg/L IL-1的RPMI 1640培养液培养2 d后传代,细胞密度为1×105个/mL,重复培养1 d后,更换无血清培养液后再培养1 d,PBS清洗,进行实验。
增殖转染组miR-145的转染:将细胞接种于6孔板内,至细胞到65%汇合时,用lipofectamineTM2000转染50 nmol/L相应的RNA mimics,继续培养3 d后即可进行后续实验。 空载体组转染miR-145-NC空载体,增殖组常规培养。
1.4 RT-PCR检测各组VSMC中SM22αmRNA、miR-145的表达
TRIzol法提取各组VSMC细胞总RNA,Primer 5.0 软件设计合成引物。 将逆转后所得的cDNA进行荧光反应实验。所有反应严格按照反应的条件进行扩增,PCR 反应条件: 94℃ 5 min; 94℃3 min 、56℃ 1 min、72℃ 1 min,72℃ 5 min,终止反应。取PCR产物(5 μL)进行电泳分析(琼脂糖凝胶1.5%)。以GAPDH为内参,共40个循环,计算方法用2-△△Ct法进行分析,引物序列见表1。

表1 引物序列
1.5 免疫印迹检测细胞周期调控相关蛋白cyclin E、细胞周期依赖性抑制蛋白p27蛋白水平
将各组VSMC进行裂解,提取核蛋白,并对核蛋白的浓度进行测量,分装后,-20℃保存。将提取出的蛋白溶液和缓冲溶液进行混均,按照4:1的比例进行,将蛋白溶液煮沸变性,电泳后转移到PVDF膜上,脱脂奶粉封闭60 min。一抗按1:150稀释后孵育过夜,后TTBS漂洗,10 min/次,共3次;二抗稀释,封闭60 min,将PVDF膜取出后重复上述漂洗,DAB显色后照相,计算其蛋白表达含量。
1.6 Transwell小室检测VSMC侵袭能力
将增殖组、空载体组组、增殖转染组细胞(1×105个/mL)接种于6孔板中,将50 mg/L的基质胶稀释后加入小室上层,37℃呈凝胶状态,上室中加入细胞悬液,下室中加入少量胎牛血清培养基,37.5℃,培养2 d,取出培养基,拭去残留细胞,现配结晶紫,每孔500 μL,将小室放入,25℃染色30 min,PBS清洗1次,稍晾干。显微镜观察,每个样本连续选5个清晰视野进行数量统计,然后计算平均数。
1.7 MTT检测VSMC活力
将各组VSMC细胞密度调整为6×103个/mL接种到96孔板中,37.2℃、5% CO2培养箱培养,当细胞的密度培养到50%时,更换培养基,24 h后加人MTT培养4 h,使用酶联免疫检测仪测每孔在12、24、48、72 h 4个时间点的吸光度 (A) 值。
1.8 流式细胞仪检测VSMC凋亡率
胰酶消化各组VSMC,完全培养基终止;PBS清洗,310 g离心5 min后弃上清,Binding Buffer(结合缓冲液) 500 μL重 悬,Annexin V-FITC 5 μL、PI 10 μL混匀,常规孵育10 min,流式细胞仪检测。
1.9 统计学处理
采用SPSS 17.0统计学软件进行分析,增殖组、空载体组、增殖转染组3组的SM22α mRNA 的表达、VSMC活力、增殖等结果采用±s表示,行方差分析检验(单因素分析采用单因素方差分析,不同时间点比较采用重复测量方差分析),组间两两比较采用t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 各组VSMC SM22αmRNA、miR-145的表达
增殖组VSMC细胞中SM22α mRNA、miR-145水平与空载体组数值差异无统计学意义(P>0.05);与增殖组及空载体组相比,增殖转染组miR-145、SM22α mRNA表达显著升高(P<0.05),说明miR-145转染成功,还可上调SM22α mRNA表达(图1)。

图1 各组SM22α mRNA、miR-145水平对比
2.2 Cyclin E、p27蛋白水平
增殖组VSMC中cyclin E、p27蛋白水平与空载体组cyclin E、p27蛋白水平相比无差异(P>0.05);增殖转染组cyclin E蛋白水平低于其他2组(P<0.05),p27蛋白水平高于其他2组(P<0.05),组间比较差异有统计学意义(P<0.05),说明转染miR-145模拟物可降低cyclin E蛋白表达,促进p27蛋白表达(图2)。
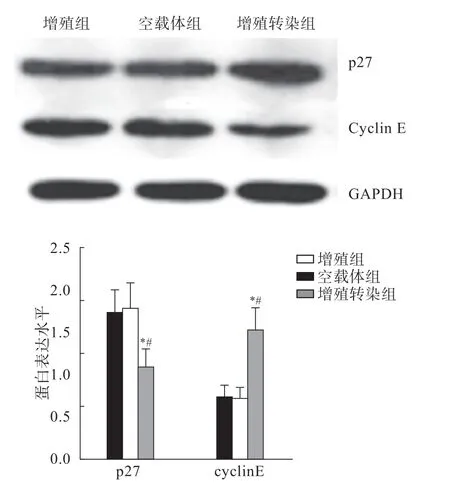
图2 各组cyclin E、p27水平的比较
2.3 VSMC迁移能力
增殖组VSMC迁移数量(92.34±8.71)个与空载体组细胞迁移数量(89.75±8.82)个相比无差异(P>0.05);增殖转染组细胞迁移数量(49.83±4.56)个明显低于其他2组,组间比较差距有统计学意义(P<0.05),说明转染miR-145模拟物可抑制VSMC侵袭(图3)。

图3 各组VSMC迁移数量对比
2.4 VSMC活力
增殖组与空载体组VSMC在不同时间点的OD值均较为接近(P>0.05);增殖转染组OD值在不同时间点均低于其他2组(P<0.05),说明转染miR-145模拟物可抑制VSMC增殖(表2)。
表2 各组VSMC在不同时间点的OD值比较(±s)

表2 各组VSMC在不同时间点的OD值比较(±s)
*P<0.05 vs增殖组; #P<0.05 vs空载体组
组别 12 h 24 h 48 h 72 h增殖组 0.87±0.07 0.95±0.11 1.23±0.14 1.45±0.31空载体组 0.86±0.06 0.93±0.10 1.21±0.12 1.42±0.29增殖转染组 0.54±0.04*# 0.59±0.07*# 0.63±0.06*# 0.68±0.09*#F 62.79 27.29 55.60 18.18 P<0.001 <0.001 <0.001 <0.001
2.5 VSMC凋亡率
增殖组VSMC凋亡率(2.43±0.33)%与 空载体组VSMC凋亡率(2.54±0.24)%数值接近,组间比较无差异(P>0.05);增殖转染组VSMC凋亡率(9.47±0.96)%较其他2组升高(P<0.05)(图4)。

图4 各组VSMC凋亡情况
3 讨论
VSMC的增殖会导致高血压等疾病发生[12]。血管内皮功能受到损伤会使生长因子等的表达发生异常,激活细胞内信号转导通路,使VSMC增殖,产生血管疾病[13]。miR-145在VSMC表型调节过程中具有重要作用,且VSMC在多种血管病疾病中均有参与[14]。有关研究表明,狼疮性肾炎肾内血管中膜增厚时,显示VSMC发生增殖,检测miR-145后发现其表达异常[15]。miR-145在正常VSMC中含量较为丰富,可调控VSMC的表型扩张或收缩[16]。本研究主要对miR-145在血管平滑肌中的作用以及对SM22α的影响进行分析。SM22α mRNA、miR-145在增殖组与空载体组中水平较低,通过转染miR-145的模拟物后,SM22α mRNA、miR-145的水平有所升高。miR-145定位在5号染色体上,早期研究主要集中在miR-145与癌症发生、发展的关系,而近年有关研究发现,miR-145是VSMC表达最丰富的miRNA,而且大部分聚集在VSMC[17]。在血管受到损伤时,VSMC表型由收缩型转为合成型,血管重构,血管管腔变窄。VSMC的表型转化过程涉及多个基因和蛋白质因子的调控。多项研究提示miR-145表达水平在VSMC表型转化过程中起关键性作用,在原代VSMC中miR-145水平较高,随着VSMC表型转化miR-145表达下降。金成吉等[18]研究提示通过提升miR-145的水平可抑制VSMC增殖及侵袭,其作用机制与细胞增殖相关的基因有关。另外,miR-145还可能通过调节SM22α的水平促使合成型的VSMC向收缩型转化。SM22α是VSMC表型标志基因,启动子序列短,由多肽链和201个氨基酸残基组成,在VSMC中SM22α异常表达会使炎症增加,收缩功能产生障碍。SM22α在收缩型VSMC大量表达,在合成型中几乎无表达。沈凤等[19]提示促进SM22α的表达可抑制VSMC的增殖与迁移,对VSMC收缩型向合成型转化具有一定的抑制作用。陈卫国[20]等在对肺动脉高压形成的研究中提出,提高miR-145水平可促进SM22α的表达,从而抑制血管平滑肌细胞的增殖,改善病情严重程度。本研究结果与上述研究结果相似,因此推测经过转染miR-145后,可能是通过促进VSMC表型标志基因SM22α水平的增加,从而抑制VSMC的活力,促使合成型VSMC向收缩型转化。
本研究结果显示,增殖组与空载体组中cyclin E水平较高、p27水平较低,经过转染miR-145的模拟物后cyclin E水平降低、p27水平升高。cyclin E是细胞周期的正调控因子,激活相应的细胞周期素依赖激酶(CDK),并加强其对底物的作用,驱动细胞由G1期向S期转换;cyclin E高表达可致细胞周期调节失控,细胞过度增殖;p27是细胞周期素依赖激酶抑制蛋白,G1后期所形成的cyclin E/CDK2复合物与p27结合,p27通过其C-末端抑制CDK2磷酸化,使其灭活,从而致细胞停滞在G1期,停止生长。p27几乎抑制所有的cyclin/CDK复合物活性,在细胞增殖、凋亡中发挥重要作用。miRNA通过调控体内蛋白编码序列表达,参与生物体的生长、发育、衰老及凋亡的调控过程。近年来,miRNA对细胞以及干细胞分化的影响受到极大的关注。有关研究提示[21],在胚胎干细胞和成体干细胞中超过100种miRNA差异性表达,miR-145可以抑制人胚胎干细胞的多能性因子,通过降低cyclin E和间接激活分化期间的p27水平,有助于调节胚胎干细胞的细胞周期。王建新[22]等提示通过抑制cyclin E的水平,促进p27的水平可抑制VSMC细胞周期及增殖。本研究结果与上述研究结果相似,因此推测miR-145可能是通过促进SM22α水平增加影响cyclin E、p27的水平,抑制血管平滑肌细胞的周期发展。
本研究结果提示,经过转染miR-145的模拟物后,VSMC迁移数量及增殖均有所下降。当血管受到损伤后,VSMC由分化状态转化为未分化状态,这一过程使VSMC获得增殖与迁移能力,是各种增殖性心血管疾病发生发展的关键因素[23]。本研究与沈凤等[24]研究结果相似,miR-145水平升高后通过促进SM22α水平可抑制VSMC的增殖、迁移。
综上所述,过表达miR-145通过促进SM22α水平增加,抑制血管平滑肌细胞的增殖,并促进其凋亡。