低氧—复氧胁迫下脊尾白虾鳃组织差异表达基因趋势分析
史文军 王盼 胡润豪 万夕和 沈辉 黎慧 王李宝 乔毅 蒋葛 成婕

摘要:【目的】探究脊尾白虾(Exopalaemon carinicauda)鳃组织在渐变式低氧—复氧胁迫下的分子调控机制,为今后开展脊尾白虾耐低氧品系(种)的选育提供理论指导。【方法】通过模拟自然低氧环境的形成过程,分别于低氧处理0(对照)、3和6 h及复氧后1和8 h采集脊尾白虾鳃组织,利用Illumina HiSeqTM4000测序平台进行转录组测序分析,经过滤和Trinity组装获得Unigenes,选取Nr、Swiss-Prot、KEGG和COG/KOG等数据库进行注释分析,在Omicsmart平台上完成差异表达基因筛选及其表达趋势分析,然后进行GO功能注释分析和KEGG信号通路富集分析,并随机选取5个差异表达基因进行实时荧光定量PCR验证。【结果】脊尾白虾鳃组织样本转录组测序数据经过滤后的Clean reads进行Trinity组装共获得93227条Unigenes,其长度范围在201~35402 bp,平均长度为834 bp,N50长度为1352 bp。通过组间两两比较分析,共鉴定出4750个差异表達基因,其中上调差异表达基因3557个、下调差异表达基因2829个;超过50%的差异表达基因被显著富集到6种基因表达趋势模式中(P<0.01),具体表现为:Profile 0模式富集到415个基因,Profile 5模式富集到201个基因,Profile 11模式富集到371个基因,Profile 13模式富集到841个基因,Profile 17模式富集到387个基因,Profile 18模式富集到411个基因。6种基因表达趋势模式中的差异表达基因被注释到代谢进程、细胞进程、单一有机体进程、细胞、细胞零件、大分子复合物及催化活性等GO功能条目上;而KEGG信号通路富集分析结果显示,以Profile 13模式中的差异表达基因富集到最多信号通路(86条),其中呈显著富集的有8条,分别为核糖体、碳代谢、氧化磷酸化、氨基酸生物合成、内质网蛋白质加工、糖酵解/糖异生、谷胱甘肽代谢和蛋白输出。【结论】脊尾白虾鳃组织在受低氧胁迫早期通过合成蛋白质及提高代谢能力来抵御低氧环境,随着低氧胁迫时间的延长,物质合成和能量代谢活动均显著下降;但在复氧后随着复氧时间的延长,其蛋白质合成和能量代谢水平又逐渐升高恢复至常氧水平。
关键词:脊尾白虾;低氧—复氧;鳃组织;转录组测序;趋势分析
中图分类号: S917;S945.49 文献标志码: A 文章编号:2095-1191(2022)03-0735-13
Trend analysis of differentially expressed genes in gill of Exopalaemon carinicauda under hypoxia-reoxygenation stress
SHI Wen-jun WANG Pan HU Run-hao WAN Xi-he SHEN Hui LI Hui WANG Li-bao QIAO Yi JIANG Ge CHENG Jie
(1Institute of Oceanology and Marine Fisheries, Nantong, Jiangsu 226007, China; 2Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai, Shandong 264003, China; 3National Demonstration Center for Experimental Fisheries Science Education(Shanghai Ocean University), Shanghai 201306, China)
Abstract:【Objective】To investigate the molecular regulation mechanisms in gill tissue of Exopalaemon carinicauda under gradually changing hypoxia-reoxygenation stress, so as to provide theoretical reference for the breeding of hypoxia tolerance strains (species) of E. carinicauda. 【Method】By simulating the formation process of hypoxia in the natural environment, gill tissues were collected at 0 (control), 3 and 6 h, and 1 and 8 h after reoxygenation, respectively. Transcriptome sequencing analysis was performed using Illumina HiSeqTM4000 sequencing platform. Unigenes were obtained by filtration and Trinity assembly. Nr, Swiss-Prot, KEGG and COG/KOG databases were selected for annotation analysis. The differentially expressed genes (DEGs) were screened and their trends were analyzed on the Omicsmart platform. Then GO functional annotation analysis and KEGG signal pathway enrichment analysis were performed, and five DEGs were randomly selected for real-time quantitative PCR(qRT-PCR) validation. 【Result】A total of 93227 uni genes whose range were from 201 to 35402 bp were obtained through transcriptome sequencing, with their average length of 834 bp and the N50 of 1352 bp. 4750 genes were identified as DEGs through pairwise comparison between groups, of which the up-regulated genes were 3557 and the down-regulated genes were 2829. More than fifty percent were significantly enriched in six gene expression trends (P<0.01):Profile 0 was enriched in 415 genes;Profile 5 was enriched in 201 genes;Profile 11 was enriched in 371 genes;Profile 13 was enriched in 841 genes;Profile 17 was enriched in 387 genes and Profile 18 was enriched in 411 genes.The DEGs in six trends were annotated to metabolic processes, cellular processes, single organism process, cell, cell parts, macromolecular complex and catalytic activity by GO functional analysis. The KEGG signaling pathway enrichment analysis showed that DEGs in Profile 13 were enriched in 86 pathways at most and significantly enriched in ribosome,carbon metabolism,oxidative phosphorylation,biosynthesis of amino acids,protein processing in endoplasmic reticulum,glycolysis or gluconeogenesis,glutathione metabolism and protein export. 【Conclusion】The gill tissues of E.carinicauda synthesizes protein and increases metabolic capacity to resist hypoxia in the early stage of hypoxia stress. But with the prolongation of hypoxia, both substance synthesis and energy metabolism were affected and decreased. After reoxygenation, with the prolongation ofreoxygenation, the protein synthesis and energy metabolism gradually recover to level under normal oxygen.038C597C-F774-40C1-9DC1-F6FE2E5B0876
Key words: Exopalaemon carinicauda; hypoxia-reoxygenation; gilltissue; transcriptome sequencing; trend analyses
Foundation items: Agricultural Major New Breed Creation of Jiangsu Province (PZCZ201747);Agricultural Scien-ce and Technology Independent Innovation Project of Jiangsu Province (CX18-2010); The Fifth “226 Project” Cultivation Fund Support Project of Nantong (NT226-202021); Science and Technology Plan Project of Nantong (JC2019057)
0 引言
【研究意義】脊尾白虾(Exopalaemon carinicauda)广泛分布于我国黄海、渤海沿岸海域,是一种重要的海洋渔业和池塘养殖品种(Ma et al.,2020),因具有良好的口感及丰富的营养而深受消费者喜爱,加之生长速度快、繁殖能力强及环境适应性广等优点,其养殖规模逐年扩大,已发展成为池塘单养和鱼虾蟹贝混养的重要经济虾类(李玉全,2014)。据统计,我国每年的脊尾白虾养殖面积和产量分别为2万ha和4.5万t(刘俊杰等,2018;Shao et al.,2018;Li et al.,2019)。为了追求高产量,当前的池塘养殖密度普遍较高,但高密度养殖易导致池底残饵和排泄物过度累积,而脊尾白虾大部分时间生活在池塘底层,由于呼吸耗氧作用及积累的有机物分解,极易出现低氧情况,尤其是在晚上和清晨,低氧严重时会威胁到脊尾白虾的生命(Cheng et al.,2003)。除了依靠开放式曝气维持水中的含氧量外,目前尚无其他更好的解决方法,但这种方法不仅增加养殖成本,还无法完全解决低氧的问题。因此,亟待明确脊尾白虾对低氧的适应机制,培育出耐低氧的新品系(种)以解决这一突出问题。【前人研究进展】至今,有关低氧对虾类影响的研究主要集中在生长发育(胡贤德和林北堃,1999)、生活习性(陈琴等,2001)、免疫能力(Cheng et al.,2002)、相关基因克隆(Li et al.,2009)、代谢过程(Dupont-Prinet et al.,2013)、行为变化(侯文杰等,2014)及组织损伤(杨明等,2019)等方面。近年来,随着新一代转录组测序技术的迅速发展,转录组分析已广泛用于揭示逆境胁迫下对虾的分子生物学过程和生理功能变化机制(Wang et al.,2020)。Hu等(2015)对低盐胁迫下凡纳滨对虾鳃组织进行转录组分析,获得了一些与离子和渗透调节相关的基因;Huang等(2017)对凡纳滨对虾低温胁迫不同时间和低温胁迫后恢复的肌肉组织进行转录组测序分析,结果发现丝氨酸/苏氨酸—蛋白激酶信号通路在冷适应中可能发挥着更重要作用;Li等(2018)对氨胁迫后的斑节对虾肝胰腺组织进行转录组分析,证实氨应激诱导氧化应激,最终导致细胞凋亡。然而,通过转录组学挖掘分析虾类低氧胁迫过程中差异表达基因的研究相对较少。Sun等(2014)通过比较分析低氧胁迫下日本沼虾肝胰腺组织中基因的表达情况,发现差异表达基因主要与呼吸代谢、血蓝蛋白合成、能量消耗、抗氧化能力和免疫应答相关。曹梅等(2020)通过研究低氧胁迫下脊尾白虾全虾组织中相关基因的表达情况,证实缺氧能促使虾体糖酵解等无氧代谢途径增强。【本研究切入点】现有的研究报道主要是将虾类直接从常氧水体转移至低氧水体中或分析常氧与低氧极限组的转录学,其低氧处理方式可能无法准确反映实际养殖环境中脊尾白虾经历的低氧形成过程:常氧—溶解氧降低—低氧—极限低溶解氧—死亡。鳃组织是虾类呼吸的重要场所,但至今有关脊尾白虾鳃组织在渐变式低氧—复氧胁迫下的适应性调节机制研究鲜见报道。【拟解决的关键问题】通过模拟自然低氧环境的形成过程,对渐变式低氧—复氧不同时间点的脊尾白虾鳃组织进行转录组测序分析,旨在探讨脊尾白虾对低氧—复氧响应的分子机制,为今后开展脊尾白虾耐低氧品系(种)的选育提供理论指导。
1 材料与方法
1. 1 试验材料
试验在江苏省海洋水产研究所如东海水虾类科研基地进行,供试用虾为取自基地外塘饲养的脊尾白虾。选取体长5.3±0.1 cm,体重2.57±0.21 g,无外伤、活力好、健康的脊尾白虾,置于1000 L的PVC圆桶中暂养7 d。暂养期间的海水盐度为25‰、水温20~21 ℃,持续充氧,每天投喂适量的商品配合饲料。正式试验前1 d停止喂食;每天换水1次,换水量约为总水量的1/3。
1. 2 试验设计及样本采集
以预试验中的脊尾白虾存活量和水体溶解氧为参考,将密封低氧时间定为6 h,然后立即开始充气复氧。正式试验在盐度25‰、水温20~21 ℃的条件下进行,将暂养稳定后的脊尾白虾随机分装到装有5 L海水的三角瓶中,每瓶10尾,每3瓶为1个组,共5组,充气适应0.5 h后,停止充气,并用带有橡胶导管的橡胶塞密封,开始计时。分别于低氧处理0(对照)、3和6 h及复氧后1和8 h采集水样和脊尾白虾鳃组织。每瓶取1个水样,每组3个重复,以碱性碘化钾和氯化锰固定液固定,用于后续的水体溶解氧测定;取完水样后立即从每瓶中选取5~6尾活虾的完整鳃组织作为1个生物学重复,每组3个重复,样品编号对应为js-0、js-3、js-6、js-7和js-14,液氮速冻后置于 -80 ℃超低温冰箱保存,用于总RNA提取。
1. 3 溶解氧测定
参照GB 17378.4—2007《海洋监测规范 第4部分:海水分析》中的碘量法测定水体溶解氧含量。038C597C-F774-40C1-9DC1-F6FE2E5B0876
1. 4 RNA提取、cDNA文库构建及高通量测序
按照TRIzol试剂盒(美国Invitrogen公司)说明提取样本总RNA,分别使用Agilent 2100生物分析仪评估RNA质量、1.0%琼脂糖凝胶电泳检测其完整性、NanoDrop微量分光光度计测定其纯度。总RNA检测合格后采用带有Oligo(dT)的磁珠富集mRNA,然后利用片段缓冲液将富集的mRNA裂解成短片段。以片段化的mRNA为模板、随机寡核苷酸为引物,在ProtoScript II逆转录酶体系中合成cDNA第一条链;随后采用RNaseH降解RNA链,在DNA Polymerase I体系下以dNTPs为原料合成cDNA第二条链。纯化后的双链cDNA经末端修复及加poly(A)尾,并连接测序接头,以AMPure XP beads筛选200 bp左右的cDNA进行PCR扩增,使用AMPure XP beads纯化PCR产物以构建cDNA文库,并通过Illumina HiSeqTM4000测序平台进行高通量测序。其中,cDNA文库构建及高通量测序均委托广州基迪奥生物科技有限公司完成。
1. 5 转录组组装与Unigenes功能注释
测序获得的原始序列(Raw reads)利用fastp(0.18.0)进行数据质量控制(Chen et al.,2018),过滤低质量数据,具体包括:(1)去除含Adapter的Reads;(2)去除含N比例大于10%的Reads;(3)去除全部都是A碱基的Reads;(4)去除低质量Reads(Q≤20碱基数占整条Reads的50%以上),剩余的有效序列(Clean reads)使用Trinity进行组装(Grabherr et al.,2011)。使用BLASTx程序将所有组装获得的序列分别在Nr、Swiss-Prot、KEGG及COG/KOG等数据库中进行比对,设定阈值1e-5,根据最佳比对结果获得序列注释信息。
1. 6 差异表达基因鉴定及其表达趋势分析
基因表达量采用RPKM法进行计算(Mortazavi et al.,2008),以DESeq2进行两组间基因表达差异分析(Love et al.,2014),将错误发现率(FDR)<0.01和差异倍数绝对值(|Fold Change|)≥2作为差异基因筛选标准。然后对所有差异表达基因进行趋势分析(Ernst and Bar-Joseph,2006),设定模块数量为20,P为0.01,以获得显著性和非显著性基因表达模式。差异表达基因筛选及其趋势分析均在Omicsmart平台(https://www.omicsmart.com)上完成。
1. 7 实时荧光定量PCR验证
为验证转录组测序结果的可靠性,随机挑选5个差异表达基因进行实时荧光定量PCR验证,以18S为内参基因,以样本RNA反转录合成的cDNA为模板,按照TB Green试剂盒操作说明进行实时荧光定量PCR验证(引物见表1),设3次重复。反应体系20.0 μL:TB Green Premix Ex Taq 10.0 μL,10 μmol/L正、反向引物各0.4 μL,ROX Reference Dye (50×) 0.4 μL,cDNA模板2.0 μL,DEPC水6.8 μL。在Step-One Plus荧光定量PCR仪上进行扩增,扩增程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,进行40个循环;熔解曲线设为95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。基因相对表达量以2-ΔΔCt 法进行换算。
2 结果与分析
2. 1 水样溶解氧含量变化趋势
低氧处理0 h(对照)的水样溶解氧含量为8.04±0.08 mg/L,低氧处理3 h的水样溶解氧含量为2.12±0.20 mg/L,即此时已达低氧环境;低氧处理6 h的水样溶解氧含量为1.04±0.12 mg/L,溶解氧继续降低,低氧胁迫更加剧烈;充气复氧后1和8 h的水样溶解氧含量分别为8.10±0.28和8.05±0.15 mg/L,已恢复至对照水样溶解氧水平。说明脊尾白虾在此试验过程中已经历了由常氧环境逐渐到低氧环境再恢复到常氧环境的胁迫过程。
2. 2 转录组数据及其组装情况
高通量测序结果(表2)显示,每个脊尾白虾鳃组织样本获得39381904~64573816条Raw reads,经数据过滤处理后,平均在每个样本获得52394125条Clean reads,平均有效率为99.84%。Q20(测序碱基正确识别率在99.0%以上)大于98.00%,Q30(测序碱基正确识别率在99.9%以上)大于94.00%,且过滤后样本的平均GC含量为47.26%,表明测序质量较好。过滤后的Clean reads经Trinity组装后共获得93227条Unigenes(表3),其长度范围在201~35402 bp(图1),平均长度为834 bp,N50长度为1352 bp,表明组装效果较良好。
2. 3 Unigenes功能注释分析结果
分别在Nr、Swiss-Prot、KEGG和COG/KOG数据库中对Unigenes进行注释分析,结果(表4)显示,在Nr数据库中注释到37346条Unigenes,在Swiss-Prot数据库中注释到29042条Unigenes,在KEGG数据库中注释到33955条Unigenes,在COG/KOG数据库中注释到24238条Unigenes,累计被注释的Unigenes为40719条,注释率为43.68%。
2. 4 样本重复性分析结果
Pearson相關系数热图(图2)显示,除js-6-2样本外,其他样本在组内的生物学重复相关性均在0.80以上(0.81~0.99),相关性较好。造成js-6-2样本相关性偏低的原因可能是取样、提取或测序等某一环节发生污染,因此后续分析与验证均将该样本测序数据剔除。038C597C-F774-40C1-9DC1-F6FE2E5B0876
2. 5 差异表达基因鉴定及趋势分析结果
通过组间两两比较分析,共鉴定出4750个差异表达基因(图3),其中上调差异表达基因3557个、下调差异表达基因2829个。由图4可看出,与对照组相比,随着低氧处理时间的延长,差异表达基因的数量呈增长趋势。差异表达基因最多的出现在js-7 vs js-14,其中上调差异表达基因1940个、下调差异表达基因815个;而js-6 vs js-7鉴定出的差异表达基因最少(上调差异表达基因240个、下调差异表达基因360个),说明低氧处理后再复氧对脊尾白虾鳃组织基因表达影响显著。
对4750个差异表达基因进行表达趋势分析,结果(图5)显示在默认的20种基因表达趋势模式中有6种显著的基因表达趋势模式(P<0.01)。其中,Profile 0模式表示基因表达量在低氧和复氧时一直下降(415个);Profile 5模式表示基因表达量在低氧时先下降后上升,复氧后再下降(201个);Profile 11和Profile 17模式表示基因表达量在低氧时上升,复氧后呈先下降再上升的变化趋势(371和387个);Profile 13模式表示基因表达量在低氧时先上升后下降,复氧后再上升(841个);Profile 18模式表示基因表达量在低氧时上升,复氧后下降(411个)。综合分析发现,超过50%的差异表达基因被富集到这6种基因表达趋势模式中。
2. 6 差异表达基因GO功能注释分析结果
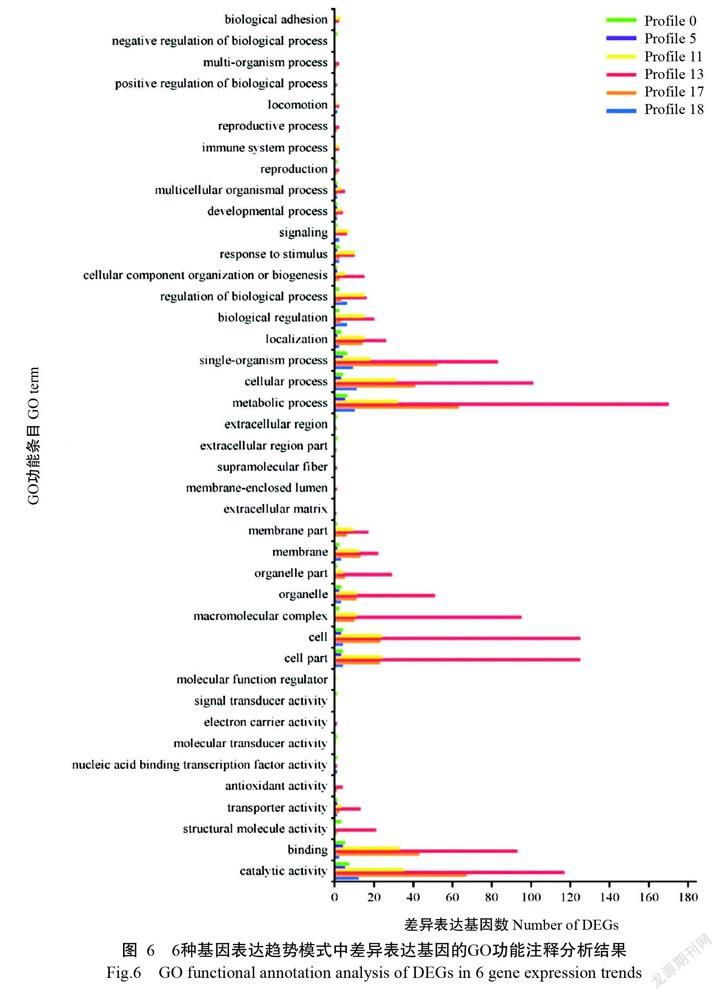
GO功能注释分析结果(图6)显示,显著富集在6种基因表达趋势模式中的差异表达基因主要注释在代谢进程(Metabolic processes)、细胞进程(Cellular processes)、单一有机体进程(Single-organism process)、细胞(Cell)、细胞零件(Cell part)、大分子复合物(Macromolecular complex)、催化活性(Catalytic activity)及结合(Binding)等GO功能条目上。
2. 7 差异表达基因KEGG信号通路富集分析结果
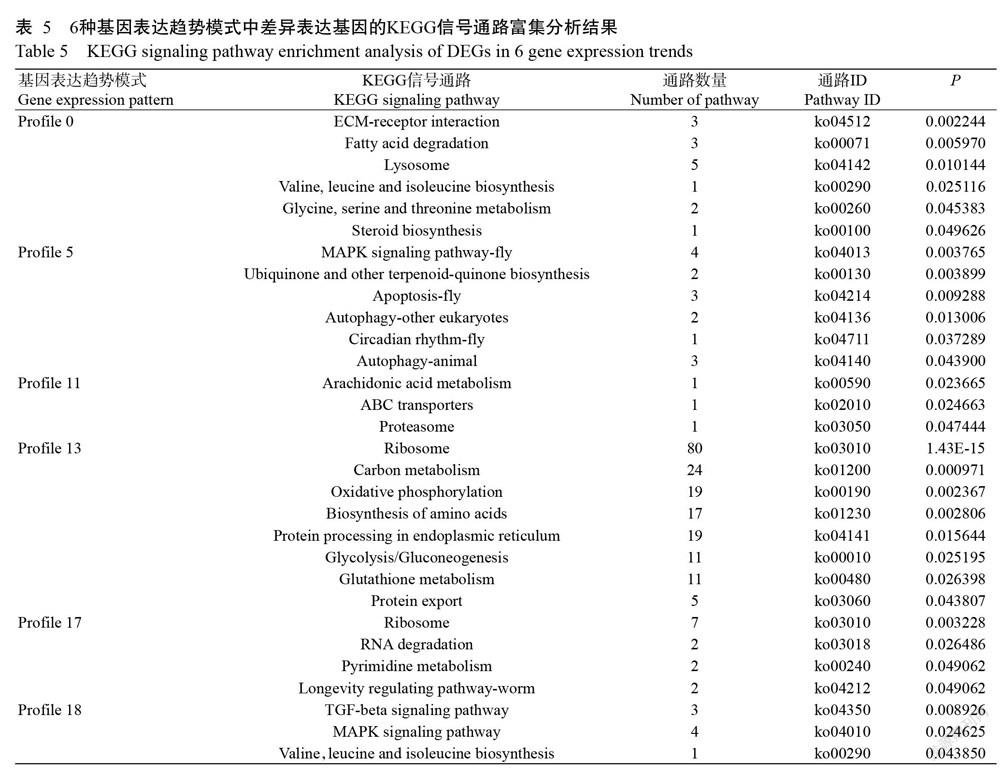
KEGG信号通路富集分析结果(表5)显示,在Profile 0模式中富集到42条信号通路,呈显著富集的有6条,分别为:①细胞外基质受体相互作用(ECM-receptor interaction);②脂肪酸降解(Fatty acid degradation);③溶酶体(Lysosome);④缬氨酸,亮氨酸和异亮氨酸的生物合成(Valine,leucine and isoleucine biosynthesis);⑤甘氨酸,丝氨酸和苏氨酸代谢(Glycine,serine and threonine metabolism);⑥类固醇生物合成(Steroid biosynthesis)。在Profile 5模式中富集到41条信号通路,呈显著富集的有6条,分别为:①MAPK信号通路(MAPK signaling pathway-fly);②泛醌及其他萜醌类生物合成(Ubiquinone and other terpenoid-quinone biosynthesis);③凋亡(Apoptosis-fly);④自噬(Autophagy-other eukaryotes);⑤自噬(Autophagy-animal);⑥生理节律(Circadian rhythm-fly)。在Profile 11模式中富集到4条信号通路,呈显著富集的有3条,分别为:①花生四烯酸代谢(Arachidonic acid metabolism);②ABC转运蛋白(ABC transporters);③蛋白酶体(Proteasome)。在Profile 13模式中富集到86条信号通路,呈显著富集的有8条(图7),分别为:①核糖体(Ribosome);②碳代谢(Carbon metabolism);③氧化磷酸化(Oxidative phosphorylation);④氨基酸生物合成(Biosynthesis of amino acids);⑤内质网蛋白质加工(Protein processing in endoplasmic reticulum);⑥糖酵解/糖异生(Glycolysis/gluconeogenesis);⑦谷胱甘肽代谢(Glutathione metabolism);⑧蛋白输出(Protein export)。在Profile 17模式中富集到17条信号通路,呈显著富集的有4条,分别为:①核糖体(Ribosome);②RNA降解(RNA degradation);③嘧啶代谢(Pyrimidine metabolism);④寿命调节途径(Longevity regulating pathway-worm)。在Profile 18模式中富集到65条信号通路,呈显著富集的有3条,分别为:①TGF-β信号通路(TGF-beta signaling pathway);②MAPK信号通路(MAPK signaling pathway);③缬氨酸、亮氨酸和异亮氨酸的生物合成(Valine,leucine and isoleucine biosynthesis)。
2. 8 实时荧光定量PCR验证结果
随机挑选5个差异表达基因(Gene4007、Gene 29395、Gene40966、Gene56231和Gene82609)进行实时荧光定量PCR验证,结果(图8)表明其相对表达量的变化趋势与转录组测序获得的基因表达量变化趋势基本一致,表明本研究的转录组测序结果真实可靠。
3 讨论
3. 1 低氧—复氧对脊尾白虾呼吸耗氧及存活的影响
溶解氧是影响水生动物呼吸的重要环境因子,与耗氧量直接相关(曹祥德等,2014;Ulaje et al.,2019)。一般情况下,甲壳类动物可通过自身调节使机体处于最小耗氧量的状态,以此耐受一定程度的低氧环境,但超出其耐受极限则会引起死亡(Larkin et al.,2008)。本研究发现,在脊尾白虾自身呼吸耗氧的情况下,随着低氧胁迫时间的延长,水体溶解氧含量逐渐降低,但低氧处理3~6 h的水样溶解氧含量降低幅度明显低于低氧处理0~3 h的水样,表明随着低氧胁迫时间的延长,脊尾白虾的耗氧率在逐渐降低。王爱敏(1997)研究表明罗氏沼虾蚤状幼体的耗氧速率随水体溶解氧含量的降低而下降;单保党等(2018)也研究发现凡纳滨对虾p12~p13阶段仔虾的耗氧率随水体溶解氧含量的降低而下降,故推测这种通过降低耗氧率的调节方式是虾类普遍应对低氧环境的一种策略。本研究还发现,低氧处理6 h时的水体溶解氧含量降至1.04 mg/L,此时脊尾白虾的死亡率为47%。李明云等(1992)研究發现平均体长为5.02 cm的脊尾白虾在水温(18.0±0.5)℃中死亡50%时的溶解氧含量为0.78 mg/L;曹梅等(2020)研究证实平均体重为3.15±0.26 g的脊尾白虾在水温22~24 ℃、溶解氧含量为1.13±0.26 mg/L的条件下处于昏厥状态。可见,虾体规格和环境条件均会影响脊尾白虾对低氧的耐受程度。038C597C-F774-40C1-9DC1-F6FE2E5B0876
3. 2 低氧—复氧对脊尾白虾鳃组织基因表达的影响
鳃组织是甲壳动物进行呼吸、排泄及调节渗透压的重要器官,其直接与水体接触,易受水环境影响(卢建平,2001)。低氧会影响虾类鳃组织的正常生理功能,进而引起能量代谢及其他物质合成代谢紊乱、抗氧化应激损伤等(Paschke et al.,2010;Sun et al.,2015),但脊尾白虾鳃组织如何适应低氧—复氧的分子调控机制尚未明确,因此利用转录组测序分析其鳃组织在渐变式低氧—复氧过程中的调节机制具有重要意义。趋势分析可从聚类结果中挑选符合一定生物学特性的基因集,从而降低数据的复杂性和分析难度(郭睿等,2018)。为此,本研究基于转录组测序分析挖掘低氧—复氧胁迫下各时间点脊尾白虾鳃组织的差异表达基因,并对所有差异表达基因进行表达趋势分析,GO功能注释分析结果显示,显著富集在6种基因表达趋势模式中的差异表达基因被注释到生物学进程(Biological process)、细胞组分(Cellular component)和分子功能(Molecular function)三大功能中,主要涉及代谢进程、细胞进程、单一有机体进程、细胞、细胞零件、大分子复合物及催化活性等,说明脊尾白虾鳃组织在低氧—复氧胁迫下的代谢和细胞活动较活跃。而KEGG信号通路富集分析结果显示,以Profile 13模式中的差异表达基因富集到最多信号通路(86条),其中呈显著富集的有8条,分别为核糖体、碳代谢、氧化磷酸化、氨基酸生物合成、内质网蛋白质加工、糖酵解/糖异生、谷胱甘肽代谢和蛋白输出。
3. 2. 1 对脊尾白虾鳃组织蛋白合成相关基因的影响
核糖体主要由核糖体RNA(rRNA)、核糖体蛋白(RPs)和小核糖体RNA(snoRNAs)組成,是蛋白翻译机制的重要组成部分(Nakhoul et al.,2014),其中RPs在rRNA加工过程中促进rRNA折叠形成功能三维结构及稳定核糖体最终空间构象方面发挥重要作用(Xie et al.,2018)。RPs除了在蛋白翻译中发挥作用外,还参与核糖体外的DNA修复、细胞凋亡和细胞内稳态等功能(Shenoy et al.,2012)。内质网是负责跨膜蛋白和分泌蛋白合成与折叠的细胞器(Iurlaro and Munoz-Pinedo,2016)。本研究发现,有80个差异表达基因富集在核糖体通路上,包括核糖体大亚基蛋白RPLP0、RPLP1和RPLP2及核糖体小亚基蛋白RPS10e、RPS11e和RPS12e;有19个差异表达基因富集在内质网蛋白加工通路上,如蛋白质二硫键异构酶A3(PDIA3)、钙网蛋白(CALR)和X-盒结合蛋白1(XBP1)。此外,有17个差异表达基因富集在氨基酸生物合成通路上,有5个差异表达基因富集在蛋白输出通路上。Land等(1993)研究发现西部锦龟(Chrysemys picta Bellii)肝细胞蛋白质合成速率在25 ℃缺氧12 h后下降92%,但能在复氧2 h后恢复正常。Smith等(1996)研究发现,鲫鱼在缺氧状态暴露48 h会导致其肝脏、心脏和肌肉的蛋白质合成率下降,但脑组织的蛋白合成率未受影响,在复氧24 h后各组织的蛋白合成率基本恢复至常氧组水平。本研究结果表明,这些通路上的差异表达基因表达量在低氧时均随溶解氧含量的降低而呈先升高后降低的变化趋势,故推测脊尾白虾鳃组织在低氧早期蛋白合成较活跃,但溶解氧含量降至低氧水平后蛋白合成能力减弱;在复氧后1 h内蛋白合成的能力尚未恢复到常氧水平,随着复氧时间的延长,蛋白合成能力逐渐恢复并有所升高。
3. 2. 2 对脊尾白虾鳃组织能量代谢相关基因的影响
呼吸代谢是生物能量代谢研究的重要内容之一,不仅能反映生物的生理状态,还可表征环境条件对生物生理活动的影响(冯雪等,2012)。本研究在Profile 13表达模式中分别发现有24、19和11个差异表达基因富集在碳代谢、氧化磷酸化和糖酵解/糖异生通路上,包括苹果酸酶(MDH)、异柠檬酸脱氢酶(IDH)、6-磷酸葡糖酸脱氢酶(PGDH)、甘油醛-3-磷酸脱氢酶(GAPDH)和果糖-二磷酸醛缩酶(ALDO)等重要呼吸代谢酶类。MDH催化苹果酸盐和草酰乙酸盐的可逆氧化还原反应及苹果酸盐氧化脱羧成丙酮酸盐,且在有氧糖酵解过程中参与苹果酸天冬氨酸穿梭,其电子受体为NAD+或NADP+(Soldatov et al.,2020);IDH催化异柠檬酸氧化脱羧生成α-酮戊二酸,在此过程中也利用NAD+或NADP+生产NADH或NADPH(Kim and Park,2010);PGD催化6-磷酸葡萄糖酸产生核酮糖-5-磷酸和NADPH;GAPDH催化D-甘油醛-3-磷酸(GAP)在有NAD+和无机磷酸盐存在的条件下可逆氧化和磷酸化成1,3-二磷酸甘油酸;ALDO催化3-磷酸甘油醛和磷酸二羟丙酮的醇醛缩合反应可逆生成果糖-1,6-二磷酸(王志刚等,2019)。这些呼吸代谢酶在糖酵解、三羧酸循环、磷酸戊糖途径及糖异生途径中发挥重要作用,为生物体物质合成代谢提供能量与底物。已有较多研究证实,低氧—复氧对水生动物鳃能量代谢有影响,但不同水生动物的响应模式可能存在差异(Crocker et al.,2013;Li et al.,2017)。
3. 2. 3 对脊尾白虾鳃组织抗氧化酶相关基因的影响
本研究发现有11个差异表达基因富集到谷胱甘肽代谢通路上。谷胱甘肽(GSH)能维持机体正常的免疫系统功能,具有抗氧化作用,而NADPH也是抗氧化剂的关键电子供体(Saetan et al.,2020)。此外,本研究中的谷胱甘肽过氧化物酶(GPX)和谷胱甘肽-S-转移酶(GST)基因表达变化趋势与王盼等(2020)研究脊尾白虾鳃组织在低氧—复氧条件下酶活性变化的趋势相似,进一步说明这2个基因的表达变化可能在低氧—复氧的抗氧化损伤中发挥重要作用。038C597C-F774-40C1-9DC1-F6FE2E5B0876
4 结论
脊尾白虾鳃组织在受低氧胁迫早期通过合成蛋白质及提高代谢能力来抵御低氧环境,随着低氧胁迫时间的延长,物质合成和能量代谢活动均显著下降;但在复氧后随着复氧时间的延长,其蛋白质合成和能量代谢水平又逐渐升高恢复至常氧水平。
参考文献:
曹祥德,张根玉,范武江,李雪松. 2014. 温度与溶氧水平对日本沼虾瞬时耗氧速率的影响[J]. 广东农业科学,41(12):123-126. [Cao X D,Zhang G Y,Fan W J,Li X S. 2014. Effects of temperature and dissolved oxygen level on instantaneous rate of oxygen consumption of Macrobrachium nipponense[J]. Guangdong Agricultural Scien-ces,41(12):123-126.] doi:10.3969/j.issn.1004-874X. 2014.12.028.
曹梅,王兴强,秦传新,沈晔,张子杨,钱诗悦. 2020. 脊尾白虾对低氧响应的转录组学分析[J]. 渔业科学进展,41(2):112-123. [Cao M,Wang X Q,Qin C X,Shen Y,Zhang Z Y,Qian S Y. 2020. Transcriptome analysis of Palaemon carincauda subjected to hypoxic stress[J]. Progress in Fishery Sciences,41(2):112-123.] doi:10.19663/j.issn2095-9869.20190924001.
陈琴,陈晓汉,罗永巨,黄钧,李贵福,宁良坤. 2001. 南美白对虾耗氧率和窒息点的初步测定[J]. 水利渔业,21(2):14-15. [Chen Q,Chen X H,Luo Y J,Huang J,Li G F,Ning L K. 2001. Determination of the oxygen consumption rate and suffocation point of Litopenaeus vannamei[J]. Reservoir Fisheries,21(2):14-15.] doi:10.15928/j.1674-3075. 2001.02.008.
冯雪,陈丕茂,秦传新. 2012. 渔业资源生物呼吸代谢研究进展[J]. 广东农业科学,39(4):92-96. [Feng X,Chen P M,Qin C X. 2012. Advancement of the study on respiratory metabolism of fishery resources organism[J]. Guangdong Agricultural Sciences,39(4):92-96.] doi:10.16768/j.issn.1004-874x.2012.04.033.
郭睿,解彦玲,熊翠玲,尹伟轩,郑燕珍,付中民,陈大福. 2018. 意大利蜜蜂4、5和6日龄幼虫肠道发育过程中差异表达基因的趋势分析[J]. 上海交通大学学报(农业科学版),36(4):14-21. [Guo R,Xie Y L,Xiong C L,Yin W X,Zheng Y Z,Fu Z M,Chen D F. 2018. Trend analysis for differential expressed genes in the developmental process of 4-,5- and 6- day-old larval guts of Apis mellifera ligustica[J]. Journal of Shanghai Jiaotong University (Agricultural Science),36(4):14-21.] doi:10.3969/J.ISSN. 1671-9964.2018.04.003.
侯文杰,周文玉,潘桂平,畢浩,周裕华,刘本伟,张年国. 2014. 溶氧水平对日本对虾耗氧能力与生理行为的影响[J]. 江苏农业科学,42(2):190-192. [Hou W J,Zhou W Y,Pan G P,Bi H,Zhou Y H,Liu B W,Zhang N G. 2014. Effect of dissolved oxygen level on the oxygen consumption capacity and physiological behavior of Penaeus japonicus[J]. Jiangsu Agricultural Sciences,42(2):190-192.] doi:10.3969/j.issn.1002-1302.2014.02.066.
胡贤德,林北堃. 1999. 水体溶氧量对对虾消化道蛋白酶活力的影响[J]. 沈阳农业大学学报,30(4):457-459. [Hu X D,Lin B K. 1999. Effect of oxygen content in water on proteases vitality in prawn digestive system[J]. Journal of Shenynag Agricultural University,30(4):457-459.]
李明云,包坚敏,吴春娥. 1992. 脊尾白虾窒息点与耗氧率的试验观察[J]. 海洋渔业,(6):251-253. [Li M Y,Bao J M,Wu C E. 1992. Experimental observations of asphy-xiation point and oxygen consumption rate in ridgetail white prawn,Exopalaemon carinicauda[J]. Marine Fishe-ries,(6):251-253.]038C597C-F774-40C1-9DC1-F6FE2E5B0876
李玉全. 2014. pH胁迫对脊尾白虾代谢酶活力的影响[J]. 南方农业学报,45(6):1098-1101. [Li Y Q. 2014. Effects of pH stress on activities of phosphatase in Exopalaemon carinicauda Holthuis[J]. Journal of Southern Agriculture,45(6):1098-1101.] doi:10.3969/j:issn.2095-1191.2014. 6.1098.
刘俊杰,肖李霞,陶冶,孟玲玲,朱善央,陆锦天,沈新强,王云龙,马凌波,顾邦祥. 2018. 脊尾白虾引种及多品种混养集成与示范[J]. 科学养鱼,(1):33-34. [Liu J J,Xiao L X,Tao Y,Meng L L,Zhu S Y,Lu J T,Shen X Q,Wang Y L,Ma L B,Gu B X. 2018. Integration and introduction of Ridgetail white shrimp (Exopalaemon carinicauda) and multispecies mixed cultivation demonstration[J]. Scientific Fish Farming,(1):33-34.] doi:10.14184/j.cnki.issn1004-843x.2018.01.022.
卢建平. 2001. 日本沼虾鳃细胞的超微结构[J]. 东海海洋,19(3):19-24. [Lu J P. 2001. Ultramicrostructure of the gill cells of Macrobrachium nipponense[J]. Donghai Marine Science,19(3):19-24.] doi:10.3969/j.issn.1001-909X. 2001.03.003.
单保党,胡壮涛,蔡娟,丁玉龙,黎秋云. 2018. 利洋1号和利洋2号南美白对虾仔虾耐低氧能力研究[J]. 当代水产,43(7):87-89. [Shan B D,Hu Z T,Cai J,Ding Y L,Li Q Y. 2018. Study on the hypoxia tolerance of Liyang No.1 and No.2 whiteleg shrimp(Litopenaeus vannamei)[J]. Current Fisheries,43(7):87-89.] doi:10.3969/j.issn.1674-9049.2018.07.027.
王爱敏. 1997. 罗氏沼虾蚤状幼体耗氧速率与窒息点测定[J]. 齐鲁渔业,14(2):37-43. [Wang A M. 1997. Experiment on oxygen consumption rates and asphyxiant points of zoeal larvae of Macrobrachium rosenbergii[J]. Shandong Fisheries,14(2):37-43.]
王志刚,刘士力,李贤露,吕卓云,毛丽盈,唐超然,郑荣泉. 2019. 翘嘴红鲌(Erythroculter ilishaeformis)果糖-1,6-二磷酸醛缩酶(ALDO-C)基因定位、克隆及表达分析[J]. 海洋与湖沼,50(5):1138-1145. [Wang Z G,Liu S L,Li X L,Lü Z Y,Mao L Y,Tang C R,Zheng R Q. 2019. Location,cloning and expression analysis of ALDO-C gene in Erythroculter ilishaeformis[J]. Oceanologia et Limnologia Sinica,50(5):1138-1145.] doi:10.11693/hyhz2019 0300049.
王盼,史文軍,万夕和,沈辉,沙士兵,黎慧,王李宝,孙瑞健,蒋葛,吴旭干. 2021. 低氧–复氧对脊尾白虾呼吸代谢和抗氧化酶活力的影响[J]. 渔业科学进展,42(4):106-115. [Wang P,Shi W J,Wan X H,Shen H,Sha S B,Li H,Wang L B,Sun R J,Jiang G,Wu X G. 2021. Effects of hypoxia and reoxygenation on respiratory metabolism enzyme and antioxidant enzyme activities in Exopalaemon carinicauda[J]. Progress in Fishery Sciences,42(4):106-115.] doi:10.19663/j.issn2095-9869.20200424 002.
杨明,孙盛明,傅洪拓,赵才源,王亚冰,胡宇宁,乔慧,张文宜,龚永生,蒋速飞. 2019. 低氧和复氧对日本沼虾抗氧化酶活力及组织结构的影响[J]. 中国水产科学,26(3):493-503. [Yang M,Sun S M,Fu H T,Zhao C Y,Wang Y B,Hu Y N,Qiao H,Zhang W Y,Gong Y S,Jiang S F. 2019. Hypoxia and reoxygenation on antioxidant enzyme activities and his-tological structure of Macrobrachium nipponense[J]. Journal of Fishery Sciences of China,26(3):493-503.] doi:10.3724/SP.J.1118.2019.18285.038C597C-F774-40C1-9DC1-F6FE2E5B0876
Chen S F,Zhou Y Q,Chen Y R,Jia G. 2018. fastp:An ultra-fast all-in-one FASTQ preprocessor[J]. Bioinformatics,34(17):i884-i890. doi:10.1093/bioinformatics/bty560.
Cheng W,Liu C H,Hsu J P,Chen J C. 2002. Effect of hypo-xia on the immune response of giant freshwater prawn Macrobrachium rosenbergii and its susceptibility to pathogen Enterococcus[J]. Fish & Shellfish Immunology,13(5):351-365. doi:10.1006/fsim.2001.0411.
Cheng W,Liu C H,Kuo C M. 2003. Effects of dissolved oxygen on hemolymph parameters of freshwater giant prawn,Macrobrachium rosenbergii (de Man)[J]. Aquaculture,220(1):843-856. doi:10.1016/S0044-8486(02)00534-3.
Crocker C D,Chapman L J,Martínez M L. 2013. Hypoxia-induced plasticity in the metabolic response of a widespread cichlid[J]. Comparative Biochemistry and Phy-siology. Part B:Biochemistry & Molecular Biology,166(2):141-147. doi:10.1016/j.cbpb.2013.08.002.
Dupont-Prinet A,Pillet M,Chabot D,Hansen T,Tremblay R,Audet C. 2013. Northern shrimp (Pandalus borealis) oxygen consumption and metabolic enzyme activities are severely constrained by hypoxia in the Estuary and Gulf of St. Lawrence[J]. Journal of Experimental Marine Biology and Eco-logy,448:298-307. doi:10.1016/j.jembe.2013.07.019.
Ernst J,Bar-Joseph Z. 2006. STEM:A tool for the analysis of short time series gene expression data[J]. BMC Bioinformatics,7(1):191. doi:10.1186/1471-2105-7-191.
Grabherr M G,Haas B J,Yassour M,Levin J Z,Thompson D A,Amit I,Adiconis X,Fan L,Raychowdhury R,Zeng Q D,Chen Z H,Mauceli E,Hacohen N,Gnirke A,Rhind N,di Palma F,Birren B W,Nusbaum C,Lindblad-Toh K,Friedman N,Regev A. 2011. Full-length transcriptome assembly from RNA-Seq data without a reference genome[J]. Nature Biotechnology,29(7):644-652. doi:10.1038/nbt.1883.
Hu D X,Pan L Q,Zhao Q,Ren Q. 2015. Transcriptomic response to low salinity stress in gills of the Pacific white shrimp,Litopenaeus vannamei[J]. Marine Genomics,24(3):297-304. doi:10.1016/j.margen.2015.07.003.
Huang W,Ren C H,Li H M,Huo D,Wang Y H,Jiang X,Tian Y S,Luo P,Chen T,Hu C Q. 2017. Transcriptomic analyses on muscle tissues of Litopenaeus vannamei provide the first profile insight into the response to low temperature stress[J]. PLoS One,12(6):e0178604. doi:10. 1371/journal.pone.0178604.
Iurlaro R,Munoz-Pinedo C. 2016. Cell death induced by endoplasmic reticulum stress[J]. The FEBS Journal,283(14):2640-2652. doi:10.1111/febs.13598.
Kim S Y,Park J W. 2010. Modulation of hypoxia-inducible factor-1α expression by mitochondrial NADP-dependent isocitrate dehydrogenase[J]. Biochimie,92(12):1908-1913. doi:10.1016/j.biochi.2010.08.004.038C597C-F774-40C1-9DC1-F6FE2E5B0876
Land S C,Buck L T,Hochachka P W. 1993. Response of protein synthesis to anoxia and recovery in anoxia-tolerant hepatocytes[J]. The American Journal of Physiology,265(1):R41-R48. doi:10.1152/ajpregu.1993.265.1.R41.
Larkin G,Closs G P,Peake B. 2008. Tolerance and behaviour of the mysid shrimp Tenagomysis novae-zealandiae to low dissolved oxygen[J]. New Zealand Journal of Marine and Freshwater Research,41(3):317-323. doi:10. 1080/00288330709509919.
Li F H,Luan W,Zhang C S,Zhang J Q,Wang B,Xie Y S,Li S H,Xiang J H. 2009. Cloning of cytoplasmic heat shock protein 90 (FcHSP90) from Fenneropenaeus chinensis and its expression response to heat shock and hypoxia[J]. Cell Stress and Chaperones,14(2):161-172. doi:10.1007/s12192-008-0069-6.
Li H L,Lin H R,Xia J H. 2017. Differential gene expression profiles and alternative isoform regulations in gill of Nile tilapia in response to acute hypoxia[J]. Marine Biotechnology,19(6):551-562. doi:10.1007/s10126-017-9774-4.
Li J T,Lü J J,Liu P,Chen P,Wang J J,Li J. 2019. Genome survey and high-resolution backcross genetic linkage map construction of the ridgetail white prawn Exopalaemon carinicauda applications to QTL mapping of growth traits[J]. BMC Genomics,20(1):598. doi:10.1186/s12864-019-5981-x.
Li Y D,Zhou F L,Huang J H,Yang L S,Jiang S,Yang Q B,He J G,Jiang S G. 2018. Transcriptome reveals involvement of immune defense,oxidative imbalance,and apoptosis in ammonia-stress response of the black tiger shrimp (Penaeus monodon)[J]. Fish & Shellfish Immunology,83:162-170. doi:10.1016/j.fsi.2018.09.026.
Love M I,Huber W,Anders S. 2014. Moderated estimation of fold change and dispersion for RNA-Seq data with DESeq2[J]. Genome Biology,15(12):550. doi:10.1186/s13059-014-0550-8.
Ma H K,Sun J Q,Xu W Y,Gao W,Hu G W,Lai X F,Yan B L,Gao H. 2020. Cloning and functional study of lipocalin:Retinol-binding protein-like gene family of the ridgetail white prawn,Exopalaemon carinicauda[J]. Molecular Genetics & Genomics,295(2):453-464. doi:10. 1007/s00438-019-01633-0.
Mortazavi A,Williams B A,McCue K,Schaefferet L,Wold B. 2008. Mapping and quantifying mammalian transcriptomes by RNA-Seq[J]. Nature Methods,5(7):621-628. doi:10.1038/nmeth.1226.
Nakhoul H,Ke J W,Zhou X,Liao W J,Zeng S X,Hua L. 2014. Ribosomopathies:Mechanisms of disease[J]. Clinical Medicine Insights:Blood Disorders,7:7-16. doi:10. 4137/CMBD.S16952.
Paschke K,Cumillaf J P,Loyola S,Gebauer P,Urbina M,Chimal M E,Pascual C,Rosas C. 2010. Effect of dissolved oxygen level on respiratory metabolism,nutritional phy-siology,and immune condition of southern king crab Lithodes santolla (Molina,1782) (Decapoda,Lithodidae)[J]. Marine Biology,157(1):7-18. doi:10.1007/s00227-009-1291-1.038C597C-F774-40C1-9DC1-F6FE2E5B0876
Saetan W,Tian C X,Yu J W,Lin X H,He F X,Huang Y,Shi H J,Zhang Y L,Li G L. 2020. Comparative transcriptome analysis of gill tissue in response to hypoxia in silver sillago (Sillago sihama)[J]. Animals,10(4):628. doi:10.3390/ani10040628.
Shao C N,Zheng H N,Zhou Z X,Li J,Luo X W,Hui G H,Zhao Z D. 2018. Ridgetail white prawn (Exopalaemon carinicauda) K value predicting method by using electronic nose combined with non-linear data analysis model[J]. Food Analytical Methods,11:3121-3129. doi:10. 1007/s12161-018-1297-8.
Shenoy N,Kessel R,Bhagat T D,Bhattacharyya S,Yu Y T,Mcmahon C,Verma A. 2012. Alterations in the riboso-mal machinery in cancer and hematologic disorders[J]. Journal of Hematology & Oncology,5:32. doi:10.1186/1756-8722-5-32.
Smith R W,Houlihan D F,Nilsson G E,Brechin J G. 1996. Tissue-specific changes in protein synthesis rates in vivo during anoxia in crucian carp[J]. The American Journal of Physiology,271(4):R897-R904. doi:10.1152/ajpregu.1996.271.4.R897.
Soldatov A A,Golovina I V,Kolesnikova E E,Sysoeva I V,Kladchenko E S. 2020. Activity of energy metabolism enzymes and ATP content in the brain and gills of the black sea scorpionfish Scorpaena porcus under short-term hypoxia[J]. Journal of Evolutionary Biochemistry & Physiology,56(3):224-234. doi:10.1134/S002209302 0030059.
Sun S M,Xuan F J,Ge X P,Fu H T,Zhu J,Zhang S Y. 2014. Identification of differentially expressed genes in hepatopancreas of oriental river prawn,Macrobrachium nipponense exposed to environmental hypoxia[J]. Gene,534(2):298-306. doi:10.1016/j.gene.2013.10.036.
Sun S M,Xuan F J,F J,Fu H T,Zhu J,Ge X P,Gu Z M. 2015. Transciptomic and histological analysis of hepatopancreas,muscle and gill tissues of oriental river prawn (Macrobrachium nipponense) in response to chronic hypoxia[J]. BMC Genomics,16(1):491. doi:10.1186/s12864-015-1701-3.
Ulaje S A,Rojo-Arreola L,Lluch-Cota S E,Ascencio F,Cruz-Hernández P,Sicard M T. 2019. Gene expression and energetic metabolism changes in the whiteleg shrimp (Litopenaeus vannamei) in response to short-term hypoxia[J]. Aquaculture Research,50(4):994-1004. doi:10.1111/are.13960.
Wang Z L,Zhou J,Li J Y,Lü W,Fan L F. 2020. A new insight into the intestine of Pacific white shrimp:Regulation of intestinal homeostasis and regeneration in Litopenaeus vannamei during temperature fluctuation[J]. Comparative Biochemistry and Physiology. Part D:Genomics & Proteomics,35:100687. doi:10.1016/j.cbd.2020.100687.
Xie X,Guo P,Yu H,Wang Y,Chen G. 2018. Ribosomal proteins:Insight into molecular roles and functions in hepatocellular carcinoma[J]. Oncogene,37(3):277-285. doi:10.1038/onc.2017.343.
(責任编辑 兰宗宝)038C597C-F774-40C1-9DC1-F6FE2E5B0876

