微波辅助提取花生红衣和花生壳中多酚物质及抗氧化活性对比研究
温志英,郭清爽,刘 坤,赵 飞
(1.河北经贸大学生物科学与工程学院,河北石家庄 050061;2.河北经贸大学工商管理学院,河北石家庄 050061)
花生(Arachis hypogaea L.)是全球最重要的四大油料作物(油菜、大豆、花生、芝麻)之一。我国是世界花生生产大国和花生加工利用强国[1],2018 年花生年总产量1 733.2 万t,居世界首位[2]。花生壳和红衣是花生的副产物,我国年产花生壳约520 万t,花生红衣600 t,除了少部分被用作中药、饲料和燃料外,资源浪费极其严重[3-4]。
Francisco M L 等人[5]、Elsorady M E 等人[6]和Adhikari B 等人[7]研究表明花生皮、壳含有丰富的多酚类物质(白藜芦醇、原花色素、黄酮类等),具有抗氧化、降血糖、抗肿瘤等生物活性,可作为防癌、抗突变、防治心血管疾病药物的主要有效成分和用作安全无毒的新型天然抗氧化剂。刘翠等人[8-9]的研究表明花生红衣多酚还是有效的食品防腐保鲜剂。微波辅助提取(MAE)具有提取时间短、效率高、能耗低的特点,同时能降低热敏性物质降解风险,是一种环境友好的绿色提取技术[10-13]。因此,通过微波辅助工艺提取花生皮、壳中的多酚类物质,并对其抗氧化活性进行比较研究。试验参考Jayaprakasha G 等人[14]的方法,以抗坏血酸当量浓度(mg AA/g)表示花生红衣、花生壳DPPH 自由基的清除能力,目前在国内未见报道。研究成果对于有效利用我国丰富的花生红衣和花生壳资源中的天然多酚活性成分,实现循环农业和循环经济具有深远意义。
1 材料与设备
1.1 材料
花生红衣、花生壳,市售带壳花生手工剥壳。
1.2 试剂
没食子酸(Gallic acid,GA),抗坏血酸(Ascorbic acid,AA),1,1-二苯基-2-三硝基苯肼(DPPH),福林酚试剂,Sigma-Aldrich 公司提供;无水Na2CO3、无水乙醇、甲醇、硫酸亚铁、水杨酸,均为分析纯。
1.3 仪器与设备
HH-4 型恒温水浴锅、RA-8 微波萃取仪、DFY-300 g 摇摆式高速中药粉碎机、SHD-Ⅲ型循环水式多用真空泵、722E 型分光光度计、72-1 型电热恒温干燥箱、800 型离心沉淀器、Synergy HT 多功能酶标仪等。
1.4 试验方法
1.4.1 花生皮、壳预处理
花生皮、壳→50 ℃下恒温鼓风干燥箱干燥4 h→粉碎机粉碎→过40 目筛→正己烷浸提脱脂24 h→-20 ℃冰箱密封避光储存,备用。
1.4.2 花生红衣、花生壳多酚提取
花生皮壳粉末→称量→乙醇水溶液恒温浴振荡(160 r/min,60 ℃)10 min→微波萃取→离心→取上清液→定容→测定吸光度→计算花生红衣、花生壳多酚得率(以当量没食子酸(GA)表示)。

式中:A——吸光度;
m——稀释倍数;
n——提取液体积,mL;
G——花生红衣、花生壳质量,g。
1.4.3 多酚含量的测定
多酚的含量测定采用Folin-Ciocalteu 法[15]。没食子酸回归方程:Y=0.006 1X+0.077 7,R2=0.999 6。
没食子酸标准曲线见图1。

图1 没食子酸标准曲线
1.4.4 花生红衣、花生壳多酚类化合物的体外抗氧化活性研究
(1)DPPD 自由基清除能力测定。以抗坏血酸(AA,0.02 mg/mL)作为对照标准,其体外抗氧化活性作用以抗坏血酸当量表示mg AA/g,采用Jayaprakasha G 等人[14]的方法测定DPPD 自由基清除能力测定。
抗坏血酸标准曲线见图2。

图2 抗坏血酸标准曲线
(2)羟基自由基的清除能力测定。采用水杨酸法[16-17]。
1.5 数据处理
采用SPSS 25.0 统计软件进行数据分析,应用单因素方差分析(ANOVA)及Duncan's 多重检验进行显著性分析,以p<0.05 为差异具有统计学意义。数值以均质±标准差SD 表示。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇体积分数对花生红衣、花生壳多酚得率的影响
准确称取2 g 花生红衣、花生壳粉末,料液比1∶40,加入不同体积分数的乙醇溶液,微波功率240 W,微波提取时间30 s,其余步骤同1.4.2。
乙醇体积分数对花生红衣、花生壳多酚得率的影响见图3。
由图3 可知,花生红衣多酚在乙醇体积分数为80%时得率最高为137.11 mg GA/g,而花生壳多酚在乙醇体积分数为60%时得率最高为15.34 mg GA/g。得率先升高后下降是由于不同体积分数乙醇极性不同,根据相似相溶原理,多酚在极性最相似的溶液中溶出最高,得率最大。由于花生红衣与花生壳二者多酚的具体成分差异较大,花生红衣中的酚类物质以原儿茶酸、儿茶素、原花青素为主[9],而花生壳中主要为木犀草素[18-19],故而乙醇体积分数对二者的影响不同。

图3 乙醇体积分数对花生红衣、花生壳多酚得率的影响
2.1.2 微波功率对花生红衣、花生壳多酚得率的影响
分别以80%,60%的乙醇为提取剂提取花生红衣、花生壳多酚,微波功率为160,320,480,640,800 W,其余条件同2.1.1 进行微波提取。
微波功率对花生红衣、花生壳多酚得率的影响见图4。
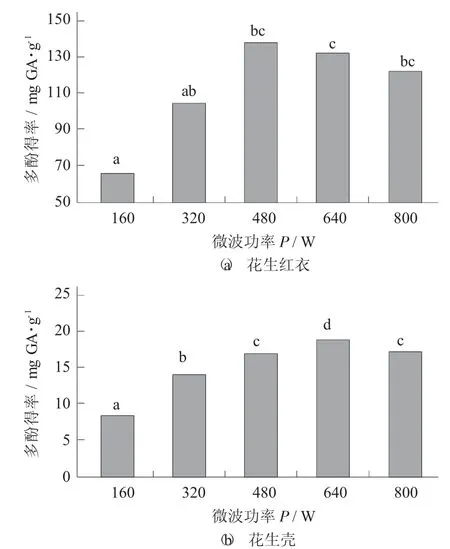
图4 微波功率对花生红衣、花生壳多酚得率的影响
由图4 可知,随微波功率的增大,总多酚得率增加,但继续增大微波功率,多酚得率下降。花生红衣在微波功率达到480 W 时,多酚得率最大为138.07 mg GA/g,花生壳在微波功率640 W时达到最大为18.96 mg GA/g。可能是因为适当的微波功率有利于花生红衣中多酚的溶出,但过高的微波功率则有可能破坏多酚类化合物,致使其得率下降。
2.1.3 料液比对花生红衣、花生壳多酚得率的影响
花生红衣(80%乙醇,480 W),花生壳(60%乙醇、640 W),料液比为1∶20,1∶30,1∶40,1∶50,1∶60,其余条件同2.1.1 进行微波提取。
料液比对花生红衣、花生壳多酚得率的影响见图5。

图5 料液比对花生红衣、壳多酚得率的影响
由图5 可知,随着料液比的增加,多酚得率逐渐增加,当料液比为1∶40 时,花生红衣、花生壳多酚得率均最大,之后增加料液比,多酚得率有所下降,由此可见增大料液比有利于多酚物质溶出,当料液比为1∶40 时,多酚溶出达到最高,当料液比继续增大会造成杂质过多的流出从而阻止了多酚类化合物的溶解,影响得率。料液比为1∶40 时,花生红衣、花生壳的多酚得率分别为145.02 mg GA/g和19.82 mg GA/g。
2.1.4 微波时间对多酚得率的影响
花生红衣(80%乙醇,480 W),花生壳(60%乙醇,640 W),料液比为1∶40,其他条件同2.1.1。
微波时间对花生壳多酚得率的影响见图6。

图6 微波时间对花生壳多酚得率的影响
由图6 可知,在10~40 s 内随着微波时间增加,总多酚得率也随之增加,在40~60 s 内得率下降,当微波时间为40 s 时多酚得率最高,这是因为微波有利于多酚的溶出,但当微波时间过长则会降解或破坏已溶出的多酚类化合物,导致总多酚得率下降,这与Ekezie F G 等人[10]和Zhang G 等人[12]的研究结果一致。微波时间40 s 时,花生红衣、花生壳多酚得率分别为145.96 mg GA/g 和20.55 mg GA/g。
2.2 正交试验
2.2.1 花生红衣多酚正交试验
根据正交试验设计原理,结合单因素试验结果,选取乙醇体积分数、料液比、微波时间3 个对花生红衣多酚得率影响显著的因素,采用三因素三水平的正交试验L9(34)优化提取工艺[19]。
花生红衣多酚正交试验结果见表1,花生红衣正交试验方差分析见表2。
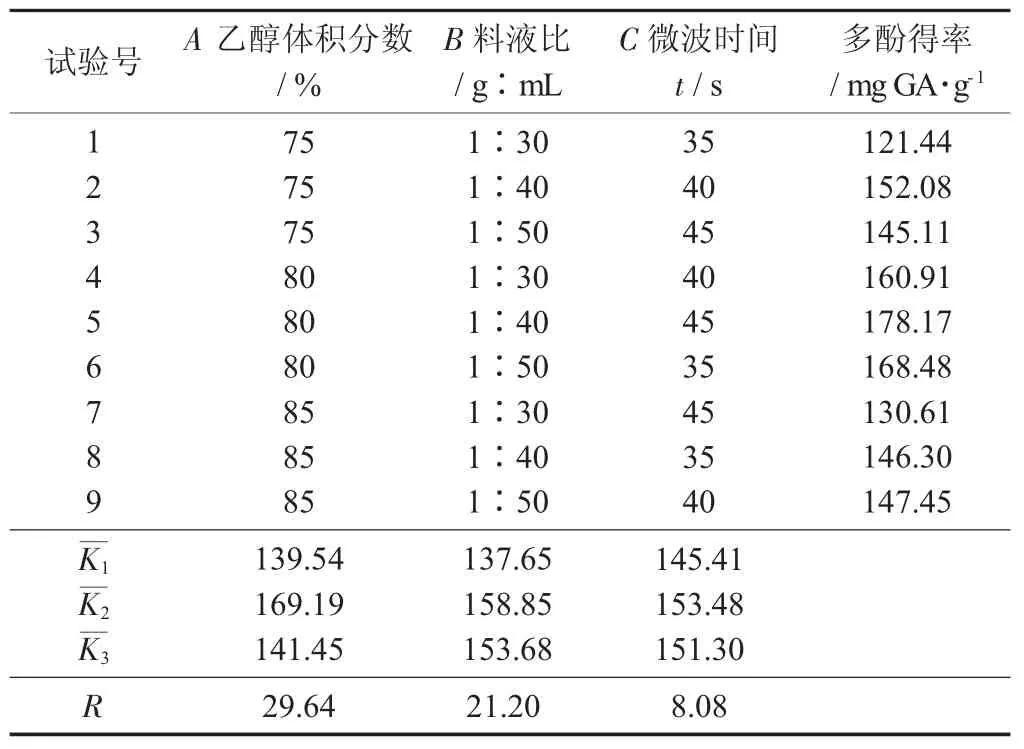
表1 花生红衣多酚正交试验结果
由表2 可知,影响花生红衣多酚得率的因素从大到小为A>B>C,A 和B 对提取有极显著影响,C对提取有显著影响。最佳工艺条件为A2B2C2,即乙醇体积分数80%,料液比1∶40,微波时间40 s。按照1.4.2 方法进行提取,试验重复3 次,花生红衣多酚得率为179.20 mg GA/g,高于李娜等人[18]报道的147.72 mg GA/g,与Francisco M L 等人[20]研究报道花生红衣中的多酚含量在110~280 mg GA/g 试验结果一致。

表2 花生红衣正交试验方差分析
2.2.2 花生壳多酚正交试验
根据正交试验设计原理,结合单因素试验结果,选取微波功率、料液比、微波时间为三因素,采用三因素三水平的正交试验L9(34)优化提取工艺。
花生壳多酚正交试验结果见表3,花生壳正交试验方差分析见表4。
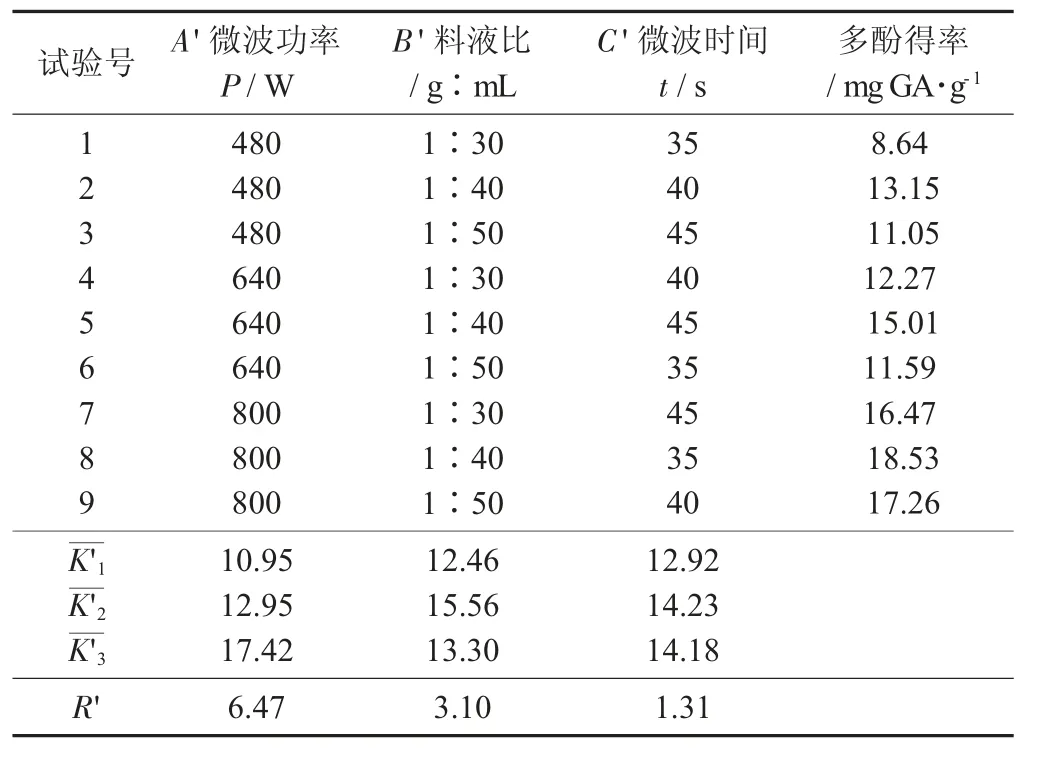
表3 花生壳多酚正交试验结果
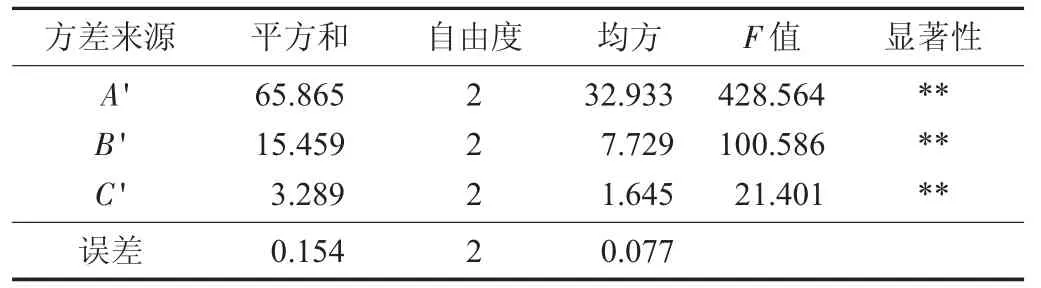
表4 花生壳正交试验方差分析
由表4 可知,影响花生红衣多酚得率的因素从大到小为A'>B'>C',三者对提取有极显著影响。最佳工艺条件为A'3B'2C'2,即微波功率800 W,料液比1∶40,微波时间40 s。以60%乙醇为提取液,按照1.4.2 方法进行提取,试验重复3 次,得花生壳多酚得率为20.63 mg GA/g。
2.3 花生红衣、花生壳多酚类对DPPH 自由基的清除能力
花生红衣、花生壳多酚抗氧化活性比较见图7。
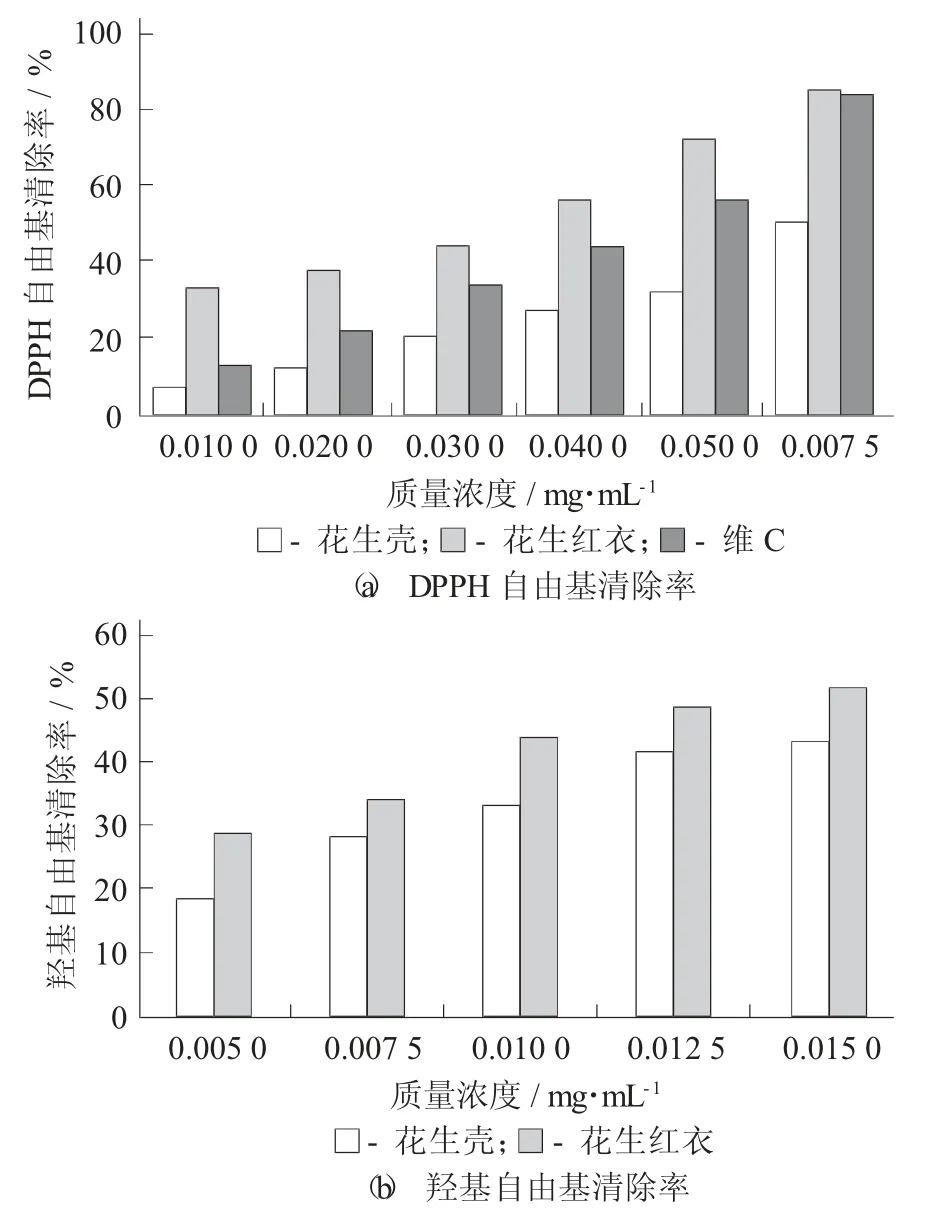
图7 花生红衣、花生壳多酚抗氧化活性比较
由图7(a)可知,当质量浓度为0.005 mg/mL时,花生红衣多酚、抗坏血酸、花生壳多酚DPPH自由基清除率分别为72.28%,56.40%,32.27%,花生红衣多酚对自由基的清除能力显著高于花生壳多酚,同时优于抗坏血酸,具有显著差异(p<0.05);当质量浓度为0.007 5 mg/mL 时,花生红衣和抗坏血酸清除率分别为85.59%和84.16%,差异不显著(p<0.05)。在质量浓度为0.000 5~0.007 5 mg/mL 时,抗坏血酸对DPPH·的清除率与质量浓度呈现线性相关性,回归方程为Y=10 885X+1.823 3,R2=0.999 3。根据抗坏血酸标准曲线,花生红衣多酚的当量抗坏血酸为131.56±2.20 mg AA/g,花生壳多酚的当量抗坏血酸为6.51±0.71 mg AA/g。因此,花生红衣清除DPPH 自由基能力显著高于花生壳(p<0.05),与李娜等人[18]和Meng W 等人[21]已报道的研究成果一致。
2.4 花生红衣、花生壳多酚对羟基自由基清除能力
由图7(b)可知,花生红衣、花生壳多酚对羟基自由基有清除能力均随着花生红衣、花生壳多酚质量浓度增加而增强,当多酚质量浓度为0.015 mg/mL 时,花生皮、壳多酚的·OH 清除率分别为51.86%和43.26%,花生红衣多酚的清除羟基自由基能力显著高于花生壳多酚(p<0.05)。
3 结论
花生红衣微波辅助提取多酚物质的最佳提取工艺为乙醇体积分数80%,料液比1∶40,微波功率480 W,微波时间40 s,花生红衣多酚得率为179.20 mg GA/g;花生壳微波辅助提取多酚物质的最佳提取工艺为乙醇体积分数60%,料液比为1∶40,微波功率800 W,微波时间40 s,花生壳多酚得率为20.63 mg GA/g。
花生红衣的DPPH 自由基清除能力和羟基自由基清除能力均优于花生壳。花生红衣DPPH 自由基清除能力优于抗坏血酸,其当量抗坏血酸为131.56±2.20 mg AA/g,花生壳的当量抗坏血酸为6.51±0.71 mg AA/g。由此可见,花生皮、壳多酚均具有抗氧化性,花生红衣抗氧化性尤为突出,是一种优良的天然抗氧化剂,为开发花生皮壳等农业废弃物资源提供了依据。

