苦树侧枝不同极性部位的抗氧化活性及对肺癌细胞A549 的生长抑制作用
李金花, 曾国芳, 臧青民, 张慧晔, 李海东 , 陈 荣,
(1.吉林农业大学中药材学院,吉林长春130118;2.玉林师范学院, 广西农产资源化学与生物技术重点实验室,广西玉林537000;3.广州白云山和记黄埔中药有限公司,广东广州510515)
苦树为苦木科苦树属植物 (Picrasma quassioides)落叶乔木树种,自然分布于印度、不丹等国及我国黄河流域以南各省区(中国科学院中国植物志编辑委员会,1997)。 中国药典收载的“苦木”药材,其来源为苦树的枝、叶,有清热解毒、健胃杀虫等作用, 以苦树为原料的诸多制剂对各种感染和脓肿疗效显著(邓延秋等,2020;朱兆仪等,1983)。在兽医临床上,有将苦树自制成粉末剂、汤剂、片剂、注射剂使用的报道,对猪和牛的溃疡清创、伤风感冒、猪胃肠炎、仔猪白痢、中暑等有较好的治疗效果,尤其对采用抗生素治疗效果不佳,反复发作的无名高热症,治疗效果更好,这部分临床报道以煎煮后使用为主, 采用的入药部位分别有茎、根和叶(覃玉忠等,2013;王启明,1995;刘富国,1986);在饲料添加剂方面,苦木提取物能够有效改善仔猪的消化性能, 提高免疫抗病能力及一定程度上能防止肉牛瘤胃酸中毒的产生(李国柱等,2014;魏吉安,2006)。
机体的新陈代谢过程以及炎症或外界刺激等都会导致自由基产生, 机体中过多的氧自由基会破坏细胞结构, 导致代谢异常、 引发疾病和衰老(张华,2013);甚至会引起突变、诱发癌症(左丽丽,2013)。 抗氧化剂可分为合成抗氧化剂和天然抗氧化剂两种, 合成抗氧化剂在食品和饲料工业中被广泛使用,但具有潜在的毒性和致癌作用,长期使用会对生命安全造成威胁, 而天然抗氧化剂更为安全, 因此筛选新的抗氧化剂和抗肿瘤的天然药物成为研究重点(吕凤,2021)。已报道的苦树化学成分主要有生物碱类、 苦味素类及黄酮类等(邓延秋等,2020)。 药理学研究表明,苦树具有抑菌、抗炎、抗肿瘤、抗氧化等作用(赵文娜等,2019;Zhao 等,2013; 刘岩等,2010; 刘军锋等,2009);但目前鲜见苦树侧枝乙醇提取物不同极性部位体外抗氧化活性研究及苦树提取物对人肺癌细胞(A549)的药效学研究报道。 考虑到不同极性溶剂对提取物中化学成分的影响, 以及由此带来的药效学差异,本试验采用苦树侧枝为原药材,对其乙醇提取物采用不同溶剂萃取, 探讨不同极性部位提取物的抗氧化和抗肿瘤活性差异, 从而进一步明确苦树侧枝乙醇提取物不同极性部位的合理使用,且为开发利用这一天然抗氧化剂,及其在兽药及饲料添加剂中的应用提供试验依据。
1 材料与仪器
1.1 材料与试剂 苦树侧枝于2020 年7 月采于广西河池市, 经广西药用植物园高级工程师鉴定为苦木科苦树属植物苦树。 人肺癌细胞(A549)由玉林师范学院岭南中草药质量控制中心保存。2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸) 二铵盐、1,1-二苯基-2-三硝基苯肼均为分析纯,购自上海蓝季生物;四甲基偶氮唑兰(MTT)、细胞培养液、 胰酶, 由上海生工生物工程股份有限公司提供;其他化学试剂均为分析纯,购自成都市科隆化学品有限公司。
1.2 主要仪器 101-1B 电热恒温鼓风干燥箱(绍兴市易诚仪器制造有限公司);UV-5100B 紫外分光光度仪 (上海精密科学仪器有限公司);HH-4 数显恒温水浴锅 (金坛区西城新瑞仪器厂);TDL-80-2B 低速台式离心机(上海安亭科学仪器厂);SHB-Ш 循环水多用真空泵 (郑州长城科技工贸有限公司);RZ01C 旋转蒸发器(郑州长城科技工贸有限公司);ATY224 型万分之一天平(日本岛津制作所);pH-25 型pH 计(上海越平);DMIL LED 倒置显微镜(莱卡);LUX 酶标仪(赛默飞);COP-T 型CO2恒温培养箱(上海笃特科学仪器有限公司);SW-CJ-VS2 双人单面超净工作台(无锡易纯净化设备有限公司)。
2 试验方法
2.1 苦树侧枝乙醇粗提物的制备 苦树侧枝干燥粉碎过40 目筛后,取100 g,按料液比1∶10(g/mL)进行回流提取, 首先加入80%的乙醇500 mL,回流提取1.5 h,过滤,滤渣再加入80%的乙醇250 mL提取1 h, 过滤, 滤渣再加入80%的乙醇250 mL提取0.5 h,合并三次滤液,减压浓缩成浸膏,加入200 mL 纯水溶解浸膏, 依次用等体积的二氯甲烷、乙酸乙酯、正丁醇进行萃取,剩余部分为水部位, 用旋转蒸发仪回收各部位萃取溶剂后进行冷冻干燥处理,得到水(4.1066 g)、正丁醇(0.9362 g)、乙酸乙酯(1.0460 g)、二氯甲烷(0.6096 g)4 个萃取部位干燥品。
2.2 ABTS 法测定ABTS 自由基清除能力 参考黄小凤等(2021)报道方法,并根据预试验结果调整后实施。具体为取苦树不同极性部位干燥品,用50%乙醇溶液配制成质量浓度为0.02、0.04、0.06、0.08、0.10 mg/mL 的供试品溶液, 备用;50%乙醇溶液配 制0.002、0.004、0.006、0.008、0.010 mg/mL的VC溶液,备用。 将7.4 mmol/L 的ABTS 溶液和
2.6 mmol/L 的过硫酸钾溶液等体积混合, 室温避光放置12 h 后即得ABTS 母液,母液用纯化水稀释45 倍作为ABTS 工作液;精密量取ABTS 工作液2 mL 及各供试品溶液1 mL, 充分摇匀室温避光反应30 min 后,测定734 nm 处的吸光度。供试品溶液吸光度为Ai,纯化水空白对照组吸光度为A0。 根据公式计算出供试品溶液对ABTS 自由基的清除率,并通过SPSS 统计分析得到IC50值。
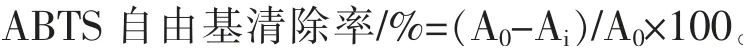
2.3 DPPH 法测定DPPH 自由基清除能力 参考黄小凤等(2021)和郭溆等(2018)并在预试验后对报道方法进行调整。 具体为分别取不同极性部位干燥品适量,以50%乙醇溶液配制成质量浓度为0.02、0.04、0.06、0.08、0.1 mg/mL 的供试品溶液,备 用; 同 样 方 法 配 制0.002、0.004、0.006、0.008、0.01 mg/mL 的VC溶液备用。取上述各供试品溶液2 mL 分别加于10 mL 试管, 再各加入2 mL 浓度为0.1 mmol/L 的DPPH 乙醇溶液, 摇匀后室温避光反应30 min,测定517 nm 处的吸光度。 测得供试品溶液吸光度Ai,纯化水空白对照组吸光度A0,无水乙醇代替DPPH 乙醇溶液的本底组吸光度Aj。根据公式计算出不同供试品溶液对DPPH 自由基的清除率,并通过SPSS 统计分析得到IC50值。

2.4 普鲁士蓝法测定铁还原能力 具体方法参考黄小凤等(2021) 报道并根据预试验调整后实施,取苦树侧枝不同极性部位干燥品以50%乙醇溶液配制成质量浓度为1.0、2.0、3.0、4.0、5.0 mg/mL 的供试品溶液备用; 用50%乙醇溶液配制0.1、0.2、0.3、0.4、0.5 mg/mL 的VC做阳性对照。 供试品溶液分别各取2.5 mL 加入10 mL 试管中,再依次加入浓度为0.2 mmol/L 的磷酸盐缓冲液(pH=6.6)以及1%铁氰化钾溶液各2.5 mL,充分摇匀,水浴锅中50 ℃反应20 min 后取出,迅速冷却后再分别加入10%三氯乙酸溶液2.5 mL 并充分摇匀,3000 r/min 离心10 min 后分别吸取上清液2.5 mL 加入0.1%FeCl3溶液0.5 mL 及纯化水1 mL,充分摇匀后室温静置10 min,测定700 nm波长处吸光度。 供试品溶液吸光度记为Ai,纯化水空白对照组吸光度为A0。 根据公式计算不同浓度样品溶液的铁还原能力并通过SPSS 统计分析得到半数还原能力(IC50)。
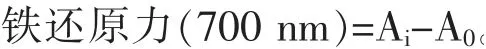
2.5 抗人肺癌肿瘤细胞活性试验 抗肿瘤活性测定参考李慧等(2019)报道方法。 细胞培养液为含有10%胎牛血清、1%青霉素、1%链霉素的DMEM 高糖培养基。 首先进行细胞复苏,取出含人肺癌细胞(A549)的冻存管于37 ℃水浴锅中快速解冻, 加37 ℃预热的细胞培养液后混匀,1000 r/min 离心5 min 后弃去最上层液体, 迅速加入2 mL 细胞培养液,用移液枪头轻轻地吹打细胞至完全分散后将其转移至无菌细胞培养皿 (90 mm)中,置于37 ℃、5%CO2、饱和湿度的培养箱中培养48 h 后传代培养,取对数生长的细胞进行后续肿瘤抑制试验。
检测肿瘤细胞抑制率试验时, 取苦树侧枝不同极性部位干燥品适量,以DMSO 配制成质量浓度为100 mg/mL 的药物溶液备用,将人肺癌细胞(A549) 以4 × 103/mL 接种于96 孔培养板中,每孔体积100 μL, 在CO2培养箱内培养8 ~12 h。待细胞贴壁且密度约大于80%后,按50、100、200 μg/mL 的浓度加药,同时设置调零孔组(培养液)和空白对照组(培养液+细胞),每组设置6 个重复。加药培养24 h 后,每孔加入MTT 溶液(1 mg/mL)50 μL, 继续在培养箱内孵育4 h, 吸去上清液,每孔加入150 μL DMSO,振荡10 min 后,使用酶标仪于490 nm 下测定各孔的光密度值。 根据公式计算不同浓度样品溶液的细胞活力, 并通过SPSS 统计分析。
抑制率/%=(药物组OD 值-空白组OD 值)/(对照组OD 值-空白组OD 值)×100。
3 结果与分析
3.1 苦树不同极性部位提取物对ABTS 自由基的清除能力 苦树侧枝各极性部位对ABTS 自由基清除结果如表1 和图1 所示。 乙酸乙酯部位药物浓度为0.08 mg/mL 时, 清除率为91.472%,该极性部位药物浓度提高到0.1 mg/mL 时, 清除率为96.981%, 此两种浓度下对ABTS 自由基清除率分别达到最高浓度Vc 清除率的92.6%和97.5% 以上, 说明苦树侧枝乙醇提取物的乙酸乙酯萃取部位对ABTS 自由基的清除率与Vc 相当,清除能力强;水层部位药物浓度为0.1 mg/mL 时,清除率为88.604%, 此浓度下对ABTS 自由基清除率达到Vc 的89.2% 以上, 说明水部位的清除能力也较强。 从IC50数值来看,二氯甲烷部位、乙酸乙酯部位、 正丁醇部位、 水部位的IC50分别为0.061、0.026、0.072、0.057 mg/mL,各部位对ABTS自由基的清除能力顺序为乙酸乙酯部位>水部位>二氯甲烷部位>正丁醇部位,4 个部位间IC50差异显著。
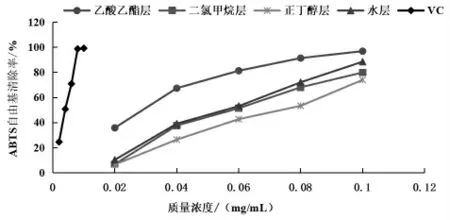
图1 苦树侧枝各极性部位提取物对ABTS 自由基的清除能力

表1 苦树侧枝各极性部位提取物对ABTS 自由基的清除能力
3.2 苦树侧枝不同极性部位提取物对DPPH 自由基的清除能力 苦树侧枝不同极性部位提取物及Vc 分别对DPPH 自由基的清除作用及线性回归求得各萃取物的IC50值如表2 和图2 所示,不同极性部位不同药物浓度间清除能力不同, 药效随药物浓度的升高而增强。相同浓度时,清除能力大小顺序为Vc>乙酸乙酯部位>二氯甲烷部位>正丁醇部位>水部位; 药物浓度为0.1 mg/mL 时,乙酸乙酯部位、二氯甲烷部位、正丁醇部位和水部位的清除率分别为75.797%、40.748%、38.603%和28.860%, 此浓度下各部位对DPPH 自由基清除率分别达到Vc 的83.3%、44.8%、42.4%和31.7%;可见乙酸乙酯部位的药效高于其他极性部位,其IC50为0.057 mg/mL,二氯甲烷部位和正丁醇部位IC50值分别为0.119、0.133 mg/mL, 水部位的药效最弱,4 个部位间IC50差异显著。
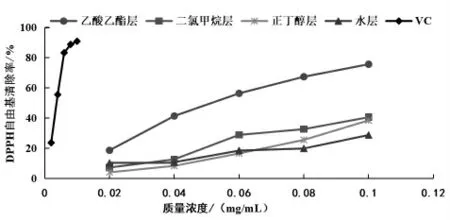
图2 苦树侧枝各极性部位提取物对DPPH 自由基的清除能力

表2 苦树侧枝各极性部位提取物对DPPH 自由基的清除能力
3.3 苦树侧枝不同极性部位提取物对铁的还原能力 通过普鲁士蓝法检测铁还原能力, 结果如表3 和图3 所示, 苦树侧枝不同极性部位均表现出一定的铁还原能力,且具有明显的量效关系。乙酸乙酯部位的铁还原能力最强, 当药物浓度为3.0、4.0、5.0 mg/mL 时,乙酸乙酯部位的铁还原力逐渐升高,分别为1.468、1.885 和2.099,此时对铁的还原力分别达到Vc 最高浓度0.5 mg/mL 时铁还原力的64.9%、91.7%、92.8%, 说明苦树侧枝乙醇提取物的乙酸乙酯萃取部位较高浓度给药时,对铁还原能力与Vc 相当,铁还原能力强;当药物浓度为5.0 mg/mL 时,二氯甲烷部位、正丁醇部位和水部位的铁还原力分别为0.974、0.665 和0.606, 此浓度下各部位的铁还原能力分别达到Vc 最高浓度时铁还原力的43.1%、29.4%和26.8%。 各极性部位药效大小顺序为乙酸乙酯部位>二氯甲烷部位>水部位>正丁醇部位, 对应的A0.5值依次为1.115、2.345、3.893、4.086 mg/mL,各极性部位A0.5数值间差异显著。
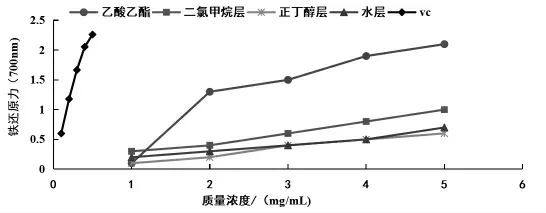
图3 苦树侧枝各极性部位提取物的铁还原能力
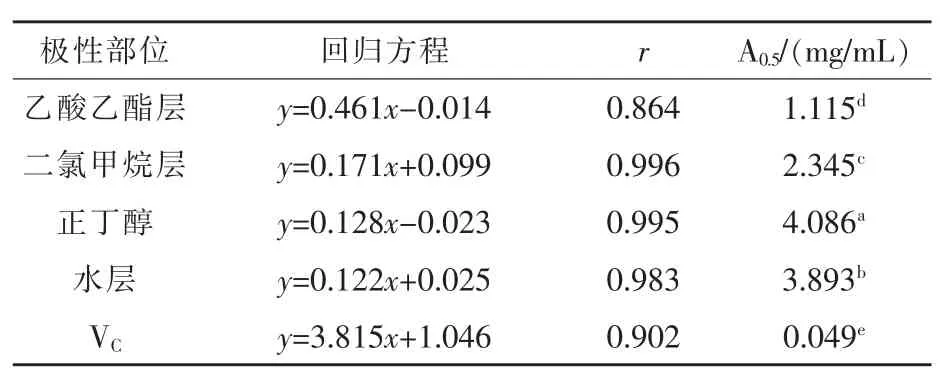
表3 苦树侧枝各极性部位提取物的铁还原能力
3.4 苦树侧枝各极性部位提取物抗肿瘤活性试验 本试验采用MTT 法来测定苦树侧枝乙醇提取物不同极性部位的抗肿瘤活性, 结果如图4 所示, 不同极性部位对人肺癌细胞A549 的增殖均存在一定的抑制作用, 就同一极性部位不同药物浓度来看,随药物浓度的增加抑制效果增强。从不同极性部位来看,正丁醇部位的抑制效果最强,在200 μg/mL 浓度时抑制率达到69.764%, 此浓度下抑制率与浓度为100 μg/mL 的抑制率差异显著, 且较其他不同部位该浓度处理均存在显著差异, 此极性部位的IC50为100.642 μg/mL;4 个极性部位中, 二氯甲烷部位的抗肿瘤活性排在第2位,IC50为178.089 μg/mL。 乙酸乙酯部位200 μg/ml 浓度的抗肿瘤活性显著高于100、50 μg/mL 浓度, 后两个浓度间差异不显著; 除乙酸乙酯部位外,其余3 个不同极性溶剂部位,均随着药物浓度的增加对应的抗肿瘤活性随之增加, 且3 个不同浓度的抗肿瘤活性均存在显著差异。
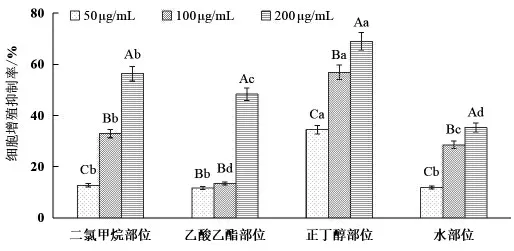
图4 苦树侧枝不同极性部位抗肿瘤活性
4 讨论与结论
抗氧化剂可通过清除自由基及提高抗氧化酶活性等途径发挥抗氧化作用, 从而产生疾病预防和治疗作用,对健康尤为重要(刘贺等,2021)。 本研究通过ABTS 法、DPPH 法和普鲁士蓝法对苦树侧枝乙醇提取物4 个不同极性部位萃取物的抗氧化活性进行了测定分析,结果显示,苦树侧枝各极性部位抗氧化能力存在差异; 研究发现乙酸乙酯部位的DPPH 自由基清除能力、ABTS 自由基清除能力,以及铁的还原能力均强于其他部位;当质量浓度达到0.1 mg/mL 时, 对ABTS 自由基的清除率可达96.981%, 其次为二氯甲烷和正丁醇部位,二者的抗氧化能力差异不显著;水部位的抗氧化能力最弱; 说明苦树侧枝乙酸乙酯萃取部位的抗氧化成分或含量较其他萃取部位要高。 韵小娟等(2012)研究发现,厚皮树的树皮不同极性部位以乙酸乙酯提取部位的抗氧化活性效果最强;夜香牛全草不同极性部位的抗氧化研究结果也与本文一致(韦志英等,2020);而在黄秋葵花不同极性部位的抗氧化报道中, 以水相提取部位的效果最佳(郭溆等,2018);金英善等(2008)研究表明,苦树不同溶剂的提取物均具一定的抗氧化活性,其中水提取物对超氧化阴离子的清除能力高于乙醇提取物和70%甲醇提取物。 可见,不同植物物种,其最优的抗氧化效果,随提取溶剂的极性变化而表现不同。 研究表明,苦树乙醇提取物乙酸乙酯萃取部位化学成分以生物碱为主; 生物碱类成分也有抗氧化作用(张秋裕等,2020;邱丹缨等,2015; 赵文娜等,2013), 苦树侧枝提取物中起抗氧化作用的化合物可能以生物碱类成分为主, 具体药效成分有待进一步研究。 Yin 等(2009) 对苦树茎甲醇提取物的不同极性部位(水、正己烷、乙酸乙酯和正丁醇)的抗氧化活性进行了研究, 发现乙酸乙酯萃取物对羟自由基的清除能力最高,达到53.49%,低于试验中阳性对照的清除率96.15%; 该报道的清除率数值与本研究有一定差距,可能与原料药材部位,或者使用的提取溶剂不同有关。
苦树具有抑制肿瘤细胞活性,Kwon 等(2018)用MTT 法,发现从苦树茎中分离纯化得到的3 个生物碱对人卵巢癌细胞(A2780、SKOV3)具显著抑制活性;Zhao 等(2019)发现从苦树茎中分离鉴定的三萜化合物对人肝癌细胞(HepG2、Hep3B)具良好抑制效果;Xu 等(2016)发现苦树茎中三萜化合物对人胃癌高转移细胞(MKN-28)具有良好的抑制活性,与阳性对照顺铂活性相当。肺癌是发病率和死亡率增长最快, 对人群健康和生命威胁最大的恶性肿瘤之一, 其中又以非小细胞肺癌(A549)最为多见(吕汪霞等,2005)。 本试验以人肺癌细胞(A549)为试验材料,用苦树侧枝乙醇提取物不同极性部位提取物进行多浓度梯度处理,结果表明, 苦树侧枝提取物对A549 细胞的增殖有显著抑制作用, 且随浓度的升高抑制效果不断增强, 不同极性部位的抑制率大小顺序为正丁醇>二氯甲烷>乙酸乙酯>水部位, 正丁醇部位对A549 的 抑 制 率 为69.764%,IC50为100.642 μg/mL; 在三脉菝葜的正丁醇部位对A549 的抑制效果报道中, 其IC50值为548.789 μg/mL (鲁遇,2019);Yin 等(2009)对苦树茎甲醇提取物的不同极性部位(水、正己烷、乙酸乙酯和正丁醇)的抗肿瘤活性进行研究, 发现正丁醇部位对人胃癌细胞(NCI-N87)具有明显的抑制作用而对人肾上皮细胞无毒性作用;李慧等(2019)研究中药茜草的抗肿瘤活性报道中提及, 茜草根对肝癌细胞(HepG2)的抑制效果最好,抑制率为52.23%,高于顺铂阳性对照的43.11%。 可见,本研究结果与Yin 等(2009)的研究结论具有相似性,从与有关报道的数据比对来看, 苦树正丁醇部位对人非小细胞肺癌具有较高的抑制活性, 值得进一步深入研究。
综上,苦树侧枝乙醇提取物不同极性部位的抗氧化及抗肿瘤活性存在差异,本研究明确了乙酸乙酯部位的抗氧化活性最强,试验中乙酸乙酯部位高浓度处理对ABTS 自由基清除能力以及铁还原能力与VC相当; 此外发现正丁醇部位的抗人肺癌细胞(A549)活性最强,药效较好。 本研究结果可为苦树资源的合理开发和利用提供科学依据。

