NO 诱导IAA 和O2·-积累于侧根尖端促进水稻侧根生长
朱雄梅,蔡慧楠,刘瑞琪,林佩锦,郞双怡,黄悦, 邓舒琪,莫亿伟*,金晨钟*
(1. 湖南人文科技学院农田杂草防控技术与应用协同创新中心,湖南 娄底 417000;2. 绍兴文理学院生命科学学院,浙江 绍兴 312000)
植物根系主要由两部分组成,一种起源于胚根的初生根,另一种在主根上形成侧根及生长于成熟组织的不定根。侧根和根毛的形成均受到多种植物激素调控[1-2],特别是生长素(IAA)在侧根的起始分化和形成中起着关键作用[3],而根系的IAA 源于地上部分向根部运输,当IAA 向根部运输增多时则利于更多侧根形成[4];当IAA 极性运输受阻,侧根的数量则显著下降[5]。一氧化氮(Nitric oxide,NO)在参与植物逆境调节和侧根发育中均起着重要作用,植物体内的NO 合成有两种途径,一种是依赖亚硝酸还原途径依靠硝酸还原酶1(NIA1) 和硝酸还原酶2(NIA2),另一种是依靠L-精氨酸的氧化途 径[6-7]。有研究表明,提供外源NO 供体硝普钠(Sodium nitroprusside,SNP)时,可使番茄侧根原基及侧根数量显著增多[8];当受NO 合成酶(NOS)抑制剂(N’-硝基-L-精氨酸甲酯盐酸盐,L-NAME)处理时,根系NO 含量显著降低并抑制侧根形成[9]。基于IAA 和NO 在侧根形成过程中均起到重要的调控作用,但这两种信号物质相互调节机制尚未弄清,有的研究认为NO 是IAA 的上游信号物质,因为在拟南芥叶片发育中发现,NO 可调控IAA 极性运输输出载体PIN1 蛋白积累于叶原基处,从而促进叶片形成[10-11];有的研究则认为NO 是IAA 的下游信号物质,因为用NOS 抑制剂L-NAME 或NO 清除剂(2-(4-羧基苯基)-4,4,5,5-四甲基咪唑啉-1-氧基-3-氧化物钾盐,cPTIO)处理后可抑制IBA 对侧根的诱导,且NAA 可通过诱导NO 的合成促进番茄侧根发育[12]。此外,活性氧(Reactive oxygen species, ROS)作为一种信号分子,在植物生长发育和激素信号调控中起着重要作用,如ROS 增多也可促进侧根及根毛形成[13-14]。由此说明,IAA、NO和O2·-在调控侧根形成过程中均有着重要作用,但前人的相关研究结果主要来源于双子叶模式植物拟南芥等,在水稻等主要农作物则研究较少。前人为了更直观地探讨IAA 定位和功能的关系,有研究发现,DR5 比天然的IAA 反应元件(AuxREs)具有更强的IAA 反应能力,表达活性可增加5~10 倍[15], 以DR5 为启动子与报告基因重组,构建成IAA 响应报告基因DR5::GUS,转入植物体获得转基因植株,已成为研究IAA 的定位及其作用的良好工具[16],利用DR5::GUS 报告基因研究IAA 的分布已在拟南芥[11]、水稻[17]和棉花[18-19]等多种植物得到应用。水稻是重要的粮食作物,侧根形成的水平直接影响水稻植株对养分的吸收能力,本研究以DR5-GUS标记转基因水稻为材料,深入探讨IAA、NO 和O2·-对水稻侧根形成的影响,以期提高水稻根系的养分利用效率。
1 材料与方法
1.1 实验材料和处理
DR5::GUS 标记的转基因水稻(Oryza sativa L.)由华中农业大学王学路教授馈赠,SNP、NO 合成酶抑制剂(L-NAME)、2-(4-羧基苯基)-4,4,5,5-四甲基咪唑啉-1-氧基-3-氧化物钾盐(cPTIO)、NO 荧 光 探 针(5,6-Diaminofluorescein diacetat,DAF-2DA)、IAA 检测的DR5::GUS 报告基因染色液均购自生工生物工程(上海)股份有限公司。水稻种子浸种和催芽后,选择种子根长约为0.5 cm 生长一致的幼苗,置于含两层滤纸的培养皿中,加入1/50 MS 微量元素培养溶液(以防单盐毒害),保持根系置于培养液中进行相应的处理。
1.2 NO 供体及清除剂对水稻种子根根系生长的影响
为研究NO 供体及NO 清除剂对水稻种子根根系生长的影响,设计了如下三组试验。1)为了探讨外源NO 供体对侧根形成的影响,设计在1/50 MS 微量元素培养溶液中分别加入0(对照)、5、10、15、20 和25 μmol/L SNP 的处理。2)为了探讨NO 合成酶抑制剂对侧根形成的影响,设计在1/50 MS 微量元素培养溶液中分别加0(对照)、50、100、200、400、800 μmol/L NO 合成酶抑制剂的处理。3)为了探讨NO 清除剂对侧根形成的影响,设计在1/50 MS 微量元素培养溶液中分别加0(对照)、50、100、200、400、800 μmol/L cPTIO 的处理。
所有处理组均置于光照培养箱中,每个处理设置4 个生物学重复,每个培养皿放置8 粒种子。光照培养箱的温度设置为28 ℃,光照强度为 500 μmol/(m2·s),每天13 h 光照,11 h 黑暗,相对湿度为85%。每天补充相应溶液,在处理的第3 d和第5 d,分别测量初生根、侧根、冠根的长度及数量。
1.3 NO、IAA 和O2·-在侧根起始部位的定位观察
1.3.1 NO 染色 经上述处理后,第3 d 剪取开始出现侧根生长的初生根,参考Sánchez-Vicente 等[10]的方法,用100 mmol/L pH7.2 的磷酸钠缓冲液配制成10 μM DAF-2DA 溶液,在25 ℃黑暗条件下对根系染色30 min,再用ddH2O 浸泡3 次,每次5 min,以洗掉材料表面的染料,置于显微镜下观察并照相。
1.3.2 GUS 染色 参考胥华伟[20]等用GUS 染色法确定IAA 在侧根的定位,具体方法为根系材料用GUS 染色液(100 mmol/L pH7.2 磷酸钠缓冲液、0.5 mmol/L 高铁氰化钾、0.5 mmol/L 亚铁氰化钾、1.0 mmol/L X-gluc 和2.0% DMSO)在37 ℃染色2 h 后,经ddH2O 浸泡3 次,每次5 min,以洗掉材料表面的染料,置于显微镜下观察并照相。
1.3.3 NBT 染色 将根系材料置于NBT 染液中(100 mmol/L pH7.2 磷酸钠缓冲液,NBT 浓度为0.1mg/mL), 室温染色1.5 h,倒掉染色液,再用ddH2O 浸泡3次,每次5 min,以洗掉材料表面的染料后,置于显微镜下观察并照相。根据染色的程度判断各处理对NO、IAA 和O2·-在侧根起始部位分布的影响。
1.4 SNP 和NO 合成酶抑制剂处理对NO 形成相关基因表达水平的检测
取上述不同SNP 及NO 合成酶抑制剂处理3 d的幼苗初生根(基部1.5 cm 内能形成侧根的部分),通过Takara RNA 提取试剂盒提取RNA,反转录成cDNA,-20 ℃保存备用。参考Zhou 等[21]方法,利用实时荧光定量PCR 分析与NO 合成相关的硝酸还原酶1(OsNIA1)和硝酸还原酶2(OsNIA1)表达情况,以水稻Actin1 作为内参基因OsActin1 (LOC_Os03g50890),具体引物设计如下:OsNIA1 引物为:F:5′-CCAATTCTTTCATCGTGTTCT-3′,R:5′-CATG CAGCATTTCGTTTCT-3′;OsNIA2 引物为:F:5′-AC TGGTGCTGGTGCTTCTGG-3′,R:5′-CGGCTGGG TGTTGAGGGACT-3′;Actin1 引物为:F:5′-CAACA CCCCTGCTATGTACG-3′,R:5′-CATCACCAGAGTC CAACACAA-3′。荧光定量PCR 试剂盒为Thermo Scientific DyNAmo ColorFlash SYBR Green qPCR Kit (Thermo),仪器为Stratagene Mx3005P 荧光定量PCR 仪,反应体系及条件参照试剂盒说明书进行。以上实验至少重复5 次,结果用平均值±SD 表示,用SPSS16.0 软件进行单因素方差分析。
2 结果与分析
2.1 不同浓度SNP 处理对水稻初生根长度及侧根数量的影响
从表1 可知,SNP 处理浓度为5 μmol/L 时,在处理后的第3 d 和第5 d,初生根长、侧根和冠根的数量与对照相比无显著差异(P >0.05);当SNP处理浓度达10 μmol/L 以上时,随着SNP 处理浓度的增加,初生根长度、侧根数量和冠根数量也逐渐增大,各处理初生根长度、侧根数量及冠根数量均显著大于对照处理。其中以SNP 处理为20 μmol/L时效果最佳,在处理后的第3 d,初生根长度、侧根数量和冠根数量分别比对照处理提高59.95%、26.89%和67.80%,均达显著性差异(P <0.05);在处理后的第5 d, 初生根长度、侧根数量和冠根数量分别比对照处理提高28.04%、25.37%和65.49%,均达显著性差异(P <0.05)。但当SNP 浓度达25 μmol/L 时,与20 μmol/L 的使用浓度相比,对初生根长度、侧根数量及冠根数量不再有显著促进作用(P >0.05),结果表明水稻幼苗根系生长需要NO信号的参与。

表1 硝普纳处理对初生根长度、侧根及冠根数的影响Table 1 The effects of SNP treatment on primary root length, lateral root and crown root number
2.2 NO 合成酶抑制剂对水稻初生根长度及侧根数量的影响
从表2 可知,当NO 合成酶抑制剂为50 μmol/L 时,在处理后的第3 d 和第5 d,初生根长、侧根和冠根的数量与对照相比无显著差异(P >0.05);当NO 合成酶抑制剂达100 μmol/L 以上时,随着NO合成酶抑制剂处理浓度的增加,初生根长度、侧根数量和冠根数量也逐渐减小。NO 合成酶抑制剂浓度达100 μmol/L 以上时,各处理的初生根长度、侧根数量及冠根数量均显著低于对照处理。其中以NO 合成酶抑制剂为800 μmol/L 时效果最佳,如在处理后的第3 d,初生根长度、侧根数量和冠根数量分别比对照处理降低30.96%、56.94%和55.05%,均达显著性差异(P <0.05);在处理后的第5 d 时,初生根长度、侧根数量和冠根数量分别比对照处理降低51.38%、64.12%和58.59%,也均达显著性差异(P <0.05)。结果表明NO 合成受到抑制时,也抑制了根系的生长。
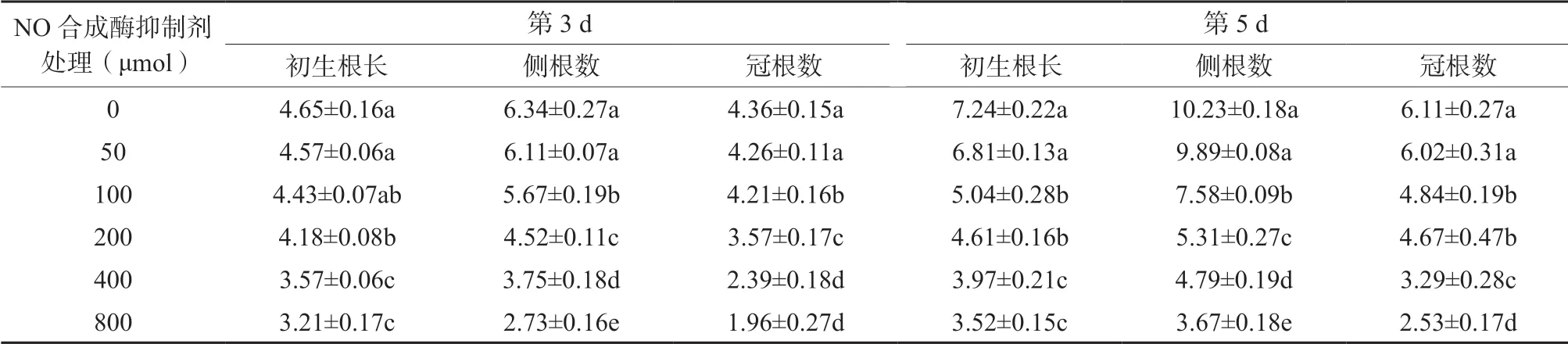
表2 NO 合成酶抑制剂处理对初生根长度、侧根及冠根数的影响Table 2 The effects of NO synthetase inhibitor treatment on primary root length, lateral root and crown root number
2.3 NO 清除剂处理对水稻初生根长度及侧根数量的影响
从表3 可知,当NO 清除剂为50 μmol/L 时,在处理的第3 d 和第5 d,初生根长、侧根和冠根的数量与对照相比无显著差异(P >0.05);当NO清除剂达100 μmol/L 以上时,随着NO 清除剂处理浓度的增加,初生根长度、侧根数量和冠根数量也逐渐减小。当NO 清除剂cPTIO 浓度达100 μmol/L 以上时,各处理的初生根长度、侧根数及冠根数均显著低于对照处理,其中以800 μmol/L NO 清除剂cPTIO 处理的效果最佳,如在处理后的第3 d,初生根长度、侧根数量和冠根数量分别比对照处理降低49.80%、56.26%和76.75%,均达显著性差异 (P <0.05);在处理后的第5 d 时,初生根长度、侧根数量和冠根数量分别比对照处理降低56.67%、56.61%和55.41%,均达显著性差异(P <0.05)。结果表明,当根系的NO 受到cPTIO 清除后,初生根、侧根及冠根的生长均受到抑制作用。

表3 NO 清除剂处理对初生根长度、侧根及冠根数的影响Table 3 The effects of NO scavenger treatment on primary root length, lateral root and crown root number
2.4 SNP、NO 合成酶抑制剂及清除剂处理对侧根NO 分布的影响
从图1 可知,经SNP 处理后,结果发现NO 在根表皮及根内大部分细胞均有分布,主要集中分布于侧根形成部位和侧根根尖部分,且荧光强度越大,表示NO 含量越高。与对照相比,外源SNP 处理后,NO 荧光强度明显大于对照处理。受NO 合成酶抑制剂和清除剂处理后,染色程度明显下降。侧根清除处理后起始部位的NO 含量明显减少,且NO 的荧光强度最浅,侧根数量少而短(图1),结果表明当NO 积累减少,侧根数量下降。
2.5 SNP、NO 合成酶抑制剂及清除剂处理对侧根IAA 分布的影响
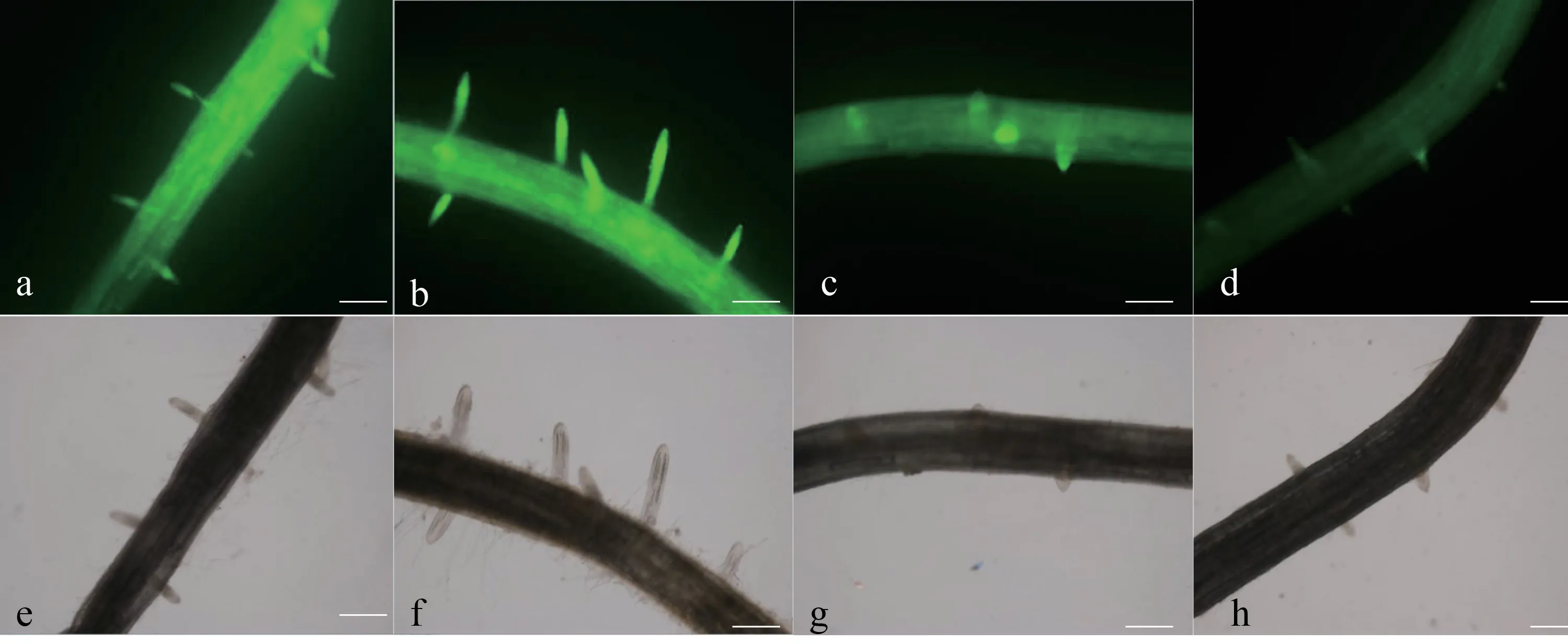
图 1 SNP、NO 合成酶抑制剂及清除剂处理对NO 分布的影响Fig. 1 The effects of SNP, NO synthetase inhibitor and scavenger treatments on NO distribution
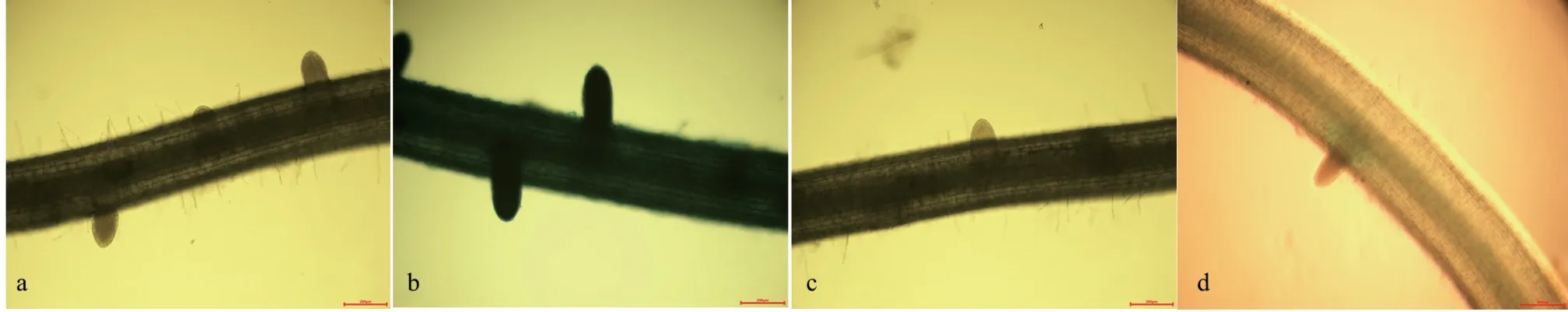
图 2 SNP、NO 合成酶抑制剂及清除剂处理对IAA 分布的影响Fig. 2 The effects of SNP, NO synthetase inhibitor and scavenger treatments on IAA distribution
从图2 可知,经SNP 处理后,通过对DR5:: GUS 标记水稻侧根起始部位染色,结果发现IAA主要分布在根的维管束部位,极性分布于侧根形成部位和侧根根尖部分,在初生根的维管束与侧根形成起始部位,明显看到染色较深,说明IAA 含量较多(图2),与对照相比,外源的SNP 处理后,染色程度明显大于对照处理。而受到NO 合成酶抑制剂和清除剂处理后,侧根数量减少,染色程度明显下降,以受NO 清除剂处理后,IAA 的GUS染色最浅,结果表明由初生根向侧根运输IAA 含量明显减少,IAA 极性积累于侧根起始形成部位,有益于侧根形成,当IAA 积累减少,侧根形成量显著下降。
2.6 SNP、NO 合成酶抑制剂及清除剂处理对侧根O2·-分布的影响
经SNP 处理后,用NBT 对水稻侧根的起始部位染色,结果发现O2·-主要分布在根的维管束部位,极性分布于侧根形成部位及侧根根尖部分,在初生根维管束与侧根形成起始部位,明显看到染色较深,表明O2·-含量较多(图3)。与对照相比,外源SNP处理后,染色程度明显大于对照处理。受到NO 合成酶抑制剂和清除剂处理后,O2·-染色程度明显下降。表明O2·-极性积累于侧根起始形成部位,有益于侧根形成,当O2·-积累减少时,侧根的形成量显著下降。
2.7 外源SNP 对OsNIA1 和OsNIA2 基因表达的影响
从图4 可知,随着SNP 处理浓度的增加,对基因OsNIA1 和OsNIA2 相对表达量的促进作用逐渐增大。当SNP 达10 μmol/L 以上时,各处理浓度均可显著提高OsNIA1 和OsNIA2 基因的表达(P <0.05)。如当SNP 浓度为15 μmol/L、20 μmol/L和25 μmol/L 时,OsNIA1 表达量分别比对照处理增 加 了107.65%、88.82% 和79.41%(P <0.05),OsNIA2 表达量分别比对照处理增加了109.36%、152.71%和146.31%(P <0.05)。表明外源SNP 能促进与NO 合成相关基因OsNIA1 和OsNIA2 的表达,且当SNP 浓度达到15 μmol/L 时,对OsNIA1诱导效果最好,而SNP 浓度超过20 μmol/L 时,对OsNIA2 诱导效果最佳。
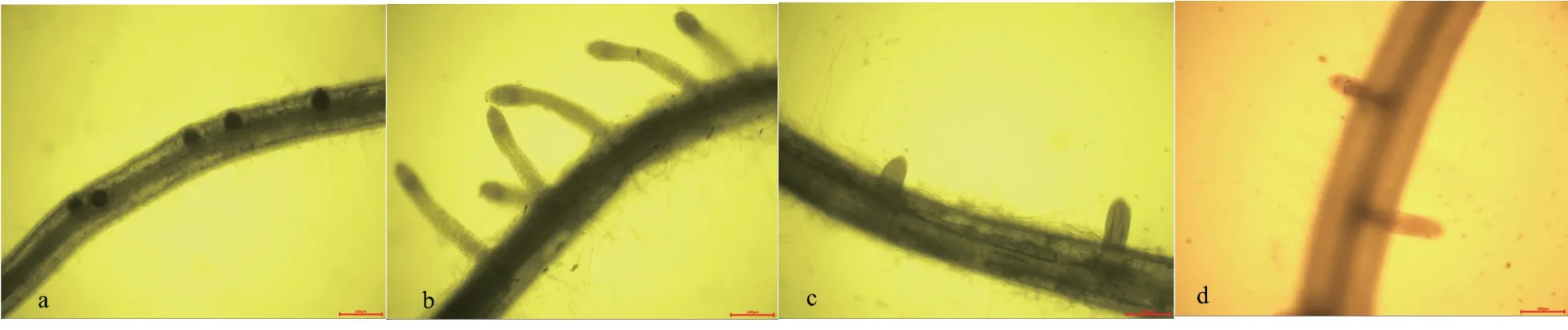
图 3 SNP、NO 合成酶抑制剂及清除剂处理对侧根O2·-分布的影响Fig. 3 The effects of SNP, NO synthetase inhibitor and scavenger treatments on O2·- distribution
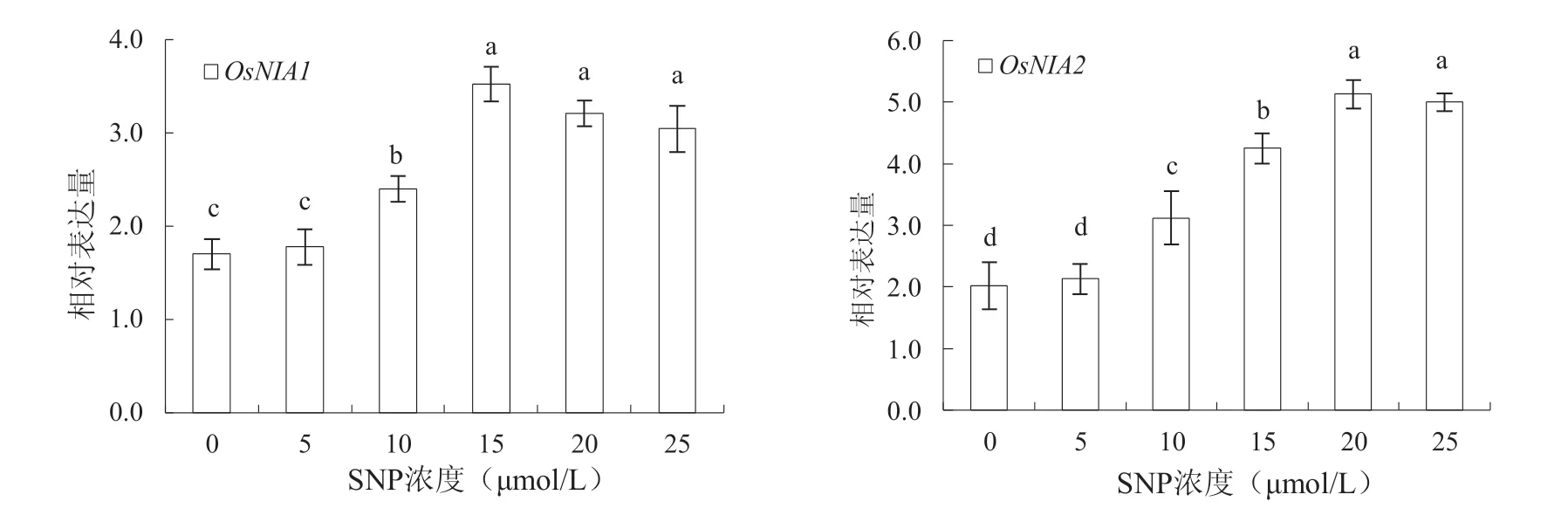
图4 SNP 处理对OsNIA1 和OsNIA2 基因表达的影响Fig. 4 The effect of SNP treatment on the expression of OsNIA1 and OsNIA2
2.8 外源NO 合成酶抑制剂对OsNIA1 和OsNIA2基因表达的影响
从图5 可知,随着NO 合成酶抑制剂处理浓度的增加,对基因OsNIA1 和OsNIA2 相对表达量的抑制作用逐渐增大。当NO 合成酶抑制剂达100 μmol/L 时,可显著抑制OsNIA1 表达(P<0.05),对OsNIA2 表达没有显著影响(P>0.05),当NO 合成酶抑制剂达200 μmol/L 时,可显著抑制OsNIA2 的表达(P<0.05),当NO 合成酶抑制剂浓度为800 μmol/L 时,对OsNIA1 和OsNIA2 的表达量受到的抑制作用最大,分别比对照下降63.85%和60.58%(P<0.05)。表明外源NO 合成酶抑制剂可抑制与NO 合成相关基因OsNIA1 和OsNIA2 的表达。
2.9 外源SNP 对NO 含量及O2·-产生速率的影响
从图6 可知,当SNP 处理浓度低于5 μmol/L时,对NO 的含量无促进作用,与对照相比无显著性差异(P >0.05)。当SNP 达10 μmol/L 以上时,随着SNP 处理浓度的增加,对NO 含量的促进作用也逐渐增大,如SNP 浓度为10 μmol/L、15 μmol/L、20 μmol/L 和25 μmol/L 时,NO 含量则分别比对照增加了45.99%、78.17%、96.43%和71.42%,均达显著性差异(P<0.05),其中当SNP 浓度为20 μmol/L处理时,NO 含量最高,当浓度达25 μmol/L 时,NO 含量又有所下降。进一步探究SNP 处理对侧根形成部位O2·-产生速率的影响时发现,当SNP 处理浓度低于5 μmol/L 时,对O2·-的产生速率无促进作用,与对照相比无显著性差异(P >0.05)。当SNP 达10 μmol/L 以上时,随着SNP 处理浓度增加,对NO 含量和O2·-产生速率的促进作用也逐渐增大,如在SNP 浓度为10 μmol/L、15 μmol/L、20 μmol/L和25 μmol/L 时,O2·-产生速率分别比对照增加了64.07%、131.13%、208.98%和174.65%,均达显著性差异(P<0.05),当SNP 浓度为20 μmol/L 处理时,O2·-产生速率最大,当浓度达25 μmol/L 时,O2·-产生速率又有所下降。
3 讨论
3.1 水稻侧根形成需要NO、IAA 和O2·-极性积累于侧根起始部位

图 5 NO 合成酶抑制剂处理对OsNIA1 和OsNIA2 基因表达的影响Fig. 5 The effect of NO synthetase inhibitor treatment on the expression of OsNIA1 and OsNIA2

图 6 SNP 处理NO 含量及O2·-产生速率的影响Fig. 6 The effect of SNP treatment on NO content and O2·-generation rate
本研究结果证实,水稻侧根形成需要NO 信号调控,且需要NO、IAA 和O2·-极性积累于侧根的起始部位。当有外源的SNP 供体时,NO 在侧根形成部位的荧光强度与对照组相比显著增强,当受到NO 合成酶抑制剂或NO 清除剂处理后,水稻侧根部位的NO 荧光强度显著减弱,同时IAA 和O2·-在侧根起始部位的积累也显著降低,表明侧根数量和长度均受到显著抑制,当清除NO 时,侧根的数量显著下降[22]。研究结果表明,O2·-和IAA 极性积累于侧根起始部位受到NO 信号调节,受NO 供体SNP 处理后,能够促进IAA 和O2·-极性积累于侧根起始部位及根尖,从而诱导侧根的发生频率和快速生长。该研究结果与前人在拟南芥中发现IAA 在侧根初始细胞的选择、根原基发育和侧根分生组织激活等过程中均起到关键作用的结论基本一致[23]。但这三种信号物质如何选择主根中的特定中柱细胞作为侧根原基并促进侧根发育的具体机制,还需深入研究。
3.2 NO 促进IAA 和O2·-积累于侧根起始部位利于侧根发育
通过对DR5-GUS 标记转基因水稻IAA 进行GUS 染色发现,IAA 主要分布在初生根中柱部位和侧根根尖,而在初生根皮层细胞的含量很少,在无侧根发育部位甚至无极性积累。当NO 供体SNP 浓度增加时,侧根形成部位NO 含量也随之增加,同时,IAA 的GUS 染色显著加深,表明侧根形成部位IAA 的积累也相应提高。因此,该研究结果证实了水稻侧根发生确实需要IAA 极性积累于侧根起始细胞才有利于侧根的快速生长,这与前人的研究结果相似[24],且本研究结果也说明IAA 位于NO 的下游信号物质。水稻侧根的形成需要NO 调控IAA极性积累于侧根起始部位,NO 信号是促进IAA 极性运输还是加强了IAA 从头合成再向侧根原基的极性积累,还需深入研究。
此外,水稻根受外源NO 供体SNP 处理后,随着NO 含量增加,侧根形成部位及根尖的O2·-极性积累也增加,这与前人发现NO 在调控ROS 在植物体内的代谢平衡有着重要作用的结论一致[25-26]。且有研究表明,NO 通过ONOO-来调控H2O2的信号,这与前人发现水稻种子萌发时受外源O2·-清除剂处理则可显著抑制初生根生长的结果相似[27-28]。因为已有研究发现,O2·-是植物生长的重要调节信号物质,在生长活跃区都有O2·-产生,当O2·-积累后可诱导SOD 活性增加,SOD 将O2·-转化成H2O2,再在O2·-和H2O2信号下诱导侧根的形成[29]。而且O2·-经SOD 作用产生H2O2的同时也形成.OH 时,.OH可促进细胞壁木糖和果胶的裂解,从而促进细胞壁松动,进而促进细胞生长,当.OH 形成途径受阻时,玉米根尖伸长区生长明显受到抑制[30]。所以侧根形成及快速生长均需O2·-信号的参与。当水稻幼苗NO 合成受到抑制或受清除时,O2·-在侧根的积累量显著下降,导致侧根形成受阻,这与前人在NO 促进其他植物不定根形成的研究结果类 似[31]。当超表达O2·-供体烟酰胺腺嘌呤二核苷酸磷酸氧化酶(Respiratory burst oxidase homologue, Rboh) 时,拟南芥的侧根数量明显增多,当Rboh基因表达受到抑制或突变时,侧根数量显著减少,当利用外源的KI 清除O2·-后,侧根数量也显著降低[14],说明侧根形成也需要O2·-积累于侧根的起始部位。Orman-Ligeza 等[14]进一步研究表明,外源IAA 和NAA 处理可显著提高Rboh基因家族表达、Rboh 蛋白在侧根原基积累可促进H2O2含量增加,从而诱导侧根形成,且外源H2O2还能部分恢复生长素运输aux1 和lax3 双突变体的侧根数量,由此说明O2·-作为IAA 下游信号物质调控侧根的形成,或存在着互作与协同关系[32]。因此,在NO 调控水稻侧根形成过程中,可能是NO 先促进IAA 极性积累,再促进O2·-极性积累,从而利于侧根形成。但水稻侧根形成过程中,NO 信号调控IAA 和O2·-极性积累并促进侧根形成的具体生理与分子机制还需要深入研究,特别是中侧根原基起始细胞的选择与NO 调控信号的关系也需深入探讨。
4 结论
1)水稻幼苗侧根形成需要NO 信号参与,当提供外源的NO 供体SNP 时,可显著促进IAA 和O2·-极性积累于侧根原基起始细胞和侧根的尖端,从而促进侧根形成。当提供外源NO 合成受到抑制和清除剂时,降低了NO 在侧根起始部位的积累,也显著降低了侧根数量。
2)在水稻幼苗侧根形成过程中,IAA 可能是NO 的下游信号物质,O2·-则可能是IAA 的下游信号物质,他们共同调控侧根的形成。

