基于生物活性导向分离及灰色关联分析的新疆紫草抑菌物质基础研究
毛 艳,王新堂,贺金华
新疆维吾尔自治区药物研究所,乌鲁木齐 830004
新疆紫草[Arnebia euchroma(Royle)Johnstn]又名软紫草,为紫草科多年生草本植物,现收载于《中华人民共和国药典》(以下简称《中国药典》)2020 年版一部[1],具有清热凉血、活血解毒、透疹消斑的功效。中国药用紫草中的70%产自新疆。新疆紫草主要分布于新疆的天山南北坡和西藏的西部等地,是新疆维吾尔族和哈萨克族民间常用药材。据文献报道,紫草中的萘醌类化合物具有很强的抑菌活性,但对其抑菌药效物质的基础研究仅局限于评价紫草提取物或某几种紫草色素(如β,β′-二甲基丙烯酰紫草素、紫草素等[2-5])的抑菌药效机制,对其关键药效组分、虽不是药效组分但起到协同作用的成分和无效成分的研究未见报道。
本研究在前期工作的基础上[6-8],采用高效液相色谱法(high performance liquid chromatography,HPLC)建立新疆紫草不同极性溶剂提取物的指纹图谱,用灰色关联度分析[9-13]对新疆紫草的特征性指纹峰和抑菌作用进行关联,探讨其谱-效关系,从而推测发挥抑菌作用的主要药效物质。借鉴已报道方法[14-15],对抑菌谱-效关系中关联度较高的成分进行验证,从新疆紫草提取物中分离得到抑菌目标成分并获得不含目标成分的阴性样品,将所有样品的抑菌药效进行等效性对比,以有效辨识新疆紫草的抑菌活性药效物质。研究过程强调把脂溶性成分作为一个整体,其目标成分的谱-效关系始终与脂溶性成分整体进行比较,以体现中医药整体观、系统观的特点和优势[16-17],为进一步探讨新疆紫草的药效物质基础提供实验依据,为开发新的广谱抑菌活性药物奠定研究基础。
1 仪器与材料
1.1 仪器
UltiMate 3000型高效液相色谱仪(包括二极管阵列检测器、四元梯度泵、在线脱气机、自动进样器、柱温箱、4~40℃恒温箱)购自美国Thermo Scientific Technologies公司;Waters 2545制备型液相色谱仪(美国Waters公司);CPA225D 型电子天平(德国Sartorius公司);FD-1A-50型冷冻干燥机(上海比朗仪器制造有限公司)。
1.2 试药
对照品:紫草素(批号110769-200405),乙酰紫草素(批号1601105,质量分数为99.9%),异丁酰紫草素(批号170223,质量分数为98.91%),均购自深圳健竹生物科技有限公司;β-乙酰氧基异戊酰紫草素(批号Must-18071610,质量分数为98.44%),β,β′-二甲基丙烯酰紫草素(批号Must-1701201,质量分数为98.60%),均购自成都曼思特生物科技有限公司。Mueller-Hinton水解酪蛋白琼脂培养基(杭州微生物制品有限公司)。
新疆紫草(产地为新疆八音布鲁克,野生,采收日期为2016年8月),由新疆维吾尔自治区药物研究所何江研究员鉴定为紫草科植物新疆紫草[Arnebia euchroma(Royle)Johnst.]的干燥根。
1.3 菌株
金黄色葡萄球菌(ATCC 25923)、大肠杆菌(ATCC 25922)、铜绿假单胞菌(ATCC 27853),均购自中国食品药品检定研究院。
2 方法与结果
2.1 溶液的制备
2.1.1 混合对照品溶液的制备 精密称取对照品各适量,加甲醇溶解并稀释至刻度,摇匀,制成紫草素、乙酰紫草素、异丁酰紫草素、β-乙酰氧基异戊酰紫草素、β,β′-二甲基丙烯酰紫草素质量浓度分别为0.022 2、0.175 5、0.080 6、0.037 7、0.140 8 mg·m L-1的混合对照品溶液。
2.1.2 供试品溶液的制备 分别称取新疆紫草各50 g,粉碎,分别加入500 m L 石油醚(60~90℃)及体积分数为95%、75%、50%、30%的乙醇溶液和水,加热回流提取2次(60℃),每次1.5 h,过滤,合并滤液,滤液减压浓缩至50 m L,备用,得6种不同极性溶剂提取物,样品编号为S1~S6。精密量取各新疆紫草不同极性溶剂提取物0.4 m L,置于10 m L 量瓶中,加入体积分数为50%的甲醇溶液超声使溶解,定容,摇匀,即得各新疆紫草供试品溶液。经0.45μm微孔滤膜过滤,以建立指纹图谱。
2.2 HPLC指纹图谱的建立
2.2.1 色谱条件 色谱柱:Agilent TC-C18(250 mm×4.6 mm,5μm);流动相:乙腈(A)-1 m L·L-1甲酸溶液(B);梯度洗脱:0~15 min,55%~65%A;15~20 min,65%~70%A;20~25 min,70%A;25~25.5 min,70%~60%A;25.5~35 min,60%A;流速:1 m L·min-1;柱温:30℃;检测波长:275 nm;进样量:10μL。结果见图1。
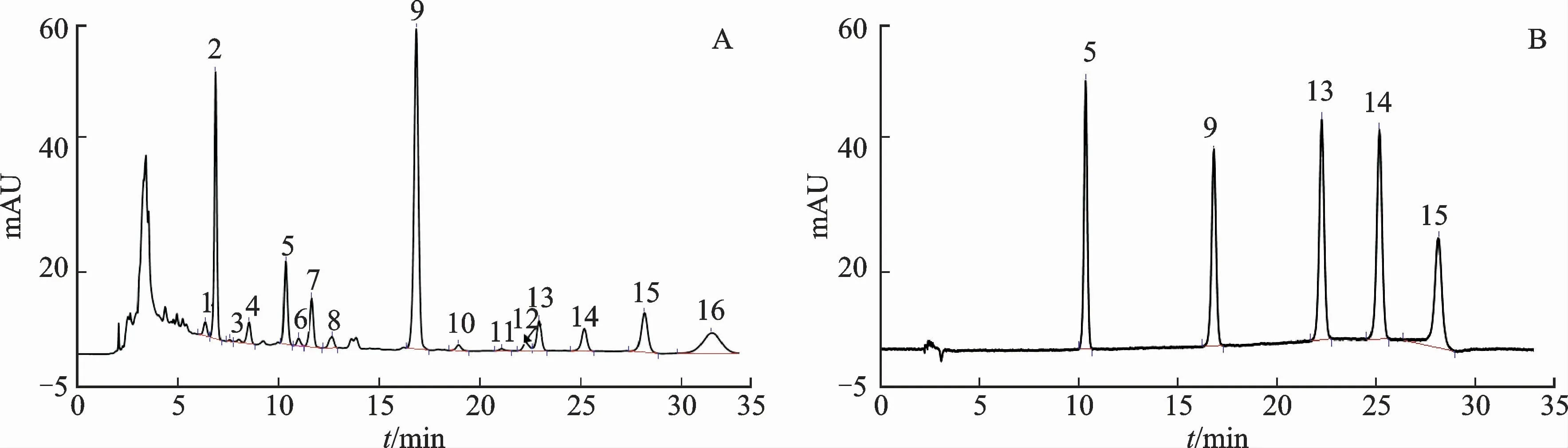
图1 新疆紫草S3样品和混合对照品的高效液相色谱图Fig.1 HPLC chromatograms of Arnebia euchroma S3 sample and mixed reference substances
2.2.2 方法学考察 分别取2.1.2 项下供试品溶液,参照2.2.1 项下条件进行指纹图谱方法学的考察。
精密度实验:16个共有峰相对保留时间RSD(n=6)<0.08%,相对峰面积的RSD(n=6)<2.99%,符合指纹图谱技术要求中精密度实验的有关规定(RSD<3%),表明仪器的精密度良好,符合指纹图谱的检测要求。
重复性实验:16个共有峰相对保留时间的RSD(n=6)<0.08%,相对峰面 积 的RSD (n=6)<4.85%,表明方法的重复性良好,符合指纹图谱研究技术的要求。
稳定性实验:结果表明,在0、4、8、12、24 h内16个共有峰相对保留时间的RSD(n=6)<0.17%,相对峰面积的RSD(n=6)<3.33%,表明供试品溶液室温放置24 h内稳定,表明该方法符合分析的要求。
2.2.3 共有峰的标定和特征峰的标定 建立新疆紫草6个不同极性溶剂提取物的HPLC 指纹图谱,结合前期研究结果[6-8],通过对照品比对指认5个共有峰,分别为紫草素、乙酰紫草素、β-乙酰氧基异戊酰紫草素、异丁酰紫草素、β,β′-二甲基丙烯酰紫草素。用相对保留时间标定共有峰16个,其中9号色谱峰(乙酰紫草素)的分离度和重复性均好、保留时间合适、特征性较强,因此将其作为指纹图谱的参照峰。结果见图2。

图2 新疆紫草不同极性溶剂提取物的指纹图谱Fig.2 Fingerprints of different polar solvent extracts of Arnebia euchroma
2.2.4 指纹图谱的生成及相似度评价 将经过积分处理的样品色谱图“AIA 文件”导入“国家药典委员会中药色谱指纹图谱相似度评价系统(2012版)”软件中,以样品S4的图谱作为参照图谱,设定时间窗为0.3 min,采用中位数法,按Mark峰进行自动匹配,生成对照指纹图谱,并进行相似度分析[9-11]。相似度评价结果见表1。
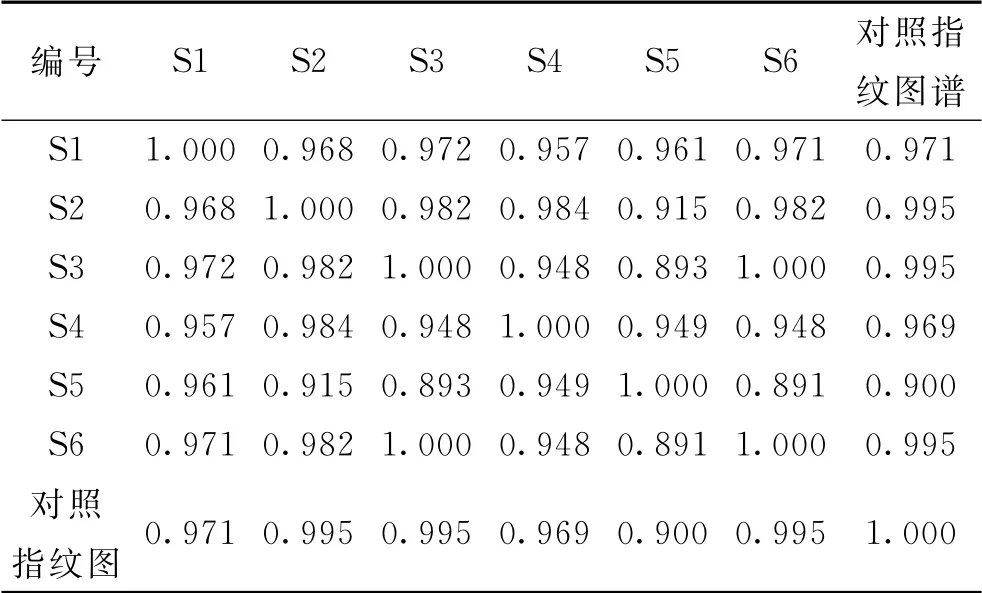
表1 新疆紫草不同极性溶剂提取物指纹图谱相似度的评价结果Tab.1 Similarity evaluation results of fingerprints of different polar solvent extracts in Arnebia euchroma
结果显示,6个样品的相似度较低,说明各新疆紫草不同极性溶剂提取物成分的差异较大,可以为新疆紫草抑菌谱-效关系的研究提供数据支持。
2.3 新疆紫草不同极性溶剂提取物体外抑菌活性有效部位的筛选
2.3.1 菌液的制备 Mueller-Hinton水解酪蛋白琼脂培养基是用于对生长较快的细菌进行药物敏感实验的标准培养基。测试菌要求:选择处于对数生长期的细菌,用生理盐水校正浓度至0.5 麦氏单位,即108cfu·m L-1备用。药敏纸片的制备:选择优质新华1号滤纸,用打孔器制成直径为6 mm 的圆形滤纸片。每200张1管,经120℃、2 h灭菌后备用。
2.3.2 抑菌测定方法 用无菌棉拭子蘸取菌液,在管壁内将多余菌液旋转挤去后在琼脂表面均匀涂布接种3次,再次旋转平板60°,最后沿平板内缘涂抹1周。平板在室温下干燥3~5 min,将药敏纸片贴在琼脂平板表面,纸片间的距离不小于24 mm,药敏纸片与平板内缘的距离大于15 mm。贴好纸片后,需在15 min内置于35℃培养箱内培养,孵育24 h后阅读结果。培养后取出平板,用游标卡尺测量抑菌圈的直径。根据抑菌圈的大小判断细菌对各组分的敏感性,抑菌圈越大表明抑菌活性越强。结果见表2。
表2 新疆紫草不同极性溶剂提取物抑菌活性的测定结果(±s,n=3)Tab.2 Antibacterial test results of different polar solvent extracts in Arnebia euchroma(±s,n=3)
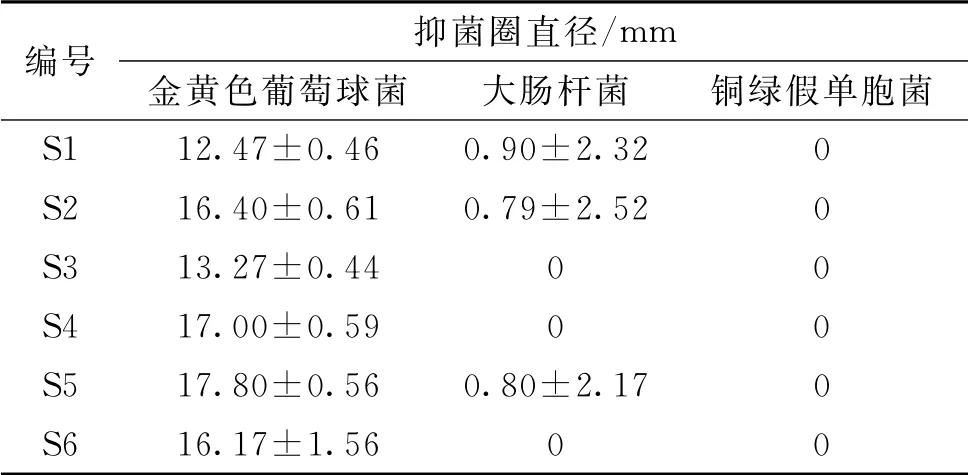
表2 新疆紫草不同极性溶剂提取物抑菌活性的测定结果(±s,n=3)Tab.2 Antibacterial test results of different polar solvent extracts in Arnebia euchroma(±s,n=3)
编号 抑菌圈直径/mm金黄色葡萄球菌 大肠杆菌 铜绿假单胞菌S1 12.47±0.46 0.90±2.32 0 S2 16.40±0.61 0.79±2.52 0 S3 13.27±0.44 0 0 S4 17.00±0.59 0 0 S5 17.80±0.56 0.80±2.17 0 S6 16.17±1.56 0 0
由表2可见,S1~S6号样品对金黄色葡萄球菌均有抑菌、杀菌作用,效果较好。S1、S2、S5号样品对大肠杆菌有抑菌、杀菌作用,但效果较差。S1~S6号样品对铜绿假单胞菌均无抑菌、杀菌作用。
2.4 新疆紫草不同极性溶剂提取物指纹图谱特征与抑菌作用的灰色关联度分析
用灰色关联分析法[12-16],对新疆紫草不同极性溶剂提取物的指纹特征峰与体外抑菌活性的相关性进行分析,计算16个共有特征峰与体外金黄色葡萄球菌抑菌效力和大肠杆菌抑菌效力的关联度,并对结果进行排序,得关联序,确定各成分对体外抑菌活性贡献大小的排序。结果见表3。
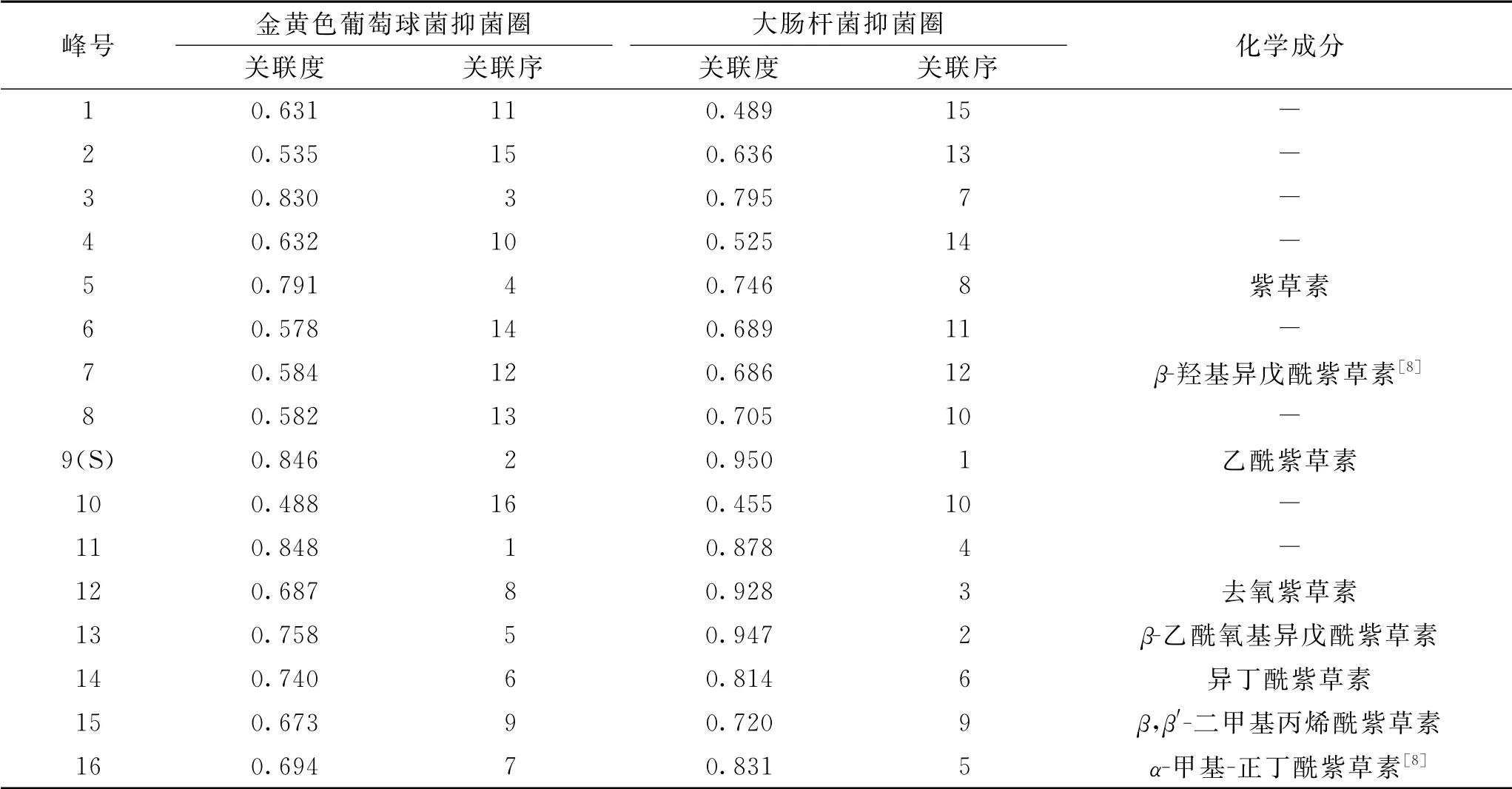
表3 共有峰与体外抑菌活性关联度的结果Tab.3 Correlation between common peaks and antibacterial activity in vitro
由以上结果可知,16个共有峰代表的化学成分中有15个与体外抑菌活性的关联度均大于0.55,说明新疆紫草的药效是多成分共同起效的结果。综合考虑16个共有峰峰面积的大小及体外抑菌活性的关联序,9、3、5号峰对应的化合物可能在新疆紫草发挥抑制金黄色葡萄球菌药效中发挥重要作用,9、13、12号峰对应的化合物可能在新疆紫草发挥抑制大肠杆菌药效中发挥重要作用,其他色谱峰对应的化合物可能也对新疆紫草提取物的抑菌药效有一定的贡献,今后将进行深入研究。其中9号峰(乙酰紫草素)、5号峰(紫草素)的抑菌作用较好,且易于敲除制备,可用于后续对药效物质的验证。
2.5 基于目标成分敲除的新疆紫草抑菌药效物质的辨识
2.5.1 样品的制备 根据2.4项下抑菌作用的灰色关联度结果,用制备高效液相色谱(preparative high performance liquid chromatography,prep-HPLC)分别在线敲除乙酰紫草素和紫草素,并收集相应阴性物质。Peek管的一端连接检测器,另一端用于收集洗脱液,当洗脱程序开始后,洗脱液经Peek管尾端流出并收集在棕色瓶A 中,当目标组分峰出现时,迅速转移至棕色瓶B 中,直至其洗脱完毕,再继续收集剩余洗脱成分至棕色瓶C 中,直至程序结束,合并棕色瓶A 和C中的物质,即为相应阴性物质,重复该步骤可将任意目标峰彻底敲除,并收集敲除后的剩余成分洗脱液[18-23]。最后将收集到的洗脱液合并,减压浓缩(-0.09 MPa,-50℃),冷冻干燥,得到固体粉末,用于后续体外抑菌活性的评价。
2.5.2 新疆紫草中乙酰紫草素和紫草素的含量 参见前期工作基础[6],新疆紫草中乙酰紫草素和紫草素的含量分别为10.690、0.526 mg·g-1。
2.5.3 在线敲除新疆紫草中乙酰紫草素及其阴性物质
2.5.3.1 prep-HPLC 色谱条件 色谱柱:YMCPack R&D ODS-A(250 mm×20 mm,5μm);流动相:甲醇(A)-水(B);梯度洗脱:0~16 min,80%A;16~16.01 min,80~95%A;16.01~24 min,95%A;24~24.01 min,95%~80%A;24.01~26 min,80%A;流速:17 m L·min-1;柱温:30℃;进样量:1 m L;检测波长:275 nm。
2.5.3.2 样品收集 4~15、19~28 min时的洗脱液为乙酰紫草素阴性物质,将两者合并,即为样品Y2。15.4~18.4 min时的洗脱液为目标峰乙酰紫草素,即为样品Y3。进行HPLC验证,结果见图3。分别收集约1 g新疆紫草提取液中的目标成分乙酰紫草素和阴性物质洗脱液,减压浓缩(-0.09 MPa,50℃),冷冻干燥,得到固体粉末,冷冻备用。
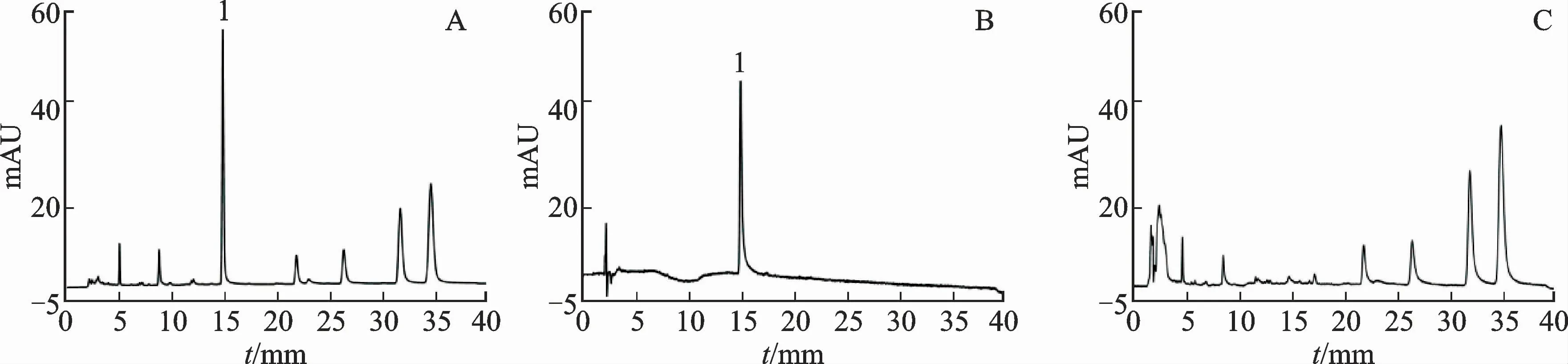
图3 乙酰紫草素目标峰及其阴性样品色谱图Fig.3 Chromatograms of acetyl shikonin’s target peak and its negative sample
2.5.4 在线敲除新疆紫草中的紫草素及其阴性物质
2.5.4.1 prep-HPLC 色谱条件 流动相:甲醇(A)-水(B);梯度洗脱:0~11 min,80%A;11~11.01 min,80~95%A;11.01~19 min,95%A;19~19.01 min,95%~80%A;19.01~20 min,80%A;流速:18 m L·min-1;柱温:30℃;进样量:1 m L;检测波长:275 nm。
2.5.4.2 样品收集 3.5~7.8、9.7~18.0 min 的洗脱液为紫草素阴性物质,将两者合并,即为样品Y4。8.0~9.5 min时的洗脱液为目标峰紫草素,即样品Y5。进行HPLC 验证,结果见图4。分别收集约1 g新疆紫草提取液中的目标成分紫草素和阴性物质洗脱液,减压浓缩(-0.09 MPa,50℃),冷冻干燥,得到固体粉末,备用。
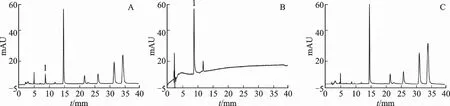
图4 紫草素目标峰及其阴性样品色谱图Fig.4 Chromatograms of shikonin's target peak and its negative sample
2.5.5 新疆紫草抑菌目标成分及其阴性物质体外抑菌活性测定
2.5.5.1 样品制备 新疆紫草提取物(Y1):根据2.1.2项下方法,将新疆紫草体积分数95%乙醇提取液浓缩为质量浓度为1 g·m L-1的溶液。
乙酰紫草素目标成分(Y3)及其阴性物质(Y2):分别将2.5.3.2项下固体粉末用0.4 m L 甲醇完全溶解,用纯化水定容至1 m L,混匀,即得。
紫草素(Y5)及其紫草素阴性物质(Y4):分别将2.5.4.2项下固体粉末用0.4 m L 甲醇完全溶解,用纯化水定容至1 m L,混匀,即得。
空白对照(Y0):取0.4 m L 甲醇,用纯化水定容至1 m L,混匀,即得。
乙酰紫草素对照品(Y6)和紫草素对照品(Y7):分别精密称取乙酰紫草素对照品和紫草素对照品适量,用0.4 m L甲醇完全溶解,用纯化水定容至1 m L,分别制成质量浓度为10.69、0.526 mg·m L-1的对照品溶液。
2.5.5.2 抑菌活性测定方法 按照2.3.2项下方法进行测定。结果见表4。
表4 抑菌活性测定结果(±s,n=3)Tab.4 Antibacterial test results(±s,n=3)
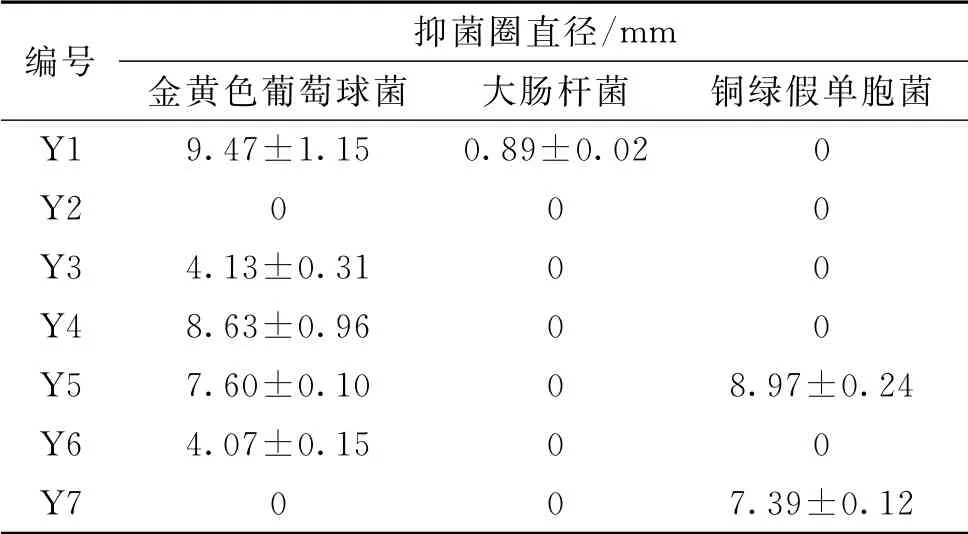
表4 抑菌活性测定结果(±s,n=3)Tab.4 Antibacterial test results(±s,n=3)
编号 抑菌圈直径/mm金黄色葡萄球菌 大肠杆菌 铜绿假单胞菌Y1 9.47±1.15 0.89±0.02 0 Y2 0 0 0 Y3 4.13±0.31 0 0 Y4 8.63±0.96 0 0 Y5 7.60±0.10 0 8.97±0.24 Y6 4.07±0.15 0 0 Y7 0 0 7.39±0.12
Y1、Y4、Y5于孵育4 h后阅片时发现,有明显的铜绿假单胞菌抑菌圈,但是孵育24 h后,仅有Y5有铜绿假单胞菌抑菌圈,表明Y1和Y4具有杀菌药效,但没有抑菌药效。
3 讨论
本文首先对新疆紫草的抑菌药效进行研究,结合化学指纹图谱,完成了谱-效关系分析,推测可能的药效物质。为进一步实现新疆紫草关键药效物质的辨识,随后采用基于中药成分“敲除/敲入”模式策略,对敲除目标成分的活性进行验证,初步筛选并确定新疆紫草的主要活性成分,为后期体内药效考察提供理论依据与实验支持。此研究模式的建立对快速辨识复杂中药中关键药效物质具有一定的指导意义。
本研究首次采用基于目标成分“敲除”模式,以紫草素与乙酰紫草素为目标成分,通过体外抑菌实验,研究新疆紫草的主要抑菌物质,该模式能较好地体现中医药的整体观、系统观以及多成分协同或拮抗作用的特点。根据前述评判依据,结合表4 中的数据可知:①乙酰紫草素目标峰对金黄色葡萄球菌有抑制作用,但是较新疆紫草提取物抑菌能力稍弱,而乙酰紫草素阴性物质对金黄色葡萄球菌无抑制作用,因此,推测乙酰紫草素为新疆紫草提取物抑制金黄色葡萄球菌的主要药效成分之一,紫草素与新疆紫草对金黄色葡萄球菌的抑制作用没有直接关系;②紫草素及其阴性物质都有类似新疆紫草提取物的抑制金黄色葡萄球菌的作用,推测紫草素与新疆紫草抗金黄色葡萄球菌的药效并无直接关系。紫草素目标峰对铜绿假单胞菌有抑制作用,而紫草素阴性物质对铜绿假单胞菌无抑制作用,推测紫草素为新疆紫草提取物中抗铜绿假单胞菌的主要药效成分之一。
综上所述,本研究发现乙酰紫草素与紫草素均为新疆紫草中主要的抑菌药效物质,但是新疆紫草中的萘醌类物质哪些发挥主要作用、哪些发挥协同作用还不清楚。因此,明确新疆紫草的化学成分、相互作用的方式等,能够为进一步研究新疆紫草抑菌药效物质基础提供理论依据。

