5种还原糖与南极磷虾粉酶解液美拉德反应产物挥发性成分的差异分析
王梦云, 杜婕妤, 桑尚源, 汤海青, 欧昌荣
5种还原糖与南极磷虾粉酶解液美拉德反应产物挥发性成分的差异分析
王梦云1,3, 杜婕妤1,3, 桑尚源1,3, 汤海青2, 欧昌荣1,3*
(1.宁波大学 食品与药学学院, 浙江 宁波 315832; 2.浙江医药高等专科学校 食品学院, 浙江 宁波 315100; 3.宁波大学 浙江省动物蛋白食品精深加工技术重点实验室,浙江 宁波 315211)
为探究不同还原糖与南极磷虾粉酶解液的美拉德反应(Maillard Reaction, MR)产物挥发性成分的差异, 以核糖、木糖、果糖、葡萄糖和半乳糖与南极磷虾粉酶解液进行MR, 检测其中间产物含量、褐变程度和感官品质, 并通过气相色谱-离子迁移谱(GC-IMS)和气相色谱-质谱(GC-MS)联用分析其挥发性风味成分. 结果表明, 核糖MR产物的中间产物含量最高, 褐变程度最大, 且色泽明亮、澄清均匀, 带有浓郁的虾香味. GC-IMS显示不同MR产物的挥发性风味物质有明显差异, 通过指纹图谱和主成分分析可以有效地区分. GC-MS则表明不同挥发性物质的含量和特征化合物造成MR产物的风味差异, 其中糠醛、2-环戊基环戊酮、2,5-二甲基吡嗪、顺-2-甲基-2-丁烯醛和吡嗪分别是5种还原糖MR产物的特征挥发性成分, 它们赋予了不同MR产物不一致的风味特征. 通过聚类热图可以直观展示不同MR产物挥发性物质的差异情况. 综合表明, 两种技术相结合, 互补优势, 获得了不同还原糖MR产物更全面的风味成分信息, 更加全面地反映不同还原糖MR产物中挥发性成分的差异, 可为南极磷虾粉MR还原糖的选取和风味产品的进一步开发提供科学依据.
还原糖; 南极磷虾粉酶解液; 美拉德反应; 气相色谱-离子迁移谱; 气相色谱-质谱; 挥发性成分
南极磷虾是一种高蛋白、低脂肪的小型虾状甲壳动物, 同时含有丰富的矿物质元素. 它在南大洋中有近5亿t的生物量, 是目前地球上最大的一种动物性蛋白资源库[1]. 南极磷虾在海洋中被捕捞后, 通常在船上用热蒸汽处理成粉末[2], 以便于流通和存储, 同时也能很好地保留其营养成分, 并作为蛋白质基料用于工业生产. 目前, 南极磷虾粉主要被用来生产成低价值的动物饲料[3], 其价值远没有得到充分利用. 为了实现南极磷虾粉蛋白质的高值化利用, 常用的方法是将蛋白质酶解制作成海鲜风味产品, 提高蛋白质利用率. 然而水产品酶解后会伴随一些不良风味的产生[4], 阻碍南极磷虾的进一步开发. 美拉德反应(Maillard Reaction, MR)常被用于减少产品中的不良风味, 并达到改变色泽和增香的作用[5], 可以利用MR提升南极磷虾粉酶解液的风味. 还原糖的种类对MR的影响很大, 因此, 比较不同还原糖对南极磷虾粉酶解液MR产物中挥发性成分的差异至关重要.
目前, 气相色谱-离子迁移谱(gas chromato- graphy-ion mobility spectrometry, GC-IMS)和气相色谱-质谱(gas chromatography-mass spectrometer, GC-MS)是两种常见的挥发性风味化合物分析方法, 且已应用在MR挥发性成分的研究. 安攀宇等[6]以鸡胸肉蛋白酶解液为研究对象, 通过GC-IMS研究还原糖添加量对鸡肉风味基料挥发性有机物的影响, 结果表明添加3%木糖的鸡胸肉蛋白酶解液风味最佳. 刘培基等[7]以香菇柄酶解液为原料, 采用GC-IMS分析MR前后挥发性风味物质的变化, 发现有环己酮、丙酮等香味物质生成, 证明MR对香菇柄酶解液风味有明显的改善. 张哲奇等[8]采用GC-MS分析了亚油酸对MR的作用, 结果显示添加亚油酸后MR产物中挥发性化合物含量降低, 表明亚油酸对MR有抑制作用. 郭福军等[9]对河蚌酶解液MR前后风味的变化进行GC-MS检测, 结果表明醇类、醛类、酮类、酯类和含硫化合物等协同作用构成了其MR产物的特征香气, 并且含有较多的醛类和酮类化合物, 明显改善了河蚌肉酶解液的风味. 虽然两种技术在MR的研究中已经涉及多类食品, 但是都存在一定的局限性. GC-IMS虽结合了气相色谱的高效分离和离子迁移谱的快速灵敏, 具有检测限低、选择性好、分析时间短、常压操作、无需样品预处理等优点, 但在准确定量分析方面仍受到一定的限制[10]. GC-MS虽结合了色谱和质谱的特点, 具备适用范围广、分析效率高、定性定量能力强等优点[11], 但无法鉴定出一些含量少却对风味至关重要的物质[12]. 因此, 将GC-IMS和GC-MS两种技术结合, 除了可以充分利用GC-IMS的快速灵敏及区分能力与GC-MS对于鉴定气味物质的独特和高效性, 更能全面且科学地对不同MR产物挥发性成分的变化进行研究.
基于此, 本实验采用GC-IMS和GC-MS分析5种还原糖与南极磷虾粉酶解液的MR产物中的挥发性成分, 以获得不同MR产物中挥发性化合物的综合信息, 旨在更加全面直观地反映不同组MR产物中挥发性成分的差异, 为筛选出与南极磷虾粉酶解液MR的最佳还原糖提供科学依据, 这对于南极磷虾风味产品的开发利用具有重要意义.
1 材料与方法
1.1 材料与仪器
南极磷虾粉购于中水集团远洋股份有限公司; 核糖、果糖、木糖、葡萄糖和半乳糖均为食品级, 购于国药集团化学试剂有限公司; 复合蛋白酶(1.5 AU-N·g-1)和风味蛋白酶(1100LAPU·g-1)购于诺维信(中国)生物技术有限公司; 氯化钠等其他试剂均为国产分析纯.
Trace 1300 ISQ三重四极杆气相色谱-质谱联用仪, 美国Thermo公司; Flavour Spec气相色谱-离子迁移谱, 德国G.A.S公司; UV-5200紫外可见分光光度计, 上海元析仪器有限公司; DCY-2006低温恒温槽, 上海舜宇恒平科学仪器有限公司.
1.2 实验方法
1.2.1 不同还原糖MR产物的制备
参考董志俭等[13]的方法并作适当修改. 取一定质量的南极磷虾粉, 料液比1g:10mL, 复合蛋白酶和风味蛋白酶等量混合, 混合酶添加量为0.7% (质量分数), 调节pH至6.0, 50℃酶解, 时间为3h; 酶解结束后于100℃灭酶10min, 完全冷却后离心10min (3000r·min-1), 取上清液120mL, 按20 g·L-1的比例加入食盐, 40g·L-1的比例加入核糖, 调节pH为8.0, 100℃密封条件下进行MR, 反应时间60min, 冷却后离心10min (3000r·min-1), 取上清液, 制得核糖MR产物于4℃条件下保存至待测.
同时按上述相同实验条件, 将核糖分别替换成果糖、葡萄糖、半乳糖、木糖, 以酶解液作为对照组, 所有样品的制备和检测重复3次.
1.2.2 中间产物含量和褐变程度的测定
参考Dong等[14]的方法并作适当修改. 将MR产物稀释25倍, 用紫外分光光度计在294、420nm处测定吸光度, 分别表示MR在中期阶段生成的中间产物含量和MR晚期阶段的褐变程度.
1.2.3 感官评价
挑选10名接受过描述性感官分析培训并具有各种食品样品感官分析经验的食品专业人员对MR产物的色泽、气味、形态进行综合评定. 每项各10分, 分值越大, 表示风味越好, 具体标准见表1.

表1 MR产物感官评定标准
1.2.4 GC-IMS条件
顶空进样条件: 取5mL制得的MR产物置于20mL顶空瓶中, 顶空孵化温度40℃; 孵化时间20min; 进样体积500µL; 进样针温度80℃.
GC条件: FS-SE-54-CB-1色谱柱(15m×0.53 mm, 1µm); 色谱柱温60℃; 分析时间25min; 载气N2; 载气流速: 2mL·min-1保持2min, 10 mL·min-1保持8min, 100mL·min-1保持10min, 150 mL·min-1保持5min.
IMS条件: 正离子模式; 迁移管温度45℃; 漂移气流速150mL·min-1.
1.2.5 GC-MS条件
固相微萃取: 取5mL制得的MR产物置于20mL顶空瓶中, 于50℃磁力搅拌器中震动平衡15min, 用老化20min的萃取头(50/30μm CAR/ PDMS/DVB)顶空吸附30min, 再将萃取头插入GC进样口, 解析5min.
GC条件: DB-WAX毛细管柱(30mm×0.25mm, 0.25µm); 载气He; 流量1.6mL·min-1; 进样量1.0 µL; 不分流进样; 进样口温度250℃; 程序升温, 35℃保持3min, 以3℃·min-1升温至40℃保持1min, 再以5℃·min-1升温至220℃保持12min.
MS条件: 电子能量70eV; 离子源温度230℃; 质量扫描范围50-550/.
1.3 数据处理
采用SPSS 26.0软件单因素方差分析(ANOVA)和邓肯多重比较分析各组间的差异,<0.05被认为具有统计学意义; GC-IMS使用自带的LAV、GC-IMS Library Search和Dynamic PCA插件进行分析; GC-MS应用NIST14.L谱库对检测到的挥发性成分进行鉴定, 若匹配度大于80%则认定该组分存在于样品中, 用峰面积法计算各物质的相对含量; 基于Origin 2018制作图形.
2 结果与分析
2.1 中间产物含量和褐变程度分析
在MR过程中, 中期阶段生成产物的吸光度值通常与低分子量化合物相关, 而末期阶段生成产物的吸光度值则与高分子量化合物相关, 末期产物统称为类黑精, 以棕色为主, 可以反映MR的褐变程度[15]. 如图1所示, 还原糖的种类对南极磷虾粉酶解液的MR产物影响较大, 中间产物含量和褐变程度的趋势一致, 其中核糖组的吸光度值最高, 其次为木糖, 这可能是因为它们都是五碳糖, 分子量小, 容易与蛋白质或蛋白质水解产物反应[16]; 葡萄糖组和果糖组吸光度值最低, 说明添加它们的MR进行程度最低.
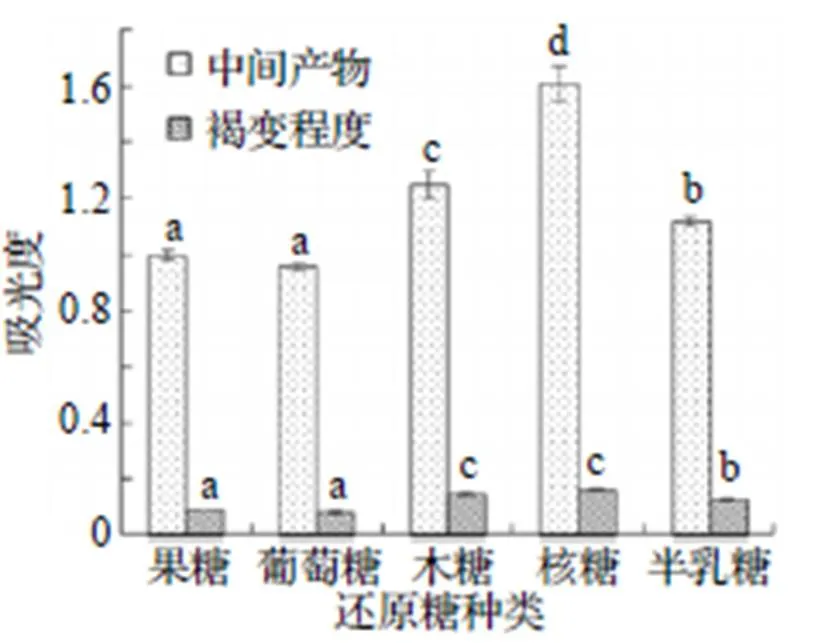
注: 不同字母代表样品存在显著差异(P<0.05).
2.2 感官分析
由表2可知, 添加不同还原糖的南极磷虾粉酶解液MR产物的各个感官评分具有显著性差异 (<0.05), 其中核糖组和木糖组在各个项目中评分比较突出. 核糖参与MR对酶解液的风味有显著的改善, 不仅没有焦糊味, 还使酶解液具有浓郁的虾香味, 且后味十足, 反应液也呈现澄清的焦糖色. 木糖也同样能提升酶解液的风味, 感官评分也处于较高层次, 不过虾香味比核糖组略淡, 且后味不足. 而果糖和葡萄糖参与的MR对酶解液的提升效果相似. 对比其他还原糖, 半乳糖组提升效果最不明显, 感官评分最低.
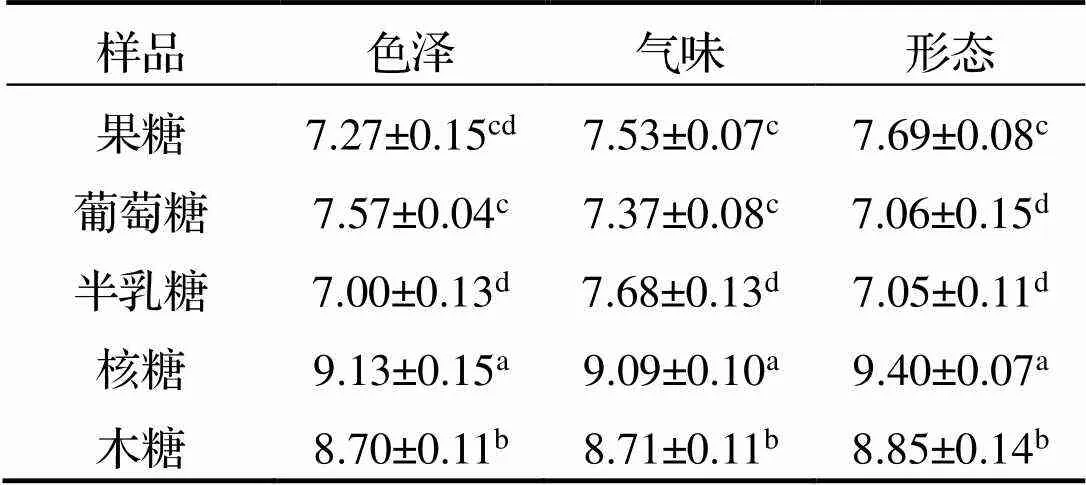
表2 5种还原糖MR产物的感官评分
注: 同一列中, 不同上标字母表示差异显著(<0.05).
2.3 MR产物挥发性风味成分的GC-IMS分析
通过GC-IMS分析核糖、木糖、果糖、葡萄糖以及半乳糖与南极磷虾粉酶解液的MR产物中挥发性风味物质的差异, 以酶解液为对照. 从图2三维谱(A代表核糖组、B代表木糖组、C代表果糖组、D代表葡萄糖组、E代表半乳糖组、F代表酶解液组, 所有分析一致)可以看出, 5种MR产物和酶解液的挥发性风味成分整体特征具有一定的差异, 但很难直接进行区分. 将图2投影到二维平面上对比样品间的风味物质, 如图3所示, 选取酶解液样品的谱图作为参比, 其他样品的谱图扣除参比. 背景为白色表示浓度一致, 蓝色表示浓度低于参比, 红色表示浓度高于参比. 可以看出, 大多数信号出现在100~700s的保留时间和1.0~1.8ms的迁移时间内, 其中核糖组、木糖组、果糖组、半乳糖组的某些挥发性化合物浓度明显高于酶解液组.

图2 5种还原糖MR产物和酶解液的GC-IMS三维谱图

图3 5种还原糖MR产物和酶解液的GC-IMS二维谱图
通过GC-IMS库进行匹配, 定性分析挥发性组分. 结果表明, 5种MR产物和酶解液共定性41种物质. 表3列出了挥发物质的名称、CAS号、分子式、保留指数、保留时间和迁移时间, 其中有部分化合物产生了单体、二聚体甚至多聚体, 因此共得到25个组分, 分别是13种醛、5种酮、2种醇、3种酯、1种吡嗪和1种呋喃物质. 可以发现, 由于GC-IMS的检测限低[17], 检测到挥发性成分的C链主要在C2~C10以内, 并且大部分为小分子低含量化合物.
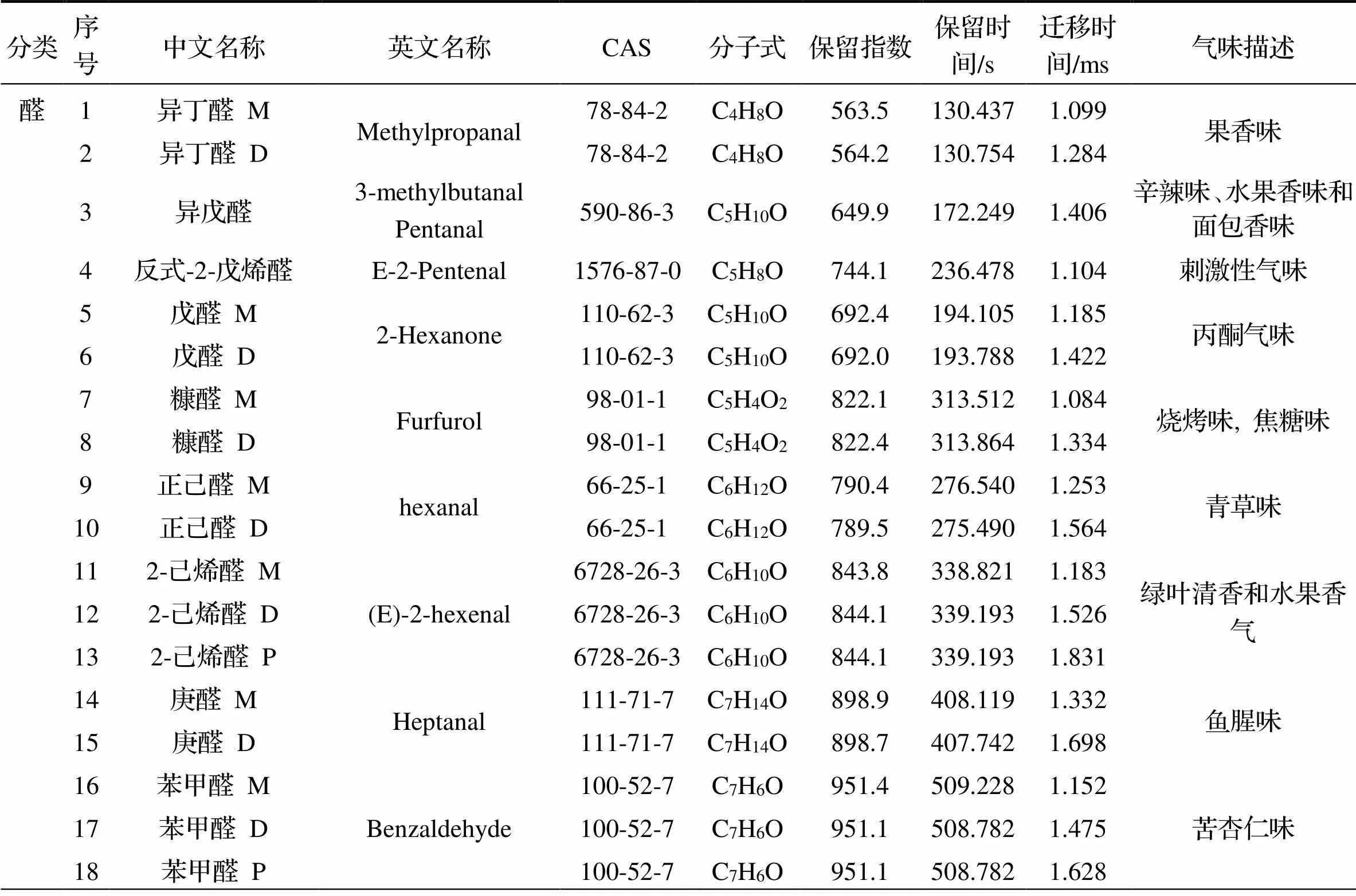
表3 GC-IMS鉴定五种还原糖MR产物的挥发性成分
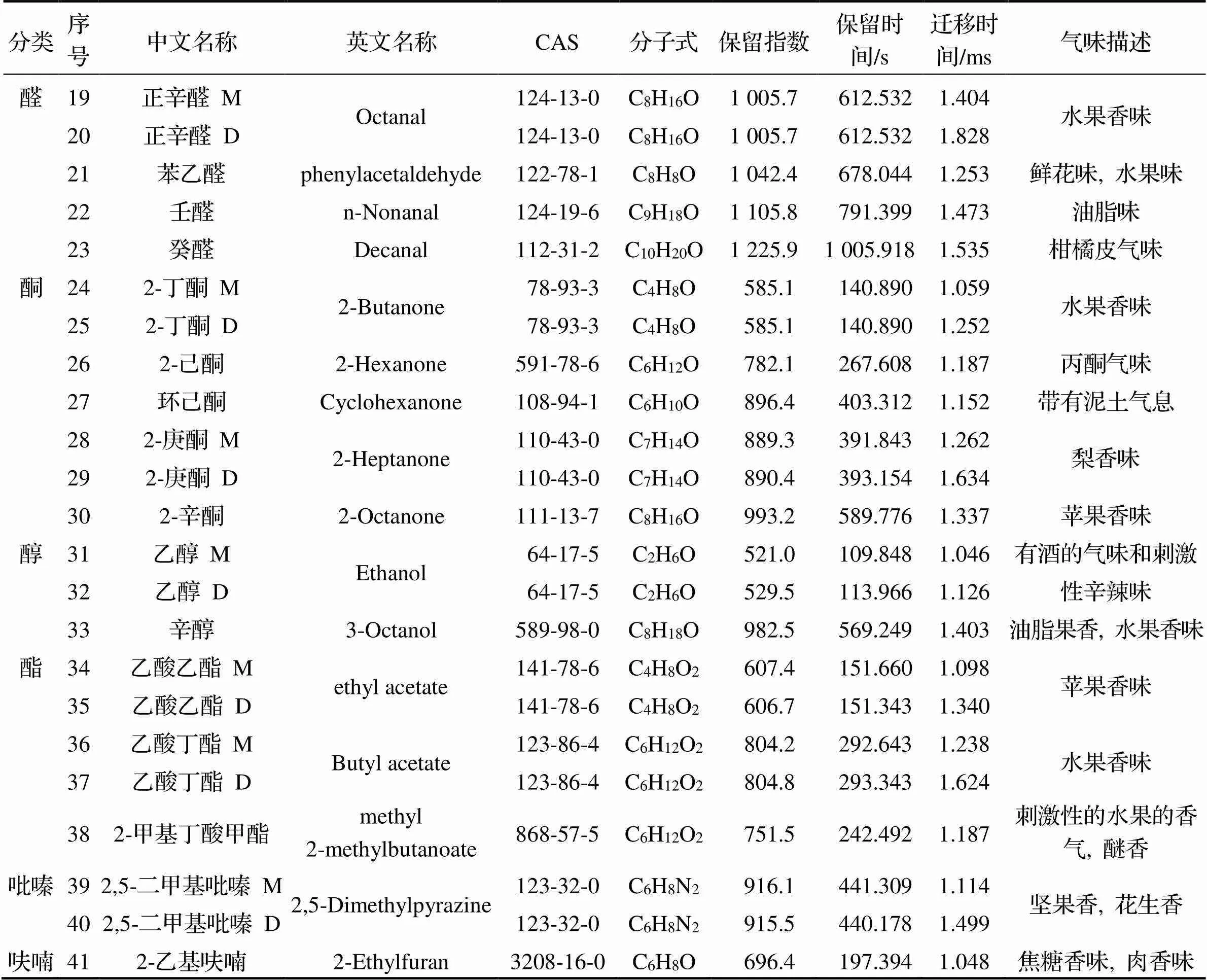
续表
注: M为单体, D为二聚体, P为三聚体.
为了更加全面地对比不同还原糖MR产物和酶解液中挥发性成分之间的差异, 使用Gallery Plot插件生成指纹图谱. 从图4可以看出, 平行测定的样品存在着共同挥发性成分, 浓度大小接近, 样品组内具有明显的相似性, 而样品组间则呈现出明显的差异, 可能是由于不同还原糖的不同反应活性造成的. 如图4所示, C、D、E区域内的挥发性成分在各样品中均存在, 但浓度上有所差异, 与酶解液相比, 核糖组、木糖组、果糖组和半乳糖组中的庚醛、正己醛、戊醛、壬醛、癸醛、正辛醛、苯甲醛、2-己酮、2-丁酮、环己酮、2-庚酮、2-辛酮、乙酸乙酯、2-乙基呋喃、辛醇等物质浓度较低; A、B、1、2、3、4区域中的乙酸丁酯、异戊醛、乙醇、异丁醛、糠醛、2,5-二甲基吡嗪和苯乙醛等物质则比酶解液中的浓度高; 5、6区域中葡萄糖组的挥发性物质种类和浓度则与酶解液中的相似, 且对比酶解液, 其他组中带有鱼腥、臭味等刺激性不良风味的庚醛、反式-2-戊烯醛[18]等物质浓度降低, 说明经过MR后腥味减轻, 酶解液的风味得到提升. 通过图4还发现酶解液中的挥发性物质主要为醛类和酮类, 经过MR后有部分物质转化成酯类、吡嗪类等具有烤香、坚果香味的化合物. 同时MR产物中产生了大量新的风味物质, 如1区中的糠醛等浓度明显高于别的样品, 为核糖MR产物的特征风味物质, 使得样品带有浓郁的虾香味和焦糖味, 对样品的整体风味有明显的改善. 2区中化合物为木糖MR产物的特征风味物质. 4区中化合物为半乳糖MR产物的特征风味物质. 3区中的2,5-二甲基吡嗪为果糖MR产物的特征风味物质, 使得MR产物具有坚果味、烘烤味.
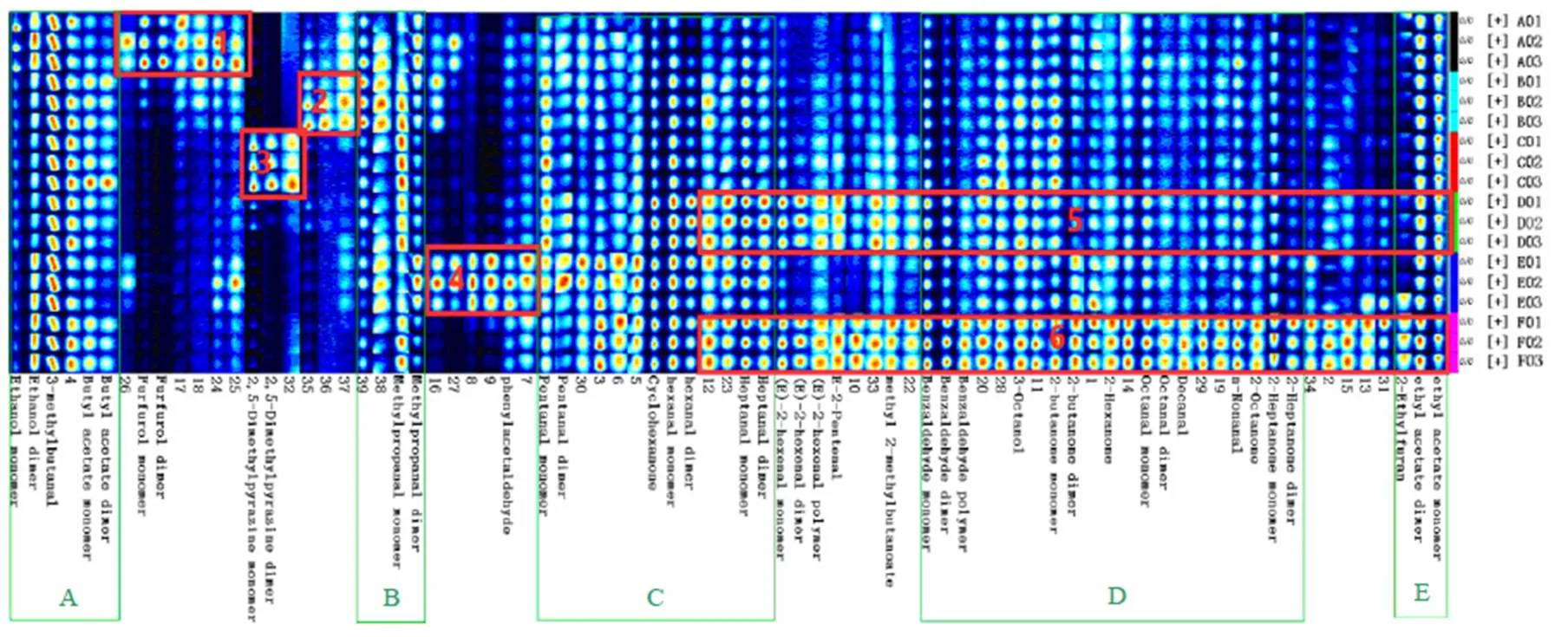
图4 5种还原糖MR产物和酶解液的指纹谱图
为了进一步区分5种MR产物, 采用Dynamic PCA插件进行动态PCA(图5). 通常, 当累积贡献率达到60%时, 可选择PCA模型作为分离模型[19]. 如图5所示, PC1和PC2的累计贡献率达到88%, 表明这两个主成分分析所得数据能很好地反映出不同还原糖南极磷虾粉酶解液MR产物的总体特征. 不同样品各组数据的成簇区域有明显间距, 说明不同MR产物间的特异性较明显, 样品间挥发性成分差异较大. 核糖组和酶解液的主要差异在PC1, 木糖组、果糖组和半乳糖组之间的主要差异体现在PC2, 而葡萄糖组与其他样品都有一定的距离, 在PC1和PC2上都表现出一定的差异, 能很好地被区分. 总体来看, 不同还原糖MR产物的挥发性物质没有明显重叠区域, 说明采用GC-IMS可以很好地实现不同还原糖MR产物挥发性成分的区分.
2.4 MR产物挥发性成分的GC-MS分析
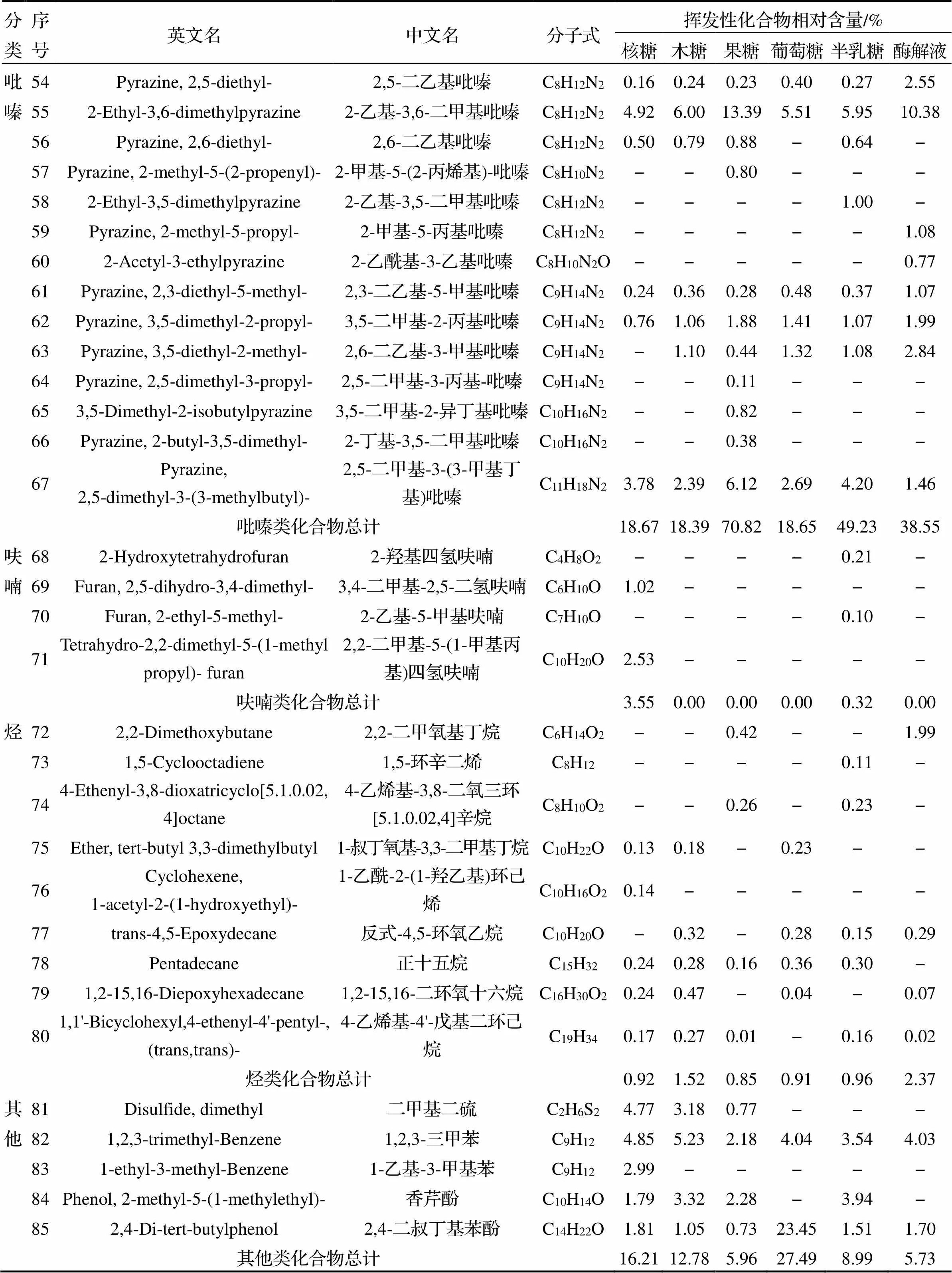
采用顶空固相微萃取法对核糖、木糖、果糖、葡萄糖、半乳糖与南极磷虾粉酶解液的MR产物中挥发性风味物质进行GC-MS分析, 以酶解液为对照, 挥发性成分数量和相对含量如图6和表4所示, 分别在核糖组、木糖组、果糖组、葡萄糖组、半乳糖组和酶解液组的MR产物中鉴别出48、46、45、44、44和35种挥发性物质, 其C链主要为C8~C21, 其中醛类13种、酮类12种、醇类16种、酯类8种、吡嗪类18种、呋喃类4种、烃类9种以及其他类5种. 由图6可以看出, 核糖组的挥发性物质最多, 酶解液的挥发性风味物质最少, 酶解液与不同还原糖发生MR后, 挥发性成分明显增加, 说明MR可以明显生成新的挥发性物质. 从表4可以看出, GC-MS定性挥发性成分的数量是GC-IMS的两倍, 展现出强大的定性能力. 还可以看出, 5种还原糖MR产物中共有的挥发性化合物有24种, 主要有2-庚酮、3,5-辛二烯-2-酮、正己醛、顺式-4-庚烯醛、苯甲醛、顺-2-戊烯醇、4-萜烯醇、α-松油醇、2,5-二甲基吡嗪、2-乙基-3,6-二甲基吡嗪、正十五烷、1,2,3-三甲苯等, 说明这些物质是南极磷虾粉酶解液MR产物中常见的挥发性成分.
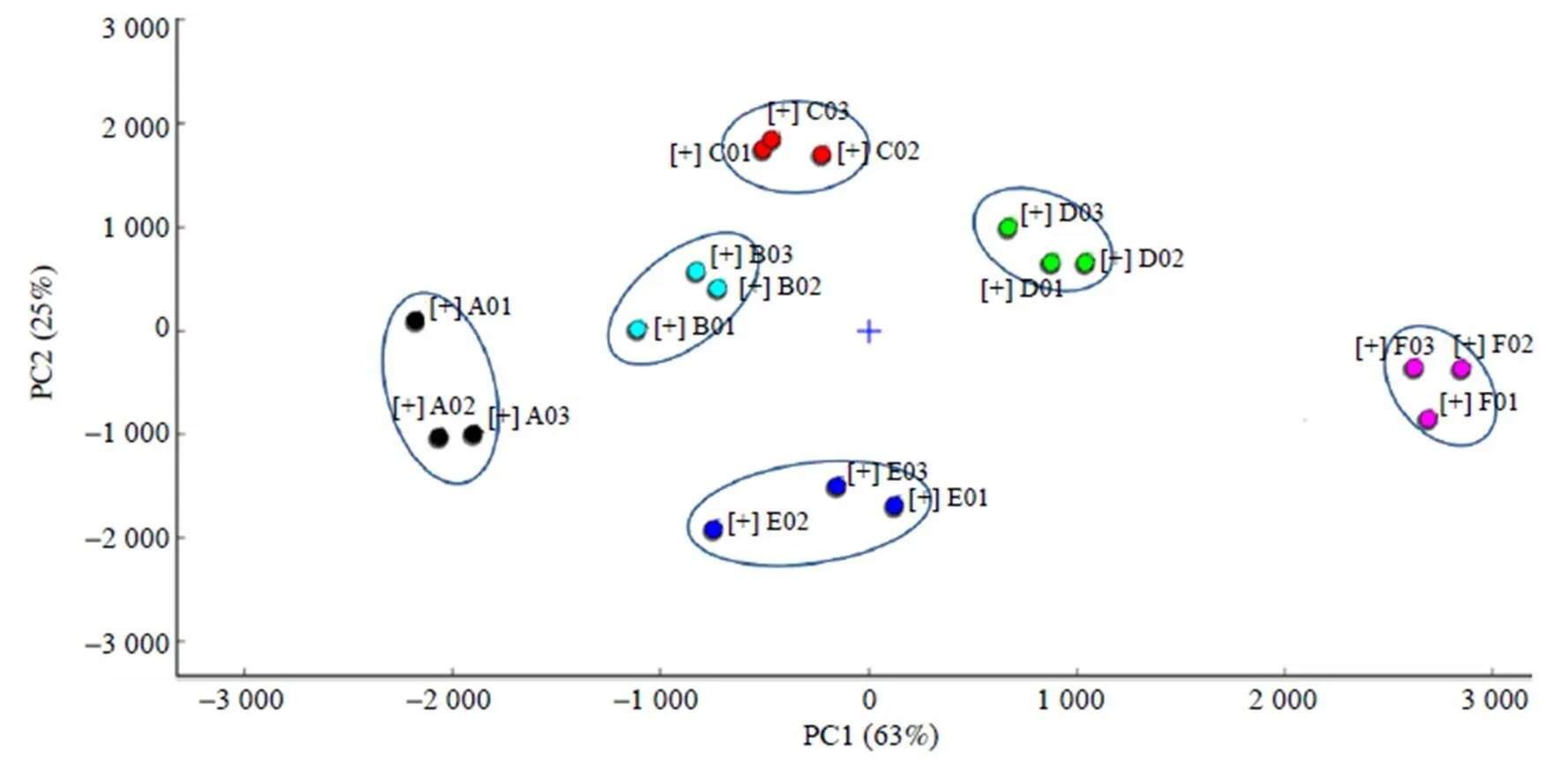
图5 5种还原糖MR 产物和酶解液的PCA 图
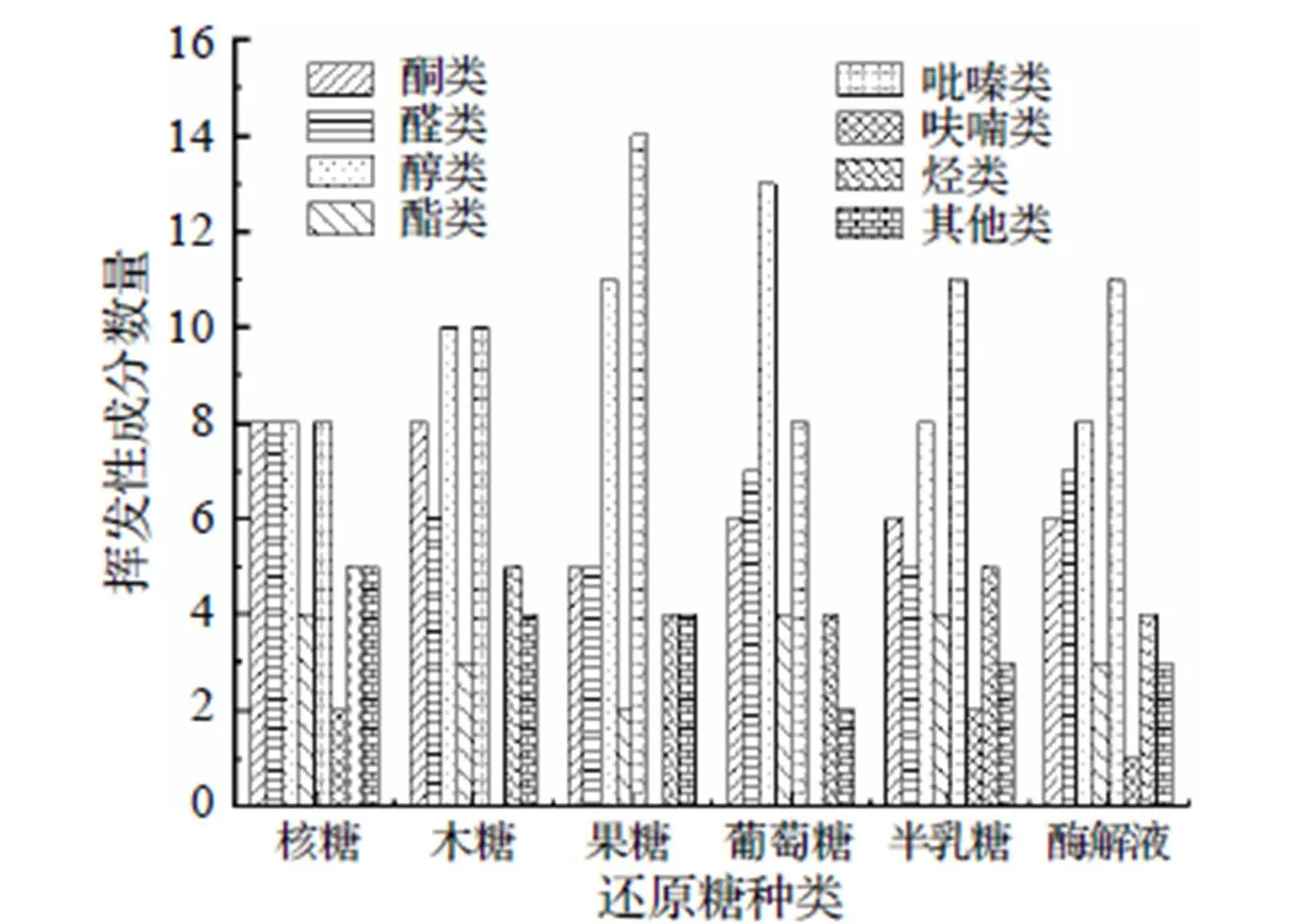
图6 5种还原糖MR产物和酶解液的挥发性成分数量
表4 GC-MS鉴定5种还原糖MR产物的挥发性成分的相对含量
续表
续表
分类序号英文名中文名分子式挥发性化合物相对含量/% 核糖木糖果糖葡萄糖半乳糖酶解液 吡54Pyrazine, 2,5-diethyl-2,5-二乙基吡嗪C8H12N20.160.240.230.400.272.55 嗪552-Ethyl-3,6-dimethylpyrazine2-乙基-3,6-二甲基吡嗪C8H12N24.926.0013.395.515.9510.38 56Pyrazine, 2,6-diethyl-2,6-二乙基吡嗪C8H12N20.500.790.88-0.64- 57Pyrazine, 2-methyl-5-(2-propenyl)-2-甲基-5-(2-丙烯基)-吡嗪C8H10N2--0.80--- 582-Ethyl-3,5-dimethylpyrazine2-乙基-3,5-二甲基吡嗪C8H12N2----1.00- 59Pyrazine, 2-methyl-5-propyl-2-甲基-5-丙基吡嗪C8H12N2-----1.08 602-Acetyl-3-ethylpyrazine2-乙酰基-3-乙基吡嗪C8H10N2O-----0.77 61Pyrazine, 2,3-diethyl-5-methyl-2,3-二乙基-5-甲基吡嗪C9H14N20.240.360.280.480.371.07 62Pyrazine, 3,5-dimethyl-2-propyl-3,5-二甲基-2-丙基吡嗪C9H14N20.761.061.881.411.071.99 63Pyrazine, 3,5-diethyl-2-methyl-2,6-二乙基-3-甲基吡嗪C9H14N2-1.100.441.321.082.84 64Pyrazine, 2,5-dimethyl-3-propyl-2,5-二甲基-3-丙基-吡嗪C9H14N2--0.11--- 653,5-Dimethyl-2-isobutylpyrazine3,5-二甲基-2-异丁基吡嗪C10H16N2--0.82--- 66Pyrazine, 2-butyl-3,5-dimethyl-2-丁基-3,5-二甲基吡嗪C10H16N2--0.38--- 67Pyrazine, 2,5-dimethyl-3-(3-methylbutyl)-2,5-二甲基-3-(3-甲基丁基)吡嗪C11H18N23.782.396.122.694.201.46 吡嗪类化合物总计18.6718.3970.8218.6549.2338.55 呋682-Hydroxytetrahydrofuran2-羟基四氢呋喃C4H8O2----0.21- 喃69Furan, 2,5-dihydro-3,4-dimethyl-3,4-二甲基-2,5-二氢呋喃C6H10O1.02----- 70Furan, 2-ethyl-5-methyl-2-乙基-5-甲基呋喃C7H10O----0.10- 71Tetrahydro-2,2-dimethyl-5-(1-methylpropyl)- furan2,2-二甲基-5-(1-甲基丙基)四氢呋喃C10H20O2.53----- 呋喃类化合物总计3.550.000.000.000.320.00 烃722,2-Dimethoxybutane2,2-二甲氧基丁烷C6H14O2--0.42--1.99 731,5-Cyclooctadiene1,5-环辛二烯C8H12----0.11- 744-Ethenyl-3,8-dioxatricyclo[5.1.0.02,4]octane4-乙烯基-3,8-二氧三环[5.1.0.02,4]辛烷C8H10O2--0.26-0.23- 75Ether, tert-butyl 3,3-dimethylbutyl1-叔丁氧基-3,3-二甲基丁烷C10H22O0.130.18-0.23-- 76Cyclohexene, 1-acetyl-2-(1-hydroxyethyl)-1-乙酰-2-(1-羟乙基)环己烯C10H16O20.14----- 77trans-4,5-Epoxydecane反式-4,5-环氧乙烷C10H20O-0.32-0.280.150.29 78Pentadecane正十五烷C15H320.240.280.160.360.30- 791,2-15,16-Diepoxyhexadecane1,2-15,16-二环氧十六烷C16H30O20.240.47-0.04-0.07 801,1'-Bicyclohexyl,4-ethenyl-4'-pentyl-, (trans,trans)-4-乙烯基-4'-戊基二环己烷C19H340.170.270.01-0.160.02 烃类化合物总计0.921.520.850.910.962.37 其81Disulfide, dimethyl二甲基二硫C2H6S24.773.180.77--- 他821,2,3-trimethyl-Benzene1,2,3-三甲苯C9H124.855.232.184.043.544.03 831-ethyl-3-methyl-Benzene1-乙基-3-甲基苯C9H122.99----- 84Phenol, 2-methyl-5-(1-methylethyl)-香芹酚C10H14O1.793.322.28-3.94- 852,4-Di-tert-butylphenol2,4-二叔丁基苯酚C14H22O1.811.050.7323.451.511.70 其他类化合物总计16.2112.785.9627.498.995.73
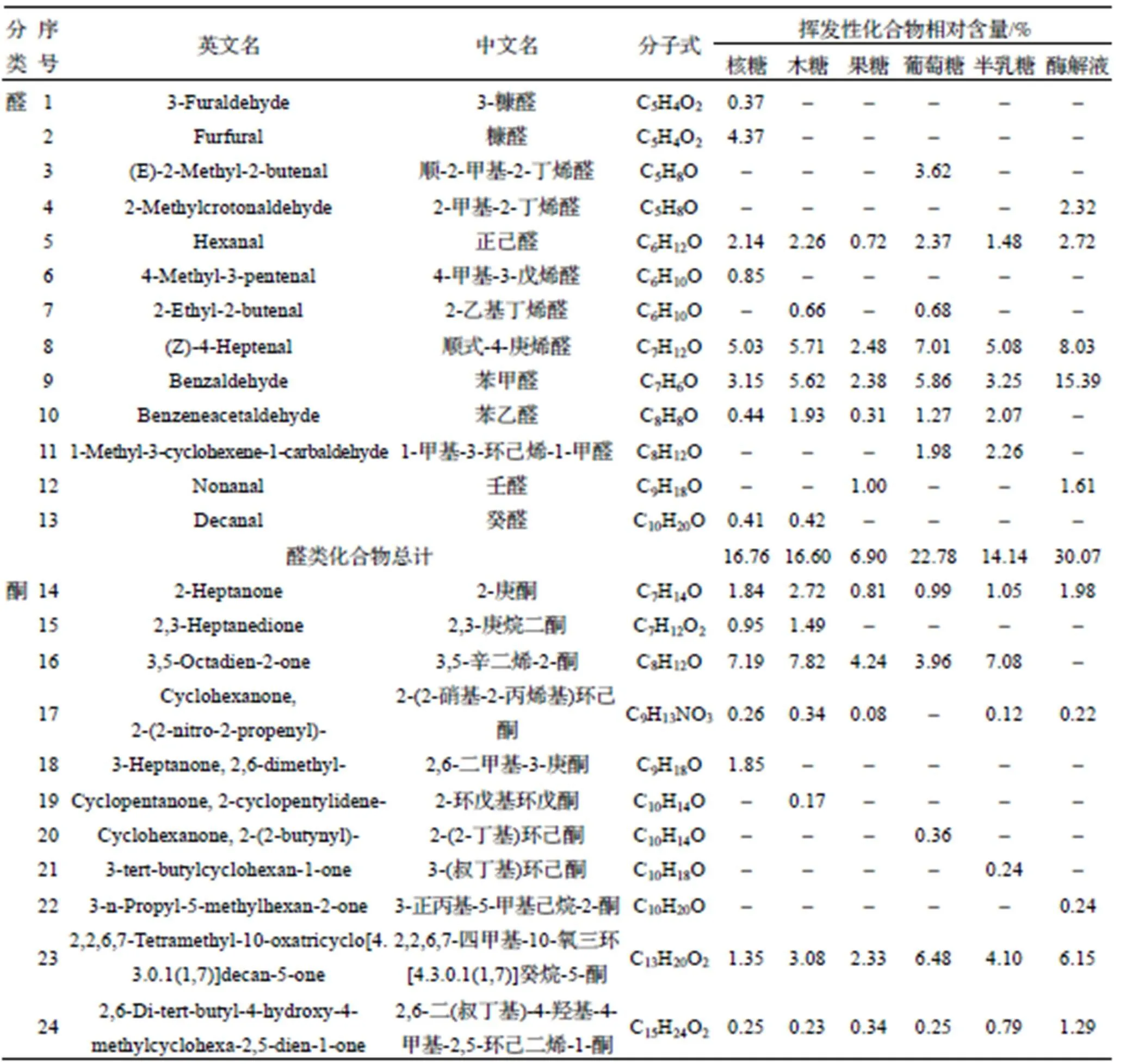
醛类物质是MR产物中挥发性物质的重要组成部分, 主要来源于脂肪氧化、降解及Strecker氨基酸反应[20]. 核糖组、木糖组、果糖组、葡萄糖组和半乳糖组中的醛类化合物相对含量分别为16.76%、16.60%、6.90%、22.78%、14.14%. 不同还原糖MR产物与酶解液共有的化合物为正己醛、顺式-4-庚烯醛和苯甲醛, 分别贡献了青草味、油脂味和苦杏仁味[21-22], 其中正己醛和顺式-4-庚烯醛产生的味道也可能是酶解液产生腥味的原因之一, 而由表4可知, 这两种化合物经过MR后的相对含量均比酶解液中的含量低. 苯甲醛是由氨基酸的Strecker降解生成的[22], 它存在于各个反应产物中, 葡萄糖组中的苯甲醛含量相对最高. 苯乙醛仅存在于发生MR后的产物中, 有鲜花味和水果味[23], 说明MR改善了酶解液的风味. 癸醛具有柑橘皮气味[24], 在木糖组和核糖组中被检测到. 糠醛仅在添加核糖的MR产物中检测到, 含量为4.37%, 具有烧烤味和焦糖味[25], 使得南极磷虾粉酶解液经过MR后产生了浓郁的虾香味和焦糖香味, 是核糖MR产物的特征化合物, 与GC-IMS中的结果一致. 顺-2-甲基-2-丁烯醛仅在葡萄糖组中被检测到, 常作为增香剂提升原有风味[26], 是葡萄糖MR产物的特征化合物.
酮类物质大多数的阈值相对较低, 它们既可以产生美妙的食品风味, 也可能导致不良风味的产生, 主要源于Strecke降解和脂类氧化[27]. 南极磷虾粉酶解液中酮类物质的相对含量为9.88%, 添加核糖、木糖、葡萄糖、半乳糖后, 酮类化合物含量均有所增加, 分别为13.74%、15.90%、12.06%、13.38%, 而果糖组中的酮含量反而减少. 不同还原糖MR产物与酶解液共有的化合物有3种, 其中2-庚酮贡献了水果香味[28]; 3,5-辛二烯-2-酮是MR之后的特有产物, 在核糖组、木糖组、果糖组、葡萄糖组、半乳糖组中的相对含量分别为7.19%、7.82%、4.24%、3.96%、7.08%, 贡献了蘑菇味[29]; 2-环戊基环戊酮仅在木糖组检测到, 具有清新的果香气息, 能够提调果香、花香及清凉香, 是木糖MR产物的特征化合物[30].
醇类物质可以从脂氧合酶途径产生, 还可来源于糖代谢或氨基酸Ehrlich机制的代谢[31], 具有花香、薄荷香、柑橘香和柚香等气味[32]. 核糖组、木糖组、果糖组、葡萄糖组和半乳糖组中的醇类化合物相对含量分别为29.04%、33.88%、7.50%、16.74%、9.83%, 核糖组、木糖组和葡萄糖组中的醇类物质含量相比酶解液明显增加, 果糖组和半乳糖组则比酶解液略微减少. 3-甲基-1,2-环戊烷二醇、顺-2-戊烯醇、4-萜烯醇为MR前后共有的挥发性化合物, 其中4-萜烯醇呈较淡的泥土香和陈腐的木材气息[33], 而经过MR后, 含量有所下降. 2-乙基己醇存在于核糖组、木糖组、果糖组、葡萄糖组中, 且在核糖组、木糖组中含量较高, 分别为19.33%和22.11%, 具有甜味和淡淡的花香味[34], 但阈值较高, 对MR产物风味贡献不明显.
酯类化合物大多是由羧酸和醇的酯化作用产生的, 贡献一种甜的花果香味[35]. 核糖组、木糖组、果糖组、葡萄糖组和半乳糖组中的酯类化合物相对含量分别为1.12%、0.93%、0.16%、1.37%和3.15%, 相比酶解液中的酯类含量均有所下降, 表明MR后, 酯类化合物含量减少. 香芹酚具有柑橘香, 为目前应用最为广泛的重要香料之一[36], 存在于核糖组、木糖组、果糖组和半乳糖组中, 含量分别为1.79%、3.32%、2.28%和3.94%. 结果表明, 含量较少的一些酯类、酚类挥发性物质也有可能是南极磷虾粉MR产物的主要赋香成分.
吡嗪类物质一般具有烧烤香、坚果香, 是一种十分重要的风味物质[37]. 核糖组、木糖组、果糖组、葡萄糖组、半乳糖组和酶解液中的吡嗪类化合物相对含量分别为18.39%、18.39%、70.82%、18.65%、49.23%和38.55%, 不同MR产物吡嗪类物质差异明显. 果糖组中的吡嗪类物质含量最高, 其中具有坚果香、花生香的2,5-二甲基吡嗪是果糖MR产物的特征性挥发性物质, 与GC-IMS结果一致. 半乳糖组的吡嗪类物质含量也较高, 其中具有玉米香、榛子香的吡嗪则是半乳糖MR产物的特征性挥发性物质. 酶解液中的吡嗪类含量较高可能是由于酶解反应或热反应产生的[38]. 结果表明, 吡嗪类物质可能导致不同种类糖的MR产物的风味改变.

图7 5种还原糖MR产物和酶解液的挥发性成分聚类热图
呋喃类物质主要由脂肪酸氧化和Heyns化合物(或Amadori化合物)通过1,2-烯醇化反应产生, 大多具有肉香味和烤香味, 其阈值极低[39]. 本研究中仅有核糖组和半乳糖组出现了呋喃类物质, 含量分别为3.55%和0.32%, 使得核糖的MR产物具有烤肉香味, 这也可能是核糖MR产物的风味优于其他样品的原因之一.
烃类物质的阈值普遍较高, 对MR产物的风味贡献不大. 核糖组、木糖组、果糖组、葡萄糖组、半乳糖组和酶解液中的烃类化合物相对含量分别为0.92%、1.52%、0.85%、0.91%、0.96%和2.37%, 主要有正十五烷、4-乙烯基-4′-戊基二环己烷、1,2-15,16-二环氧十六烷等成分.
为了更直观地展示不同还原糖MR产物的差异情况, 根据GC-MS检测出的挥发性成分的相对含量, 使用Origin软件绘制5种还原糖MR产物和酶解液的聚类热图(图7). 从图7可以看出, 不同MR产物和酶解液可聚为3类, 第1类为葡萄糖组和酶解液, 与其他样品差异较大, 醛类、醇类和吡嗪类含量较高, 主要有顺-2-甲基-2-丁烯醛、壬醛、2,4-二甲基环戊醇、2,5-二乙基吡嗪等. 第2类为核糖组和木糖组, 其醛类、酮类、醇类和呋喃类含量较高, 主要有糠醛、2-环戊基环戊酮、顺-3-壬烯-1-醇、3,4-二甲基-2,5-二氢呋喃等. 第3类为果糖组和半乳糖组, 以吡嗪类为主, 醛类、酮类和烃类含量较少. 结果表明, 5种MR产物的风味具有显著差异.
3 结论
本研究通过检测不同还原糖MR产物的中间产物含量、褐变程度、感官品质, 再结合GC-IMS和GC-MS分析其挥发性成分, 探讨不同还原糖与南极磷虾粉酶解液MR产物挥发性成分的差异. 结果表明, 添加核糖的MR产物的中间产物含量最多, 褐变程度最大, 带有浓郁的虾香味, 且呈现澄清均匀的焦糖色. 在5组产物和酶解液样品中采用GC- IMS共定性41种物质, 通过指纹图谱发现不同还原糖MR产物中挥发性成分差异显著, 再结合PCA可有效区分, 其中主成分累计贡献率达到88%, 能很好地反映出不同还原糖MR产物的总体特征. 通过GC-MS在核糖、木糖、果糖、葡萄糖、半乳糖组MR产物和酶解液样品中分别鉴定出48、46、45、44、44和35种挥发性成分, 通过各成分相对含量和聚类热图可以发现, 不同物质的含量和特征化合物造成了MR产物风味的差异, 其中糠醛、顺-2-甲基-2-丁烯醛、香芹酚、2-环戊基环戊酮、2,5-二甲基吡嗪和吡嗪等是不同MR产物的重要特征化合物. 综合表明, GC-IMS具有更强的区分能力, GC-MS则具有更强的鉴定能力, 两者结合, 获得了不同还原糖MR产物更全面的风味成分信息, 表明了不同还原糖对南极磷虾粉酶解液MR产物的风味提升效果有明显差异. 本研究可为南极磷虾粉酶解液MR最佳还原糖的选取提供科学依据, 也可为南极磷虾风味产品的开发利用提供理论支撑.
[1] Tharaka K, Benitez-Santana T, Gunathilaka B E, et al. Evaluation of Antarctic krill () meal supplementation in diets for olive flounder ()[J]. Aquaculture Research, 2020, 51(6):2291-2302.
[2] 杜紫燕, 徐杰, 熊菁晶, 等. 南极磷虾粉贮藏过程中品质变化研究[J]. 食品工业科技, 2018, 39(9):267-271.
[3] Feng H X, Tang S L, Liang X F, et al. Protein source affects apparent digestibility of feed ingredients and protein metabolism in Chinese perch () [J]. Aquaculture Nutrition, 2021, 27(6):2651-2661.
[4] 常钰菲, 侯虎, 李八方. 大孔树脂处理对鳕鱼蛋白酶解液中腥味物质的影响[J]. 食品与发酵工业, 2015, 41(6):52-58.
[5] 李学鹏, 刘晏玮, 高郡焕, 等. 美拉德反应改良四角蛤蜊酶解液的风味[J]. 食品科学, 2018, 39(16):82-89.
[6] 安攀宇, 李燮昕, 李艳梅, 等. 美拉德反应制备鸡肉风味基料的工艺条件优化[J]. 核农学报, 2021, 35(10): 2328-2340.
[7] 刘培基, 崔文甲, 王文亮, 等. 美拉德反应改善香菇柄酶解液的风味[J]. 食品与发酵工业, 2020, 46(22):71-78.
[8] 张哲奇, 臧明伍, 张凯华, 等. GC-MS结合电子鼻分析复热对亚油酸-木糖-半胱氨酸体系挥发性风味物质的影响[J]. 食品科学, 2020, 41(12):166-172.
[9] 郭福军, 姜启兴, 许艳顺, 等. 河蚌酶解液美拉德反应前后风味成分的分析[J]. 食品工业科技, 2014, 35(18): 171-174.
[10] Yin J X, Wu M F, Lin R M, et al. Application and development trends of gas chromatography-ion mobility spectrometry for traditional Chinese medicine, clinical, food and environmental analysis[J]. Microchemical Journal, 2021, 168:106527.
[11] Yue B, Wen Y J, Chen W D, et al. Analysis of polar components in potato wide vermicelli by GC-MS[J]. IOP Conference Series: Earth and Environmental Science, 2021, 687(1):012075.
[12] 杨芳, 杨莉, 粟立丹. 基于电子鼻和气相-离子迁移谱对美人椒酱的风味分析[J]. 食品工业科技, 2019, 40(23):193-198.
[13] 董志俭, 李冬梅, 徐永霞, 等. 利用电子鼻分析不同反应条件下制备的热反应虾味香精的香气变化[J]. 食品工业科技, 2013, 34(18):86-89.
[14] Dong Z Y, Liu W, Zhou Y J, et al. Effects of ultrasonic treatment on Maillard reaction and product characteristics of enzymatic hydrolysate derived from mussel meat[J]. Journal of Food Process Engineering, 2019, 42(6):e13206.
[15] Wang H, Qian H, Yao W. Melanoidins produced by the Maillard reaction: Structure and biological activity[J]. Food Chemistry, 2011, 128(3):573-584.
[16] Jing H, Kitts D D. Chemical and biochemical properties of casein-sugar Maillard reaction products[J]. Food and Chemical Toxicology, 2002, 40(7):1007-1015.
[17] Piotr Konieczka P, Aliaño-González M J, Ferreiro- González M, et al. Characterization of Arabica and Robusta coffees by ion mobility sum spectrum[J]. Sensors(Basel, Switzerland), 2020, 20(11):3123.
[18] Chen F, Lin L, Zhao M, et al. Modification ofhydrolysate through maillard reaction for sea cucumber peptide based-beverage[J]. LWT, 2021, 136:110329.
[19] Wu Z B, Chen L Z, Wu L M, et al. Classification of Chinese honeys according to their floral origins using elemental and stable isotopic compositions[J]. Journal of agricultural and food chemistry, 2015, 63(22):5388-5394.
[20] 许丹, 方益, 何鹏飞, 等. 美拉德反应对南极磷虾酶解液中非挥发性物质的影响[J]. 食品研究与开发, 2019, 40(2):41-46.
[21] Yu Y, Boyer N P, Zhang C. Three structurally similar odorants trigger distinct signaling pathways in a mouse olfactory neuron[J]. Neuroscience, 2014, 275:194-210.
[22] 刘夏磊, 刘芯如, 王雨恬, 等. 鲈鱼干加工过程中热处理及内源酶对风味形成的影响[J]. 食品科学, 2022, 43(8):220-226.
[23] Tava A, Biazzi E, Ronga D, et al. Identification of the volatile components ofL. andleavipes opiz from the western Italian Alps[J]. Molecules (Basel, Switzerland), 2020, 25(10):2333.
[24] 赵玉, 詹萍, 王鹏, 等. 猕猴桃中关键香气组分分析[J]. 食品科学, 2021, 42(16):118-124.
[25] Çelik E E, Gökmen V. Formation of Maillard reaction products in bread crust-like model system made of different whole cereal flours[J]. European Food Research and Technology, 2020, 246(6):1207-1218.
[26] 郑美华, 高然, 李玉霜, 等. 虾蟹漂烫汁酶解液美拉德反应工艺优化及其挥发性物质分析[J]. 食品工业科技, 2020, 41(16):140-149.
[27] Chung H Y, Yeung C W, Kim J S, et al. Static headspace analysis-olfactometry (SHA-O) of odor impact components in salted-dried white herring ()[J]. Food Chemistry, 2007, 104(2):842-851.
[28] Mehdi M A H, Alawi A H M A A, Thabet A Z A, et al. Analysis of bioactive chemical compounds of leaves extracts fromusing FT-IR and GC-MS spectroscopy[J]. Asian Journal of Research in Biochemistry, 2021, 8(1):22-34.
[29] 李大雷, 翁彦如, 杜丽平, 等. 电子鼻和气质联用法分析普洱茶香气成分[J]. 食品与发酵工业, 2019, 45(3): 237-245.
[30] 许绍东. 2-环戊基环戊酮香料的制备与应用[J]. 精细石油化工, 2003, 20(4):38-39.
[31] Wen X, Chen A, Xu Y, et al. Comparative evaluation of volatile profiles of Asian hard clams () with different shell colors by electronic nose and GC-MS [J]. Journal of Aquatic Food Product Technology, 2021, 30(1):107-121.
[32] Chua J, Lu Y, Liu S. Evaluation of five commercial non-yeasts in fermentation of soy (tofu) whey into an alcoholic beverage[J]. Food Microbiology, 2018, 76:533-542.
[33] Kim M K, Jang H W, Lee K G. Characterization of key aroma-active compounds isolated from Omija fruit treated differently based on odor activity values and descriptive sensory analysis[J]. Foods (Basel, Switzerland), 2020, 9(5): 638.
[34] Wang X, Li X X, Liu B, et al. Comparison of chemical constituents of-mediated pure and mixed fermentation in summer-autumn tea[J]. LWT, 2021, 143:111132.
[35] Zhao Y P, Wang L, Li J M, et al. Comparison of volatile compounds in two brandies using HS-SPME coupled with GC-O, GC-MS and sensory evaluation[J]. South African Journal of Enology and Viticulture, 2016, 32(1):9-20.
[36] 罗成江, 周炜, 侯轩, 等. 气相色谱法测定香味剂中桉油精肉桂醛百里香酚及香芹酚的含量[J]. 中国兽医杂志, 2019, 55(2):113-115.
[37] Shahidi F. 肉制品与水产品的风味[M]. 李洁, 朱国斌, 译. 北京: 中国轻工业出版社, 2001.
[38] 陶美洁, 孟粉, 董烨, 等. 贻贝蒸煮液酶解工艺的优化[J]. 中国食品学报, 2020, 20(12):209-220.
[39] 贾梦, 刘金光, 康学栋, 等. 海南特色米中营养成分及挥发性风味物质的分布特征[J/OL]. 中国粮油学报, [2022-01-13]. https://kns.cnki.net/kcms/detail/detail.aspx? dbcode=CAPJ&dbname=CAPJLAST&filename=ZLYX20211227009&uniplatform=NZKPT&v=CEyCh8fPdKdCOD-mnfZQFJ6pN7mJ-MSsg2UuTho-y0JtOkYtN5hnfXUcBydEmmVP.
The difference analysis of volatile components in Maillard reaction products prepared from hydrolysate of Antarctic krill powder and five kinds of reducing sugar
WANG Mengyun1,3, DU Jieyu1,3, SANG Shangyuan1,3, TANG Haiqing2, OU Changrong1,3*
( 1.College of Food and Pharmaceutical Sciences, Ningbo University, Ningbo 315832, China; 2.Faculty of Food Science, Zhejiang Pharmaceutical College, Ningbo 315100, China; 3. Key Laboratory of Animal Protein Food Deep Processing Technology of Zhejiang Province,Ningbo University, Ningbo 315211, China )
The current study was aimed to explore the difference of the volatile components in Maillard reaction products prepared from hydrolysate of Antarctic krill powder and ribose, xylose, fructose, glucose, and galactose. The Maillard reaction products were detected by intermediate products contents, degree of browning, and sensory quality, and volatile components were analyzed by gas chromatography-ion mobility spectrometry (GC-IMS) and gas chromatography-mass spectrometry (GC-MS). The results showed that Maillard reaction products prepared by ribose produced the most intermediate products. The same reaction also produced the largest degree of browning and an attractive color with strong shrimp flavor. GC-IMS demonstrated that five kinds of Maillard reaction products displayed significant differences in the volatile flavor. The fingerprint and principal component analysis could effectively distinguish the Maillard reaction products prepared from different reducing sugar species. GC-MS indicated that the causes for the discrepant results were the content of volatile compounds and the difference of characteristic compounds. Furthermore, the cluster heat map could comprehensively and intuitively reflect the changes of volatile components. GC-IMS has a much stronger distinguishable power and GC-MS possesses more reliable identification. The combination of GC-MS and GC-IMS has complementary advantages and could better reflect the differences of volatile components in five kinds of Maillard reaction products prepared different reducing sugar. The results provide a scientific basis for the selection of optimal reducing sugar and the development of flavor products of Antarctic krill.
reducing sugar; Antarctic krill powder hydrolysate; Maillard reaction; gas chromatography-ion mobility spectrometry; gas chromatography-mass spectrometry; volatile components
2022−02−21.
宁波大学学报(理工版)网址: http://journallg.nbu.edu.cn/
浙江省公益应用研究项目(LGN18C200019).
王梦云(1996-), 男, 湖北荆州人, 在读硕士研究生, 主要研究方向: 水产品加工与风味研究. E-mail: wang0905aa@163.com
通信作者:欧昌荣(1974-), 男, 湖北荆门人, 教授, 主要研究方向: 水产品加工与风味研究. E-mail: ouchangrong@nbu.edu.cn
TS254.1
A
1001-5132(2022)04-0015-14
(责任编辑 韩 超)

