GM1对高胆红素血症脑损伤新生大鼠血清S100B蛋白水平的影响
宋 瑞,阴怀清,赵小静,武师润
高胆红素血症是新生儿科常见的疾病,也是新生儿住院的主要原因之一[1],该病主要是由于胆红素生成过多,肝对胆红素摄取和结合能力降低,肠肝循环增加等多种原因导致血清未结合胆红素升高,患儿出现皮肤黏膜及巩膜黄染。未结合胆红素透过血脑屏障,在脑组织特定的神经核团中沉积,若不及时有效地干预,随着病情进展,可能导致中枢神经系统发生不可逆损伤,甚至导致死亡[2-4]。本研究通过建立7 d龄SD大鼠胆红素脑损伤模型,给予外源性单唾液酸四己糖神经节苷脂(GM1)干预,通过检测血清S100钙结合蛋白B(S100B)蛋白水平,观察GM1对高胆红素血症脑损伤的保护机制,为临床诊疗提供思路。
1 材料与方法
1.1 实验动物与分组 7 d龄SD大鼠120只,清洁级,生产许可证号SCXK(晋)2019-0004,购自山西医科大学动物实验中心,体质量12~18 g,雌雄不限。随机分为3组:对照组(腹腔注射生理盐水)、高胆红素血症组(A组,腹腔注射胆红素150 mg/kg)和GM1干预组(B组,腹腔注射胆红素150 mg/kg+GM1 10 mg/kg)。将每组分为5个亚组,每组8只,分别于6 h、12 h、24 h、48 h、72 h处死。
1.2 实验试剂 胆红素购自美国Sigma公司;大鼠S100B酶联免疫吸附测定(ELISA)试剂盒、脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)细胞凋亡检测试剂盒-POD(50T)购自博士德生物技术公司;单唾液酸四己糖神经节苷脂钠注射液[2 mL(20 mg)],批准文号:国药准字H20046213,齐鲁制药公司生产;5%水合氯醛由山西医科大学第一医院儿科提供;甲醛、双蒸水、3%H2O2溶液、磷酸缓冲盐溶液(PBS)、二甲苯、二氨基联苯胺法(DAB)显色试剂、苏木素等试剂由山西医科大学第一医院病理科提供。
1.3 胆红素配制 黑暗环境下精确称取胆红素50 mg,溶于1 mL 0.5 mol/L NaOH溶液中,加入双蒸水9 mL,使用浓度0.5 mol/L的HCl调节pH值为8.5,浓度为85.5 μmol/L,避光保存,并于1 h内使用。
1.4 动物模型制作 A组、B组大鼠腹腔注射胆红素150 mg/kg,对照组大鼠腹腔注射等量生理盐水;造模后,B组腹腔注射GM1 10 mg/kg,连续3 d,每日1次,对照组和A组注射等量的生理盐水。给药后,各组大鼠均返回原生长环境下母乳喂养。
1.5 观察指标
1.5.1 行为学变化 观察各组大鼠皮肤黄染情况、对外界刺激的反应、活动力有无减弱等。
1.5.2 血清S100B蛋白水平测定 于相应时间点抓取大鼠,以5%水合氯醛麻醉,剂量为0.03 mL/10 g,待大鼠进入深昏迷状态后,使用胶带固定,打开大鼠胸腔、腹腔,充分暴露心脏,在心室舒张末期,迅速用1 mL注射器刺入左心室,抽取0.5 mL血液置于干燥EP管中,静置30 min,高速离心机离心,吸取上层血清,采用ELISA法测定血清S100B蛋白水平。
1.5.3 病理学改变 使用生理盐水充分灌洗,当观察到血性液体变清亮时停止,再使用20 mL甲醛进行灌流,结束后立即取脑组织,浸泡于甲醛中固定24 h,将固定好的脑组织于视交叉后约5 mm处进行冠状切割,海马区包含在所取组织中,梯度乙醇脱水后包埋。将包埋好的石蜡块进行连续切片。①行苏木精-伊红(HE)染色,观察海马区神经元细胞形态结构改变;②TUNEL法测定细胞凋亡,光镜下观察到细胞核呈棕黄色,即为凋亡细胞。
1.5.4 图像处理 应用Scanscope CS数字病理扫描系统(美国Aperio公司)进行图像采集。扫描所取脑组织病理切片,每张切片中截取海马区5个非重叠视野(×400)。记录各视野凋亡细胞数目和细胞总数,凋亡率=凋亡细胞数目/细胞总数×100%。

2 结 果
2.1 3组大鼠行为学变化 整个实验过程中,无大鼠发生死亡,实验开始前,所有大鼠活动均无异常。对照组大鼠全程皮肤、黏膜红润,行为活动无异常;A组、B组大鼠造模后约6 h开始出现烦躁、尖叫、抽搐等异常变化,且随着时间推移,皮肤黄染程度逐渐加重,对外界刺激反应越来越差,活动力减弱;A组较B组表现更明显。
2.2 3组大鼠不同时间血清S100B蛋白水平比较 A组血清S100B蛋白水平较对照组、B组升高,且与时间呈正相关,差异有统计学意义(P<0.05);B组较A组降低,仍高于对照组,差异有统计学意义(P<0.05)。详见表1、图1。

表1 3组大鼠不同时间血清S100B蛋白水平比较(±s) 单位:pg/mL
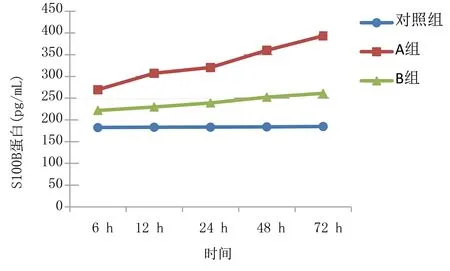
图1 3组不同时间血清S100B蛋白水平折线图
2.3 病理学变化
2.3.1 海马区HE染色改变 对照组大鼠海马区细胞胞清晰可见,各细胞形态正常且排列规整;A组、B组海马区细胞水肿变性,排列紊乱,大量空泡形成,胞核固缩、溶解、碎裂消失,部分胶质细胞增生;同一时间点相比,镜下可见B组受损程度较A组减轻。详见图2。

图2 3组大鼠脑组织海马区HE染色图(×400)
2.3.2 海马区细胞凋亡情况 对照组各时间点均无或仅有极少数细胞发生凋亡,A组、B组大鼠于造模后约6 h开始出现凋亡细胞,24~48 h凋亡细胞数目进一步增加,72 h达到峰值,同一时间比较,B组凋亡细胞数目较A组减少,且高于对照组,差异有统计学意义(P<0.05)。详见表2、图3。

表2 各组大鼠不同时间点脑组织海马区神经细胞凋亡率(±s) 单位:%

图3 3组大鼠不同时间脑组织神经细胞凋亡情况(×400)
3 讨 论
国内外有多种模拟高胆红素血症脑损伤的方法,如经静脉[5]或经小脑延髓池注入[6]胆红素、皮下或腹腔注射盐酸苯肼[7]、使用基因缺陷Gunn大鼠[8]等。本研究采用陈舜年等[9]腹腔注射胆红素的方法,注射剂量为150 mg/kg,分析原因:选用腹腔注射胆红素,重复性好、简单经济、容易操作,成功率高。一项关于建立胆红素脑损伤模型的研究显示,观察造模后各组大鼠行为学及病理学变化,发现腹腔注射胆红素剂量50 mg/kg、100 mg/kg、150 mg/kg、200 mg/kg均可成功复制新生儿高胆红素血症模型,通过测定脑组织及血清S100B蛋白含量发现,若进行胶质细胞损伤方面的研究,注射胆红素剂量为150 mg/kg更合适[10]。
GM1在临床上广泛用于治疗各种脑出血、缺血再灌注损伤等,该药较安全,半数致死量(LD50)是872 mg/kg(静脉注射大鼠)至>8 g/kg(s.c.小鼠),各种动物(大鼠、小鼠、Beagle犬及兔)进行亚急性和慢性毒性试验、致畸试验、生殖毒性试验、围生期毒性试验及诱变性试验均未显示其任何毒性作用。相关研究显示,动物实验选用低剂量GM1即可发挥中枢神经系统保护作用[11-14]。本研究选择GM1剂量为10 mg/kg,与新生儿常用剂量每日20 mg(8 mg/kg)相近。
胆红素脑病是新生儿高胆红素血症严重的并发症,若不及时发现并进行早期干预,可能遗留锥体外系运动障碍、听觉异常、眼球向上运动受限、牙釉质发育不良等后遗症,给社会及家庭带来沉重负担[15]。临床诊断胆红素脑病主要依靠新生儿行为神经测评(Neonatal Behavioral Neurological Assessment,NBNA)、头颅磁共振(MRI)、脑干听觉诱发电位检查等,这些检查反映脑损伤情况滞后,临床早期诊断具有一定的局限性。新生儿胆红素脑病进展快,早期临床表现有精神萎靡、反应低下、嗜睡、拒乳等症状不典型,易被忽视,单纯依靠影像学检查易延误治疗,具有较高的致残率和致死率。有研究表明,S100B蛋白作为早期预测中枢神经系统损伤的生化指标[16],是一种钙离子结合蛋白,主要分布在星形胶质细胞中,在神经系统表达含量最多。多项研究显示,正常生理状态下,S100B蛋白存在于中枢神经系统,血清含量较少,当中枢神经系统受损时,激活星形胶质细胞分泌大量的S100B蛋白,使其在脑脊液中含量增加;同时S100B蛋白可透过损伤的血脑屏障进入血液循环,使其在血清水平升高[17-18]。有研究表明,胆红素脑损伤与血清S100B变化存在相关性,且随着胆红素脑损伤程度加重,血清S100B蛋白水平逐渐增高[19]。一项前瞻性研究显示,发生脑损伤时,短时间内血清S100B蛋白水平升高,达到峰值,并持续2 d[20]。本研究结果显示,A组和B组大鼠血清S100B蛋白水平6 h开始升高,24~48 h增长迅速,72 h达到峰值。有研究显示,S100B可预测新生儿脑损伤严重程度,灵敏度和特异度分别为100.0%、93.9%[21]。S100B蛋白在诊断和预测脑损伤严重程度方面有较高的灵敏度和特异度,临床应用广泛,在动静脉血液、脑脊液、尿液、唾液中均能检测到,且具有易取样、性质稳定、不受溶血等优点[22]。因此,S100B蛋白可作为早期诊断胆红素脑损伤的生化标志物。
胆红素是一种内源性的抗氧化剂,在生理状态下,可有效清除脂质过氧化物、氧自由基,具有一定的保护作用[23]。过量的胆红素,尤其是亲脂性的未结合胆红素可透过血脑屏障,沉积于脑组织中,引起能量代谢异常,诱发兴奋性氨基酸持续升高,钙离子超载,导致神经细胞水肿变性[24]。过量的游离胆红素通过刺激神经胶质细胞增生,减少髓鞘对脑组织造成毒性破坏,导致机体出现一系列异常行为表现[25]。神经节苷脂广泛存在于脊椎动物组织中,患泰萨氏幼年型黑白痴病(Tay-sachs病)的小儿脑中发现,脑白质含量很多,GM1通过选择性阻止兴奋性氨基酸类神经递质异常释放和重摄取,扭转酪氨酸羟化酶抑制脂质过氧化物作用及抑制脑细胞自噬等多种方式保护受损的脑组织[26-28]。GM1是可通过血脑屏障的神经节苷脂,通过血脑屏障嵌入细胞膜,保护神经细胞膜Na+-K+-ATP酶、Ca2+-ATP酶等相关生物酶活性,从而降低细胞膜转运机制,调节Ca2+、K+水平,减轻脑组织水肿[29-30],对损伤神经元的修复、再生发挥重要的保护作用。有研究显示,GM1通过促进星形胶质细胞糖酵解发挥作用,从而导致这些细胞摄取葡萄糖和释放乳酸,存在星形胶质细胞时培养神经元,GM1可增强线粒体活性并触发神经保护基因表达[31]。本研究结果显示,造模后A组、B组细胞排列紊乱,出现凋亡细胞,且与时间呈正相关,同一时间比较,B组细胞凋亡数目较A组减少,差异有统计学意义(P<0.05),表明随着胆红素进入脑组织时间延长,细胞凋亡数目和凋亡程度逐渐增加;同时观察到GM1可减轻神经细胞水肿变性,减少神经元细胞凋亡,对受损脑组织起到一定的保护作用,具体机制尚需进一步研究。
综上所述,S100B蛋白作为早期诊断新生儿高胆红素血症脑损伤的生化标志物之一,GM1可减轻胆红素对中枢神经系统的毒性作用,以期为临床提供实验依据。

