西蓝花种子EMS诱变条件筛选
李慧慧 丁强强 张书 张晓慧




摘 要:以西蓝花种子为材料,设置6个甲基磺酸乙酯(EMS)含量(w,后同)梯度(0、0.2%、0.4%、0.6%、0.8%、1.0%)与3个诱变时长(4、8、12 h)的处理组合,分析诱变后的种子发芽和M1植株表型的变异情况。结果表明,随着EMS含量的增加及处理时间的延长,西蓝花种子的发芽率、相对发芽率呈下降趋势,相对致死率呈上升趋势。0.6%EMS+12 h处理的西蓝花种子成苗率为50%,得到的M1表型变异类型包括花球嵌合体、叶色及叶形变异等。根据半致死率和M1诱变效果综合考虑,0.6%的EMS诱变处理12 h可作为西蓝花种子适宜的EMS诱变条件。
关键词:西蓝花;种子;EMS诱变;发芽率;表型
中图分类号:S635.3 文献标志码:A 文章编号:1673-2871(2022)06-035-06
Suitable conditions for EMS mutagenesis of broccoli seeds
LI Huihui DING Qiangqiang ZHANG Shu ZHANG Xiaohui
(1. Fuyang Academy of Agricultural Sciences, Fuyang 236065, Anhui, China; 2. Anhui Academy of Agricultural Sciences, Hefei 230041, Anhui, China)
Abstract: To determine proper condition of EMS mutagenesis of broccoli (Brassica oleracea var. italica) seed, six EMS concentration (0, 0.2%, 0.4%, 0.6%, 0.8%, 1.0%) and three treatment periods (4 h, 8 h, 12 h) were tested. Germination rate of the treated seeds and phenotype variation of M1 plants were statistically analyzed. The results showed that, with the increase of EMS concentration and the extension of treatment time, the seed germination rate and vigor showed a downward trend, and the relative fatality rate showed an upward trend. The seedling establishment rate was 50% for the treatment 0.6% EMS + 12 h. M1 plant phenotypic variation included curd mosaic, leaf color and leaf shape variation. Based on the consideration of semi-lethal rate and the mutagenic effect of M1, the 0.6% EMS and 12 h are suitable EMS mutagenic condition for broccoli seeds. This result provides a reference for carrying out related research work on EMS mutation breeding of broccoli.
Key words:Broccoli; Seed; EMS mutagenesis; Germination rate; Phenotype
西蓝花(Brassica oleracea var. italica)又称绿花菜、青花菜等,属十字花科甘蓝的一个变种,其口感佳,且富含萝卜硫苷、蛋白质、维生素C等物质,因而有“蔬菜皇冠”之称[1-3]。西藍花起源于地中海,近年来在中国的栽培面积快速增长。目前,西蓝花种植产业已经成为我国的优势产业之一,其面积约占全球的30%[4]。但在栽培过程中存在一个较为突出的问题,即我国所使用的95%以上的西蓝花种子主要从日本、荷兰等国家进口[4]。这个问题产生的主要原因之一是,我国掌握的西蓝花种质材料较少,且这些材料间遗传多样性较低,难以育成有突破性的品种[4]。因此,创制优异种质成为解决这个问题的关键环节。
诱变是植物获得新基因和新性状的手段之一,不仅比自然变异频率大、突变类型多,还可避免转基因带来的安全隐患问题。甲基磺酸乙酯(ethyl methyl sulfonate,EMS)是一种不会造成染色体畸变,又可以诱导点突变的化学诱变剂[5]。目前,EMS已经被广泛地应用于萝卜、玉米、马铃薯、大豆、小麦和水稻等作物的诱变育种[6-11]。迄今,关于西蓝花的研究多是在营养价值、栽培技术和采后贮藏等方面[12-14],关于EMS诱变西蓝花种子的研究还未见报道。因此,笔者利用不同EMS含量(w,后同)与诱变时长组合处理西蓝花种子,并统计分析种子发芽情况与M1的表型变化情况,以此探究西蓝花种子EMS诱变的适宜条件,为后续利用EMS诱变技术创制西蓝花种质资源提供参考。
1 材料与方法
1.1 材料
试验所使用的材料为耐寒优秀西蓝花杂交一代种子,来自日本坂田公司(SAKATA)。
1.2 方法
1.2.1 种子处理与发芽试验 发芽试验于2020年8月下旬在阜阳市农业科学院科技园区连栋温室中进行,期间日均气温为28 ℃,土壤相对湿度保持在70%~80%。设置6个EMS含量梯度(0、0.2%、0.4%、0.6%、0.8%、1.0%)与3个诱变时长(4、8、12 h)不同组合处理西蓝花种子,每个处理3次重复,每次重复50粒。不同梯度的EMS溶液使用含量0.1 mol·L-1、pH=7.0的磷酸缓冲液作为溶剂进行配制。处理的具体方法为:每个处理的种子(150粒)分别放在滤袋中,在水中浸泡14 h进行预处理,使其吸水萌动,然后吸去种子表面水分再进行不同组合的EMS处理。处理后的种子用流水冲洗2 h,取出轻微晾晒后播种在草炭土中。以后每3 d观察并记录1次西蓝花种子发芽情况,且以0 梯度的EMS处理作为对照组进行统计分析。
1.2.2 观察M1植株表型变异情况 2020年9月27日,苗龄30 d左右时,以行距60 cm、株距40 cm定植于普通塑料大棚中。以梯度为0的EMS处理的表型为对照,主要观察记录M1植株表型及花球表型变异情况,包括叶形、叶色、植株分枝、花球大小、花球颜色、蕾粒大小等。
1.2.3 统计相关的指标 发芽率/%=播后15 d发芽种子数/种子总数×100[15];相对发芽率/%=处理组的发芽率/对照组的发芽率×100[15];相对致死率/%=(1-相对发芽率)×100[15];成苗率/%=成苗株数/种子总数×100;变异率/%= 变异株数/总成苗株数×100。
1.3 数据处理
采用Excel 2016和SPSS 22.0进行试验数据的处理分析,采用Excel及Origin 7.5进行绘图。
2 结果与分析
2.1 不同含量EMS处理对西蓝花种子发芽动态的影响
由图1可以看出,与对照相似,低含量(0.2%和0.4%)的EMS处理4、8、12 h后,种子发芽基本在播后6 d完成,且集中在播后3 d。处理时间4 h时,当EMS含量为0.6%时,种子发芽在播后6 d基本完成,集中在前3 d;EMS含量为0.8%时,种子发芽在播后6 d基本完成,但1~3 d种子发芽量与4~6 d较为接近;EMS含量为1.0%时,种子发芽在播后9 d基本完成,且4~6 d种子发芽数最多。8、12 h与0.6%、0.8%、1.0% EMS的组合处理中,种子发芽在播后9 d基本完成,除0.6%和0.8%处理8 h的1~3 d种子发芽量与4~6 d较为接近外,其他组合处理的种子发芽量集中在4~6 d。说明较低含量的EMS溶液和较短的诱变时间对西蓝花种子发芽完成时间、发芽高峰期影响较小,较高含量(0.6%、0.8%和1.0%)的EMS处理时间较长(8 、12 h)会导致西蓝花种子发芽完成时间、发芽高峰期明显推迟。
2.2 不同含量EMS处理对西蓝花种子发芽率的影响
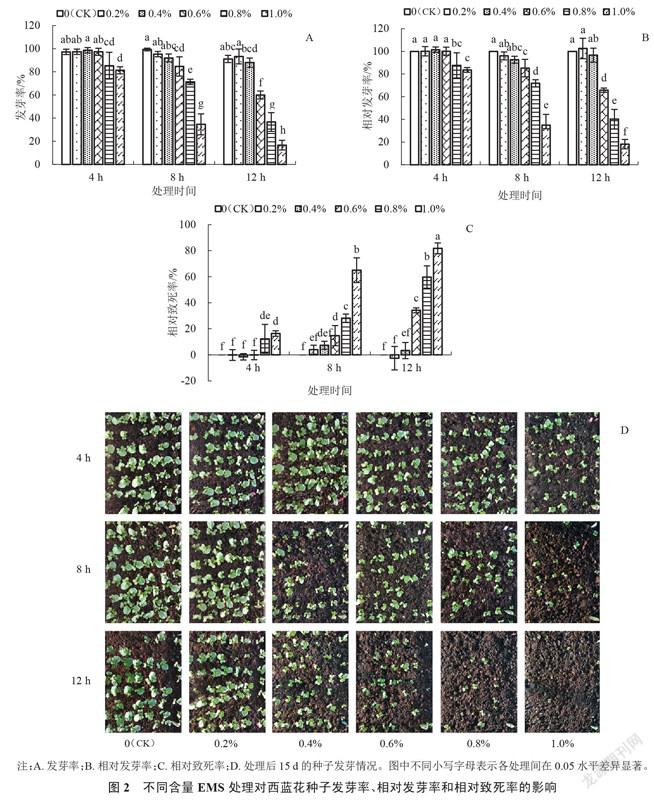
由图2可以看出,除0.4%EMS+12 h处理组合以外,较低含量的EMS(0.2%和0.4%)处理4 h、8 h和12 h种子的发芽率和相对发芽率均与对照差异不显著,各处理组合之间差异也不显著,发芽率和相对发芽率均在90%以上。使用0.6%的EMS时,种子的发芽率、相对发芽率和相对致死率在处理4 h时与对照差异不显著,但在处理8 h、12 h时发芽率和相对发芽率显著下降,不同的处理时间之间差异显著。使用更高含量的EMS(0.8%和1.0%)时,处理4 h、8 h和12 h均与对照差异显著,而且同含量下不同时间处理也差异显著,均表现为随着处理时间的延长种子发芽率、相对发芽率显著下降,相对致死率显著上升。从图2 也可以看出,EMS含量越高或处理时间越长,西蓝花种子发芽数就越少,1.0%EMS处理12 h后的种子发芽极少。综上可知,随着EMS含量及处理时间的增加会导致西蓝花种子的发芽率和相对发芽率下降,相对致死率上升。
由表1可知,EMS处理的含量和时间对西蓝花种子的发芽率影响均极显著,两者皆为影响西蓝花种子发芽的主要因素,同时EMS含量和处理时间的交互作用对西蓝花种子发芽的影响也极显著。因此,在使用EMS对西蓝花种子进行诱变时,应综合考虑EMS诱变含量和诱变时间。
2.3 不同含量EMS处理西蓝花种子对田间性状的影响
由图3可知,诱变处理的西蓝花M1植株整体长势明显弱于对照,且表现出整株变异、某一器官变异和某器官的一部分变异。西蓝花M1表型变异主要集中在叶片和花球上,如叶片变圆、叶片皱缩卷曲、叶片部分(或边缘)黄化或白化或黄绿化、花球颜色嵌合体、花球鹅黄色、花蕾变细小、花球小叶皱缩、花球变小、花茎黄化、花朵颜色变浅等,还有少数的植株变异,如分枝性变强、生长点畸变等。
由表2可知,随EMS处理含量的增加或者处理时间的延长,总表型变异率呈增加趋势,成苗率呈下降趋势。1.0%EMS+12 h处理下表型变异率高达80.00%,但成苗率仅有6.67%,且主要是畸变。EMS处理时间为8 h的组合,得到的表型变异类型较多,包括花蕾细小、花球颜色变异、叶片颜色变异等。花球是西蓝花最重要的经济性状,花球的诱变结果尤为重要。0.4%+8 h、0.6%+8 h、0.8%+8 h和0.4%+12 h EMS组合处理出现花蕾细小变异株分别为1、1、2、1棵。0.4%+8 h、0.6%+8 h、0.8%+8 h、0.6%+12 h、0.6%+4 h和0.8%+4 h EMS组合處理出现花球颜色嵌合体变异株分别为1、4、1、2、3、3棵,0.2%+8 h处理组合诱导1株西蓝花整个花球变为鹅黄色。总体上,0.6%+8 h、0.8%+8 h两个EMS处理得到的植株中花蕾细小、花球颜色变异比例较高,畸变比例中等。
3 讨论与结论
EMS处理是一种常用的诱变手段,不同作物或同种作物的不同器官对EMS诱变剂的敏感性存在一定的差异,因此相应的适宜诱变条件也不同。在进行EMS诱变时,大白菜种子的适宜条件为0.4%~0.6% EMS处理4 h,而大白菜花粉的适宜条件则为0.15% EMS处理45~60 min[16]。与杨楠等[15]、李林章等[17]及薛红霞[18]的研究结果一致,随着EMS含量的增加及诱变时间的延长,西蓝花种子的发芽率呈下降趋势。这可能是因为长时间的浸泡阻碍了种子的正常呼吸代谢过程,而高含量的诱变剂则产生毒害作用,从而抑制了种子萌发[19]。本试验结果显示,EMS含量、诱变时间以及两者的交互作用均对西蓝花种子发芽率产生极显著的影响。因此,在对西蓝花种子进行EMS诱变时应综合考虑EMS诱变含量和诱变时间。
适宜的诱变条件应同时满足较低的生理损伤和较高的突变频率,一般以造成半致死率的条件作为适宜诱变条件[17]。前人报道中分别将发芽率、相对发芽率、花粉活力、相对成苗率等指标的半致死剂量作为最佳条件[20-24]。在本试验中,EMS含量为1.0%时,处理8 h和12 h的成苗率都非常低,且M1畸变株占比大。这可能是EMS含量较高,造成种子内部生理性损伤较大,导致发芽率和成苗率低,不宜作为EMS诱导西蓝花种子的适宜条件。其他诱变条件,如0.2%+8 h处理出现鹅黄色花球,0.4%+8 h、0.6%+8 h、0.8%+8 h处理出现花球颜色嵌合体和花蕾变细小,在以后的相关研究中可被利用,但这些组合中EMS含量较低或处理时间较短,种子损伤较小,发芽率和成苗率较高,在M1筛选过程中工作量较大。0.8% EMS处理12 h,西蓝花种子的相对致死率为59.78%,但成苗率仅为30%,且突变体中主要是畸变株(占比96.88%),也不是最佳的EMS诱变条件。值得注意的是,0.6%+12 h组合处理的西蓝花种子成苗率为50%,得到的M1表型包含多种变异,包括花球嵌合体、叶色及叶形变异等。据徐美隆[25]报道,EMS诱导丽格海棠的变异株系中35%~45%变异株系为嵌合体,且其中一些嵌合体变异性状可以稳定遗传。因此,0.6%+12 h组合处理西蓝花获得的变异性状也有可能稳定遗传,具有利用价值。
综上所述,根据西蓝花M1变异率和成活率综合考虑,以50%成苗率作为半致死剂量,0.6%+12 h的EMS处理组合可初步作为西蓝花种子的适宜诱变条件。本试验结果可为开展西蓝花EMS诱变育种相关研究工作提供理论参考。
参考文献
[1] 张学杰,樊守金,孙稚颖,等.中国十字花科植物系统分类近期研究进展[J].武汉植物学研究,2003,21(3):267-272.
[2] 赵贵云,邓国庆,张祥明,等.阜阳市西兰花产业解惑破局之策[J].长江蔬菜,2019(1):4-7.
[3] 李爱莲.青花菜营养品质的分析及杂种优势的遗传研究[D].泰安:山东农业大学,2015.
[4] 施俊生.国家西兰花良种重大科研联合攻关进展及对策建议[J].浙江农业科学,2019,60(12):2223-2225.
[5] 刘威,杨峰,任旭东,等.EMS对种子萌发影响的进展[J].分子植物育种,2017,15(11):4585- 4589.
[6] 黄萍,李飞,颜谦.EMS诱变马铃薯抗寒突变体筛选[J].西南农业学报,2019,32(2):241- 245.
[7] 李世升,郑紫君,曾陈秋瑜,等.EMS诱变获得黄州萝卜雄性不育材料[J].北方園艺,2019 (8):58-62.
[8] 张纪元,张平平,姚金保,等.以EMS诱变创制软质小麦宁麦9号高分子量谷蛋白亚基突变体[J].作物学报,2014,40(9):1579-1584.
[9] 顾佳清,张智奇,周音,等.EMS诱导水稻中花11突变体的筛选和鉴定[J].上海农业学报,2005,21(1):7-11.
[10] 祝丽英,池书敏,刘志增,等.甲基磺酸乙酯(EMS)在创造玉米新种质中的应用[J].玉米科学,2001,9(3):14-17.
[11] 冯悟一,王楠,李朔,等.大豆EMS突变体种子品质鉴定[J].齐鲁工业大学学报(自然科学版),2016,30(2):22-26.
[12] 韩宇,朱振宇,沈敏熙,等.高温胁迫下硒硫互作调控西兰花芽苗生理及萝卜硫素代谢研究[J].核农学报,2020,34(6):1350-1358.
[13] 刘伟明,林俊,汪恩国.主要栽培技术对西兰花产量与品质的影响[J].中国农学通报,2010,26(15):274-280.
[14] 李庆鹏,崔文慧,郭芹,等.曲酸处理对鲜切西兰花品质及生理变化的影响[J].核农学报,2014,28(9):1664-1664.
[15] 杨楠,聂江力,辛微,等.化学诱变剂EMS对知母种子萌发的影响[J].植物研究,2019,39(2):246- 251.
[16] 卢银.EMS处理诱发大白菜变异的研究[D].河北保定:河北农业大学,2011.
[17] 李林章,余珊珊,宋慧.EMS处理青刀豆最佳诱变剂量的选择[J].长江蔬菜,2015(24):48-49.
[18] 薛红霞.黄瓜EMS突变体库的构建及鉴定[D].河北秦皇岛:河北科技师范学院,2018.
[19] 李娟宁,吕英,赵桂琴,等.化学诱变剂EMS和MNU对燕麦种子萌发和幼苗生长的影响[J].草原与草坪,2021,41(3):108-118.
[20] 程蛟文,钟建,程雨柔,等.苦瓜种子EMS诱变条件分析[J].中国蔬菜,2019(1):26-31.
[21] 康保珊,李俊香,刘丽锋,等.甲基磺酸乙酯诱变瓠瓜种子的条件筛选[J].中国瓜菜,2017,30(2):7-10.
[22] 叶卫军,杨勇,张丽亚,等.绿豆EMS诱变突变体库的构建及 表型分析[J].中国农学通报, 2020,36(17):36-41.
[23] VICENTE-DOLERA N,PINILLOS V,MOYA M,et al.An improved method to obtain novel mutants in Cucurbita pepo by pollen viability[J].Scientia Horticulturae,2014,169:14-19.
[24] 王春霞,何亚萍,李陈浩,等.西瓜种质M08甲基磺酸乙酯诱变条件筛选[J].中国瓜菜,2021,34(10):26-31.
[25] 徐美隆.丽格海棠遗传转化及离体诱变体系的研究[D].四川雅安:四川农业大学,2007.

