纤维蛋白原与前白蛋白比值在结直肠癌预后预测中的作用
季云,李学勇,高怡,张东丽
结直肠癌(colorectal cancer,CRC)是消化系统最常见的恶性肿瘤之一,全球范围内,其发病率和死亡率分别居肿瘤排行榜第3和第2位[1-2]。近年来,随着居民饮食方式的转变,CRC发病率明显增多,且患者呈年轻化趋势。与此同时,我国医疗水平的改善和居民保健意识逐渐增强,CRC检出率逐渐增多,但由于其病情隐匿,多数患者确诊时处于中晚期,错过最佳治疗时机,以致预后不满意[3]。外科手术是治疗CRC的最有效方式,但部分患者术后出现肿瘤复发或转移,这也是导致患者预后较差的主要原因。早期预测CRC患者预后风险,并在早期采用相对应的干预措施,可能对提高生存率有显著的促进作用。炎症反应在肿瘤的侵袭和转移中发挥重要作用,与患者预后相关。目前,已有多个炎症反应标志物用于肿瘤患者预后的预测,如中性粒细胞与淋巴细胞比值(neutrolphil to lymphocyte ratio,NLR)可用于肝癌的辅助诊断及预后评估[4]、C反应蛋白(C-reactive protein,CRP)与食管癌[5]、纤维蛋白原与白蛋白比值与胃癌[6]等,虽然可早期评估患者预后,但预测价值有限。纤维蛋白原与前白蛋白比值(fibrinogen to prealbumin ratio,FPR)是新型炎症反应标志物,既往研究显示,FPR表达水平与胃癌直径、分化程度、TNM分期以及脉管浸润状态有关,且能反映患者生存率[7-8]。目前,FPR与CRC患者预后风险关系的研究较少。本研究探讨FPR预测CRC患者预后的临床价值,报道如下。
1 资料与方法
1.1 研究对象
本研究经我院医学伦理委员会批准,回顾性分析2011年1月至2015年12月我院诊治的398例CRC患者的临床资料。其中男性252例,女性146例;年龄43~76岁,平均年龄(60.26±8.34)岁。纳入标准:①患者行根治性切除术,组织病理证实为原发性CRC;②首诊首治,术前未行放化疗,术后按照指南治疗[9];③术前临床资料完整患者;④均签署知情同意书。排除标准:①转移性CRC或合并其他部位恶性肿瘤者;②手术切缘阳性患者;③合并血液系统疾病或近期输血、献血者;④近期使用免疫抑制剂者;⑤合并其他急慢性感染性疾病或威胁生命的疾病;⑥合并肝肾疾病、凝血功能异常者;⑦预后信息缺失者。
1.2 方法
1.2.1 资料收集 通过电子病历系统收集患者的临床资料,包括:①基本资料:年龄、性别等;②血液学指标(术前指标,如术前多次检测,取均值):纤维蛋白原(Fibrinogen, Fib)、前白蛋白(prealbumin, PA)、白蛋白(albumin, Alb)、NLR、CRP、FPR、CEA、CA19-9等;③肿瘤特征:部位、直径、TNM分期、分化程度、淋巴管转移、浸润深度等,其中TNM分期依据国际指南(第8版)规定[10]。NLR=中性粒细胞计数/淋巴细胞计数;FPR=纤维蛋白原(g/L)/前白蛋白(g/L)。
1.2.2 随访 对所有患者随访,采用门诊、电话、再入院等形式随访。术后12个月内每3个月随访1次,之后每6个月随访1次,共随访5年。记录患者总生存期(overall survival,OS)。
1.3 统计学方法

2 结果
2.1 FPR预测CRC患者预后
398例患者,术前FPR为5.36~89.73,中位数为20.56。共随访60个月,398例CRC患者中位OS为35个月,5年累积生存率为77.89%(310/398)。ROC曲线分析显示,FPR预测CRC患者5年内死亡的AUC为0.853(95%CI:0.802~0.904),敏感度77.27%、特异度为75.16%,临界值为22.35,见图1。

图1 FPR预测CRC患者5年内死亡的ROC曲线图
2.2 高/低FPR患者的临床特征比较
根据ROC曲线的临界值(22.35),将患者分为高FPR组(>22.35)103例,低FPR组(≤22.35)295例。
高FPR组(>22.35)患者年龄>60岁、TNM分期Ⅱ-Ⅲ期、浸润深度T3-T4、淋巴结转移N1-N2比率高于低FPR组(≤22.35),5年生存率低于FPR组(≤22.35),见表1,图2。
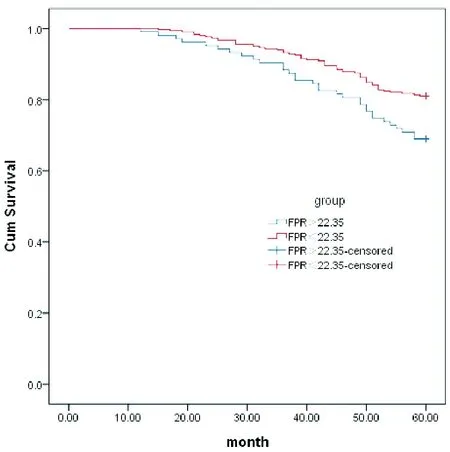
图2 两组Kaplan-Meier生存曲线比较

表1 高/低FPR患者的临床特征比较
2.3 CRC患者预后影响因素分析
以年龄、性别、FPR等为自变量,OS为因变量进行Cox回归分析。单因素分析显示,Fib、PA、NLR、CRP、FPR、TNM分期、淋巴结转移、浸润深度有统计学意义(P<0.05),进一步将单因素分析具有统计学意义的指标纳入模型进行多因素Cox回归分析,结果显示FPR>22.35、TNM分期Ⅱ-Ⅲ期、浸润深度T3-T4、淋巴结转移N1-N2是CRC患者5年内死亡的独立危险因素,见表2、3。

表2 CRC患者死亡危险因素的单因素Cox回归分析
3 讨论
随着我国人口老龄化加剧,我国CRC病例呈增高的趋势,但由于其发病隐匿,早期无特异性症状,难以进行早期诊断,内镜是诊断CRC的最有效方法,但其为有创检查,难以作为筛查手段广泛应用。据报道,超过五分之三的CRC病例确诊时处于中晚期状态,极大程度地影响了患者预后[3]。关于CRC的生存率,不同的研究中存在较大差异。段军等[11]对120例CRC患者术后随访,结果显示5年生存率为47.55%~63.12%。大型回顾性分析结果显示,CRC患者5年累积生存率为73.87%,5年无进展生存率为72.25%,且年轻患者(45岁以下)5年OS率显著缩短[12]。Simon等[13]研究显示,临床分期为早期CRC患者5年生存率可高达90%,而出现远处转移者5年生存率不足15%。本研究结果显示,398例行根治术CRC患者5年累积生存率为77.89%,与信亚晨等[14]研究报道结果相近。不同研究之间,CRC预后生存率差异较大的原因,笔者认为可能与以下因素有关:①纳入患者的临床特征不同,如临床分期、治疗方式(根治术手术、姑息术式)、是否辅助治疗等;②患者基础状况不同,如年龄、合并慢性疾病等,均影响患者生存预后。因此,CRC患者生存率存在明显的差异,早期进行风险评估具有重要意义。
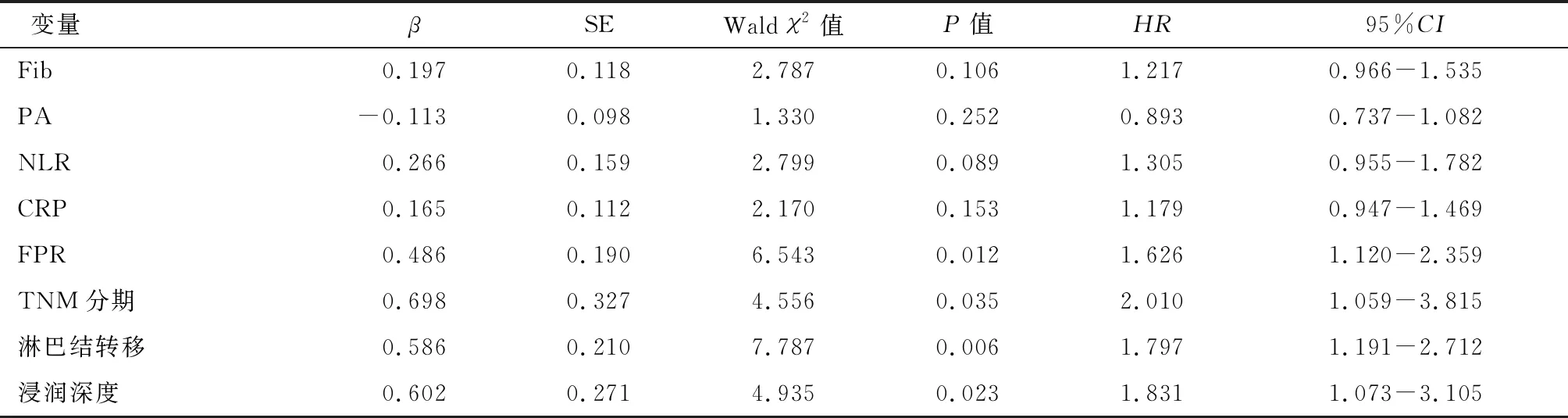
表3 CRC患者死亡危险因素的多因素Cox回归分析
TNM分期是临床常用的CRC患者预后评估指标,一般来说分期越高,患者预后越差。文献显示,TNM分期Ⅰ期患者5年累积生存率约为Ⅳ期患者的4倍[12]。本研究结果显示,TNM分期为Ⅱ-Ⅲ期是CRC患者预后的危险因素,与既往报道一致[15]。但单独TNM分期预测CRC预后的临床价值有限,常需结合其他指标如炎症指标、浸润深度、淋巴结转移状态等[16]。CEA、CA19-9等肿瘤标志物是CRC辅助诊断的常用指标,但其在患者生存期的预测中应用受限,且部分良性病变患者中CEA、CA19-9也会显著升高,导致假阳性结果[17]。研究显示,单一CEA诊断CRC的敏感度仅为46.6%,其联合CA19-9的敏感度也不超过50%(49.5%)[18]。因此,亟需寻找新的分子标志物用于CRC的预后评估。
研究显示,肿瘤的复发及转移除了与其侵袭、进展特性有关外,肿瘤微环境在其中起重要作用[19]。炎症细胞诱导的炎症反应是肿瘤微环境的重要组成成分,其在肿瘤进展中的作用逐渐得到重视。炎症反应在肿瘤进展的作用[20]:①炎症反应导致的炎症损伤及其对局部pH的影响,为肿瘤的转移和侵袭提供了适宜的环境和基础;②炎症因子可介导肿瘤细胞免疫逃逸,不利于肿瘤细胞的清除。Alb是血浆主要蛋白,其主要由肝脏合成,用于评估营养状态。肿瘤细胞进展过程中,由于代谢加快,细胞合成过程需要大量蛋白,侵袭过程需要大量营养物质供应,易导致机体营养不良。同时,大量蛋白质消耗影响正常蛋白质的合成,如抗体、补体等,降低机体免疫功能,进一步为肿瘤进展提供有利条件。既往报道显示,Alb降低(≤37 g/L)的CRC患者预后不良的风险是Alb正常患者(>37 g/L)的5.37倍[21]。但Alb受多种因素的影响,且年龄在一定程度上也影响Alb水平。PA甲状腺素蛋白,与Alb功能类似,亦可反映机体营养状况,且与炎症反应关系密切。与Alb相比,PA的半衰期更短,对营养状况的变化更敏感[22]。国外研究显示,PA降低是CRC患者预后不良的独立危险因素[23]。周航亮等[24]对212例CRC患者研究表明,PA升高与CRC患者OS延长有关(HR=0.52, 95%:0.39-0.83)。但亦有研究显示,PA水平与CRC患者临床分期、浸润深度、有无脉管浸润及神经侵犯等均无关系,其在肿瘤患者预后中的作用需进一步明确[25]。本研究单因素分析显示,PA与CRC患者OS率有关,经多因素Cox校正后PA对OS率无显著影响,与上述报道结果一致。可能是由于随着居民生活水平的日益提高,营养摄取呈过剩状态,营养不良较少见有关。
Fib是肝脏合成的二聚体,不仅参与凝血,且与炎症反应关系密切。其促进肿瘤的机制[26]:①促进新生血管的生成,并促进炎症因子分泌,有利于肿瘤细胞远处转移;②Fib升高提示血液呈高凝状态,有利于肿瘤细胞的黏附功能;③可转化为纤维蛋白,发挥肿瘤细胞保护作用。有研究显示,CRC患者中血浆Fib水平显著上调,且与肿瘤的浸润深度、淋巴结转移呈正相关[17]。Son等[27]对624例CRC患者进行回顾性分析表明,血浆Fib升高与TNM分期呈正相关,且是DFS、OS缩短的独立危险因素。但近期研究显示,Fib升高与CRC患者OS无明显关系[14]。钱香等[17]亦得到了类似的结果,认为Fib水平并不是CRC患者预后的影响因素。本研究多因素Cox回归分析未显示Fib与CRC患者OS有关,符合最新报道结果。可能是与Fib表达特异性较差有关。
FPR是Fib与PA的比值,可综合反映肿瘤患者的凝血功能、营养状况及炎症反应水平。既往研究显示,FPR高表达胃癌患者的低分化程度、肿瘤直径≤3 cm、有脉管侵犯及淋巴管转移比例显著高于FPR低表达患者[8]。信亚晨等[14]在CRC患者中,也得到一致的结论。本研究结果显示,FPR表达水平与TNM分期、浸润深度、淋巴结转移状态呈正相关,与最新报道相符[14]。关于FPR对肿瘤患者的生存率的影响,周航亮等[24]研究显示,FPR>18.00的CRC患者OS显著缩短,多因素分析显示,FPR>18.00患者预后不良的风险是FPR≤18.00患者的3.4倍。信亚晨等[14]比较不同FPR水平CRC患者的预后,结果发现FPR>21.47组OS及5年累积生存率均降低,多因素校正后FPR>21.47是CRC患者预后不良的独立危险因素。Fan等[23]亦认为,FPR降低有利于CRC患者生存率的改善。本研究多因素Cox回归分析显示,FPR>22.35是CRC患者累积生存的独立危险因素,提示FPR升高与患者不良预后有关。可能是由于FPR越高,提示炎症反应较强,持续的炎症反应促进肿瘤远处转移;血液高凝有利于肿瘤细胞黏附于血管内皮,转移至远处器官;而营养过度消耗甚至呈恶病质状态能降低机体的免疫监视、防御功能,有利于肿瘤细胞免疫逃逸,综合原因导致预后较差。本研究ROC曲线显示,FPR以22.35为临界值,预测CRC患者5年内死亡的AUC高达0.853,且敏感度和特异度均较高,提示具有较高的预测价值。
综上所述,FPR水平与CRC患者预后有关,其以22.35为临界值对CRC患者生存率具有较好的预测作用,且FPR检测方便,费用较低,有助于临床对CRC患者预后的早期评估。本研究还存在以下局限性:①未对FPR变化进行动态监测;②如何将本研究结果转化为临床应用,需进一步探讨。

