杨梅素类衍生物H10对肺癌细胞H460影响的体外实验研究
李 艳,刘 静,刘 健
(蚌埠医学院第一附属医院妇瘤科,安徽 蚌埠 233000)
研究表明,杨梅素具有多种病理生理特性,包括抗氧化、抗病毒、抗微生物和抗血小板特性[1-2]。杨梅素可通过多种方式发挥抗肿瘤作用,如抑制异常细胞增殖、诱导凋亡;激活相关信号通路;抑制血管生成和肿瘤转移[3-5]。在多种类黄酮化合物研究中,杨梅素抑制酶活性和细胞增殖活性作用最强[6]。本团队一直致力于在研究杨梅素衍生物体外抗肿瘤活性,其中发现杨梅素衍生物H10[5,7-二甲氧基-3-(4-(4-(3-三氟甲基苯基)磺酰基)哌嗪-1-基)丁氧基-2-(3,4,5-三甲氧基苯基)-4H-色烯-4-酮,结构式如图1]表现出对人大细胞肺癌细胞H460有较好的体外抗肿瘤活性。研究证实天然产物在控制癌症进展方面具有显著效果。本团队以天然产物杨梅素的衍生物H10为研究对象,检测了该目标化合物对人大细胞肺癌细胞H460体外生物活性,以期为该类药物的开发提供理论基础。
1 材料与方法
1.1 材料人类肺腺癌细胞(H460)购自普诺赛生命科技有限公司,RPMI medium1640培养基(美国GIBCO 公司)、DMEM培养基(美国GIBCO公司)、四甲基偶氮唑盐(MTT)、胰酶、细胞凋亡检测试剂盒、DMSO、DAPI、ACTIN染色剂购自上海碧云天生物技术有限公司。
1.2 细胞培养H460细胞用含体积分数为10%胎牛血清的RPMI1640、DMEM培养液在37 ℃、5%的CO2培养箱中培养。
1.3 H10制备和储存液及工作液的配制以杨梅苷为原料,碘甲烷为甲基化试剂,在酸性条件下脱苷得到3-羟基-5,7-二甲氧-2-(3,4,5-三甲氧基苯基)-4H-色烯-4-酮(杨梅素中间体1),然后再与1,3-二溴丙烷或1,4-二溴丁烷反应生成中间体2。取代磺酰氯和哌嗪反应制得中间体6,根据活性拼接原理,然后中间体6与中间体2反应合成一系列含磺酰胺的杨梅素衍生物B,其合成路线如图1。
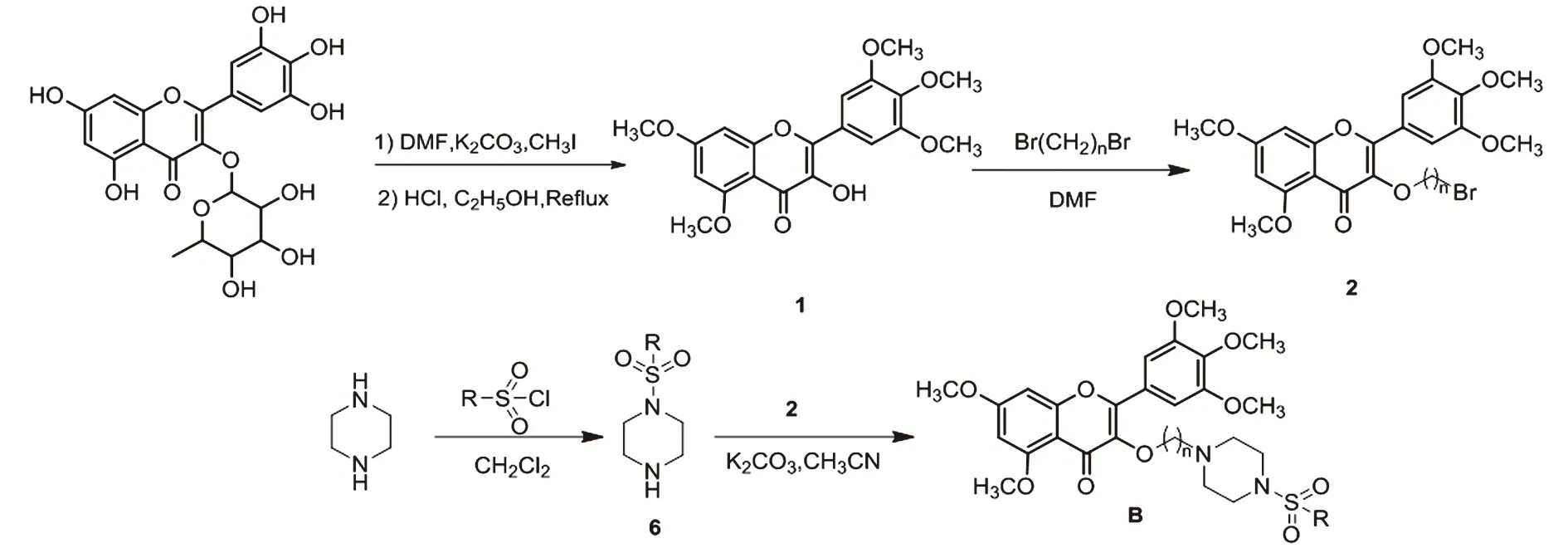
图1 含磺酰胺的杨梅素衍生物B系列的合成路线
本研究中的目标化合物H10(结构式如图2)为杨梅素衍生物B系列之一。
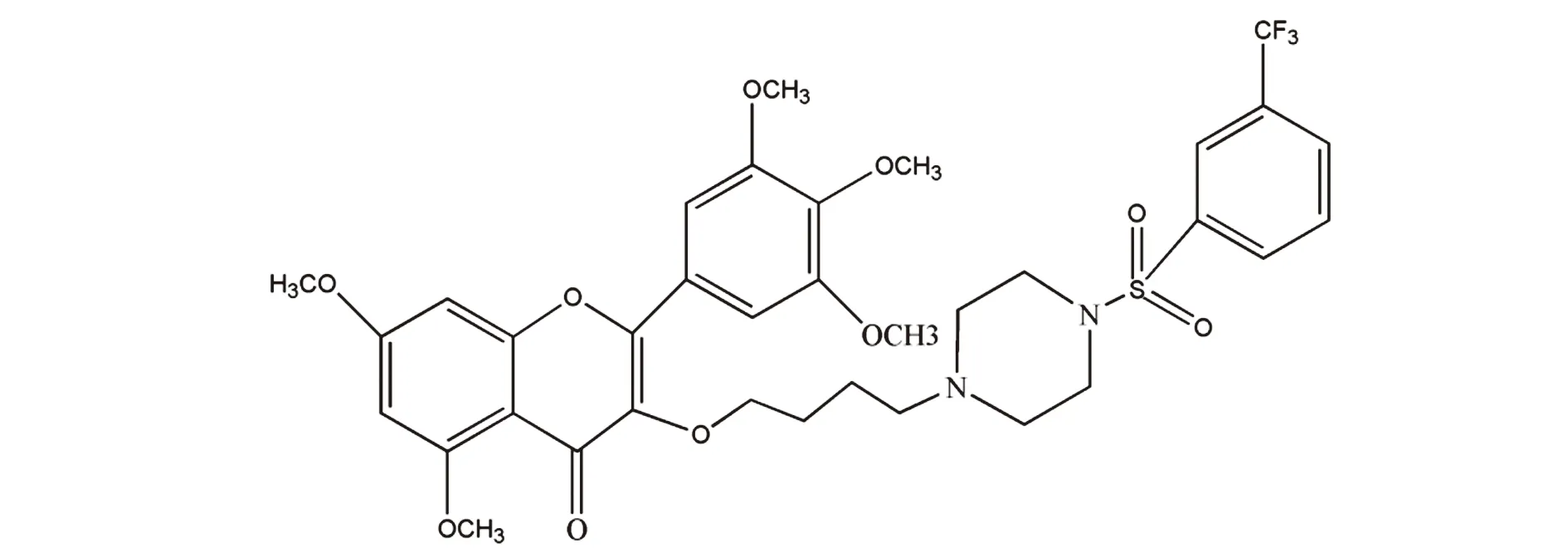
图2 杨梅素衍生物H10的结构式
以DMSO为溶剂、配制20 mM、10 mM、5 mM、2 mM、1 mM、0.5 mM、0.1 mM浓度的H10作为储备溶液,并在4 ℃下储存。在含有10%胎牛血清的RPMI-1640完全培养基中进行进一步的稀释液作为工作液。
1.4 四甲基偶氮唑盐法(MTT比色法)取对数生长期细胞,接种于96孔板,细胞密度在每孔3000。板四周每孔各加100 μL的无菌水封边,培养箱培养24 h后,取20 mM、10 mM、5 mM、2 mM、1 mM、0.5 mM、0.1 mM浓度的H10储存液在含有10%胎牛血清的RPMI-1640完全培养基中,按1∶1000配成工作液,每组6个复孔,DMSO按比例1∶1000稀释作为阴性对照组。培养箱培养48 h,随后每孔加入10 μL的MTT工作溶液,放置保温箱继续培养4 h后,加入DMSO溶解形成MTT在细胞内形成的甲瓒,酶标仪测定OD-592 nm,计算每个浓度的抑制率。抑制率(%)=[1-(处理组OD值-空白对照组OD值)/(阴性对照组OD值-空白对照组OD值)]×100%。
1.5 DAPI-Actin染色将H460细胞(3×104)接种于24孔板中,培养箱中培养过夜,取10 mM的H10储备液0.8 μL加入到0.8 mL的完全培养基中,DMSO作阴性对照,24 h后,PBS洗两遍,4%多聚甲醛固定30 min。加入Actin-tracker-green染色液,每孔200 μL,孵育30 min,PBS洗两遍,每次5 min。加入1 μg/mL DAPI染色工作液,每孔200 μL,孵育10 min。PBS洗两遍,每次5 min。荧光倒置显微镜下观察。
1.6 细胞克隆形成实验取对数生长期的细胞,于6孔培养板中接种细胞,每孔500个细胞,置37 ℃、5% CO2及饱和湿度的细胞培养箱中培养过夜,取2 mM、5 mM、10 mM的H10储备液2 μL加入到2 mL的完全培养基中培养48 h,DMSO作阴性对照,根据细胞状态更换培养基,培养2~3周。当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用PBS小心浸洗2次。加入甲醇1 mL/孔,固定25 min。去固定液,加适量结晶紫染色液,染色10 min。用流水缓慢洗去染色液,空气干燥。
1.7 细胞成像将细胞暴露于10 μM的H10药物48 h,并通过倒置显微镜观察药物作用后细胞的形态学变化。
1.8 伤口愈合实验取对数生长期细胞,预先在6孔板底画直线,间距为0.5 cm,接种细胞密度每孔8×105。保温箱培养24 h后,用200 μL的黄色枪头垂直于直线,刮出划痕,PBS清洗两次,于倒置显微镜下观察拍照(0 h拍照),取10 mM的H10储存液2 μL加入到2 mL的完全培养基中,DMSO作阴性对照,24 h后取出,PBS清洗两次,倒置显微镜下观察拍照,利用 Image J计算划痕面积值。迁移率(%)=[(0 h划痕面积-24 h划痕面积)/0 h划痕面积]×100%
1.9 流式分析细胞凋亡将H460细胞(2×105)接种于6孔板中,保温箱过夜,取10 mM的H10储存液2 μL加入到2 mL的完全培养基中,同上,DMSO作阴性对照,保温箱培养48 h。收集细胞,悬浮在结合缓冲液中。加入2.5 μL FITC Annexin V和1 μL碘化丙啶(PI),室温黑暗中孵育30 min。流式细胞仪检测,使用FlowJo-V 10软件分析细胞凋亡率。
1.10 数据分析计量数据用“均数±标准差”表示,使用Graphpad Prism 8.0软件分析作图,统计方法采用两样本t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 H10抑制H460细胞的增殖能力MTT比色法结果如图3,将40 mM、20 mM、10 mM、5 mM、2 mM、1 mM、0.5 mM、0.1 mM H10储存液在RPMI-1640完全培养基中进一步稀释,作用肺癌细胞H460细胞48 h,与对照组相比,随着浓度的升高,细胞抑制率逐渐增加,P<0.001,具有统计学意义。
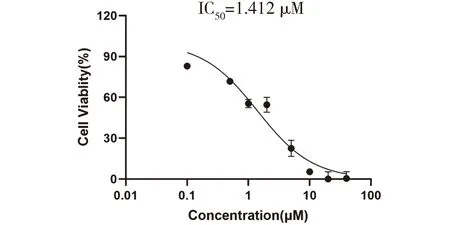
图3 H10在肺癌细胞H460中IC50值
2.2 H10处理H460细胞后,促使细胞形态皱缩、变圆及碎裂倒置显微镜下观察,结果如图4,将80 mM、40 mM、10 mM、5 mM、1 mM的H10储存液在RPMI-1640完全培养基中按1∶1000进一步稀释。随着H10药物浓度增加,H460细胞数目明显减少,细胞缩小,变圆变亮,周围出现细胞碎片。
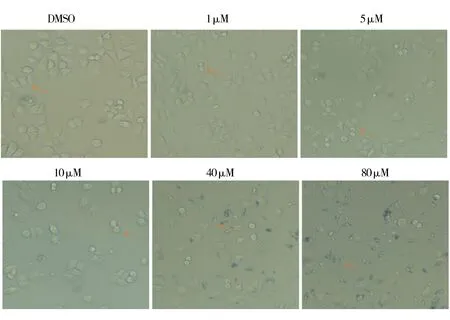
图4 H10处理肺癌细胞H460后形态学变化
2.3 H10抑制H460细胞形成克隆斑结果如图5,将浓度为10 mM、5 mM、2 mM的H10按1∶1000配成工作液作用肺癌细胞H460细胞,与DMSO对照组相比,实验组细胞随着H10药物浓度的升高,克隆细胞团的数目明显减少。DMSO组的克隆形成率为(101.93±8.86)%;2 μM浓度组:(39.67±4.64)%;5 μM浓度组:(21.67±1.7)%;10 μM浓度组:(4.13±0.5)%;P<0.001。
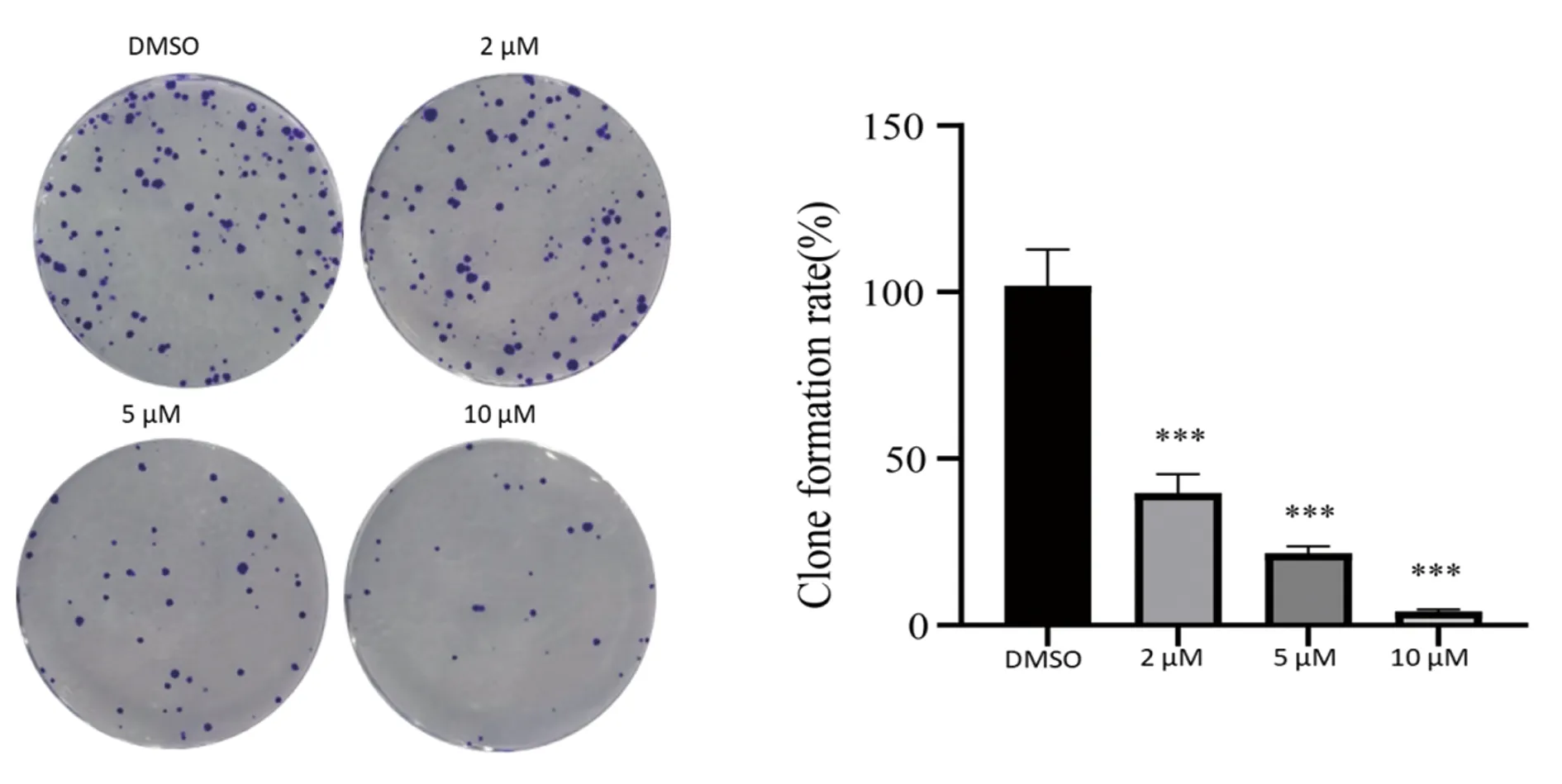
图5 H10处理肺癌细胞H460后的克隆斑形成结果
2.4 H10促使H460细胞结构改变结果如图6,将浓度为10 μM的H10作用肺癌细胞H460细胞24 h,观察到对照组细胞形态呈近椭圆形,外观较大,染色均匀,实验组细胞数量减少,细胞骨架结构发生改变,形态呈近不规则,外观较小,染色不均匀,胞核开始出现明显的固缩或分裂,多可看到胞质及核碎块状荧光,即典型的凋亡细胞核特征。
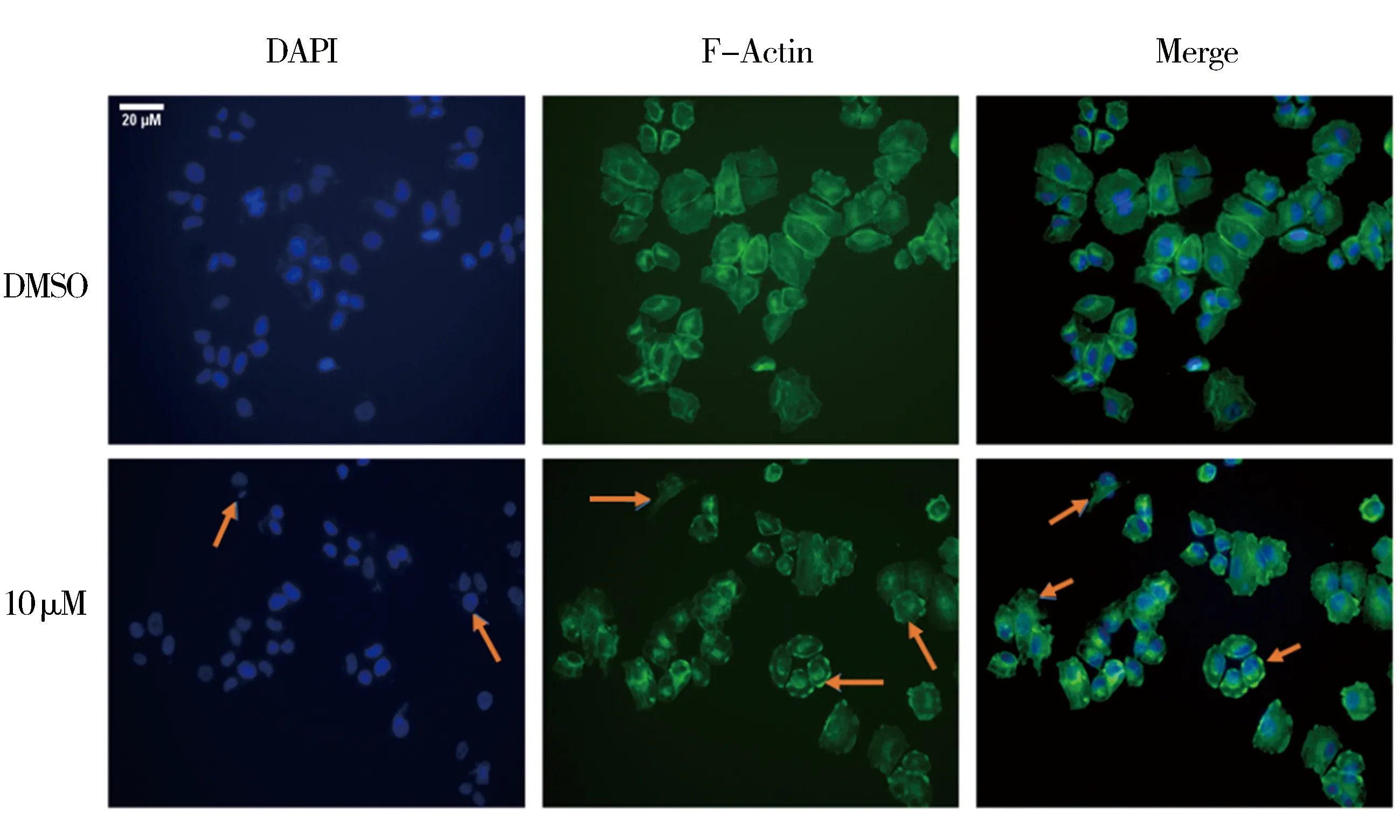
图6 H10处理肺癌细胞H460后的免疫荧光染色结果
2.5 H10抑制H460迁移结果如图7,将浓度为10 μM的H10作用肺癌细胞H460细胞24 h,与对照组相比,实验组细胞的迁移率明显被抑制。对照组迁移率为(14.82±1.82)%,实验组迁移率为(10.00±1.32)%,P=0.02。

图7 H10处理肺癌细胞H460后的细胞迁移结果
2.6 H10诱导H460凋亡Annexin V-FITC/PI双标记法检测细胞凋亡结果如图8,使用浓度为10 μM的H10处理H460细胞48 h后,与对照组相比,对照组的总凋亡率(早期凋亡+晚期凋亡):(10.22±0.82)%;实验组细胞凋亡率明显增加,总凋亡率:(50.27±5.05)%;P=0.00038。

图8 H10处理肺癌细胞H460后的凋亡结果
3 讨论
肺癌是最常见的肿瘤死亡原因。治疗手段主要以手术为主,辅以放化疗治疗[1]。然而放化疗的不良反应严重,目前急需一种有效方法,减轻癌症患者症状,加强治疗疗效。自然界中,多酚类物质种类繁多,人类饮食中最常见的多酚类物质是类黄酮[2]。黄酮类化合物具有抗菌、抗病毒、抗炎、抗氧化、低毒等特性[3-4]。研究表明,黄酮类化合物可增强化疗疗效,改善患者预后[1,5-6]。其中杨梅素是一种作用较强的黄酮类化合物,在多种肿瘤中均可影响肿瘤的恶性进程,如肝癌、乳腺癌、甲状腺乳头状癌等[4-10]。目前杨梅素类药物是否使患者获益的相关临床研究数量较少,临床前研究数据的增加支持了杨梅素的有益作用[2]。因此,研究这类药物在抗肿瘤、辅助放化疗等方面的作用值得我们进行的深入研究。
本课题组一直致力于研究杨梅素类衍生物的抗肿瘤活性筛选。本研究以肺癌细胞H460细胞为筛选模型,使用MTT比色法进行筛选,结果表明杨梅素类衍生物H10表现出较强体外抗肿瘤作用。因为在肿瘤的发生发展过程中,细胞增殖、迁移等行为学变化,细胞畸形、细胞膜泡的形成、凋亡小体的出现和核碎裂等形态学变化是十分重要的[11]。因此H10对细胞的影响具有潜在的研究价值。本研究将不同浓度H10作用肺癌细胞H460细胞后,不仅测出细胞的吸光度值随浓度增加而减小,还观察到细胞形态随浓度增加而缩小、皱缩。取浓度为10 μM的H10处理肺癌细胞H460细胞,通过细胞伤口愈合实验及流式分析凋亡实验,观察到H10可明显抑制肺癌细胞H460细胞的迁移及诱导细胞凋亡。有研究表明,杨梅素可通过抑制BRCA1-GADD45信号通路诱导乳腺癌细胞凋亡[12];抑制PI3K/Akt/mTOR信号转导诱导人结肠癌细胞凋亡[13]。下调基质金属蛋白酶-2/9活性抑制乳腺癌细胞转移;抑制PIM1和干扰PIM1/CXCR4的相互作用可有效抑制前列腺癌的转移。下调YAP的表达抑制肝细胞癌的生长。根据杨梅素的抗肿瘤机制中,PI3K/Akt是诱导凋亡的明星途径,下调基质金属蛋白酶是研究迁移的主要机制,杨梅素衍生物H10发挥抗肿瘤作用是否同杨梅素,还需要进一步的实验验证。本研究在肺癌H460中,证实H10具有显著的抗肿瘤作用,不仅影响H460细胞形态和结构变化,还可抑制细胞增殖、迁移及诱导凋亡,其中诱导凋亡具有显著结果。鉴于此,我们下一步将研究杨梅素衍生物H10在体外诱导凋亡的分子通路,由于H10可影响H460形态和结构的改变,因此我们可从此方面研究H10是否通过影响细胞膜蛋白的传导激活其下游蛋白,引发结构发生改变及诱导细胞走向凋亡。

