茯苓多糖调节2型糖尿病模型大鼠肝脏糖异生的机制研究
韩思婕 潘翔 朱芊芊 张丹丹 张涵瑞 方敬贤 魏琼 刘丹 叶晓川




关键词茯苓多糖;2 型糖尿病;氧化应激;PI3K/Akt/FoxO1通路;糖异生
2 型糖尿病占糖尿病发病例数的90%以上,由2 型糖尿病导致的并发症大多与患者的高病死率有关[1-2]。目前,临床上用于治疗糖尿病的双胍类药物具有明显的副作用[3]。而中药在治病救人方面有几千年的历史,更是在防治2 型糖尿病及其并发症方面具有多靶点、多途径、个体化等不可替代的优势,因此,寻找标本兼治、副作用小、疗效稳定的中药及其有效成分治疗糖尿病是国内外研究的重点。
茯苓为多孔菌科真菌茯苓Poria cocos(Schw.)Wolf的干燥菌核,具有利水渗湿、健脾、宁心的功效[4]。糖尿病属中医“消渴症”范畴,而茯苓是中医治疗消渴症的高频用药[5]。茯苓多糖为茯苓菌核中的主要成分,占菌核质量的70%~80%[6],具有抗肿瘤、抗炎、保肝、调节免疫等多种药理作用[7]。有研究报道,茯苓多糖能通过调节肠道菌群来改善肥胖小鼠的糖脂代谢,减轻肝脏脂肪变性[8]。多项研究表明,茯苓多糖可以减轻糖尿病肾病小鼠的肾损伤[9-11]。在生理条件下,机体血糖水平通过体内葡萄糖产生和摄取间的动态平衡来维持稳定。糖异生是将一些非糖前体,如乳酸、甘油、生糖氨基酸等转变为葡萄糖的过程,肝脏糖异生是导致内源性葡萄糖生成增加的重要原因,而2 型糖尿病患者中糖异生作用异常活跃[12]。目前已有研究证明,抑制肝脏糖异生是治疗2型糖尿病的有效策略[13]。另有研究证实,磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/叉头框转录因子O1(forkheadbox transcription factor O1,FoxO1)信号通路可调节肝脏糖异生[14]。本研究主要探讨茯苓多糖是否可以通过调节PI3K/Akt/FoxO1 通路,抑制糖异生关键酶——磷酸烯醇丙酮酸羧化激酶(phosphoenolpyruvate carboxykinase,PEPCK)和葡萄糖-6- 磷酸酶(glucose-6-phosphatase,G6Pase)的蛋白表达,进而调节2 型糖尿病模型大鼠血糖,以期为阐明茯苓多糖发挥降血糖的作用机制提供数据支持。
1 材料
1.1 仪器
LiDE110 型凝胶成像仪购自日本Canon 公司;Spark10M型酶标仪购自瑞士Tecan 公司;Centrifuge 5810R型高速离心机购自德国Eppendorf 公司;530 活力型手持血糖仪购自江苏鱼跃医疗设备股份有限公司;WTM-1812D型膜分离实验设备、ST-2B-1812 型微滤膜元件、V0.2-2B-1812 型超滤膜元件均购自杭州沃腾膜工程有限公司;FD-1A-50 型冷冻干燥机购自北京博医康实验仪器有限公司;Eclipse E100 型光学显微镜、DS-U3 型成像系统均购自日本Nikon公司。
1.2 药材与试剂
茯苓药材采自湖北省英山县石头咀镇,经湖北中医药大学药学院叶晓川教授鉴定为多孔菌科真菌茯苓P.cocos(Schw.)Wolf 的干燥菌核。盐酸二甲双胍片(批号ABU7707,规格0.5 g/片)购自中美上海施贵宝制药有限公司;链脲佐菌素(streptozotocin,STZ,批号301V021,规格1 g)购自北京索莱宝科技有限公司;三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)、肝糖原试剂盒(批号分别为20210423、20210426、20210422、20210420、20210425、20210426、20210420)均购自南京建成生物工程研究所;苏木素-伊红(HE)染液套装、RIPA 裂解液(批号分别为G1003、CR2103126)均购自武汉赛维尔生物科技有限公司;TBST缓冲液(批号21128946)购自合肥白鲨生物科技有限公司;兔抗磷酸化PI3K(p-PI3K)、甘油醛-3-磷酸脱氢酶(GAPDH)(批号分别为ab182651、ab181602)均购自英国Abcam 公司;兔抗磷酸化Akt(p-Akt)、兔抗磷酸化FoxO1(p-FoxO1)(批号分别为#4060、#9461)均购自美国CST 公司;兔抗G6Pase(批号LS-C446262)购自美国LSBio 公司;兔抗PEPCK(批号14892-1-AP)购自武汉三鹰生物技术有限公司;辣根过氧化物酶标记的山羊抗兔IgG 二抗(批号AS1107)购自南非Aspen 公司;磷酸和氢氧化钠均为食品级;水为纯水。
1.3 动物
SPF 级SD 大鼠购自湖北省医学实验动物中心,动物许可证号为SCXK(鄂)2020-0018,动物合格证号为42000600040888。动物实验经湖北中医药大学伦理委员会批准,批准号为HUCMS202103009。大鼠饲养于(20±2)℃、相对湿度50%~70%、12 h 明暗交替环境中,自由饮水、摄食,适应性喂养5 d 后用于实验。
2 方法
2.1 茯苓多糖的制备
茯苓丁粉碎后经80%乙醇回流提取2 次(提取时间分别为2、1 h),滤过,取滤渣,挥干至无醇味后用氢氧化钠溶解,常温下充分搅拌后过滤。滤液用磷酸調至pH=7,沉淀用纯水洗涤数次,滤过后的洗涤液经WTM-1812D型膜分离实验设备微滤、超滤后,与上述沉淀合并,冷冻干燥后得茯苓多糖。采用苯酚-硫酸法测得茯苓多糖含量为95.60%。
2.2 分组、造模与给药
大鼠适应性喂养5 d 后,禁食4 h(每次禁食均换垫料以避免垫料内遗漏有饲料,影响禁食效果),取大鼠尾尖静脉血,用530 活力型手持血糖仪检测空腹血糖,作为大鼠基础血糖值。将大鼠按照禁食4 h 后基础血糖水平组间差异无统计学意义(P>0.05)为标准,分为空白对照组、模型组、二甲双胍组(阳性对照,剂量为200mg/kg)和茯苓多糖低、中、高剂量组(剂量分别为100、200、400 mg/kg),每组8 只,各给药组的剂量依据来自前期预实验。除空白对照组外,其余各组大鼠采用高脂饲料联合STZ 诱导构建2 型糖尿病大鼠模型:大鼠饲喂高脂饲料,第21 天时禁食不禁水12 h,根据预实验结果腹腔注射STZ 40 mg/kg;3 d 后检测造模大鼠空腹血糖值均大于11.3 mmol/L,表明造模成功;继续饲喂高脂饲料至第28 天,巩固造模。造模同时,模型组和空白对照组大鼠每日灌胃等体积水,各给药组大鼠每日灌胃相应剂量的药物,每日1 次,连续灌胃42 d。
2.3 日常状态观察及体质量检测
实验期间观察大鼠的饮水量、尿量、饮食量、毛色、精神状态等情况,并每日测定大鼠的体质量。
2.4 空腹血糖检测和口服葡萄糖耐量试验
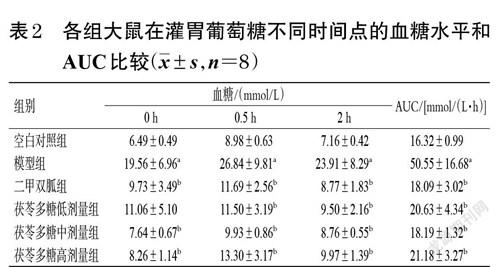
各组大鼠在给药前、给药后(给药结束前1 d)检测空腹血糖。口服葡萄糖耐量试验:给药前1 d 禁食4 h 后取大鼠尾尖静脉血,用530 活力型手持血糖仪检测灌胃葡萄糖前(0 h)的血糖;然后灌胃2.5 g/kg 葡萄糖,分别在灌胃0.5、2 h 时检测血糖,计算口服葡萄糖耐量试验曲线下面积(area under curve,AUC):AUC=0.25×(血糖0 h+4×血糖0.5 h+3×血糖2 h)。AUC越大说明2 型糖尿病模型大鼠对葡萄糖的代谢能力越弱,侧面反映糖尿病的病程。
2.5 脏器指数计算
末次给药后,取大鼠腹部主动脉血,再解剖得大鼠心脏、肝脏、肾脏组织,用生理盐水清洗、滤纸擦拭、称定质量后,置于-80 ℃冰箱保存。脏器指数=脏器质量/体质量×1 000。
2.6 HbA1c、TG、TC、MDA、GSH-Px、SOD水平及肝糖原含量检测
取“2.5”项下血样和肝脏组织。用肝素抗凝管取全血2~4 mL,以1 000 r/min 离心5 min,弃上清液,留沉淀的红细胞,再用生理盐水按上述方法洗涤2~3 次,得压积红细胞。取压积红细胞1 mL,加冷双蒸水1.5 mL,用漩涡混匀器充分混匀1 min 制得溶血液,置于-20 ℃冰箱保存,用于检测HbA1c 水平。用普通采血管取全血5mL,以3 000 r/min 离心10 min,小心吸取上清液即为血清,置于-80 ℃冰箱保存,用于检测血脂指标TG、TC水平和抗氧化指标MDA、GSH-Px、SOD 水平。取肝脏组织约100 mg检测肝糖原含量。各指标检测操作均严格按照相应试剂盒说明书进行。
2.7 肝脏和胰腺组织病理学观察
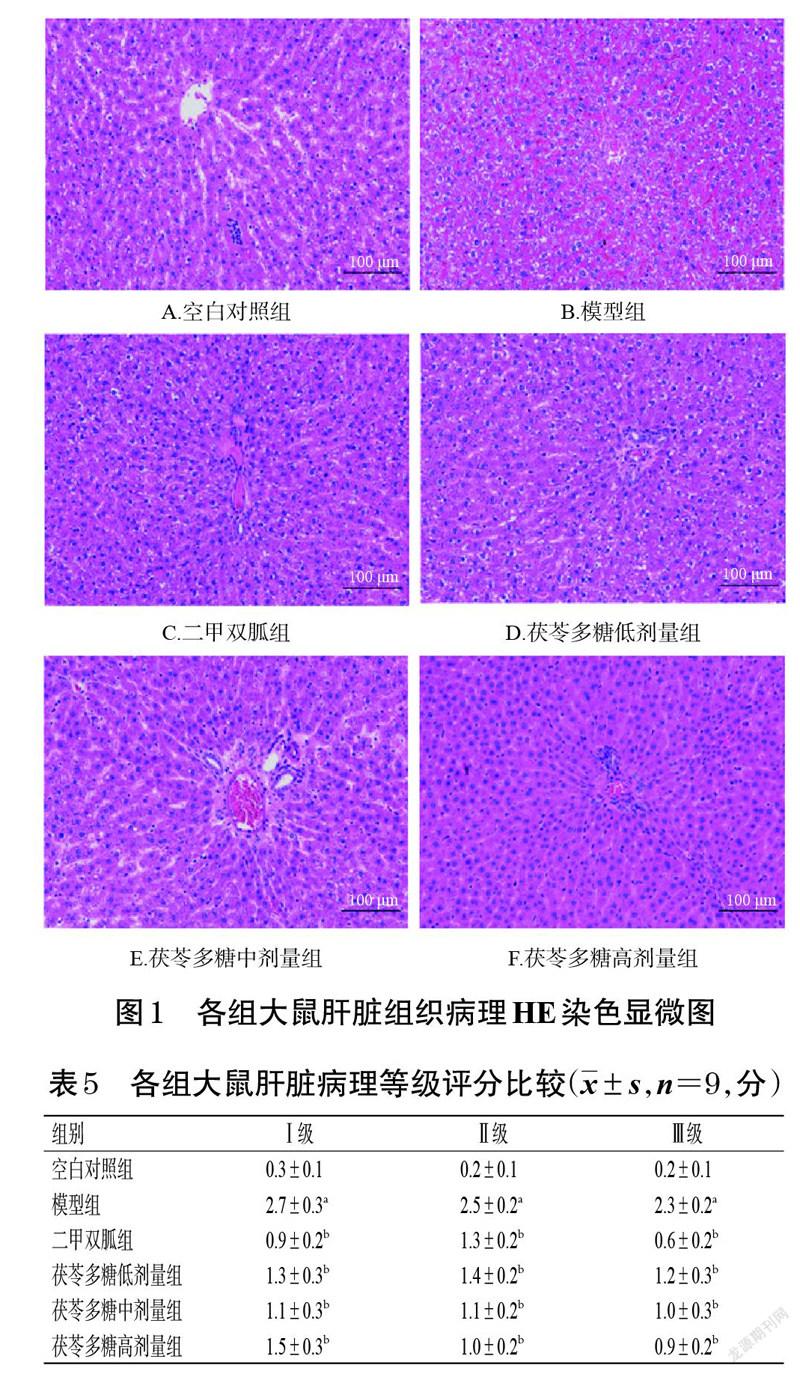
随机选择“2.5”项下每组3 只大鼠的肝脏和胰腺组织,用4%多聚甲醛固定、梯度乙醇脱水、石蜡包埋、切片,HE染色、二甲苯透明后,于光学显微镜下观察肝细胞情况和胰岛细胞变性坏死情况,并用显微镜照相系统拍照(每个样品随机选取3 个区域),进行病理学等级评分。其中肝脏病理等级评分采用Knodell 组织学活动指数评分系统并参考文献[15]:Ⅰ级为界面性炎症及桥接坏死的程度,按0~4 分评定;Ⅱ级为小叶内肝细胞变性和坏死的范围及汇管区的炎症状况,按0~4 分评定;Ⅲ级为纤维化程度,按0~4 分评定。胰腺病理等级评分标准参考文献[16]:Ⅰ级为胰岛形态损坏的程度,按0~4分评定;Ⅱ级为胰岛细胞排列紊乱及细胞核游离的程度,按0~4 分评定;Ⅲ级为胰岛细胞数量减少及细胞坏死的程度,按0~4 分评定。以上评分越接近0 分代表病理程度越轻,越接近4分代表病理程度越重。
2.8 肝脏组织PI3K/Akt/FoxO1 通路相关蛋白表达水平检测
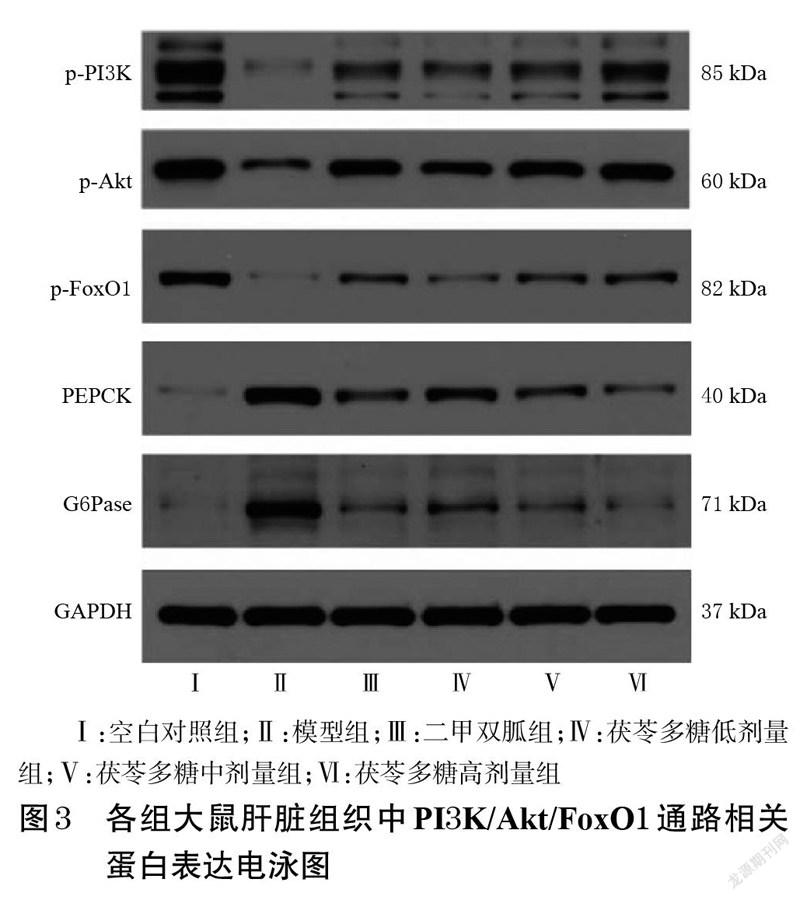
采用Western blot 法检测。取“2.5”项下部分冻存肝脏组织,加RIPA裂解液,冰浴彻底匀浆,将匀浆液转移至离心管中,振荡,冰浴30 min,同时用移液器反复吹打,确保匀浆液完全裂解。以12 000 r/min 于4 ℃离心5min,收集上清液,即为总蛋白溶液。取部分总蛋白溶液用BCA试剂盒测定总蛋白含量,剩余部分沸水浴5 min使蛋白变性,变性后置于-80 ℃冰箱保存,备用。取变性蛋白40 μg,采用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离目的蛋白,其中分离胶电压80 V,浓缩胶电压120 V;用0.45 μm的PVDF膜300 mA转膜90 min,用牛奶封闭1 h,分别加入p-PI3K、p-AKT、p-FoxO1、PEPCK、G6Pase 和GAPDH一抗(稀释度分别为1 ∶500、1 ∶1 000、1 ∶500、1 ∶500、1 ∶2 000、1 ∶10 000),于4 ℃孵育过夜;次日,用TBST 漂洗3 次,加入相应二抗(稀释度为1 ∶10 000),于常温下继续孵育1 h 后,用TBST漂洗3 次,滴加新鲜配制的ECL混合溶液(鲁米诺与过氧化氢体积比1 ∶1 混合)至膜的蛋白面,暗室中曝光,根据不同的光强度调整曝光条件,显影、定影。将胶片进行扫描存档,采用AlphaEase® FC 软件处理系统导出目的蛋白和内参GAPDH的灰度值,采用Excel 软件计算,以目的蛋白条带与内参蛋白GAPDH条带灰度值的比值表示目的蛋白的表达水平。
2.9 統计学分析
采用SPSS 23.0 软件对数据进行统计学处理。计量资料以x±s 表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 茯苓多糖对2 型糖尿病模型大鼠日常状态和体质量的影响
实验期间,大鼠均有较强的行动力。空白对照组大鼠皮毛健康有光泽,实验前后饮食量几乎无变化。模型组大鼠表现狂躁,出现多饮、多食、多尿症状,毛色不华,部分呈浅黄褐色并伴有掉毛现象,体质量较空白对照组显著减轻(P<0.05)。给予相应剂量药物后,二甲双胍组大鼠多饮、多食、多尿、毛色不华等状态改善,但体质量与空白对照组比较仍显著减轻(P<0.05),并伴有便溏现象。与模型组比较,茯苓多糖低、中、高剂量组大鼠狂躁状态改善,多饮、多食、多尿、毛色不华等现象得到缓解,体质量回升,其中茯苓多糖中剂量组分别与模型组、二甲双胍组比较,以及茯苓多糖高剂量组与二甲双胍组比较,差异均有统计学意义(P<0.05)。结果见表1。
3.2 茯苓多糖对2型糖尿病模型大鼠脏器指数的影响
与空白对照组比较,模型组大鼠肝脏、肾脏脏器指数均显著升高(P<0.05)。与模型组比较,二甲双胍组大鼠肾脏脏器指数和茯苓多糖低、中、高剂量组大鼠肝脏(除茯苓多糖低剂量组外)、肾脏脏器指数均显著降低(P<0.05)。结果见表1。
3.3 茯苓多糖对2 型糖尿病模型大鼠口服葡萄糖耐量的影响
灌胃葡萄糖溶液0~0.5 h 期间,各组大鼠的血糖水平均呈逐渐增加的趋势;而在灌胃0.5~2 h 期间,其血糖水平又均呈逐渐降低的趋势。与空白对照组比较,模型组大鼠在灌胃葡萄糖溶液0、0.5、2 h 时的血糖水平和AUC均显著升高(P<0.05)。与模型组比较,二甲双胍组和茯苓多糖低(除0 h 时外)、中、高剂量组大鼠在灌胃葡萄糖溶液0、0.5、2 h 时的血糖水平和AUC均显著降低(P<0.05)。结果见表2。
3.4 茯苓多糖对2 型糖尿病模型大鼠空腹血糖和HbA1c的影響
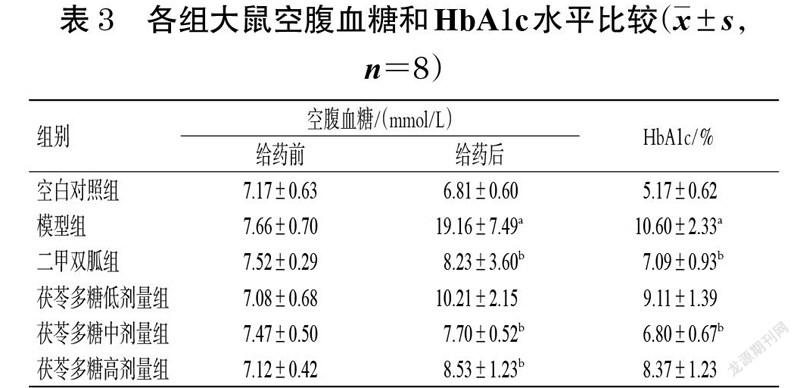
给药前,各组大鼠空腹血糖水平比较,差异无统计学意义(P>0.05)。给药后(给药结束前1 d),与空白对照组比较,模型组大鼠空腹血糖、HbA1c 水平均显著升高(P<0.05);与模型组比较,二甲双胍组和茯苓多糖中、高剂量组大鼠空腹血糖水平,以及二甲双胍组和茯苓多糖中剂量组大鼠HbA1c 水平均显著降低(P<0.05)。结果见表3。
3.5 茯苓多糖对2 型糖尿病模型大鼠血脂水平、抗氧化水平及肝糖原含量的影响
与空白对照组比较,模型组大鼠血清中TC、TG、MDA水平和肝糖原含量显著升高,GSH-Px、SOD 水平显著降低(P<0.05)。与模型组比较,二甲双胍组和茯苓多糖低、中、高剂量组大鼠TC、TG、MDA水平和肝糖原含量均显著降低,SOD水平显著升高(P<0.05);茯苓多糖中剂量组大鼠GSH-Px 水平显著升高(P<0.05)。结果见表4。
3.6 肝脏和胰腺组织病理学观察结果
大鼠肝脏组织HE染色结果见图1。由图1 所示,空白对照组大鼠肝小叶形状规则,肝细胞形态正常,肝索排列整齐、呈放射状分布。模型组大鼠肝小叶不明显,肝细胞排列散乱,肝索结构消失,肝窦扩大,细胞间呈不同程度的皱缩,导致空泡较多,可见淋巴细胞浸润。二甲双胍组大鼠肝索明显,但中央静脉周围有巨噬细胞,表明肝细胞有炎症。茯苓多糖低、中、高剂量组大鼠肝索和肝窦结构较模型组有所恢复,细胞皱缩情况均有所改善。各组大鼠肝脏病理等级评分见表5。由表5可知,与空白对照组比较,模型组大鼠肝脏病理等级评分均显著升高(P<0.05);与模型组比较,二甲双胍组和茯苓多糖低、中、高剂量组大鼠肝脏病理等级评分均显著降低(P<0.05)。
大鼠胰腺组织HE染色结果见图2。由图2 所示,空白对照组大鼠胰岛形态结构完整、呈椭圆形,细胞排列整齐、孔隙较小,细胞核大小相差不大。模型组大鼠胰岛形态被破坏、变形呈葫芦状,中央可见空亮区和许多空泡,细胞核大小不一且游离于细胞边缘。二甲双胍组和茯苓多糖低、中、高剂量组大鼠胰岛形态、细胞核情况较模型组均有所改善。各组大鼠胰腺病理等级评分见表6。由表6 可知,与空白对照组比较,模型组大鼠胰腺病理等级评分均显著升高(P<0.05);与模型组比较,二甲双胍组和茯苓多糖低、中、高剂量组大鼠胰腺病理等级评分均显著降低(P<0.05)。
3.7 茯苓多糖对2 型糖尿病模型大鼠肝脏组织中PI3K/Akt/FoxO1 通路相关蛋白表达的影响
与空白对照组比较,模型组大鼠肝脏组织中p-PI3K、p-Akt、p-FoxO1 蛋白表达水平均显著降低(P<0.05),PEPCK、G6Pase蛋白表达水平均显著升高(P<0.05)。与模型组比较,二甲双胍组和茯苓多糖低、中、高剂量组大鼠肝脏组织中p-PI3K、p-Akt、p-FoxO1(除茯苓多糖低剂量组外)蛋白表达水平均显著升高(P<0.05),PEPCK、G6Pase蛋白表达水平均显著降低(P<0.05)。结果见图3、图4。
4 讨论
本研究采用高脂饲料联合STZ构建了2 型糖尿病大鼠模型,所得模型大鼠常伴有血脂异常、体质量减轻,且伴有HbA1c 水平持续升高等症状,与以往文献一致[17]。
体质量下降被认为是糖尿病的典型特征,这与葡萄糖代谢缺陷和组织蛋白过度分解有关,而HbA1c 常作为糖尿病控制的监测指标[18]。在糖尿病的发生过程中,高血糖、高胰岛素血症和游离脂肪酸升高均可诱导活性氧产生,而强氧化环境可能会导致胰岛素抵抗等生理功能障碍和糖尿病并发症发生[19]。本研究结果显示,茯苓多糖给药后,能够恢复大鼠体质量,显著降低2 型糖尿病模型大鼠的空腹血糖、HbA1c 水平,改善葡萄糖耐受情况,减轻氧化应激水平。此外,茯苓多糖还可降低2 型糖尿病模型大鼠血清中的TC、TG 水平,遏制糖尿病病程中因糖脂代谢异常导致的胆固醇代谢异常,减轻胰腺组织的结构破坏,从而发挥保护胰岛β细胞的作用。
肝脏在能量平衡中起着至关重要的作用,而糖尿病病程发展中容易引起肝脏相关并发症发生,严重者甚至导致死亡[20]。因此,肝脏损伤程度和肝糖原含量间接反映了机体的胰岛素活性和糖代谢能力[21]。本研究中,模型组大鼠肝糖原含量显著升高,肝脏病理切片显示肝细胞形态改变,肝小叶不明显,肝细胞排列散乱,肝索结构消失,肝窦扩大,表明2 型糖尿病模型大鼠的肝脏损伤可能与糖脂代谢失调及长期高糖刺激引起的炎症损伤有关。茯苓多糖给药后,各剂量组大鼠的肝糖原含量显著降低,肝脏组织病理学检查显示肝索和肝窦结构得到改善,表明茯苓多糖可以改善2 型糖尿病模型大鼠的肝脏损伤情况,也间接反映了茯苓多糖可以改善胰岛素活性和糖代谢能力。
PI3K信号分子调节葡萄糖的攝取和代谢,其下游的关键节点Akt 磷酸化后可以调节糖异生和糖原合成[22]。FoxO1 是位于PI3K/Akt 途径下游的关键因子,其转录活性受磷酸化的Akt 调节,而肝脏FoxO1 功能增强会导致胰岛素作用受损及肝脏糖异常增多;相反,糖尿病发展过程中会损坏PI3K/Akt 通路,负调控使FoxO1 去磷酸化相对激活并移位到细胞核,去磷酸化的FoxO1 活性增强,从而增加糖异生[23]。本研究结果显示,与模型组比较,茯苓多糖低、中、高剂量组大鼠p-PI3K、p-Akt、p-FoxO1 蛋白表达水平均显著升高,表明茯苓多糖可以激活2 型糖尿病模型大鼠肝脏PI3K/Akt/FoxO1通路。
正常生理情况下,肝脏通过葡萄糖和糖原的互相转化来维持空腹血糖的正常水平。而2 型糖尿病患者的空腹高血糖主要是由肝脏糖异生所导致的[24]。PEPCK 和G6Pase 是肝脏糖异生过程中2 种关键的限速酶,可通过抑制这2 种酶来干预肝脏糖异生[25]。FoxO1 是肝脏糖异生关键酶调控的上游靶点,被磷酸化的FoxO1 能够抑制G6Pase 和PEPCK 的蛋白表达,从而抑制糖异生[26]。本研究结果显示,与模型组比较,茯苓多糖低、中、高剂量组大鼠PEPCK 和G6Pase 蛋白表达水平均显著降低,表明茯苓多糖可以抑制肝脏糖异生。
综上所述,茯苓多糖可以通过减弱氧化应激,上调PI3K/Akt/FoxO1 通路,从而下调糖异生关键酶PEPCK和G6Pase的蛋白表达,发挥抑制肝脏糖异生的作用,进而有效降低2型糖尿病模型大鼠的血糖水平,调节糖脂代谢。

