20 ℃时海水体系相平衡研究
刘 晴,巩学敏,张向祎,李亚杰
(华北理工大学 化工学院,河北 唐山 063210)
0 引 言
海洋是世界上重要的资源和能源宝库,不仅含有丰富的油、气能源储量、矿物元素、淡水资源和可供食用或研究的动植物、微生物资源,还富含钠、氯、钾、溴、镁等基础的化工生产原料。
对海水资源的利用,最重要的一项就是淡水资源的利用。海水淡化技术是有效利用海水中的淡水资源来解决水资源短缺问题的开源技术。鉴于水资源短缺造成的严重危害,世界各国都非常重视海水淡化技术的发展。
全球海水淡化的产能在2020 年已达到1 亿t/d,沙特、以色列等国由海水淡化技术提供的饮用水已达到总水量的70%。
我国海水淡化产业也初具规模,截至2020 年底,已建海水淡化工程规模达165.108 3 万t/d。海水淡化项目副产大量浓海水,若直接排放将严重污染生态环境,并造成资源浪费,对其综合利用十分迫切。
除了海水淡化获取水资源外,海水资源种类多,数量大,但富集程度较低,海水组成复杂,从而增大了元素提取和综合利用的难度。
近年来,对于海水元素提取方法进行了大量研究。刘燕等人基于三元体系相图的研究分析,提出错流蒸发浓海水提钾工艺;郭小甫等人采用离子交换法研究了不同类型吸附剂和洗脱剂对海水提钾工艺的影响,从而得出提取效率更好的沸石和洗脱剂类型;王亚敏等人研究利用电渗析法浓缩淡化浓海水制备氯化钠;陈建新等人对于海水浓缩体系的研究,通过五元介稳相图,观察到硫酸镁和氯化钾的结晶区域变化,得出采用海水蒸发浓缩工艺,可直接制备氯化钾的技术。
对于目前的海水淡化浓海水元素提取的相关研究,很大程度上缓解了浓海水排放造成的资源浪费和环境污染问题。海水相关体系相平衡特征有利于分析相关离子组成特征和蒸发结晶固体析出规律,可用于指导海水资源的进一步开发和高效利用。
基于水盐体系相平衡理论,本文研究了20 ℃Mg2+、Na+//SO42-、Cl--H2O 时四元交互体系相平衡特征,分析该条件下的等温共饱点和结晶规律。通过分析海水蒸发结晶析出氯化钠的工艺路线,为海水体系化学元素提取和资源综合利用提供重要的理论指导意义。
20 ℃时Mg2+、Na+//SO42-、Cl--H2O 四元交互体系相平衡特征,还可用于指导镁型盐矿资源的加工分离,为盐湖资源的综合利用提供数据和技术支持。
1 实验部分
1.1 试剂和仪器
1.1.1 实验试剂
氯化钠、六水氯化镁、无水硫酸钠、无水硫酸镁。分析所用试剂均为分析纯,所用水均为去离子水。
1.1.2 主要仪器
(1) CHD-0530 低温恒温水浴:江苏中大仪器科技有限公司,控温精度为±0.1 ℃。
(2) 电动搅拌机:自制,转速为100 r/min。
1.2 实验装置及方法
1.2.1 实验装置
相平衡反应在恒温水浴中进行,直玻璃反应管完全浸没于水浴中恒温搅拌,20 ℃时相平衡反应时间为8 h。
相平衡反应实验装置如图1 所示。

图1 相平衡反应实验装置Fig.1 Experimental equipment for phase equilibrium reaction
1.2.2 分析测定方法
(1) 相平衡液相组成SO42-浓度采用加入BaCl2生成BaSO4重量法测定。
(2) Cl-浓度采用硝酸银滴定法测定。
(3) Mg2+浓度用EDTA 滴定法测定。
(4) Na+浓度采用离子电荷守恒差减法得出。
(5) 固相组成采用湿固相结合X射线衍射法(XRD)分析确定。
(6) XRD 采用日本理学smartlab 型号射线衍射仪测定,Cu 靶Kα 射线,管电压为40 kV,管电流为100 mA,扫描速度为10°/min,扫描范围为10°~90°。
2 结果与讨论
2.1 四元体系相平衡溶解
基于20 ℃时各三元子体系溶解度数据,测定并计算20 ℃时Mg2+、Na+//SO42-、Cl--H2O 四元体系相平衡溶解度。其中,液相组成Na+、SO42-离子和H2O 的耶涅克指数J以总干盐100 mol 为基础计算得出。
20 ℃Mg2+、Na+//SO42-、Cl--H2O 时四元体系溶解度数据见表1。
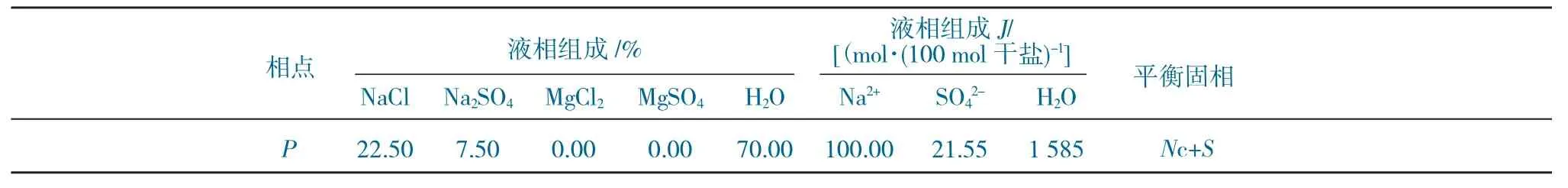
表1 20 ℃时Mg2+、Na+//SO42-、Cl--H2O 四元体系溶解度数据Table 1 Solubility data of Mg2+、Na+//SO42-、Cl--H2O quaternary system at 20 ℃
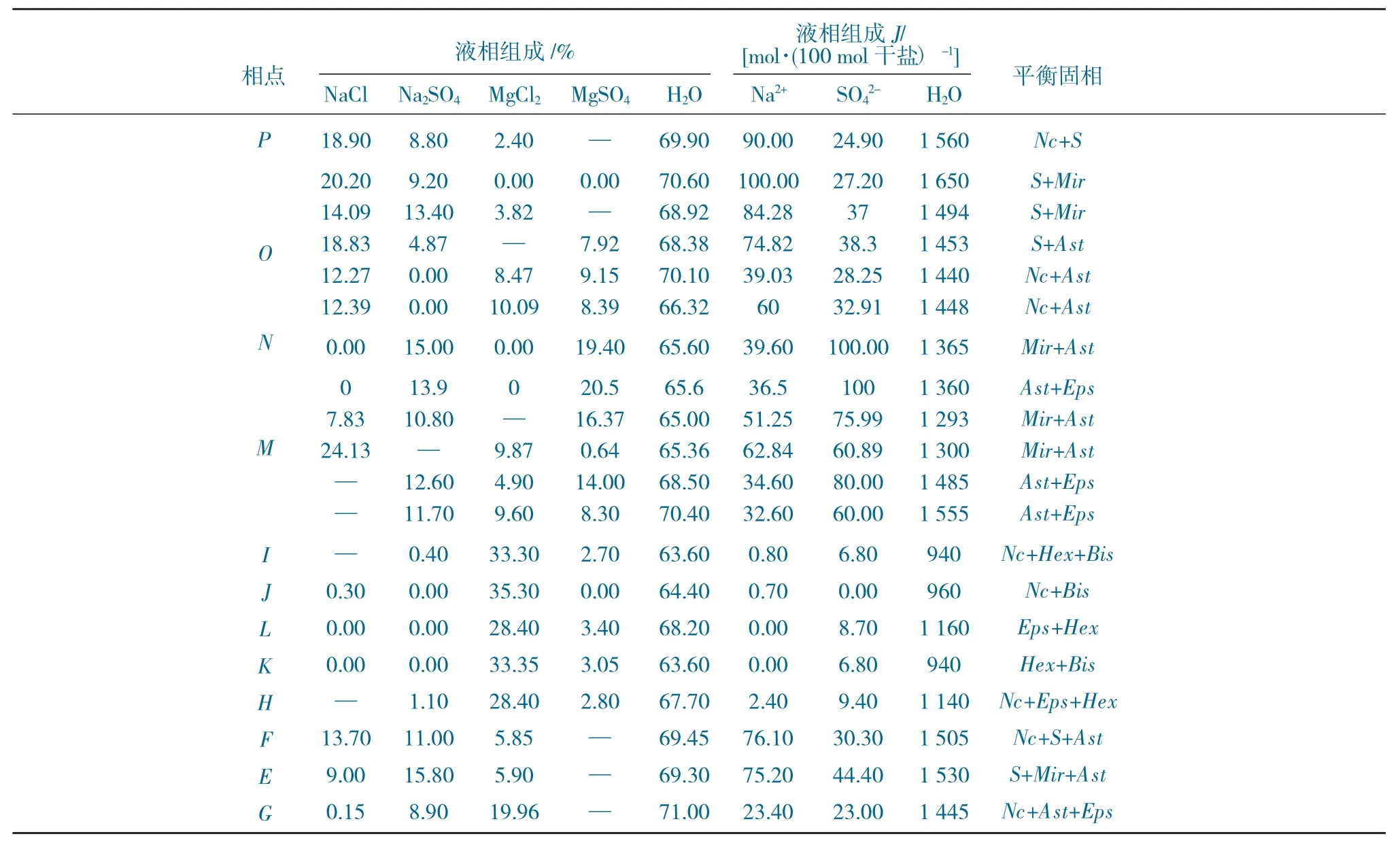
续表
由表1 可知,20 ℃时Mg2+、Na+//SO42-、Cl--H2O四元体系可生成5 个等温共饱点,其饱和液相分别对应的平衡固相组成XRD 表征,并将XRD 谱图与标准卡对比,如图2 所示。


图2 等温共饱点组成XRD 图谱分析Fig.2 XRD analysis of isothermal saturation point composition
由图1 可以看出:
(1) 等温共饱点E所对应的平衡固相组成分别 为Na2SO4、Na2SO4·10H2O 和Na2SO4·MgSO4·4H2O。
(2) 等温共饱点F所对应的平衡固相组成分别为NaCl、Na2SO4和Na2SO4·MgSO4·4H2O。
(3) 等温共饱点G所对应的平衡固相组成分别为NaCl、Na2SO4·MgSO4·4H2O 和MgSO4·7H2O。
(4) 等温共饱点H所对应的平衡固相组成分别为NaCl、MgSO4·7H2O和MgSO4·6H2O。
(5) 等温共饱点I所对应的平衡固相组成分别为NaCl、MgSO4·6H2O和MgCl2·6H2O。
2.2 20 ℃时Mg2+、Na+//SO42-、Cl--H2O 四元体系相图
依据20 ℃时Mg2+、Na+//SO42-、Cl--H2O四元体系相平衡溶解度数据绘制相图,如图3 所示。
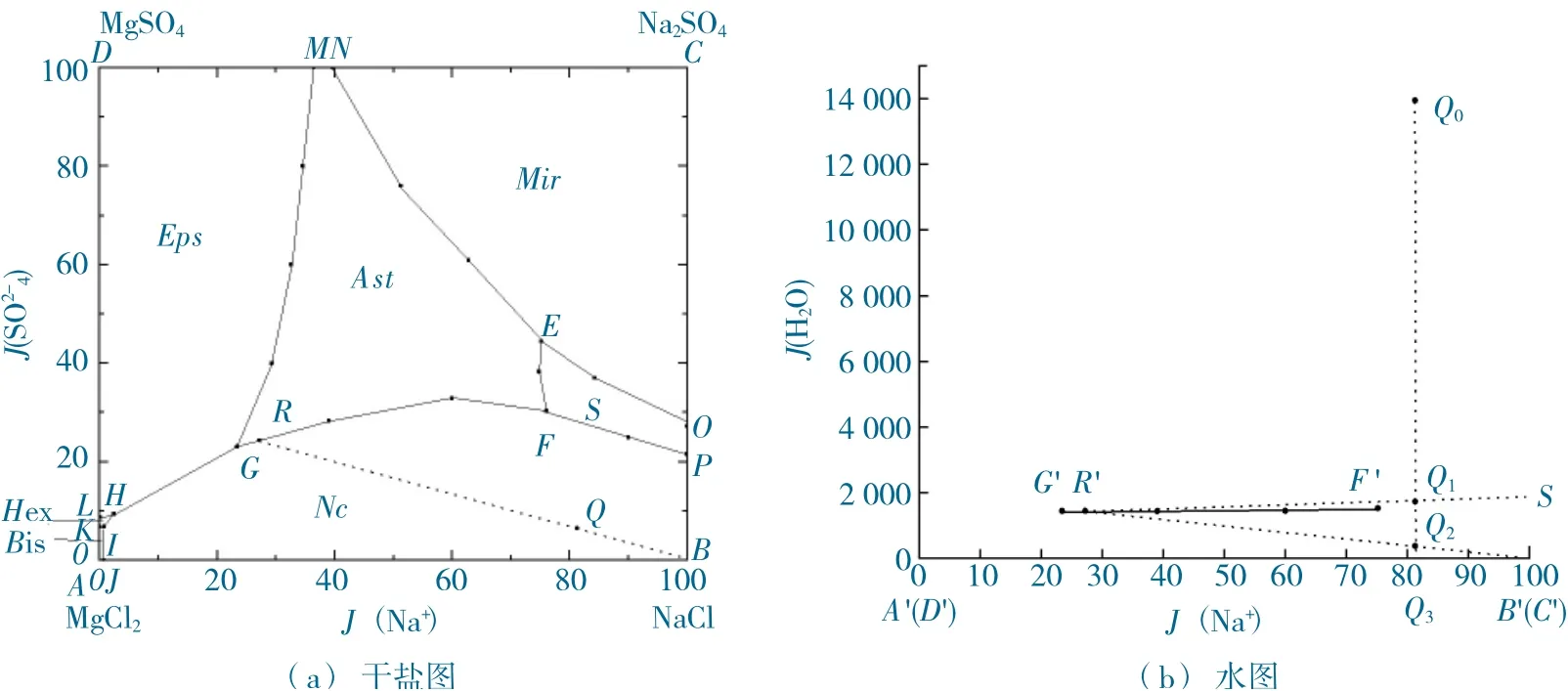
图3 20 ℃时Mg2+、Na+//SO42-、Cl--H2O 四元体系相图Fig.3 Phase diagram of Mg2+、Na+//SO42-、Cl--H2O quaternary system at 20 ℃
由图3 可以看出,20 ℃时Mg2+、Na+//SO42-、Cl--H2O四元交互体系可生成5 个三盐等温共饱点。其中:
(1) 等温共饱点E表示固相Na2SO4、Na2SO4·10H2O 和MgSO4·4H2O 与其共饱和溶液.
(2) 等温共饱点F表示NaCl、Na2SO4和Na2SO4·MgSO4·4H2O 与其共饱和溶液。
(3) 等温共饱点G表示NaCl、Na2SO4·MgSO4·4H2O 和MgSO4·7H2O 与其共饱和溶液。
(4) 等温共饱点H表示NaCl、MgSO4·7H2O和MgSO4·6H2O 与其共饱和溶液。
(5) 等温共饱点I表示NaCl、MgSO4·6H2O和MgSO4·6H2O 与其共饱和溶液。
形成7 个单盐结晶区,分别包括:
(1)BJIGFPB为固相与共饱和溶液的结晶区。
(2)OPFEO为Na2SO4固相与共饱溶液的结晶区。
(3)COENC为Na2SO4·10H2O 固相与共饱和溶液的结晶区。
(4)MNEFGM为Na2SO4·MgSO4·4H2O 固相与共饱和溶液的结晶区。
(5)MGHLD为MgSO4·7H2O 固相与共饱和溶液的结晶区。
(6)KLHIK为MgSO4·6H2O 固相与共饱和溶液的结晶区。
(7)AKIJA为MgCl2·6H2O 固相与共饱和溶液的结晶区。
较大面积的结晶区的形成,有利于20 ℃时等温蒸发海水结晶过程研究。
形成的两盐共饱和曲线分别包括:
(1)PF为NaCl 与Na2SO4两盐固相共饱曲线。
(2)FG为NaCl 与Na2SO4·MgSO4·4H2O 两盐固相共饱曲线。
(3)GH为NaCl 与MgSO4·7H2O 两盐固相共饱曲线。
(4)HI为NaCl 与MgSO4·6H2O 两盐固相共饱曲线。
(5)IJ为NaCl 与MgCl2·6H2O 两盐固相共饱曲线。
(6)OE为Na2SO4与a2SO4·10H2O 两盐固相共饱曲线。
(7)EF为Na2SO4与Na2SO4·MgSO4·4H2O 两盐固相共饱曲线。
(8)EN为Na2SO4·10H2O 与Na2SO4·MgSO4·4H2O 两盐固相共饱曲线。
(9)MG为Na2SO4·MgSO4·4H2O 与·MgSO4·7H2O 两盐固相共饱曲线。
2.3 20 ℃时海水体系等温蒸发结晶NaCl 过程分析
选取京唐钢海水淡化副产浓海水为研究对象,其海水体系组成如表2 所示。

表2 海水体系组成Table 2 Composition of seawater system
20℃时海水体系等温蒸发结晶NaCl 过程为图3所示。图3(a) 为干盐图,图3(b) 为水图,干盐图和水图中的点一一对应。图中实线表示相间线,虚线表示蒸发结晶过程工艺线。组成点为图3(a) 干盐图中Q点,其干盐组成落在NaCl 结晶区内。根据J(H2O)值对应水图中Q0点,为未饱和溶液。
海水体系蒸发结晶过程中,干盐含量组成不变,所以,图3(a) 干盐图中体系点Q不发生变化;蒸发水过程中,海水中含水不断减少,即水图中海水体系组成点垂直向下由Q0向Q3移动,Q3为海水蒸发结晶过程工艺线与A'(D')B' (C')交点。
图3(a) 中,连接NaCl 组成点B与海水组成点Q,其延长线与NaCl 和Na2SO4·MgSO4·4H2O两盐共饱曲线GF相交于R,对应于水图中R'。
图3(b) 中,S点表示NaCl 溶解度组成点,连接SR'与B'R',分别与Q0Q3交于Q1与Q2。
(1) 20 ℃时海水等温蒸发水过程中,当体系组成点在Q0Q1时,均为未饱和蒸发水状态。
(2) 随着水的不断蒸发,海水体系点组成达到Q1时,蒸发水量最大,此时即将饱和析出。
(3) 继续恒温20 ℃蒸发水,当体系组成点落在Q1Q2时,固相不断有结晶析出,且结晶产量由Q1到Q2逐渐增大,组成点在Q2时,NaCl 析出量最大。
(4) 随着海水的继续蒸发,Na2SO4·MgSO4·4H2O固相同时达到饱和,将与NaCl 固相共同析出结晶。
即对于20 ℃海水恒温蒸发结晶NaCl 工艺,组成点在Q2为最佳NaCl 结晶析出工艺点。
2.4 四元体系溶解度和相图特征分析的应用
20 ℃时Mg2+、Na+//SO42-、Cl--H2O 四元体系溶解度和相图特征分析,也可以应用于镁型盐矿资源的加工分离技术研究。
镁型盐矿资源主要由MgCl2和MgSO4组成,加入Na2SO4溶于水后,可形成Mg2+、Na+//SO42-、Cl--H2O四元混合体系。所以,可采用Na2SO4为盐析剂,以镁盐矿为原料,研究MgCl2与Na2SO4的复分解反应生成和MgSO4的工艺过程。
工艺技术流程和技术参数可依据20 ℃时Mg2+、Na+//SO42-、Cl--H2O 四元交互体系相图的特征进行分析。
一定条件下,按照相图计算配比,向镁盐矿中加入Na2SO4使其溶解,当混合体系组成点落在NaCl 单盐饱和结晶区时,进行相平衡反应。反应平衡后,NaCl 固相可结晶析出,离心分离,可得到NaCl 产品;调整混合体系组成,当混合体系组成点落在MgSO4单盐饱和结晶区时,MgSO4可结晶析出。
20 ℃时Mg2+、Na+//SO42-、Cl--H2O 四元交互体系相图特征为镁型盐矿资源的加工分离奠定了理论和数据基础,为盐矿资源的开发和综合利用提供工艺和技术支持。
3 结 语
(1) 等温法测定20 ℃时Mg2+、Na+//SO42-、Cl--H2O 四元体系溶解度,绘制相图分析表明,该体系存在5 个共饱点和7 个结晶区。7 个结晶区分别为NaCl 结晶区、Na2SO4结晶区、Na2SO4·10H2O结晶区、Na2SO4·MgSO4·4H2O 结晶区、MgSO4·7H2O结晶区、MgSO4·6H2O 结晶区和MgCl2·6H2O 结晶区。较大面积的NaCl 结晶区的形成,有利于20 ℃时等温蒸发海水结晶NaCl 过程研究。
(2) 基于20 ℃时Mg2+、Na+//SO42-、Cl--H2O四元体系相图特征,结合水图变化过程,分析京唐钢海水淡化副产浓海水蒸发水,制备结晶NaCl 固相过程,分析最佳NaCl 固相析出组成情况。基于该体系相图特征,还可设计Na2SO4为盐析剂,以镁盐矿为原料,研究MgCl2与Na2SO4的复分解反应生成NaCl 和MgSO4的工艺过程,为镁型盐矿资源的加工分离技术提供理论和技术支持。

