MTNR1a和MTNR1b基因在繁殖期与非繁殖期雄性高原鼢鼠HPG轴上的表达
安康 包明芳 姚宝辉 康宇坤 谭宇尘 王艳莉 苏军虎*
(1甘肃农业大学草业学院,草业生态系统教育部重点实验室,中美草地畜牧业可持续发展研究中心,兰州 730070)(2甘肃农业大学—新西兰梅西大学草地生物多样性研究中心,兰州 730070)(3甘肃省祁连山草原生态系统野外科学观测研究站,天祝 733200)
季节性繁殖是动物适应复杂环境所采取的一种策略,受光照、温度、降水和食物等多种因素的影响。其中光照的周期性变化被认为是影响动物繁殖的主要因素(Shinomiyaet al.,2014)。光信号通过视网膜传到大脑调节褪黑素(Melatonin)的分泌(Dardenteet al.,2016),进而影响繁殖激素的合成与分泌。作为感知光周期变化的神经激素,褪黑素主要由松果体分泌(Ceconet al.,2019),血液循环中的色氨酸是其生物合成前体,经过芳香胺-N-乙酰基转移酶(Arylalkylamine-N-acetyl transferase)和羟基吲哚-O-甲基转移酶(Hydroxyindole-O-methyl transferase)最终合成为褪黑素(Axelrod and Wurtman,1968;Pandi-Perumalet al.,2008)。褪黑素还在胃、心脏、肝脏、卵巢等组织器官中合成和分泌(Reiteret al.,2015),但周期性分泌仅存在于松果体和视网膜中(姚蔚等,2017)。研究发现,褪黑素的周期性分泌主要受下丘脑视交叉上核(Suprachiasmatic nucleus,SCN)的昼夜节律振荡器控制,其激素分泌水平与夜间长度呈正相关(Simonneaux and Ribelayga,2003),呈现出昼低夜高的特点(Wurtman and Ozaki,1978);随着一年中光周期的变化,褪黑素又表现出季节性分泌规律(陈玉林和张小辉,2005),促使动物在行为和生理上与季节变化同步,进而调整其繁殖状态。因此,褪黑素在动物的季节性繁殖调控中具有重要作用,通过与下丘脑—垂体—性腺(Hypothalamic-pituitary-gonadal,HPG)轴上的受体结合发挥生物学功能(Aleandriet al.,1996)。
在哺乳动物中,褪黑素的生理功能主要通过两种高亲和力的膜受体介导,即褪黑素受体1a(Melatonin receptor 1a,MTNR1a)和褪黑素受体1b(Melatonin receptor 1b,MTNR1b),两者均属于G蛋白偶联受体家族成员,参与多种功能调节(Jockerset al.,2008;Wuet al.,2013)。MTNR1a 和 MTNR1b已证实存在于小鼠(Mus musculus)下丘脑SCN中,共同调节其昼夜节律(Liuet al.,1997;Jinet al.,2003)。陈健楠等 (2020)采用qRT-PCR(Quantitative real-time PCR)技术检测到MTNR1a和MTNR1b基因在牦牛(Bos grunniens)垂体中表达。MTNR1a和MTNR1b除了在下丘脑和垂体中发挥作用外,在动物睾丸中也有作用(Frungieriet al.,2005)。Izzo等(2010)发现大鼠(Rattus norvegicus)睾丸中存在MTNR1a和MTNR1b;Yang等(2014)发现褪黑素通过与MTNR1a和MTNR1b结合调节荷斯坦牛(B.taurus)睾丸支持细胞的发育与功能发挥。这表明褪黑素与受体结合,可独立于下丘脑和垂体,直接影响动物睾丸的生长和发育。现已证实,褪黑素与垂体中MTNR1a结合,一方面通过中间信使分子调节垂体远侧催乳激素(Prolactin,PL)的分泌和门脉血管的发生,调控繁殖(Lincoln and Clarke,1994);另一方面通过促甲状腺激素—甲状腺激素(Thyroid stimulating hormone-thyroid hormone)通路诱导促性腺激素释放激素神经元活性,分泌促性腺激素释放激素(Gonadotropin releasing hormone,GnRH)调节垂体合成、分泌卵泡刺激素(Follicle-stimulating hormone)和黄体生成素(Luteinizing hormone),参与调控繁殖(Nishiwaki-Ohkawa and Yoshimura,2016)。褪黑素参与繁殖作用的研究,丰富了动物季节性繁殖调控理论,探明了更多动物类群褪黑素繁殖调控作用机理,对完善动物繁殖理论具有重要意义。
高原鼢鼠(Eospalax baileyi)是青藏高原特有的地下啮齿动物(张堰铭和刘季科,2002),主要栖息在高寒草甸、高寒草原和高山灌丛等地带,受到气候、地形、食物和土壤等因素的制约(Keinathet al.,2014),繁殖期为每年的4月中旬到6月中旬(郑生武,1980),是典型的季节性繁殖动物。近年来,由于人类活动和气候变化等影响,高原鼢鼠种群数量急剧增加,加剧了对草原环境的破坏。繁殖是啮齿动物种群数量发生及其危害的重要生物学基础,掌握其繁殖调控机理对其种群进行有效管理至关重要。长期营地下生活的啮齿动物视觉系统严重退化,但是感受光周期的“非成像”视觉通路仍高度发达,能够感光和感知外界光周期的变化,并产生与外界昼夜循环同步的生物节律(孟衫衫等,2010)。安晓宇等(2020)发现,高原鼢鼠褪黑素水平在繁殖期和非繁殖期存在显著差异,暗示了褪黑素在高原鼢鼠季节性繁殖调控中的潜在作用,然而褪黑素受体基因表达模式和组织特异性等未知。基于此,本研究通过分析MTNR1a和MTNR1b基因在繁殖期与非繁殖期雄性高原鼢鼠HPG轴上的表达模式,探究褪黑素在高原鼢鼠繁殖调控中的作用机理,旨在丰富光周期诱导地下啮齿动物季节性繁殖调控的理论,为高原鼢鼠有效管理提供参考。
1 研究方法
1.1 实验材料
于2020年5月(繁殖期)和9月(非繁殖期)在甘肃省天祝藏族自治县甘肃省祁连山草原生态系统野外科学观测研究站进行高原鼢鼠样本采集,依据其胴体重判断是否成年(苏军虎等,2018),在两个时期分别非损伤活捕10只成年健康雄性个体。为避免褪黑素的昼夜节律性对实验结果造成影响,将两个时期所有实验样品的采集工作控制在同一天的2 h内完成(20:00—22:00)。取出每只个体的睾丸、附睾和精囊腺称重记录,下丘脑、垂体以及一侧睾丸于-80℃冷冻保存,用于RNA的提取;另一侧睾丸保存于4%多聚甲醛组织固定液中,用于免疫组织化学实验。
1.2 实验方法
1.2.1 总RNA提取及引物设计
将两个时期各10只成年雄性高原鼢鼠个体的下丘脑、垂体及睾丸在同等条件下,按照RNAiso Plus Total RNA提取试剂盒(TaKaRa)的操作说明进行总RNA的提取,于-80℃储存。所有样品的ODA260/A280值均为1.8~2.0,说明RNA质量高(Huoet al.,2017)。根据NCBI数据库中已发布大鼠和小鼠MTNR1a(NM_001100641.1)和MTNR1b(NM_145712.2)的碱基序列,使用Primer3 Input 0.4.0软件设计高原鼢鼠MTNR1a和MTNR1b引物,引物序列由西安擎科有限责任公司进行合成 (表1)。
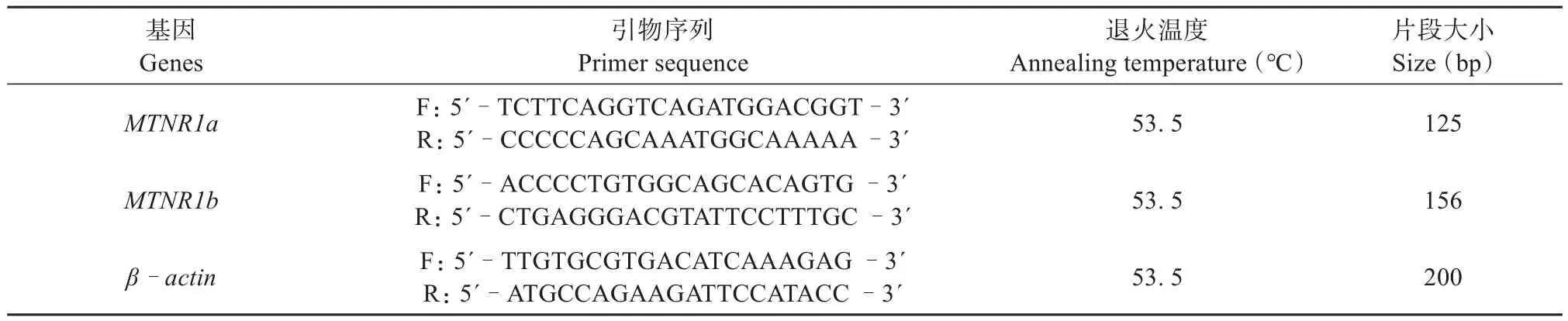
表1 雄性高原鼢鼠MTNR1a和MTNR1b引物序列Table 1 Primers sequence for MTNR1a and MTNR1b of male plateau zokor
1.2.2 RNA逆转录和实时荧光定量PCR测定
使用PrimeScript 1st Strand(Takara)试剂盒将所有样品RNA反转录为cDNA,使用TB Green®Premix Ex TaqTM II(Takara)在实时PCR系统(Light Cycler 96 System)中通过实时荧光定量(q-PCR)扩增cDNA。
1.2.3 免疫组织化学实验
将保存在4%多聚甲醛溶液中的睾丸(繁殖期和非繁殖期各10个)同批进行冲洗、脱水、浸蜡和包埋处理,5 μm切片在60℃恒温6 h,然后常规脱蜡、蒸馏水冲洗,按照免疫组化染色试剂盒(SP-0032,北京博奥森®)的操作说明进行。其中,实验组用兔抗羊MTNR1a(bs-0027R)和MTNR1b(bs-0963R)多克隆抗体(1∶250)作为第一抗体进行阳性反应,阴性对照组用PBS代替第一抗体进行处理,所有样品4℃过夜(12 h),后加山羊抗兔IgG,加辣根酶标记链霉卵白素工作液(S-A/HRP),最后用DAB显色剂显色。借助Motic Images Plus 3.0软件拍照。进一步对免疫组化阳性进行定量评价。根据实验效果,选择两个时期每只实验动物1张切片(每张重复3个视野),利用Image Pro Plus软件进行平均光密度值(Average optical density)测定,用IP图像处理技术计算:平均光密度值=累计光密度/有效测量区面积。
1.3 数据处理
q-PCR实验结果使用相对定量法(2-ΔΔCq)计算目的基因的相对表达量,每个基因相对表达量均以内参基因为基准进行校正。以上所有数据均使用SPSS 26.0软件,采用独立样本t检验分析,结果用平均值±标准误(mean±SE)表示,用Excel进行数据统计作图。
2 结果
2.1 高原鼢鼠繁殖期和非繁殖期性腺器官重量变化
高原鼢鼠体重在繁殖期与非繁殖期无显著变化(P>0.05),但非繁殖期的睾丸、附睾以及精囊腺的重量较繁殖期分别下降了87.98%、89.95%和97.02%,表现出显著的季节性变化(P<0.05)(表2)。
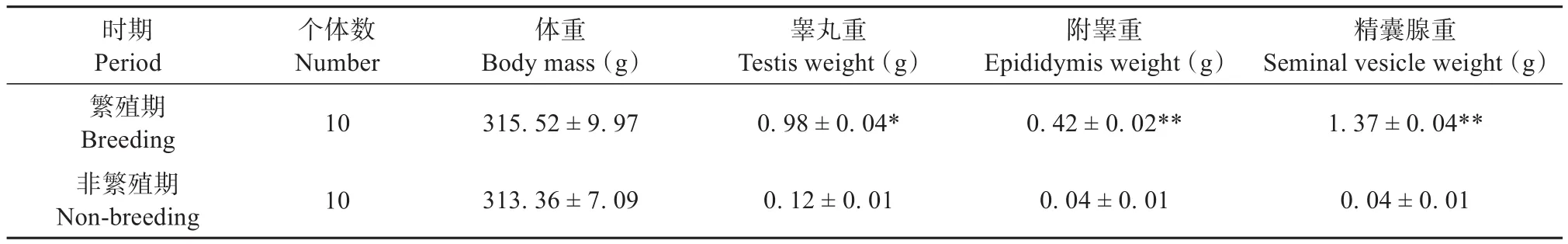
表2 高原鼢鼠繁殖期和非繁殖期性腺器官重量变化Table 2 Weight changes of gonad organs during the breeding and non-breeding seasons of plateau zokor
2.2 MTNR1a和MTNR1b mRNA在高原鼢鼠中的表达
高原鼢鼠繁殖期和非繁殖期下丘脑、垂体和睾丸中均检测到MTNR1amRNA的表达。在繁殖期,高原鼢鼠下丘脑和垂体中MTNR1amRNA的相对表达量显著高于非繁殖期(P<0.05),但繁殖期睾丸中的相对表达量显著低于非繁殖期(P<0.01)(图1A)。
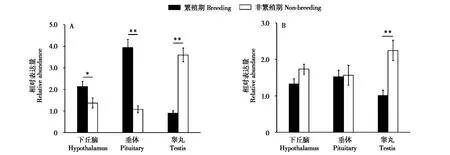
图1 MTNR1a和MTNR1b mRNA在繁殖期与非繁殖期高原鼢鼠下丘脑、垂体和睾丸中的表达.A:MTNR1a mRNA的相对表达量;B:MTNR1b mRNA的相对表达量.*P<0.05;**P<0.01Fig.1 MTNR1a and MTNR1b mRNA in the hypothalamus,pituitary,and testis of plateau zokor during the breeding and non-breeding seasons.A:relative expression level of MTNR1a mRNA;B:relative expression level of MTNR1b mRNA.*P<0.05;**P<0.01
高原鼢鼠下丘脑和垂体中,繁殖期与非繁殖期的MTNR1b基因相对表达量无显著差异(P>0.05),但在睾丸中MTNR1b基因在繁殖期的相对表达量显著低于非繁殖期(P<0.01)(图1B)。
2.3 MTNR1a和MTNR1b在高原鼢鼠中的定位
高原鼢鼠繁殖期MTNR1a在睾丸间质细胞的胞浆中具有免疫阳性信号,在曲细精管内的支持细胞以及除长形精子细胞以外的各级生殖细胞中均有阳性表达,其中包括精原细胞、初级精母细胞、次级精母细胞和圆形精子细胞;但非繁殖期MTNR1a在高原鼢鼠睾丸的间质细胞、支持细胞和精原细胞中均有阳性表达(图2A、D)。
MTNR1b在高原鼢鼠繁殖期多种细胞的胞浆中存在免疫阳性信号,包括支持细胞、初级精母细胞、次级精母细胞、圆形精子细胞和间质细胞,但在细胞核中无表达,在精原细胞和长形精子细胞中也无免疫信号;在非繁殖期睾丸间质细胞和支持细胞的细胞质中均检测到MTNR1b的阳性信号,但在精原细胞中无表达(图2B、E)。
2.4 高原鼢鼠睾丸中MTNR1a和MTNR1b的免疫组化阳性评价
高原鼢鼠非繁殖期睾丸中MTNR1a的阳性信号的平均光密度值显著高于繁殖期(P<0.01)(图3A)。与MTNR1a相似,繁殖期睾丸中MTNR1b的平均光密度值显著低于非繁殖期(P<0.01)(图 3B)。
3 讨论
伴随着高原鼢鼠性腺的季节性发育,褪黑素受体基因在其下丘脑、垂体和睾丸中也呈现出季节性变化,但MTNR1a基因表达量在下丘脑、垂体和睾丸中有显著季节性差异,MTNR1b基因仅在睾丸中有季节性差异。免疫定位和表达量分析发现,褪黑素通过与不同细胞上的受体结合,影响高原鼢鼠睾丸的生长发育,揭示了褪黑素在高原鼢鼠季节性繁殖调控中的重要作用,对丰富高原鼢鼠繁殖调控理论具有重要意义。
季节性繁殖动物的性腺活性在全年中出现周期性变化,包括睾丸大小、精子发生以及生殖激素的合成和分泌等(郝伟丽等,2016;Wanget al.,2017)。本研究发现,高原鼢鼠性腺发育在非繁殖期出现明显退化,具有季节性繁殖特征。高原鼢鼠属于地下啮齿动物,感光受洞道限制,安晓宇等(2020)发现高原鼢鼠褪黑素水平在繁殖期和非繁殖期有显著差异,说明褪黑素可能参与了高原鼢鼠的季节性繁殖调控,但有关机理未知。本研究发现MTNR1a和MTNR1b基因在雄性高原鼢鼠下丘脑、垂体和睾丸中显著表达。相似的研究也在其他物种中报道,如甘加藏羊(Ovis aries)整个发情周期下丘脑、垂体和卵巢中MTNR1a基因均有表达,且不同时期存在差异(杨大鹏等,2019)。MTNR1a和MTNR1b基因在牦牛下丘脑、垂体以及睾丸中明显表达 (陈健楠等,2020)。王玉军等(2020)通过对高原鼠兔(Ochotona curzoniae)繁殖期注射褪黑素处理,发现其睾丸重量下降,精子发生停止,而在非繁殖期注射褪黑素受体拮抗剂,发现睾丸重量显著增加,各级生殖细胞重新出现,精子发生恢复。这提示光周期诱导的褪黑素是引起季节性繁殖动物性腺周期性变化的潜在原因。作为相同高原环境下生存的高原鼢鼠,褪黑素可能有类似的作用,推测褪黑素通过与HPG轴上受体结合调控高原鼢鼠的季节性繁殖,但这还需后续通过注射褪黑素处理等研究来进一步验证。
利用原位杂交组织化学技术发现,MTNR1a和MTNR1bmRNA在小鼠下丘脑SCN中表达(Dubocovichet al.,1998)。这与本研究在下丘脑不同时期检测到MTNR1a和MTNR1b基因的表达相似。下丘脑SCN是控制行为、代谢和生理节律的主时钟(Reppert and Weaver,2001;Gillette and Mitchell,2002),包括光信号调节松果体褪黑素的合成与分泌(Moore,1995)。研究发现,松果体产生的内源性褪黑素可通过反馈机制影响MTNR1a和MTNR1b基因的表达,调节SCN神经元活性和昼夜节律(Gillette and Mitchell,2002)。本研究中,MTNR1a和MTNR1bmRNA在高原鼢鼠下丘脑中表达,暗示其在SCN中转录翻译的受体可能与褪黑素结合,调节神经元活性和昼夜节律,使之在行为上与一天中光周期的变化同步,进而适应一年中的季节变化。研究发现,位于下丘脑弓状核中的亲吻素(kisspeptins,Kp)是一种调节生殖功能的激活剂(Anselet al.,2010)。Simonneaux等 (2013)将金色中仓鼠(Mesocricetus auratus)暴露在短日照条件下,手术切除松果体去除内源性褪黑素影响,发现弓状核中Kp蛋白表达增加,并在几周内金色中仓鼠恢复到繁殖期状态;Fischer等(2017)证实下丘脑弓状核中也存在MTNR1a,这说明褪黑素通过与MTNR1a结合参与调节Kp蛋白的表达水平,间接调控动物繁殖。本研究中,MTNR1a基因表达量在高原鼢鼠下丘脑中存在明显的季节差异,说明MTNR1a基因转录翻译出不同水平的受体与褪黑素结合,但具体的通路,如是否参与调节下丘脑弓状核中Kp蛋白的表达,间接调控高原鼢鼠的繁殖状态,还需要进一步分析验证。
在绵羊垂体结节部体外培养细胞的研究中发现,佛司可林(Forskolin)能诱导MTNR1a基因表达增加,但这种增加又被褪黑素本身所抑制(Barrettet al.,1996);同样,给处于黑暗环境中的大鼠施加光照,发现MTNR1a基因的表达在1 h内显著增加,相反在施加光照前15 min注射外源褪黑素可以逆转上述现象,说明褪黑素对大鼠垂体结节部MTNR1a基因的表达具有抑制作用(Guerreroet al.,2000)。这些研究说明垂体中MTNR1a基因的表达受褪黑素本身抑制,而高原鼢鼠内源性褪黑素水平在繁殖期显著低于非繁殖期(安晓宇等,2020)。本研究发现高原鼢鼠繁殖期垂体中MTNR1a基因的相对表达量显著高于非繁殖期,基因的表达量与激素水平呈负相关,这与以上结果相似。垂体结节部是褪黑激素受体密度最高的部位(Masson-Pévet and Gauer,1994)。在原仓鼠 (Cricetus cricetus)垂体结节部产生促甲状腺素(Hyroid stimulating hormone,TSH)的细胞上,发现MTNR1a高表达(Dardenteet al.,2003),说明褪黑素影响TSH的合成和分泌。TSH通过调控2型甲状腺素脱碘酶(Type 2 thyroid hormone deiodinase)和3型甲状腺素脱碘酶(Type 3 thyroid hormone deiodinase)的转换,调节甲状腺素(Thyroid hormone)水平(Hanonet al.,2008;Klosenet al.,2013),进而诱导GnRH神经元活化促进动物繁殖(Nishiwaki-Ohkawa and Yoshimura,2016)。此外,褪黑素与受体结合还可调节垂体远侧PL的分泌和门脉血管的发生,从而影响动物繁殖(Lincoln and Clarke,1994),证明垂体的MTNR1a在动物的繁殖调控中发挥关键作用。综上可推断,繁殖期MTNR1a基因转录翻译的受体与低水平褪黑素结合,可能对高原鼢鼠繁殖活动的发生具有促进作用;相反,非繁殖期高水平的褪黑素抑制MTNR1a基因的表达,从而可能限制其繁殖活动的进行。陈健楠等(2020)在牦牛的垂体中检测到MTNR1bmRNA的表达,说明MTNR1b存在于牦牛垂体中,但对其在繁殖功能性状的研究较少,在本研究中同样检测到不同时期高原鼢鼠垂体中MTNR1b基因的表达,而繁殖期与非繁殖期表达差异不显著。
HPG轴上除了下丘脑和垂体外,性腺组织中也存在褪黑素受体结合位点(Clemenset al.,2001;Kuşet al.,2002)。本研究中,MTNR1a和MTNR1bmRNA在高原鼢鼠不同时期睾丸中均存在明显表达,表明褪黑素与受体结合直接影响高原鼢鼠睾丸的生长发育。外源褪黑素绵羊体外共培养发现,褪黑素能促进绵羊睾丸间质细胞和支持细胞分泌睾酮,并检测到MTNR1a基因的表达(Denget al.,2018)。而通过蛋白质印迹技术发现,雄性狍(Capreolus capreolus)睾丸中MTNR1a和MTNR1b的表达在发情期前(5月)和发情期(7—8月)均高于发情期后(9月),表明褪黑素通过与不同受体结合对雄性狍睾丸(即类固醇生成和精子发生)发育具有促进作用(Koziołet al.,2020)。与之相反,在欧洲雄性野牛(Bison bonasus)中发现,与发情期前(6月)相比,发情期后 (12月)检测到睾丸中MTNR1a和MTNR1b基因高水平表达,证明发情期后褪黑素与不同受体结合对欧洲野牛睾丸精子发生的抑制作用增强(Tabecka-Lonczynskaet al.,2017);同样将金色中仓鼠(Mesocricetus auratus)暴露在3种不同的光照条件下,发现睾丸类固醇合成减少,MTNR1a基因的表达增加并且伴随局部褪黑素水平的升高(Mukherjee and Haldar,2014),与本研究结果相似,褪黑素与MTNR1a和MTNR1b结合对睾丸组织发育具有抑制作用,这也表明MTNR1a和MTNR1b基因在睾丸中的功能性状存在物种差异。本研究在非繁殖期高原鼢鼠睾丸中检测到MTNR1a和MTNR1b基因高表达,推测在这一时期褪黑素与受体结合可能最大限度地抑制高原鼢鼠繁殖,从而减少能量损失来度过寒冷的冬季。为进一步探究褪黑素与睾丸间的关系,本研究利用免疫组化技术检测到睾丸的多种细胞类型中存在MTNR1a和MTNR1b的阳性信号,并存有差异,这表明褪黑素对高原鼢鼠睾丸的调控作用是在不同类型细胞上完成的。
综上所述,高原鼢鼠褪黑素受体基因在HPG轴上存在明显表达,且MTNR1a和MTNR1bmRNA在繁殖期与非繁殖期高原鼢鼠下丘脑、垂体和睾丸中的表达模式不同,推测褪黑素通过与不同类型细胞上的受体结合,直接调节高原鼢鼠睾丸的生长发育和精子发生。本研究为理解光周期调控高原鼢鼠季节性繁殖的机理提供了参考,同时对丰富地下物种季节性繁殖调控理论具有重要意义。然而,针对褪黑素对高原鼢鼠睾丸发育、精子发生的影响,后续仍需进一步研究。

