GPx5在牦牛隐睾附睾组织的分布特征及定位分析*
邢引弟,袁莉刚 ,陈少宇,马晓杰,杨大鹏,王 华,宋娟娟
(甘肃农业大学 动物医学院,甘肃 兰州 730070)
谷胱甘肽过氧化物酶-5 (glutathione peroxidase-5,GPx5)也称附睾特异性谷胱甘肽过氧化物酶,最早分离自鼠类附睾精子,其蛋白大小为35 ku,是GPX家族中硒非依赖型谷胱甘肽过氧化物酶[1]。REJRAJI等[2]研究表明:GPx5在附睾中有可溶性、游离性和结合性3种蛋白形式。GPX活性受到抑制或还原型谷胱甘肽数量不足均可引起脂质过氧化增多。TAYLOR等[3]提出哺乳动物GPx5通过还原底物硫氧还蛋白 (thioredoxin,Trx)、减少氧化物单体和二聚体形成从而发挥抗氧化作用。GPx5在附睾各区域的表达具有种属差异性。GRIGNARD等[4]研究报道:相比于马属动物,GPx5在牛附睾头部表达量较高;而GPx5在山羊[5]、小尾寒羊[1]和骆驼[6]等动物的附睾特异性表达,能够调节附睾管微环境活性氧含量,使精子免受脂质过氧化损伤,维持其活力和DNA完整性,且可防止精子在附睾尾部过早发生顶体反应,在雄性动物繁殖中发挥着重要作用。
在缺血或缺氧、离子辐射或紫外线照射等条件下,动物有机体可诱导附睾中的活性氧(reactive oxygen species,ROS)水平升高。细胞抗氧化保护机制不足时,ROS大量堆积,会对细胞产生毒性,导致氧化和抗氧化系统调节功能失衡。GPX能够及时清除生物体内的自由基并维持代谢平衡,通过还原性谷胱甘肽催化过氧化物,保护细胞因子、蛋白和脂质体等敏感生物分子,使其避免受到自由基的氧化损伤[7]。研究表明:精液中低含量的ROS在维持精子成熟、运动和获能等方面发挥着重要作用[8]。GPx5基因敲除小鼠的附睾尾部ROS水平升高,生育能力明显下降,流产率增加,子代发育出现缺陷[9]。研究发现:相比于正常大鼠,GPx5在去势大鼠附睾不表达;去势14 d的大鼠注射睾酮后其GPx5基因表达量明显增加,提示睾酮与GPx5基因表达量密切相关[10]。低氧环境中GPx5与附睾组织自由基结合,使之转化成易代谢的酸类物质加速自由基排泄,减轻附睾上皮细胞损伤,促进精子成熟[11]。牦牛长期生活在高原低氧环境,是典型的季节性发情动物,由于附睾微环境的改变,导致其繁殖力下降。本研究以高原成年牦牛正常附睾和隐睾附睾为研究对象,采用实时荧光定量PCR、蛋白免疫印迹、免疫组织化学及免疫组织荧光等技术检测其组织中GPx5的含量及分布特点,探讨GPx5在牦牛附睾中的抗氧化机制,以期为提高牦牛的繁殖能力技术研究提供理论依据。
1 材料与方法
1.1 试验材料
试验样品采自青海省西宁市大通牧区,选取体况相近的4岁成年牦牛8头,分为2组,正常组和隐睾组各4头。采用睾丸摘除手术取正常及隐睾附睾各8对,形态学组织样本(附睾头、附睾体和附睾尾)经4 mL/L福尔马林固定液固定备用;生物学试验组织样本置于液氮中,转入-80 ℃冰箱保存备用。
1.2 试验方法
1.2.1 样品制备
正常组及隐睾组附睾头、附睾体和附睾尾组织块进行常规梯度酒精脱水、石蜡包埋和切片机连续切片(片厚4 μm)。切片用于组织特殊染色、GPx5免疫组织化学SP法染色及阴性对照和免疫荧光染色。
1.2.2 正常附睾和隐睾附睾的组织结构特点
采用HE染色并观察。正常附睾和隐睾附睾组织样本置于4%多聚甲醛中固定24 h以上,经脱水、透明、浸蜡、包埋、切片、摊片、粘片和烤片,脱蜡至水后将切片用苏木精染色,经盐酸分化、自来水返蓝和水洗后依次投入梯度酒精中脱水,再加入伊红染色,经无水乙醇和二甲苯透明,最后用中性树胶封片,进行镜检并采集图像,统计附睾管腔内外径、上皮厚度和纤毛长度。
1.2.3 正常附睾和隐睾附睾的免疫组织化学分布
采用免疫组织化学染色并观察。切片经常规梯度酒精脱蜡和水洗后,采用柠檬酸盐缓冲液高温抗原修复10 min;PBS冲洗3次,滴加3%H2O2封闭过氧化物酶,37 ℃孵育15 min;PBS水洗,山羊血清白蛋白37 ℃孵育15 min,倾去勿洗,每张切片滴加50 μL兔源GPx5一抗(1∶400),阴性对照组用 0.01 mol/LPBS代替一抗,4 ℃过夜;PBS水洗后滴加生物素标记IgG工作液,37 ℃孵育15 min;PBS水洗,滴加辣根酶标记链霉卵白素工作液,37 ℃孵育15 min;滴加DAB显色液显色,苏木素(Mayer)复染3 min,自来水返蓝10 min,脱水、透明和封片后进行显微镜观察并拍照。附睾头、附睾体和附睾尾各选取3个平行组织块,显微镜下200倍视野随机选取10个圆形附睾小管,采用Image-Pro Plus 6.0软件采集数据,以积分光密度(IOD)对正常附睾和隐睾附睾的免疫组织化学分布进行分析。
1.2.4 实时荧光定量PCR检测GPx5基因相对表达量
通过GeneBank (https://www.ncbi.nlm.nih.gov/)查找牛源GPx5序列和β-actin序列,使用Primer-Blast 5.0设计引物,所用引物(表1)均由兰州天启基因生物有限公司合成。按照TransZol法提取牦牛正常附睾和隐睾附睾组织样品总RNA,用超微量紫外分光光度计检测RNA浓度和纯度,并使用反转录试剂盒合成cDNA,-20 ℃保存。以反转录的cDNA作为模板进行PCR扩增,发现引物特异性强,可进行qRT-PCR试验。反应总体系为20 μL,其中模板1 μL,2×TransStart Tip Green qPCR SuperMix 10 μL,上、下游引物各1 μL,ddH2O 7 μL;反应条件为94 ℃预变性30 s,94 ℃变性5 s,60 ℃退火延伸30 s,循环45次。正常组和隐睾组各存样300 μL,每个样品3个生物学重复。根据Ct值采用2-ΔΔCt分析GPx5mRNA的相对表达量。
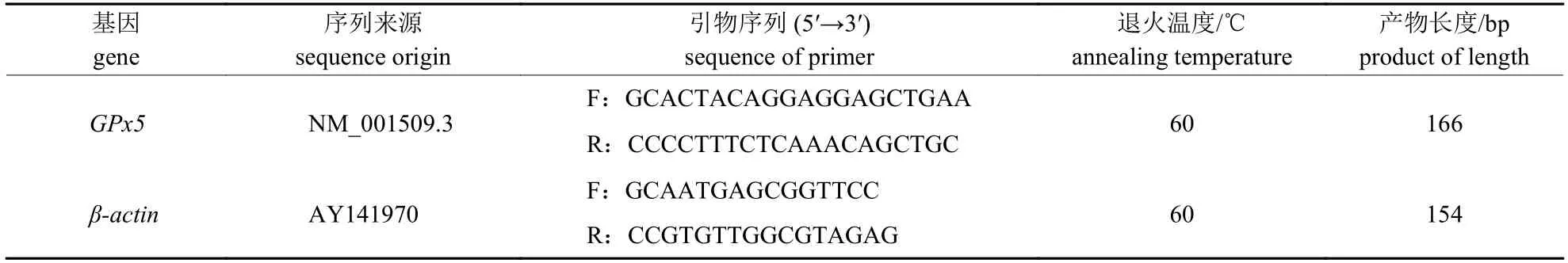
表1 GPx5和β-actin基因引物来源Tab.1 Source of primers for GPx5 and β-actin genes
1.2.5 Western-blot检测GPx5蛋白表达量
取牦牛正常附睾和隐睾附睾组织用液氮研磨,加入RIPA (组织裂解液) 1 mL,再加入PMSF 10 mL提取总蛋白,研磨组织样品置于4 ℃冰箱裂解30 min,于4 ℃条件下10 000 r/min离心15 min,吸取上清液为样品总蛋白。使用BCA试剂盒法进行总蛋白质量浓度测定,其蛋白质量浓度为280 pg/mL。待使用蛋白加入SDS-PAGE loading buffer (5×),金属浴95 ℃,变性10 min,保存至-20 ℃冰箱待用。变性蛋白经过12% SDSPAGE电泳分离,总蛋白量为1.68 pg,每个泳道上样6 μL,待电泳结束后转至PVDF膜。将转印有蛋白的PVDF膜放入5%脱脂奶粉中室温封闭2 h,再分别使用兔源GPx5一抗(1∶500)和鼠源β-actin一抗(1∶3 000) 4 ℃孵育过夜。PBST洗膜2 h后,加入二抗(1∶3 000),37 ℃孵育1 h,最后使用ECL曝光及成像采集。
1.2.6 GPx5的定位分析
采用免疫荧光组织化学染色并观察。将石蜡切片,经常规梯度酒精脱蜡和水洗后,采用柠檬酸盐缓冲液抗原修复,PBS水洗3次,滴加山羊血清白蛋白37 ℃孵育15 min;PBS水洗3次,每张切片滴加50 μL兔源GPx5一抗(1∶400),4 ℃孵育过夜;PBS水洗后进行避光操作,滴加荧光素Alexa Fluor 555标记链霉亲和素(1∶500)孵育50 min;PBS水洗,滴加DAPI染色液(1∶800)孵育15 min;PBS水洗,抗荧光淬灭封片剂封片。采用激光扫描共聚焦显微镜观察并拍照。
1.3 统计与分析
数据通过SPSS 25.0进行独立样本t检验分析,结果用“平均值±标准差”表示,P<0.05表示差异显著,P<0.01表示差异极显著,P≥0.05表示差异不显著;采用Grandpad Primer 8.0作图。
2 结果与分析
2.1 牦牛正常附睾和隐睾附睾的组织结构特点
由图1可知:牦牛正常附睾被膜结构致密,基膜平整,附睾管发育良好,间质结缔组织分布均匀,血管丰富,附睾上皮细胞排列整齐,管腔内有大量精子;与正常附睾相比,隐睾组附睾基膜增厚内陷,管腔缩小,上皮细胞排列不整齐,附睾管腔内无精子形成,实质部分组织结构模糊,管周肌样细胞减少,间质疏松,血管壁皱缩。由图2可知:正常组附睾体和附睾尾的柱状上皮厚度极显著大于隐睾组(P<0.01),附睾头的柱状上皮厚度显著大于隐睾组(P<0.05);正常组附睾体管腔内径显著大于隐睾组(P<0.05),附睾头和附睾尾之间无显著差异(P>0.05);正常组附睾头和附睾尾的纤毛长度极显著大于隐睾组(P<0.01),附睾体的纤毛长度显著大于隐睾组(P<0.05);正常组和隐睾组的附睾管腔外径无显著差异(P>0.05)。

图1 牦牛正常附睾和隐睾附睾组织HE染色(1 000×)Fig.1 HE staining of normal epididymis and cryptorchidism epididymis of yak
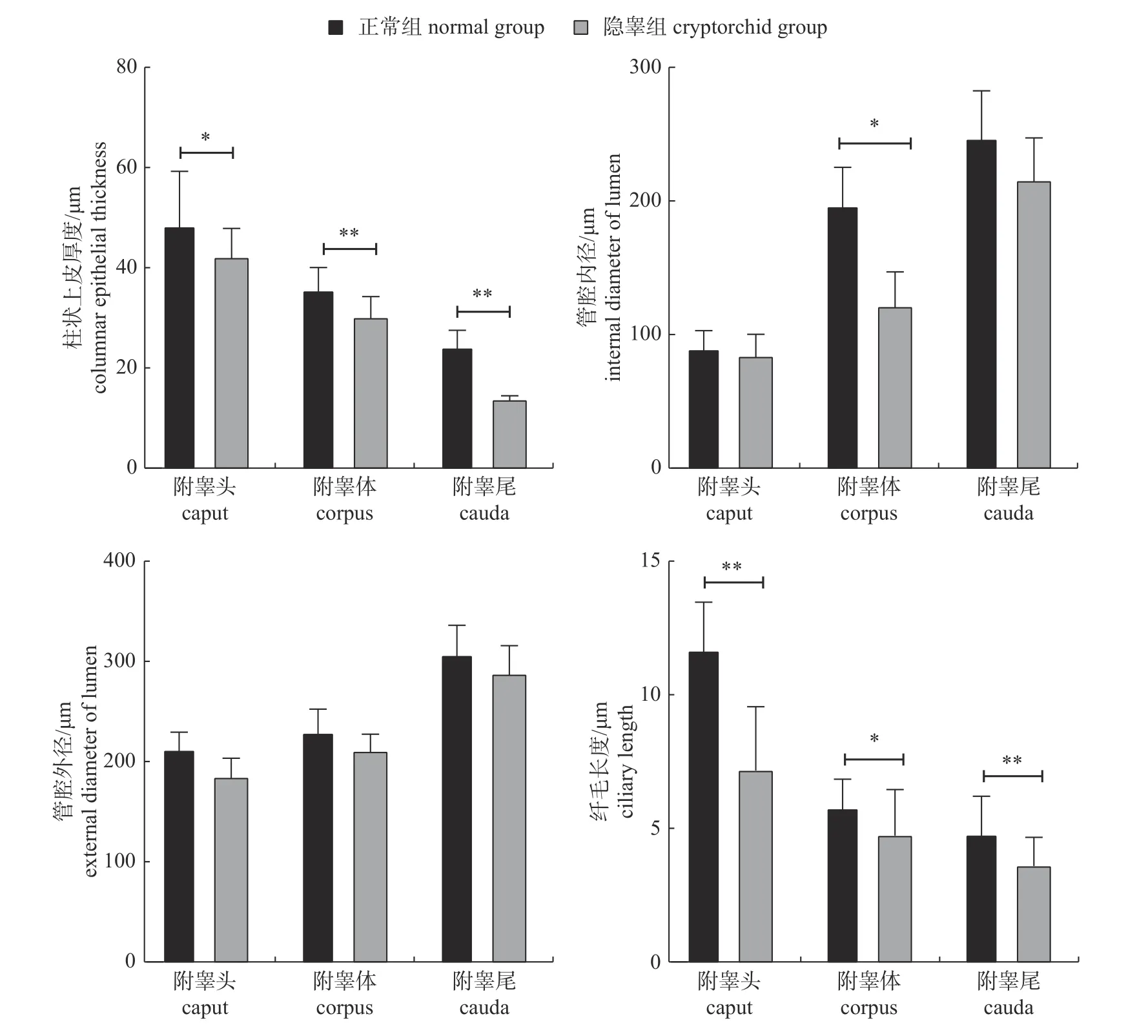
图2 牦牛正常附睾和隐睾附睾组织学指数特征Fig.2 Histologic parameters of normal epididymis and cryptorchidism epididymis of yak
2.2 GPx5在牦牛正常附睾和隐睾附睾的免疫组织化学分布比较
由图3可知:GPx5在正常组附睾头基细胞、附睾体主细胞和附睾尾管腔游离面强阳性表达,在附睾头静纤毛弱阳性表达;阴性对照组无阳性表达。隐睾附睾组织中,GPx5在附睾头上皮细胞和静纤毛、附睾体管腔游离面和管周肌样细胞以及附睾尾管腔游离面呈强阳性表达;阴性对照组无阳性表达。由图4可知:GPx5在正常附睾和隐睾附睾中的分布无显著差异(P>0.05)。

图3 GPx5在牦牛正常附睾和隐睾附睾免疫组织化学分布特点比较(1 000×)Fig.3 Comparison of GPx5 immunohistochemical distribution in normal and cryptorchidism epididymis of yaks

图4 GPx5在牦牛正常附睾和隐睾附睾阳性信号积分光密度值Fig.4 Integrated optical density of positive signals of Gpx5 in normal epididymis and cryptorchidism epididymis of yak
2.3 GPx5 mRNA在正常附睾和隐睾附睾中的相对表达量比较
由图5可知:GPx5mRNA在成年牦牛正常附睾头和附睾体的表达量极显著高于隐睾附睾(P<0.01),附睾尾的相对表达量在两者间无显著差异(P>0.05)。

图5 GPx5 mRNA在正常附睾和隐睾附睾中的相对表达量Fig.5 Relative expression levels of GPx5 mRNA in normal epididymis and cryptorchidism epididymis
2.4 GPx5蛋白在牦牛正常附睾和隐睾附睾的表达
由图6可知:GPx5蛋白在牦牛正常附睾头和附睾体的表达量明显,在隐睾附睾头和附睾体有少量表达;正常组附睾头和附睾体的GPx5蛋白表达量极显著高于隐睾组(P<0.01),附睾尾的GPx5蛋白表达量在2组间无显著差异(P>0.05)。

图6 GPx5蛋白在牦牛正常附睾和隐睾附睾的表达Fig.6 Expression of GPx5 protein in normal and cryptorchidism epididymis of yak
2.5 GPx5在正常附睾和隐睾附睾组织中不同部位定位分析
由表2和图7可知:GPx5在牦牛正常附睾和隐睾附睾的主细胞、基细胞、晕细胞、管周肌样细胞及管腔纤毛均有不同强度表达。正常附睾中,GPx5在附睾头基细胞和管周肌样细胞均呈强阳性表达,在晕细胞偶有阳性表达,在精子、纤毛和血管管壁呈弱阳性表达;GPx5在附睾体管腔上皮基底部呈弱阳性表达;GPx5在附睾尾基细胞呈强阳性表达,在管周肌样细胞呈中等强阳性表达,在血管内皮细胞呈中等阳性表达。相较于正常组,GPx5在隐睾附睾头主细胞无阳性表达,主要在上皮基底部、管周肌样细胞及血管呈强阳性表达,晕细胞偶见阳性表达;GPx5在隐睾附睾体近管腔游离面和间质组织中小血管呈阳性表达,基底部弱阳性表达;GPx5在隐睾附睾尾血管壁呈强阳性表达,管周肌样细胞偶见阳性表达,管腔游离面和基底部呈弱阳性表达。
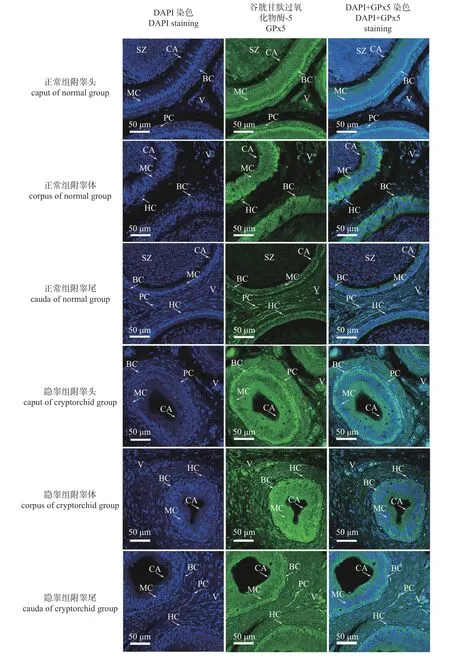
图7 GPx5在正常附睾和隐睾附睾组织中不同部位定位(200×)Fig.7 GPx5 localization in different parts of normal and cryptorchidism epididymis tissues

表2 GPx5在牦牛正常附睾和隐睾附睾组织中不同部位的分布密度Tab.2 Distribution density of GPx5 in different parts of normal and cryptorchidism epididymis of yak
3 讨论
附睾是由睾丸输出管和附睾管组成高度弯曲的管道,向后与输精管连接,可分为附睾头、附睾体和附睾尾。啮齿动物在输出管和附睾头之间还有1个初始段[11]。附睾头和附睾体分泌物与保持精子受精能力密切相关,附睾尾则对维持精子活力发挥着重要作用[12]。SULLIVAN等[13]发现:人附睾管腔直径从附睾近端到远端逐渐增大,近端上皮较厚,富含大量纤毛;附睾尾端膨大,上皮厚度减小,精子数量显著增加,与低蛋白合成和分泌活性有关。体外研究证明:附睾管上皮细胞也参与精子细胞间信号传递[14]。隐睾附睾是由于睾丸异位未通过腹股沟管沿腹膜鞘突下降至阴囊内,长时间停留在腹腔或腹股沟内,高温低氧环境使附睾局部组织受损[15]。实验性小鼠隐睾症表明:温度升高对附睾尾功能有显著影响[16]。本研究中,牦牛正常附睾头至附睾尾上皮逐渐变薄,管腔上皮细胞结构完整,附睾管腔可贮存大量精子,管腔外围结缔组织丰富;与正常组相比,隐睾组附睾没有精子贮存,间质内胶原纤维增生,组织结构异常。隐睾附睾不适当的修复会引起睾丸及附睾实质与间质细胞肿瘤的发生[17]。本研究牦牛隐睾附睾小管基膜增厚内陷,间质及管腔面积较正常组显著增加,间质组织胶原纤维异常增生,提示隐睾附睾局部有纤维化的趋势。
附睾特异表达的GPx5具有很强的过氧化物转化能力[18]。有研究表明:GPx5基因在成年绵羊附睾头的表达量极显著高于附睾体和附睾尾,附睾体表达量显著高于附睾尾[5];GPx5基因主要在大鼠附睾头表达,在附睾体和附睾尾弱表达[2]。本研究结果与之相似,即:GPx5基因在牦牛正常附睾头、体、尾的表达逐渐减弱。GPx5作为附睾特异抗氧化剂,在附睾头大量表达,能够清除活性氧,使精子免受氧化损伤并维持受精能力。有研究报道:野生型雌性小鼠与GPx5基因缺失的雄性小鼠交配造成流产和胚胎缺陷,抗氧化酶缺失增加了精子的氧化应激[19];NOBLANC等[20]研究表明:snGPx4和GPx5基因双敲除小鼠表现出精核异常。本研究中,牦牛隐睾组GPx5基因在附睾头和附睾体中的相对表达量极显著低于正常组,但与正常组相比附睾尾表达无显著差异,因此,隐睾主要影响附睾头和附睾体GPx5分泌,影响局部微环境的抗氧化调节机制,这也是隐睾组附睾管腔无正常精子的原因之一。
GPx5蛋白主要由附睾头上皮细胞合成,分泌到管腔与精子质膜结合,以还原性谷胱甘肽为底物,催化过氧化氢物和磷脂氢过氧化物,调节管腔微环境的ROS水平[21]。GPx5可促进精子成熟,使缺乏抗氧化酶的精子得到补偿[22]。研究表明:GPx5在小鼠[2]、绵羊[5]和骆驼[6]等均以附睾头为主要表达位置,从附睾头到尾表达量逐渐下降。GPx5蛋白主要由附睾头大量分泌并支持精子成熟;附睾尾端维持精子静止状态以保存能量,并在精子储存过程中发挥作用[23]。与此相一致,本研究GPx5蛋白在正常附睾和隐睾附睾的表达结果与GPx5基因一致,正常附睾头和附睾体极显著高于隐睾附睾头和附睾体,两者尾部差异不显著,提示GPx5蛋白对正常精子的产生发挥着重要作用,隐睾时GPx5蛋白表达下降可能会影响附睾的局部抗氧化机制。
附睾腔内的假复层上皮由主细胞、基细胞、顶端细胞、晕细胞及管周肌样细胞构成。TINGARI[24]研究发现:骆驼附睾上皮细胞主要由主细胞、基细胞、顶端细胞、晕细胞和暗细胞组成。不同动物附睾由于有独特的上皮细胞类型和功能特点,其组织化学特征也有明显差异[25]。主细胞是附睾蛋白分泌的主要来源[26]。研究发现:GPx5在附睾头上皮细胞表达后分泌到附睾管腔,以补偿未成熟精子抗氧化物酶的缺失,增加精子抗氧化能力,在雄性生殖系统中发挥着重要作用[27]。本研究中,牦牛正常组附睾头主细胞、基细胞和管腔游离面均有GPx5表达,这与GPx5在骆驼附睾中的表达结果一致,提示在附睾头上皮合成的GPx5通过静纤毛分泌到管腔中,为精子运输中免受氧化损伤和维持DNA的完整性调节局部微环境;但是,GPx5在隐睾附睾头主细胞几乎无表达,提示其在主细胞的表达缺失可能使精子抗氧化能力下降,不能正常发育。有研究报道:附睾体基细胞数量较多,而尾部较少,基细胞与相邻主细胞相互作用介导细胞吞噬作用,调节电解质和运输水分,维持上皮细胞稳定性及其机械作用[28]。本研究中,正常附睾体基细胞GPx5呈强阳性表达,附睾尾有少量表达,表明其与主细胞高表达GPx5相互作用,吞噬细胞代谢产物,维持细胞间信号传输。隐睾附睾体基细胞数量减少,GPx5无阳性表达,提示隐睾时基细胞的正常发育受到影响,数量减少,抗氧化能力降低。晕细胞包括淋巴细胞、单核细胞和巨噬细胞等多种免疫细胞,在附睾头、体和尾均有分布[29]。本研究中,晕细胞在正常附睾上皮基部以及附睾头、体和尾均有分布,GPx5呈阳性表达;GPx5在隐睾附睾头、体和尾的晕细胞均无阳性表达,提示隐睾晕细胞GPx5表达异常或影响附睾免疫功能。顶端细胞保护腔内精子免受氧化攻击,胞质内线粒体生成大量 ATP,在精子成熟过程以及细胞膜运输 H+和 Cl-过程中发挥作用[30]。本研究中,顶端细胞在正常附睾管腔上皮均有分布,附睾尾部顶端细胞GPx5呈强阳性表达,表明顶端细胞可明显影响附睾尾部管腔微环境调节。隐睾附睾头、体和尾顶端细胞GPx5呈强阳性表达,提示隐睾时附睾顶端细胞对微环境的调节能力并未受到影响,其机理有待进一步研究。
4 结论
高原低氧环境下,牦牛隐睾附睾趋向纤维化;与正常组相比,GPx5在牦牛隐睾附睾头及附睾体的表达显著降低,影响局部微环境的抗氧化调节,且主要表现为主细胞及基细胞的表达缺失,提示其与精子氧化应激损伤及发育异常密切相关。

