银杏内酯B 对帕金森病模型大鼠的保护作用
丁旭,殷紫,邓祥敏,张艳军,宋晓莉
1.江苏护理职业学院药学与中药学院,江苏 淮安 223005;2.淮安广济医药连锁有限公司,江苏 淮安223001
帕金森病(Parkinson's disease,PD)是仅次于阿尔茨海默病的第二大神经系统退行性疾病,对全球数百万人造成严重影响[1]。随着人口的迅速老龄化,PD 的预防和治疗迫在眉睫。目前,用于治疗PD 的药物能够改善患者症状,尚缺乏神经保护作用[2]。有研究显示,植物提取物和植物化学物质可通过抗氧化和抗炎发挥对PD 的神经保护作用[3]。银杏内酯B(ginkgolide B,GB)为银杏叶提取物,是一种强效的血小板活化因子拮抗剂,具有明显的神经保护作用[4]。Wu 等[5]研究发现,银杏内酯B 与原儿茶酸联合应用可以增强对PD 的治疗效果。但GB 神经保护作用的机制有待阐明。本研究以GB 治疗PD 模型大鼠,探讨GB 对PD 神经功能的保护作用及其可能机制,旨在为PD 治疗提供可靠根据。
1 材料与方法
1.1 实验动物、试剂和仪器
健康SPF 级别SD 雄性大鼠,体重200~220 g,动物许可证号:SCXK(苏)2020-0006,由本省实验动物中心提供。将大鼠饲养于本院实验室SPF 级别动物房中,温度20~25 ℃,湿度55%~60%,12 h 光照和12 h暗处理交替,使用标准饲料和水饲养,自由进食和饮水。GB(南京紫曦生物制品有限公司);美多芭(上海罗氏制药有限公司);6-羟基多巴胺(6-OHDA)、阿扑吗啡(美国艾美捷公司);丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、还原型谷胱甘肽(reduced glutathione,GSH)检测试剂盒(南京建成生物工程研究所);白介素-6(Interleukin-6,IL-6)、白介素-1β(Interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA 试剂盒(上海酶联生物公司);组织裂解液(上海威奥生物科技有限公司);BCA 蛋白定量试剂盒、鼠单克隆抗体GAPDH(广州泛思生物科技有限公司);PI3K、Akt、p-PI3K、p-Akt 一抗(美国CST 公司);羊抗兔二抗(北京博尔迈生物技术有限公司);酶标仪(美国Bio-Rad 公司);化学发光检测仪(美国贝克曼库尔特有限公司)。
1.2 方法
1.2.1 分组及PD 模型制备 将大鼠随机分为6 组:Sham 组、模型组、美多芭组和GB 低、中、高剂量组,每组8 只。按照文献[6],腹腔注射水合氯醛麻醉大鼠后,将其固定于立体定向仪上,取俯卧位,牙齿固定于前方,两侧耳棒插入外耳道;碘伏消毒,备皮,无菌刀切开头部皮肤,对筋膜肌肉予以分离,精准认定前囟位置;将右侧脑前内侧束为立体定向注射位点,使用微量注射器垂直进针,徐缓注射2 μL 6-OHDA(8 μg),速度为0.5 μg/min,注射完留针3 min;缝合伤口,将大鼠放回笼内,Sham 组大鼠右侧脑前内侧束立体定向注射生理盐水(4 μL);术后2 周腹腔注射阿扑吗啡,诱发大鼠旋转行为,记录其30 min 内旋转圈数,转速>420 r/h 即为造模成功。GB 低、中、高剂量组予以15、30、60 mg/kg 剂量GB 腹腔注射,美多芭组予以20 mg/kg 美多芭(Madopar)灌胃,Sham 组、模型组予以等量0.9%氯化钠溶液灌胃,每天1 次,共4 周。
1.2.2 行为学检测 用阿扑吗啡(5 mg/kg)诱导,检测各组大鼠给予治疗药前12 h 及最后给药12 h 在开阔、空旷的空间30 min 内旋转的圈数。
1.2.3 氧化应激指标检测 4 周以后,采用脊髓脱臼法将大鼠处死,立即断头取脑,取大鼠脑组织黑质部位,加入生理盐水匀浆,采用试剂盒检测MDA、SOD活性、GSH 水平,严格按照说明书进行实验操作。
1.2.4 炎症因子检测 取样方法同上,通过ELISA 检测IL-6、IL-1β、TNF-α 水平,步骤如下:每孔加入100 μL 待测样品,同时加入100 μL 不同浓度的标准品;封板,4℃孵育过夜;洗涤液洗板3 次,彻底甩干;加入100 μL 二抗,封板,37 ℃孵育1 h,洗涤液洗板3 次,彻底甩干;加入100 μL TMB 显色底物,室温避光孵育10 min;加入100 μL 终止液,于10 min 内在450 nm 波长处读取各孔OD 值,绘制标准曲线,并计算各样品对应的浓度值。
1.2.5 Western blot 检测PI3K/Akt 信号通路 4 周后,采用脊髓脱臼法将大鼠处死,立即断头取脑,在冰上取黑质和纹状体组织进行彻底匀浆,加入组织裂解缓冲液(1 μL/2 μg),并于超声裂解仪中裂解组织,15000 r/min 离心15 min,提取组织总蛋白;采用BCA法测定组织蛋白浓度,接着进行Western blot 蛋白分析,配制分离胶和浓缩胶,电泳,转膜,封闭,加一抗PI3K(1:500)、AKT(1:500)、p-PI3K(1:500)、p-AKT(1:500)、GAPDH(1:1000),于4 ℃孵育过夜,加二抗羊抗兔IgG(1:2000)于室温孵育2 h,进行抗体杂交,显色,使用Image J 软件分析所扫描的图像,具体步骤为:将条带转换为灰度图像,再将条带区域变成亮色,背景区域变成暗色,然后沿着目标条带的边缘画线,将目标条带圈起来,操作重复3 次,取平均数,得到目标条带的平均灰度值。
1.2.6 抑制PI3K/Akt 信号通路对大鼠氧化应激指标、炎症因子水平的影响 加入PI3K/Akt 信号通路LY294002 抑制剂,将大鼠随机分为5 组:Sham 组、Model 组、Ginkgolide B 60 mg/kg 组、LY294002 组、(GB 60 mg/kg+LY294002)组,每组8 只,各组大鼠检测氧化应激指标、炎症因子水平,方法参照1.2.3 和1.2.4。
1.3 统计学分析
应用SPSS 20.0 软件和GraphPad Prism 5.0 软件分析处理数据,计量数据以均数±标准差()形式进行统计描述,多组间数据对比采用单因素方差分析,两组间数据对比采用t检验,P<0.05 表示差异存在统计学意义。
2 结果
2.1 大鼠行为学检测
治疗前,各组大鼠30 min 内旋转圈数无明显差异(P>0.05);治疗后,GB 低剂量组与模型组行为学检测比较无明显差异(P>0.05),美多芭组和GB 中、高剂量组大鼠旋转圈数明显少于模型组(P<0.05)(图1)。

图1 银杏内酯B 对阿朴吗啡诱导的帕金森模型大鼠旋转行为的影响*P<0.05,与模型组比较n=8Fig.1 Effects of Ginkgolide B on rotation behaviors of model rats with apomorphine-induced Parkinson’s disease*P<0.05,compared with the model group, n=8
2.2 大鼠氧化应激指标水平
与Sham 组比较,模型组大鼠MDA 水平明显升高(P<0.05),SOD、GSH 水平明显降低(P<0.05);GB 低剂量组与模型组比较无明显差异(P>0.05),美多芭组和GB 中、高剂量组大鼠MDA 水平明显低于模型组(P<0.05),SOD、GSH 水平明显高于模型组(P<0.05)(图2)。
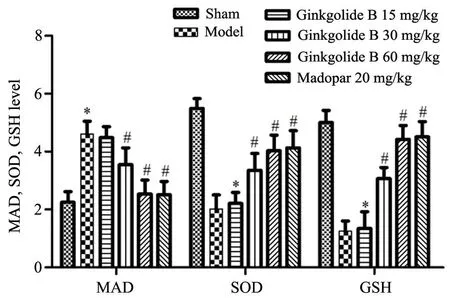
图2 银杏内酯B 对帕金森模型大鼠脑内MDA、SOD、GSH 水平的影响*P<0.05,与Sham 组比较 #P<0.05,与模型组比较n=8Fig.2 Effects of Ginkgolide B on levels of MDA,SOD and GSH in the brain of rats with Parkinson's disease*P<0.05,compared with the sham group;#P<0.05,compared with the model group, n=8
2.3 大鼠炎症因子水平
与Sham 组比较,模型组大鼠IL-6、IL-1β、TNF-α水平明显升高(P<0.05);GB 低剂量组与模型组比较无明显差异(P>0.05),美多芭组和GB 中、高剂量组大鼠IL-6、IL-1β、TNF-α 水平明显低于模型组(P<0.05)(图3)。
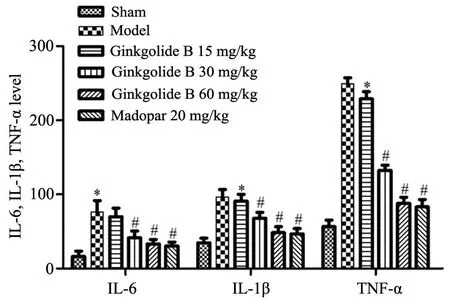
图3 银杏内酯B 对帕金森模型大鼠脑内IL-6、IL-1β、TNF-α 水平的影响*P<0.05,与Sham 组比较 #P<0.05,与模型组比较n=8Fig.3 Effects of Ginkgolide B on levels of IL-6,IL-1β and TNF-α in the brain of rats with Parkinson's disease*P<0.05,compared with the sham group;#P<0.05,compared with the model group, n=8
2.4 大鼠黑质和纹状体组织PI3K/Akt 信号通路
Western blot 结果显示,各组PI3K、Akt 蛋白表达比较无明显差异(P>0.05),与Sham 组比较,模型组大鼠p-PI3K、p-Akt 蛋白表达明显下调(P<0.05);与模型组比较,GB 低剂量组无明显改变(P>0.05),美多芭组和GB 中、高剂量组大鼠p-PI3K、p-Akt 蛋白表达明显上调(P<0.05)(图4)。

图4 银杏内酯B 对帕金森模型大鼠黑质和纹状体PI3K、Akt、p-PI3K、p-Akt 蛋白表达的影响*P<0.05,与Sham 组比较 #P<0.05,与模型组比较n=8Fig.4 Effects of Ginkolide B on protein expressions of PI3K,Akt,p-PI3K and p-Akt in the substantia nigra and striatum of model rats with Parkinson’s disease.*P<0.05,compared with the sham group;#P<0.05,compared with the model group, n=8
2.5 抑制PI3K/Akt 信号通路对大鼠氧化应激指标、炎症因子水平的影响
Western blot 结果显示,与GB 60 mg/kg 组比较,LY294002 组大鼠p-PI3K、p-Akt 蛋白表达明显下调(P<0.05);与 LY294002 组比较,(GB 60 mg/kg+LY294002)组大鼠p-PI3K、p-Akt 蛋白表达明显上调(P<0.05),表明抑制PI3K/Akt 信号通路可削弱GB 对大鼠p-PI3K、p-Akt 蛋白的下调能力,而加入GB 可一定程度恢复GB 对大鼠p-PI3K、p-Akt 蛋白的上调能力(图5A 和B)。
与GB 60 mg/kg 组比较,LY294002 组大鼠MDA水平明显升高(P<0.05),SOD、GSH 水平明显降低(P<0.05);与 LY294002 组比较,(GB 60 mg/kg+LY294002)组大鼠MDA 水平明 显降低(P<0.05),SOD、GSH 水平明显升高(P<0.05),表明抑制PI3K/Akt 信号通路可削弱GB 对大鼠MDA 水平的下降能力和对SOD、GSH 水平的升高能力,加入GB 可一定程度恢复GB 对大鼠MDA、SOD、GSH 水平的调节能力(图5D)。
与GB 60 mg/kg 组比较,LY294002 组大鼠IL-6、IL-1β、TNF-α 水平明显升高(P<0.05);与LY294002 组比较,(GB 60 mg/kg+LY294002)组大鼠IL-6、IL-1β、TNF-α 水平明显降低(P<0.05),表明抑制PI3K/Akt 信号通路可削弱GB 对大鼠IL-6、IL-1β、TNF-α 水平的下降能力,而加入GB 可一定程度恢复GB 对大鼠IL-6、IL-1β、TNF-α 水平的下降能力(图5C)。
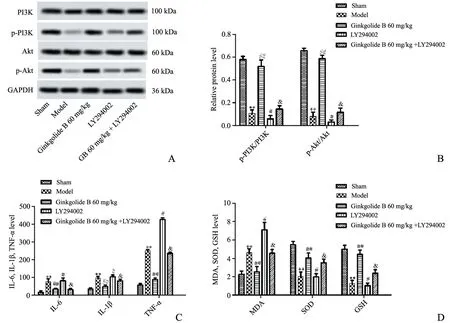
图5 抑制PI3K/Akt 信号通路对帕金森病模型大鼠氧化应激指标和炎症细胞因子的影响A、B:Western blot 检测PI3K、Akt、p-PI3K、p-Akt 蛋白表达 C:ELISA 检测IL-6、IL-1β、TNF-α 水平 D:试剂盒检测MDA、SOD 活性、GSH水平**P<0.01,与Sham 组比较 ##P<0.01,与模型组比较 #P<0.05,与GB 60 mg/kg 组比较 &P<0.05,与LY294002 组比较n=8Fig.5 Effects of inhibiting PI3K/Akt signaling pathway on oxidative stress indexes and inflammatory cytokines of model rats with Parkinson's diseaseA~B: Detection of protein expressions of PI3K,Akt,p-PI3K and p-Akt by Western blot; C: Detection of IL-6,IL-1β and TNF-α by ELISA; D:Detection of MDA,SOD activity and GSH level by kit;**P<0.01,compared with the sham group;##P<0.01,compared with the model group;#P<0.05,compared with the GB 60 mg/kg group;&P<0.05,compared with the LY294002 group, n=8
3 讨论
PD 是由脑黑质多巴胺能神经元遭到破坏所诱发的进行性神经退行性疾病[7]。PD 发病机制复杂,目前认为,在PD 病理生理过程中有神经炎症、氧化应激、线粒体功能障碍、神经递质失衡、凋亡以及遗传等多种因素共同参与。IL-6、IL-1β、TNF-α 均是促炎症因子,一方面可激活小胶质细胞,升高其活性,进而诱导多巴胺能神经元细胞损伤;另一方面还可结合多巴胺能神经元细胞相关受体,诱导其发生细胞凋亡,进而加重PD 病情[8]。氧化应激为PD 发病最重要的病理生理基础之一,研究显示,多巴胺能神经元受损早期氧化应激水平明显升高[9]。MDA、SOD、GSH 是机体最重要的抗氧化剂和氧化应激调节剂,SOD 是机体抵御活性氧的第一道防线,可作为活性氧清除剂,保护多巴胺能神经元。文献报道,PD 大鼠脑组织黑质部位处于氧化应激状态,SOD、谷胱甘肽过氧化物酶以及过氧化氢酶等抗氧化应激因子水平降低,MDA水平升高,造成抗氧化应激系统功能异常,进而导致多巴胺能神经元损伤,最终损伤PD 大鼠神经功能[10]。本研究发现,6-OHDA 诱导的大鼠PD 模型中,大鼠右侧脑半球氧化应激指标MDA 明显升高,SOD、GSH明显降低,炎症因子IL-6、IL-1β、TNF-α 水平明显升高,提示大鼠抗氧化应激体系遭到6-OHDA 的破坏,炎症损伤加重。予以美多芭和中、高剂量GB 干预后,大鼠行为学明显改善,且MDA 和IL-6、IL-1β、TNF-α 水平更低,SOD、GSH 水平更高,表明中、高剂量GB 干预可激活大鼠抗氧化应激体系,减轻神经炎症损伤,保护多巴胺能神经元,继而改善大鼠行为学。提示中、高剂量GB 有可能成为PD 神经保护作用的新靶点。张辉等[11]研究显示,银杏叶提取物可改善PD 大鼠氧化应激状态,起脑保护作用。刘星亮等[12]报道,GB 对体外诱导的PD 模型细胞具有保护作用,能够抑制细胞凋亡,提高神经元细胞存活率,提示GB可用于治疗神经退行性疾病。本研究结果与之一致。PI3K/Akt 信号通路是细胞内最重要的信号转导通路之一,在细胞凋亡、生长等过程中行使重要功能。证据表明,PI3K/Akt 信号通路可调控细胞凋亡和小胶质细胞活化,抑制神经炎症,防治活性氧积累,进而控制氧化应激水平,对多巴胺能神经元起到神经保护作用[13]。Gong 等[14]指出,SHC3 沉默可能通过下调PD大鼠PI3K-AKT-FoxO 信号通路,进而加重黑质多巴胺能神经元氧化应激损伤。一项体内和体外实验表明,激活PI3K/Akt 信号通路可改善PD 小鼠运动障碍,抑制神经元凋亡和炎症反应[15]。为进一步通过体内实验探究GB 发挥PD 神经功能保护作用的可能机制,本研究检测PI3K/Akt 信号通路蛋白表达情况,结果显示,予以GB 干预以后,GB 中、高剂量组大鼠p-PI3K、p-Akt 蛋白表达明显上调,表明中、高剂量GB 可上调PD 大鼠黑质和纹状体p-PI3K、p-Akt 蛋白表达。GB治疗PD 的作用机制可能是通过激活PI3K/Akt 信号通路,促进蛋白磷酸化,进而发挥神经元保护作用。LY294002 是PI3K 的特异性抑制剂,可阻断蛋白激酶Akt 磷酸化。而本研究发现,采用LY294002 抑制PI3K/Akt 信号通路激活后,可阻断GB 诱导的p-PI3K、p-Akt 蛋白上调作用,加入GB 后这种作用又可得到一定恢复。此外,LY294002 组大鼠氧化应激和炎症损伤明显高于GB 60 mg/kg 组,(GB 60 mg/kg+LY294002)组氧化应激和炎症损伤明显减轻,进一步表明GB 是通过激活PI3K/Akt 信号通路来发挥对PD大鼠神经元的保护作用。尽管PI3K/Akt 信号通路抗PD 的具体作用机制尚不清楚,但有选择性地激活PI3K/Akt 信号通路可能会成为延缓PD 进展的新方向,为PD 预防和治疗提供全新思路。此次研究有待继续进行体外实验以深入研究分析。
综上所述,高剂量GB 可改善PD 大鼠行为学,增强抗氧化应激能力,减轻炎性损伤,起到一定保护作用,其机制可能与激活PI3K/Akt 信号通路有关,可为PD 的预防和治疗提供新的途径。

