二甲双胍对高脂饮食诱导的肥胖小鼠肝脏维生素B12的影响及维生素B12与糖脂代谢的关系*
简 颖, 郭婉蓉, 刘子瑜, 梁 华, 蔡梦茵, 许 雯, 徐 芬
(中山大学附属第三医院,广东省糖尿病防治重点实验室,广东 广州 510630)
随着人口老龄化与生活方式的变化,我国2 型糖尿病的患病率从1980年的0.67%[1]飙升至2017年的11.2%[2]。2 型糖尿病已成为我国主要的慢性病及老年病之一。二甲双胍(metformin,Met)因具有降糖效果明确、减轻体重、致低血糖风险小和降低心血管事件及死亡率等优点而被众多糖尿病诊治指南推荐为2 型糖尿病患者降糖治疗的一线用药和药物联合治疗中的基本用药[3]。然而,既往有临床研究提示Met可导致血清维生素B12水平下降甚至缺乏,从而引起巨幼细胞贫血和周围神经病变的可能[4-7]。
天然的维生素B12 由自然界微生物合成,高等动植物均不能靠自身合成[8]。人体获取它的主要方式是动物来源的食物,长期素食可导致维生素B12的缺乏,且它的吸收与胃肠道功能和状态密切相关[8]。食物中的维生素B12 与胃壁细胞分泌的内因子结合后,在回肠被机体吸收[9]。由于肠道菌群参与了Met 抑制机体吸收内因子-维生素B12 复合体的过程[10],而饮食作为对肠道菌群有重要影响的因素,可能在Met 抑制肠道维生素B12 吸收中起重要的作用。因此,本项工作拟在动物模型中探讨高脂饮食(high-fat diet,HFD)喂养下,Met 的干预是否影响C57BL/6J小鼠血清和肝脏中的维生素B12水平。
此外,临床研究提示血清维生素B12 缺乏与肥胖、脂代谢紊乱以及胰岛素抵抗等异常状态亦有关联[11-16],而肝脏维生素B12 与它们之间的研究较少,本项工作将探讨HFD诱导的肥胖小鼠模型中血清和肝脏维生素B12 水平与糖脂代谢表型之间的相关性。
材料和方法
1 实验动物模型的建立和干预方法
SPF 级 C57BL/6J 雄性小鼠 20 只,7~8 周龄,21~25 g,购于江苏集萃药康生物科技有限公司,许可证号为SCXK(苏)2018-0008。动物饲养于中山大学SPF 级实验动物中心,饲养室温度(22±2)℃,光照周期为明暗交替12 h,可自由获取饲料和水。适应性喂养1 周后,随机将小鼠分为普通饮食(chow diet,CD)组和HFD 组,分别给予普通饲料(热卡百分比碳水化合物占68%,脂肪占11%,蛋白质占21%)和高脂饲料(Research Diets,货号D12331;热卡百分比碳水化合物占25.5%,脂肪占58%,蛋白质占16.4%)喂养。HFD 喂养12 周诱导肥胖2 型糖尿病小鼠模型[17],造模成功后,将不同饮食的小鼠再各自随机地分为两组,小鼠分别可自由获取含或不含Met 的饮用水,干预为期 4 周,Met(Selleck,货号 S1950)的摄入剂量为250 mg·kg-1·d-1[18]。即分为 4组,分别为CD组、CD Met 组、HFD 组和 HFD Met 组,每组 5 只小鼠。每2 周收集小鼠体重和空腹血糖的数据。干预结束后,异氟烷吸入麻醉并使用颈椎脱臼法处死小鼠,采集血样和肝脏组织标本。新鲜全血静置半小时后进行离心,离心条件为1 700×g、4 ℃、20 min,收集血清放入-80 ℃冰箱保存。取适量肝脏组织标本置于4%多聚甲醛中固定后做组织学染色实验,其余组织放于-80 ℃冰箱保存。以上实验获中山大学动物实验伦理委员会批准。
2 实验试剂和方法
2.1 肝脏甘油三酯(triglyceride,TG)和总胆固醇(total cholesterol,TC)的测定 分别采用TG 定量比色试剂盒(BioVision,货号K622-100)和TC 定量比色试剂盒(BioVision,货号 K603-100)测定肝脏 TG 和TC 水平:(1)TG:取 20 mg 肝脏组织,加入200 μL 5%NP-40 溶液匀浆,匀浆完全后90 ℃金属浴加热5 min,冷却至室温后重复加热1 次,20 000×g、25 ℃离心2 min 后吸取上层清液,即获取肝脏甘油三酯测定的原液;(2)TC:以7∶11∶0.1 的比例配制氯仿、异丙醇和NP-40 的混合液,称取20 mg 肝脏组织,加入400 μL 的混合液进行匀浆,15 000×g、25 ℃离心 10 min 后小心吸取上层液体至新的EP 管,并于50 ℃中干燥,完成干燥后再放入真空环境下30 min,最后,用400 μL 胆固醇测定缓冲液溶解干燥的脂质,涡旋均匀,即获取肝脏胆固醇测定的原液。后续操作严格按照BioVision试剂盒说明书进行实验。
2.2 血清和肝脏维生素B12 的测定 采用维生素B12 ELISA 试剂盒(BioVision,货号 E4638-100)。(1)血清维生素B12 的测定:血清稀释5 倍后,严格按照该ELISA 试剂盒说明书进行操作,依次进行加样、孵育、洗涤、加酶、显色、测定吸光度(A)。通过标准品绘制标准曲线,根据各样品的A值算出对应的浓度(μg/L),再乘以稀释倍数得到血清实际的维生素B12浓度。(2)肝脏维生素 B12 的测定:取 10 mg 肝脏组织,用冷冻的 1×PBS 溶液(GBCBIO Technologies,货号G3524-2L)彻底清洗肝脏多余的溶血,加入90 μL的1×PBS 溶液以及1%蛋白酶抑制剂(Thermo Scientific,货号 78440)后充分匀浆,5 000×g、4 ℃离心 5 min后收集上清,再依次进行加样、孵育、洗涤、加酶、显色、测定吸光度(A)值和绘制标准曲线,最后计算出的肝脏维生素B12 浓度(μg/L),并用肝蛋白浓度(g/L)进行校正。
2.3 肝脏H&E 染色 将肝脏组织置于4%多聚甲醛溶液(GBCBIO Technologies,货号G0528)中固定过夜。石蜡包埋后,在室温下切片,厚度为3~5 μm。按照H&E 染色步骤依次对切片进行脱蜡、染色、脱水、透明和封片。使用DMi8倒置显微镜(Leica)拍照采集肝脏形态学图片。
2.4 肝脏油红O 染色 将肝脏组织置于4%多聚甲醛溶液(GBCBIO Technologies,货号G0528)中固定过夜,依次用20%及30%蔗糖溶液脱水24 h,脱水后经OCT(SAKURA,货号4583)包埋进行切片,切片时温度在-18 ℃,厚度为6~8 μm。按照每0.15 g 油红O粉末溶于30 mL异丙醇的比例配制油红O储存液,再以油红储存液∶双蒸水=3∶2配制油红工作液,现配现用。肝脏冰冻切片于油红工作液中染色1h,并在双蒸水下轻柔冲洗20 min;然后用苏木精染核及盐酸乙醇分色;最后用10%甘油封片;封片后用DMi8 倒置显微镜(Leica)进行拍照。染色全程以及拍片时均在避光条件下进行,整个过程在2 h内完成。
3 统计学处理
利用SPSS 25.0 软件进行统计分析。正态分布的计量资料以均数±标准误(mean±SEM)的形式表示。多组计量资料比较使用单因素方差分析,组间两两比较采用LSD-t检验。双变量符合正态分布的相关性分析采用Pearson 相关检验,若不符合正态分布则采用Spearman 相关检验。以P<0.05 为差异有统计学意义。
结 果
1 HFD 喂养小鼠的体重、血糖、血脂以及肝脏脂质显著增加
与CD 组相比,HFD 组小鼠体重和肝重显著增加(P<0.05);空腹血糖、血TG 水平及血TC 水平显著上升(P<0.05);肝脏TG和TC均显著增加(P<0.05),见图1。肝脏组织的HE染色显示高脂组的肝细胞空泡增多,油红O 染色显示高脂组的肝细胞脂滴染色更红,见图2。
2 Met干预对HFD喂养小鼠糖脂代谢的改善作用
与HFD 组对比,HFD Met 组小鼠体重和肝重显著减轻(P<0.05);空腹血糖、肝脏TG 和肝脏TC 均显著下降(P<0.05),见图1。肝脏组织的HE 染色显示Met干预的HFD组肝细胞空泡数量减少,油红O染色显示Met 干预的HFD 组肝细胞脂滴红染程度减轻,见图2。
3 Met 干预对HFD 喂养的小鼠血清和肝脏维生素B12的影响
4 组小鼠的血清维生素B12 水平两两比较差异无统计学显著性,见图3A;但小鼠肝脏维生素B12的水平,HFD Met 组与 CD Met 组对比显著下降(P<0.01),HFD Met 组与 HFD 组对比也显著下降(P<0.05),见图3B。
4 Met 干预HFD 喂养的肥胖2 型糖尿病小鼠后肝脏维生素B12 水平与糖脂代谢各指标间的相关性分析
CD Met组和HFD Met组这两个药物干预组小鼠的肝脏维生素B12 与各糖脂代谢表型做相关性分析:肝脏维生素B12 水平与体重(r=-0.660,P<0.05)、肝重(r=-0.881,P<0.01)、空腹血糖(r=-0.801,P<0.01)、血清TG水平(r=-0.917,P<0.01)、血清TC 水平(r=-0.873,P<0.01)、内脏脂肪组织重量(r=-0.753,P<0.05)和皮下脂肪组织重量(r=-0.759,P<0.05)呈显著负相关;肝脏维生素B12 水平与肝脏TG含量(r=-0.126,P=0.728)和肝脏TC含量(r=0.045,P=0.933)未观察到相关性,见图4。
5 Met 干预HFD 喂养的肥胖2 型糖尿病小鼠后血清维生素B12 水平与糖脂代谢各指标间的相关性分析

Figure 1. Comparison of glucose and lipid metabolism phenotypes in different groups. Mean±SEM. n=5.*P<0.05 vs CD group;#P<0.05 vs HFD group.图1 四个组间的糖脂代谢指标对比

Figure 2. Liver histological staining. A:HE staining;B:oil red O staining. The images indicated that liver lipid deposition was aggravated in the mice fed with high-fat diet(HFD),and metformin(Met)could alleviate hepatic steatosis.图2 小鼠肝脏组织学染色
CD Met组和HFD Met组这两个药物干预组小鼠的血清维生素B12 与各糖脂代谢表型做相关性分析:血清维生素B12 水平与体重(r=0.221,P=0.539)、肝重(r=-0.327,P=0.357)、空腹血糖(r=0.107,P=0.769)、血清 TG 水平(r=-0.282,P=0.431)、血清TC 水平(r=-0.008,P=0.983)、内脏脂肪组织重量(r=0.181,P=0.617)、皮下脂肪组织重量(r=0.164,P=0.651)、肝脏TG 含量(r=0.513,P=0.129)和肝脏TC 含量(r=-0.707,P=0.116)均未观察到相关性,见图5。
讨 论
口服Met 治疗2 型糖尿病导致血清维生素B12的缺乏在临床报道中较为常见[4-7],可引起或加重神经病变和血液系统疾病[19]。然而亦有研究指出Met的使用与血清维生素B12缺乏无显著相关性[20-21];有荟萃分析提示虽然Met 使血清维生素B12 水平下降并增加维生素B12 缺乏的发生风险,但与贫血和神经病变无显著关联[22]。新版的Met 临床应用专家共识中提到其禁忌症时,把维生素B12 缺乏未纠正者囊括进来[23];而在阐述Met对维生素B12的吸收是否产生影响时,表明仍未有定论;但共识建议长期使用Met者可每年测定一次维生素B12 的水平,如缺乏应适当补充维生素 B12[23]。

Figure 3. Serum and liver vitamin B12 levels in the 4 groups. A:there was no statistical difference in serum vitamin B12 level among all groups;B:liver vitamin B12 level decreased in HFD Met group compared with CD Met group. Mean±SEM. n=5. ††P<0.01 vs CD Met group;#P<0.05 vs HFD group.图3 四个组血清和肝脏维生素B12的含量
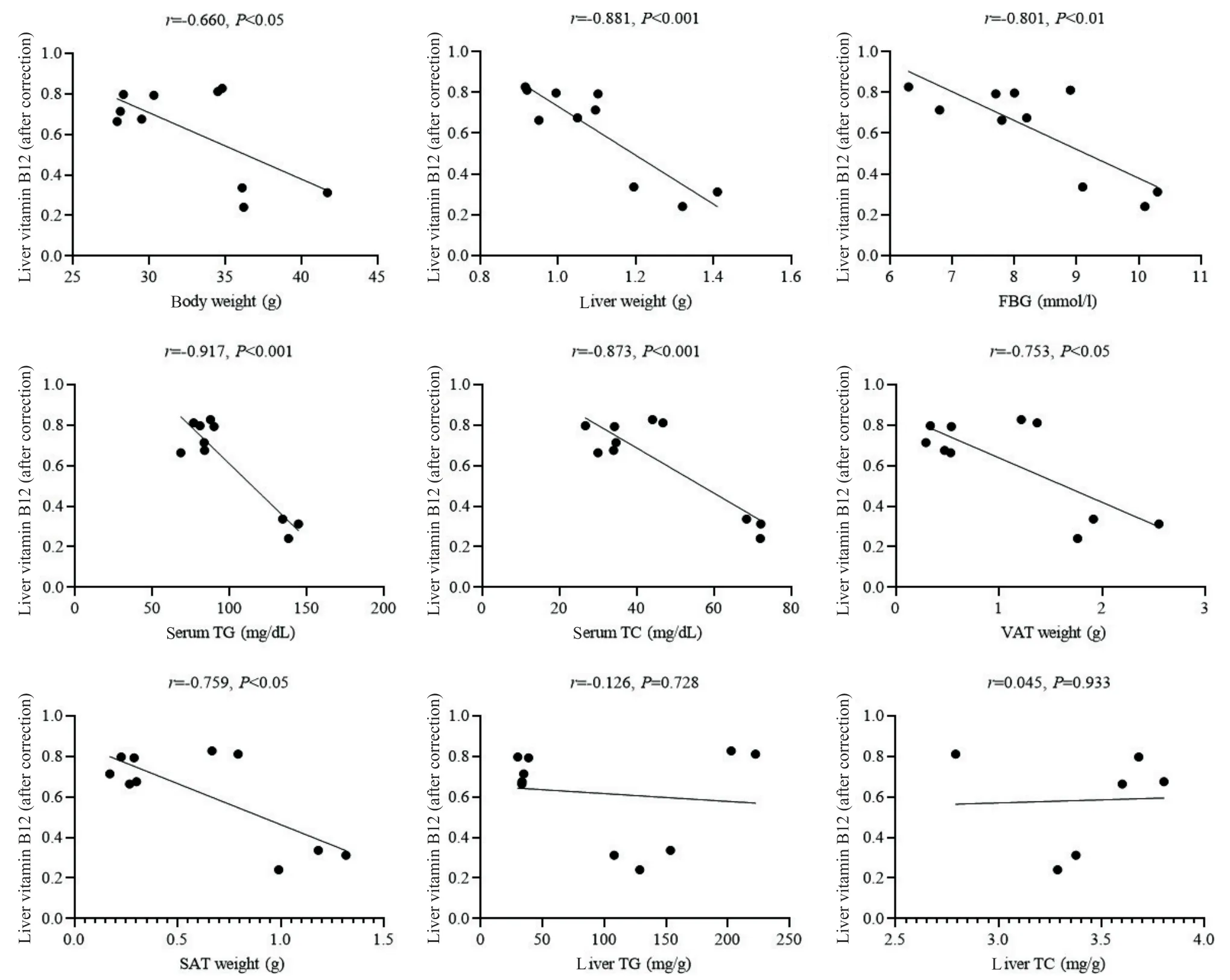
Figure 4. Correlation analysis between liver vitamin B12 level and glucose and lipid metabolic phenotypes in CD Met group and HFD Met group. VAT:visceral adipose tissue;SAT:subcutaneous adipose tissue. r was Pearson correlation coefficient;P<0.05 was considered statistically significant.图4 肝脏维生素B12与糖脂代谢各指标间的相关性分析

Figure 5. Correlation analysis between serum vitamin B12 level and glucose and lipid metabolic phenotypes in CD Met group and HFD Met group. No correlation was showed between serum vitamin B12 level and the glucolipid metabolic phenotypes.VAT:visceral adipose tissue;SAT:subcutaneous adipose tissue. r was Pearson correlation coefficient;P<0.05 was considered statistically significant.图5 血清维生素B12与糖脂代谢各指标间的相关性分析
本研究旨在探讨HFD 喂养的肥胖2 型糖尿病小鼠模型中,Met的干预是否影响维生素B12 在血清和肝脏中的水平。我们观察到C57BL/6J肥胖小鼠的禁食血糖出现升高[(11.58±0.55)mmol/L],因此我们把C57BL/6J 肥胖小鼠模型归为2 型糖尿病模型。从糖脂代谢表型及肝脏病理学结果方面分析,HFD 喂养的小鼠发生了糖脂代谢紊乱和肝脏脂肪变性,且Met能缓解上述病变,这提示我们的造模是成功的。
与既往研究相比,我们观察到在食物中维生素B12 供应正常的情况下,单用Met 对不同饮食(HFD和CD)的小鼠血清总维生素B12 影响较小;并且我们率先观察到Met 可导致HFD 喂养小鼠的肝脏维生素B12 水平的下降。肝脏作为维生素B12 主要的储存器官,其维生素B12含量下降应是机体维生素B12缺乏最初的表现,这与我们最初假设Met 能导致肝脏维生素B12的缺乏相一致。目前,关于2型糖尿病患者在服用Met 后是否引起肝脏维生素B12 变化的研究较少,需在临床Met 治疗前后的肝脏穿刺标本中行进一步的验证,在实际操作中存在较大的困难。而Met 所致维生素B12 降低的病理生理机制目前仍未完全阐明,较为一致的观点是与Met 干扰维生素B12 的吸收[24-33]以及 Met 使维生素 B12 的组织重分布[34]有关。其中,有研究[24-25]认为Met 可导致肠道菌群过度增生,使内因子-维生素B12 复合体更多与细菌结合,同时肠道菌群改变也可导致胃肠道蠕动及回肠形态的改变,进一步减少机体对它的吸收。但遗憾的是本研究未进行小鼠肠道菌群的检测以及肠道标本的收集,后续研究可对此进行完善。此外,文献提示肝组织中维生素B12 水平受到肝细胞膜上CD320受体和TCN-II的调节[35],Met是否通过影响肝脏CD320受体和TCN-II的表达从而导致肝内维生素B12 的缺乏还需更深入地研究;另一方面,本研究观察到小鼠肝脏维生素B12 水平与体重、肝重、血脂水平、空腹血糖呈中-高度负相关,这提示在Met干预下HFD 喂养的肥胖合并2 型糖尿病小鼠肝脏维生素B12 的降低与恶化的糖脂代谢表型相关。这与既往采用血清维生素B12 作为评价机体维生素B12 状态的临床研究相比[11-16],其一致性为机体维生素B12水平越低糖脂代谢相关的指标越差;但差异在于肝脏中而非血清中的维生素B12 水平可能才是反应Met所致维生素B12 缺乏的主要指标。鉴于本研究只在C57BL/6J 小鼠模型中进行,该结论还需在更多糖脂代谢紊乱的模型小鼠甚至人群中进行验证。
本研究具有一定的局限性和片面性,在评价血清维生素B12状态时只测定了总的维生素B12水平,未测定能够反应维生素B12 功能和活性的其他指标,如血清全反钴胺素(holotranscobalamin,HoloTC)、甲基丙二酸(methylmalonic acid,MMA)和同型半胱氨酸(homocysteine,Hcy)。维生素B12 作为甲基丙二酰辅酶A 转变为琥珀酰辅酶A 以及同型半胱氨酸转化为甲硫氨酸所必需的辅酶,若出现缺乏或功能障碍,血清 MMA 和 Hcy 水平会升高[36]。此外,本研究虽保证了不同饮食中维生素B12 的补充量可以满足小鼠正常的生理需求,但在HFD 的条件下,Met 干预后肝脏维生素B12 水平发生下调的具体机制尚未展开深入研究。
综上所述,短期Met干预HFD 诱导的肥胖合并2型糖尿病小鼠,可引起肝脏维生素B12 而非血清维生素B12 水平的下调,且肝脏而非血清中的维生素B12 水平与体重、肝重、血脂水平、空腹血糖、内脏脂肪组织重量和皮下脂肪组织重量等糖脂代谢指标呈负相关。这提示口服Met 治疗2 型糖尿病的过程中可能导致机体肝脏维生素B12 的水平下降,而适当补充维生素B12对改善糖脂代谢紊乱可能获益。

