纳米材料在肿瘤光热治疗中存在的问题及解决策略
常梦宇,王 曼,侯智尧,林 君*
(1.中国科学院长春应用化学研究所稀土资源利用国家重点实验室,吉林长春 130022;2.南洋理工大学 物理与数学科学学院,新加坡 637371;3.广州医科大学 基础医学院,广东 广州 511436)
1 引 言
癌症严重威胁人类健康,是人类死亡的主要原因之一。据世界卫生组织国际癌症研究机构(IARC)发布的数据显示,2020 年全球新发癌症病例1 929 万例,全球癌症死亡病例996 万例[1]。传统的癌症治疗手段,主要包括手术、化疗、放疗等,均难以治愈癌症[2]。因此,研发新颖的疗效显著且毒副作用低的抗癌治疗药物和技术是极其必要的。随着纳米技术的发展,具有优异理化性能的纳米材料(尺寸小,比表面积大,独特的声、光、电、磁、热性能等)为癌症治疗提供了广阔的创造空间[3-5]。纳米药物可通过高渗透性和滞留(EPR)效应或主动靶向作用富集在肿瘤部位,从而提高抗肿瘤疗效[6-7]。此外,针对肿瘤微环境(弱酸性,大量葡萄糖、过氧化氢和谷胱甘肽过表达)或特定的外部刺激(激光、超声、磁力、X 射线),可设计“刺激响应”性肿瘤靶点激活的纳米药物[8-10]。因此,具有强疗效以及低毒副作用的纳米药物已成为生物医学高速发展的推进器。
热疗是指将靶向肿瘤部位暴露于41~48 ℃温度范围内的一种疗法[11]。由于热疗可增加血管通透性、提高血液流动速度并改善肿瘤氧合状态,临床上其已被用为传统放化疗疗法的辅助治疗[12]。更重要的是,热疗具有直接杀死癌细胞的效果[13]。当肿瘤受到热疗时,部分不耐热的细胞内蛋白质发生变性,随后与癌细胞中的其他蛋白质形成共聚物[14-15]。过热诱导的蛋白质变性和聚集可以严重损害生物体内的一些生理活动,如蛋白(酶)失活、染色质改变、DNA 合成和修复抑制等,最终导致癌细胞死亡[16-17]。基于纳米材料的光热疗法(PTT)已广泛应用于临床治疗和实验室科学研究。在PTT 过程中,利用激光照射富集有光热转换试剂(PTAs)的肿瘤部位,可将光能转换为热能[18-19]。特别是在近红外(NIR)生物窗口(700~1 400 nm)内,PTT 可实现组织的深度穿透,降低组织的热效应,从而减少对邻近健康器官和组织的光损伤[20-23]。总体而言,与传统治疗方法相比,外部激光刺激介导的基于纳米材料的PTT 具有非侵入性、时空可控性、良好的靶向性以及对正常组织毒副作用小等优势[24-27]。
因此,研发高效且安全的纳米PTAs 对抗肿瘤治疗具有重要意义。目前,贵金属材料、金属硫族化合物、二维材料、有机小分子和半导体聚合物等作为纳米PTAs 已被应用于抗肿瘤PTT 领域[28-34]。然而,由于PTAs 光热转换效率不足、肿瘤富集量不足、在体内长期滞留、治疗过程中肿瘤复发和转移、对肿瘤周围正常组织的热损伤、肿瘤耐热性以及单一疗法的局限性等问题的存在,使PTT 在未来的临床转化过程中面临巨大的挑战。鉴于此,本综述针对PTT 在发展过程中遇到的实际问题和不足,总结了相应的解决策略,以使PTT 在临床实践中成为一种高效安全的癌症治疗手段。
2 光热转换原理
在PTT 过程中,PTAs 可将吸收的光子能量转化为热能,以消融肿瘤[35]。目前,许多无机和有机纳米材料,包括贵金属PTAs、半导体PTAs、碳材料PTAs、以及基于有机分子的PTAs 已被广泛应用于PTT。在这部分,我们将分别介绍这四种经典的PTAs 的光热转换原理。
2.1 贵金属PTAs
当光子的入射频率与金属表面电子的振荡频率相同时,贵金属材料可以表现出独特的局域表面等离子体共振效应(LSPR)[36]。这一现象使贵金属具有较强的光学吸收能力和较高的光热转换效率。贵金属PTAs,例如金、银、铂等,可从NIR 光吸收能量,将它们的电子从基态激发到激发态,随后通过非辐射衰减以热的形式将能量释放出来[37]。如图1(a)所示,当光照射到等离子金属表面时,一部分光被吸收,另一部分光被散射。其中,只有被吸收的能量才能部分转化为热能。处于激发态的PTAs可以通过辐射衰减和非辐射衰减两种途径释放能量回到基态,前者发射光子并产生荧光,后者可产生热量。由此可见,可通过增加贵金属PTAs 的光学吸收、减少光学散射、以及促进非辐射衰减的能量转换过程来提高其光热转换效率。
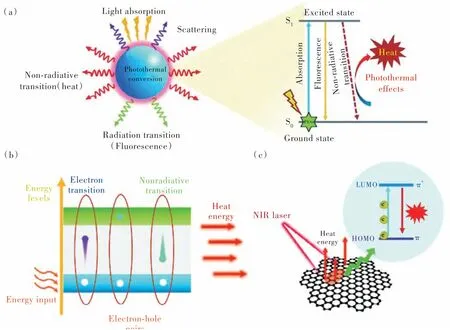
图1 (a)光触发的等离子体金属不同过程示意图[37];(b)半导体材料光热转换机理图[37];(c)碳基纳米材料光热转换机理图[37]。Fig.1 (a)Schematic representation of the activated different processes when a light beam interacts with a plasmonic metal[37].(b)Schematic representation of the photothermal conversion principle of semiconductor materials[37].(c)Schematic diagram of the photothermal conversion principle of carbon-based nanomaterials[37].
2.2 半导体PTAs
具有固有吸收带隙的半导体,例如CuS、MoS2等在近红外区具有优异的光学吸收[38-41]。其光热转换过程主要依赖于光子与电子相互作用过程中的能量跃迁和非辐射弛豫(图1(b))。这种半导体纳米材料的近红外光吸收是由于具有未占据d轨道的过渡金属元素发生d-d 跃迁所致。当入射光子的能量大于半导体的带隙能量时,位于价带的电子会被激发并转移到导带,形成电子-空穴对。处于激发态的电子是不稳定的,它们最终会弛豫回到低能级释放能量。当能量以声子的形式释放时,会引起晶格局部加热,从而产生光热效应[42]。
2.3 碳材料PTAs
碳基纳米材料(碳纳米管、石墨烯、石墨烯氧化物、碳点)的光热转换性能是由它们的共轭结构所致[43]。由于碳材料电子之间的键合强度较弱,π键的能量相对较低,因此电子从π 轨道跃迁到π*轨道只需要较低的激发能量。通过提高共轭π 键的比例,不仅可以减小最高占据分子轨道(HOMO)和最低未占据分子轨道(LUMO)之间的能隙,还可以将最大吸收波长从可见光区调整到近红外区。如图1(c)所示,当NIR 光辐照材料时,吸收光子的电子从LUMO 被激发到HOMO,然后通过电子-声子耦合回到基态,释放热量。因此,基于共轭结构和较小的轨道能隙,碳基PTAs 具有出色的近红外吸收和优异的光热性能。
2.4 超分子PTAs
超分子组装起源于生物系统,广泛应用于生物学和医学领域。通过超分子组装,将药物、光敏剂等功能性试剂聚集在一起,构成一个完整的纳米平台[44]。该组装基于非共价分子间相互作用,主要包括静电相互作用、氢键作用、疏水相互作用和范德华相互作用[45]。一般来讲,在光激发后,有机敏化剂分子被激活到激发态(S1)。激发态衰减回到基态主要通过三个过程(图2(a)):发射光子(荧光)、系间窜越(磷光)和非辐射弛豫(热量)。对于分子敏化剂来说,这三种途径通常是相互竞争的,导致产生的热量有限。因此,为了提高光热转换效率,发光和系间窜越必须得到抑制。超分子组装导致分子敏化剂之间相互堆积、分子间碰撞频繁,这种碰撞会猝灭荧光发射和系间窜越,从而增强超分子产热效率(图2(b))。
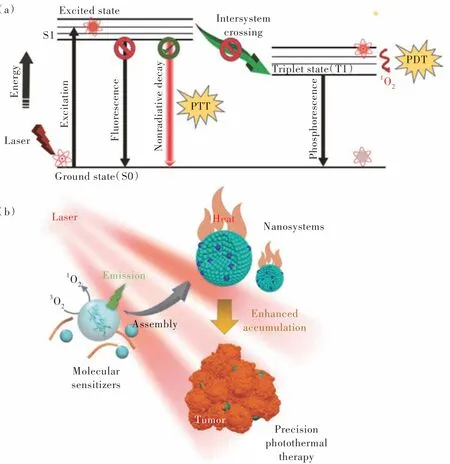
图2 (a)各种能量转移机制的雅布伦斯基示意图[18];(b)超分子光热效果示意图。自组装的光敏剂可提高光热转换效率,并增加其在肿瘤部位的蓄积,从而提高肿瘤治疗效果[45]。Fig.2 (a)Schematic Jablonski diagram representing different energy transfer mechanisms[18].(b)Schematic illustration of supramolecular photothermal effects. Self-assembly of photosensitizers gives rise to enhanced photothermal conversion efficiency and accumulation at tumor site,thereby improving the cancer therapeutic efficacy[45].
3 光热治疗抗肿瘤机制
热疗已被应用于癌症的诊断和治疗,它通常作为一种辅助疗法,与手术、化疗和放疗相结合来治疗癌症[46]。由于肿瘤中的血管与正常组织中的脉管系统不同,肿瘤组织较比正常组织更易受到热损伤[47]。热疗后肿瘤细胞活力降低的重要机制是蛋白质变性,及其下游途径的激活和失活[12]。治疗窗口在41~47 ℃范围内,组织细胞即可发生凋亡[48]。如图3 所示,在光热治疗的刺激下,特定半胱氨酸蛋白酶(Caspases)的信号级联被激活,随后Caspase-8 和-9 激活下游负责蛋白质水解分解细胞的“效应因子”Caspase-3、-6 和-7[49]。并且,这些信号通路在线粒体中得到增强[50]。当温度超过50 ℃时,细胞死亡途径是坏死过程[51]。坏死是一种更迅速和无组织的细胞死亡形式,不需要连续的蛋白激活[52]。细胞内蛋白质结构的改变可以破坏肿瘤细胞的运动、细胞内信号转导,进而抑制肿瘤的生长和转移[53]。
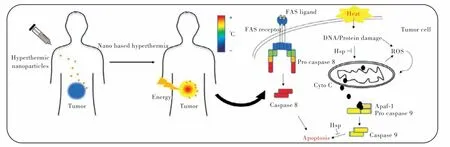
图3 光热治疗恶性肿瘤机制图[54]Fig.3 The proposed mechanism of PTT against malignant tumors[54]
4 PTT 面临的问题及解决策略
4.1 解决PTAs 光热转换效率不足
如前所述,PTT 主要依赖于PTAs 将光能转化为热能以达到肿瘤消融的目的。为了实现安全高效的PTT,PTAs 须在生物窗口具备良好的光热性能,包括大的吸收截面、优异的光热转换效率和光热稳定性。该部分,我们从PTAs 固有光热性能的改善以及近红外生物窗口的选择两个角度出发,来总结提高PTAs 光热转换效率的策略。
4.1.1 Au 纳米材料形貌调控
在过去的几十年里,科研工作者已经研发出了多种具有前景的PTAs,包括基于金属的纳米材料、碳纳米材料、二维材料、有机小分子、半导体聚合物等[55-56]。在众多的PTAs 中,Au 纳米材料的局域表面等离子共振(LSPR)峰可通过改变其大小、形状、结构等参数而被调节到近红外生物窗口[57]。因此,近些年,Au 纳米材料受到了极大的关注。多种Au 纳米结构,包括聚集的胶体粒子、纳米壳、纳米笼、纳米棒等已应用于近红外光响应的PTT[58]。令人备受鼓舞的是Au 纳米颗粒已在临床前列腺癌的PTT 中取得了突破性的成功[59]。因此,探索合适的Au 纳米材料形貌对进一步实现PTT 疗效的最大化是很有必要的。基于此,夏幼南课题组制备了Au 纳米六足、纳米棒、纳米笼结构(图4(a)~(c))[60]。并在相同的实验条件下,给小鼠尾静脉注射相同体积和浓度的生理盐水、PEG 修饰的Au 纳米六足、纳米棒和纳米笼。3 天后,将肿瘤区域暴露于1.2 W·cm-2的808 nm 激光。从图4(d)可见,Au 纳米六足实现了最佳的光热转换效果。因此,优化实验参数以合成特定形貌的纳米材料,可有效提高纳米材料的光热转换效率。

图4 (a)~(c)Au 纳米六足、纳米棒和纳米笼透射图[60];(d)不同Au 纳米结构注射后,808 nm 激光激发下,小鼠肿瘤部位的热成像图[60]。Fig.4 (a)-(c)The TEM images of Au nanohexapods,nanorods,and nanocages[60].(d)Thermal imaging of tumor sites in mice stimulated by 808 nm laser after injection of different Au nanostructures[60].
4.1.2 金属/半导体异质结结构构建
贵金属和半导体的紧密接触可以提高贵金属的局域表面等离子共振(LSPR)效应,改变半导体的电子跃迁途径,从而提高光热转换效率[61-62]。因此,含有等离子体金属和半导体的杂化异质结结构可以协同增强PTT。例如,张海元课题组制备了Bi2S3-Au 异质结纳米棒(图5(a))[63]。和单独的Bi2S3相比,Bi2S3-Au 具有更多的深层缺陷。因此,在808 nm 激 光 照 射 下,Bi2S3-Au 结 构 更 有利于激发电子和空穴的非辐射衰减以产生更多的声子,从而通过强烈的晶格振动向周围介质释放热量。因此,与Bi2S3(33.58%)相比较,Bi2S3-Au(51.06%)的光热转换效率有显著的提高。在此基础上,我们课题组针对稀土钒酸盐半导体在近红外波段光学吸收不足的问题,设计了稀土钒酸盐半导体/贵金属(Ce-VO4/Ag, NdVO4/Au)异质结纳米结构,有效增强了稀土钒酸盐半导体的光热转换能力,并提高了抗肿瘤疗效(图5(b)、(c))[64-65]。此外,一些其他的异质结结构耦合体,例如Cu2MoS4/Au、Au-Cu9S5、AuNR@Cu2-xSe、Au/Fe3O4等,在光热转换效率性能上面均有显著的提升[66-69]。

图5 (a)808 nm 激光照射下Bi2S3和Bi2S3-Au 的光热机理图[63];(b)CeVO4/Ag 的合成机理图[64];(c)NdVO4/Au 的LSPR 机理图[65]。Fig.5 (a)Schematic illustration of photothermal mechanism of Bi2S3 and Bi2S3-Au under 808 nm irradiation[63].(b)Schematic illustration of the synthesis process of CeVO4/Ag[64].(c)The proposed mechanism for LSPR effect of NdVO4/Au[65].
4.1.3 近红外生物窗口选择
光作为PTT 的一个重要参数,已受到科研工作者的广泛关注。与第一近红外生物窗口(NIR-Ⅰ,700~980 nm)相比,第二近红外生物窗口(NIR-Ⅱ,1 000~1 400 nm)可显著降低组织自热,提高组织穿透深度[70]。更重要的是,在NIR-Ⅱ生物窗口,安全的最大允许暴露(MPE)激光功率密度为1 W·cm-2,而在NIR-Ⅰ窗口仅为0.33 W·cm-2[71]。因此,在NIR-Ⅱ生物窗口内探寻具有高光热转换效率的PTAs,对于提高组织深部肿瘤的治疗效果是极其重要的。例如,施剑林课题组通过两步液相剥离法设计了二维可生物降解的碳化铌[72],其具有高光热转换效率(808 nm 激发:36.5%,1 064 nm 激发:46.65%),在NIR-Ⅰ和NIR-Ⅱ生物窗口内均实现了有效的PTT(图6(a))。张洪杰课题组设计了一维Fe2P(图6(b))[71],其在808 nm 处的光热转换效率为55%,在1 064 nm 处的光热转换效率为56.6%。在安全的MPE 范围内,和NIR-Ⅰ(808 nm,0.3 W·cm-2)相比,肿瘤在1 064 nm(0.5 W·cm-2)激光辐照下可完全消融(图6(c))。此外,Fe3O4@CuS、Au@Cu2-xS、Bi、Cu3BiS3等纳米材料在NIR-Ⅱ窗口内也具有优异的光热转换性能[73-75]。

图6 (a)碳化铌在NIR-Ⅰ和NIR-Ⅱ生物窗口内体内光热肿瘤消融示意图[72];(b)Fe2P 的合成过程和体内治疗示意图[71];(c)不同治疗模式后小鼠照片、离体肿瘤照片以及肿瘤切片[71]。Fig.6 (a)Schematic illustration of Nb2C for in vivo photothermal tumor ablation in NIR-Ⅰand NIR-Ⅱbio-windows[72].(b)Diagram of Fe2P synthesis and treatment mechanism[71].(c)Photos of mice,excised tumors,and tumor sections after different treatment models[71].
在PTT 中,选择合适的激光辐照强度一直是困扰人们的一个难题。一方面,高功率激光会对肿瘤附近的正常组织造成不可避免的热损伤;另一方面,低功率激光不能完全消灭残存的癌细胞,往往导致肿瘤复发。因此,提高纳米材料的光热转换效率,使辐照近红外激光的功率密度在人体可耐受的MPE 范围内发挥显著疗效,对于PTT 未来的发展是至关重要的。
4.2 联合治疗解决单一PTT 疗效欠佳
虽然PTT 具有较高的特异性和可忽略的侵袭性,但NIR 光在肿瘤组织中穿透深度有限,在激光辐射范围之外的肿瘤无法被完全消融,导致肿瘤复发和转移。因此,单一的PTT 往往不能彻底治愈肿瘤,特别是对于较大的肿瘤,以及伴有远端转移性和扩散性的病灶。令人感到鼓舞的是PTT 介导的热效应具有一些功能性效用,如控制药物释放、调节细胞内基因表达和酶活性、触发抗肿瘤免疫响应、增加靶向组织的化学反应等[76]。因此,将PTT 与其他治疗方法联合使用,为协同增强抗肿瘤疗效提供了一种有效的策略。
目前,PTT 联合化疗、放疗、基因治疗、化学动力学治疗(CDT)、光动力治疗(PDT)、声动力治疗(SDT)、饥饿治疗、气体治疗(GT)、热动力治疗、酶动力治疗、免疫治疗、以及基于PTT 的多模态治疗模式已被大量报道(图7)[77-78]。例如,张先正课题组制备了PEG-cRGD 修饰的MoTe2纳米片,并高效负载抗癌药物DOX,实现了协同增强的化疗/PTT(图8(a))[79];Younis 等将NIR 激发的光动力试剂吲哚菁绿(ICG)锚定在了双等离子光热试剂(Au 纳米棒/MoS2异质结)上,实现了联合的PTT/PDT(图8(b))[80];刘扬中课题组制备了单原子锰,实现了联合的酶动力和光热抗肿瘤治疗(图8(c))[81];蔡称心课题组制备了MCF-7 细胞膜包裹的空心多孔Cu7S4纳米球(HPCu7S4@MCF-7),其不仅可以实现有效的PTT,还可以在肿瘤微环境的触发下催化羟基自由基(·OH)和硫化氢(H2S)气体的产生,从而促进CDT 和GT(图8(d))[82];在最近的一项工作中,陈填烽课题组通过将Au 装载入Te 纳米棒的中心,并在Te 纳米棒表面包裹一层Pd,制备了BTe-Pd-Au 三元异质结结构,获得了协同的放疗/PTT,并触发了一系列抗肿瘤免疫响应(图8(e))[83];此外,我们课题组制备了多功能的空心Cu2MoS4(CMS)担载葡萄糖氧化酶(GOx)的纳米体系(CMS@GOx),其作为一种具有酶活性的疫苗类纳米治疗剂实现了级联的CDT/PDT/PTT/饥饿治疗/免疫治疗的高效联合治疗(图8(f))[84]。

图7 近红外光激活纳米药物PTT 协同抗肿瘤治疗模式[77]Fig.7 The scheme of near-infrared light activated nanomedicines for PTT-synergistic cancer treatment[77]
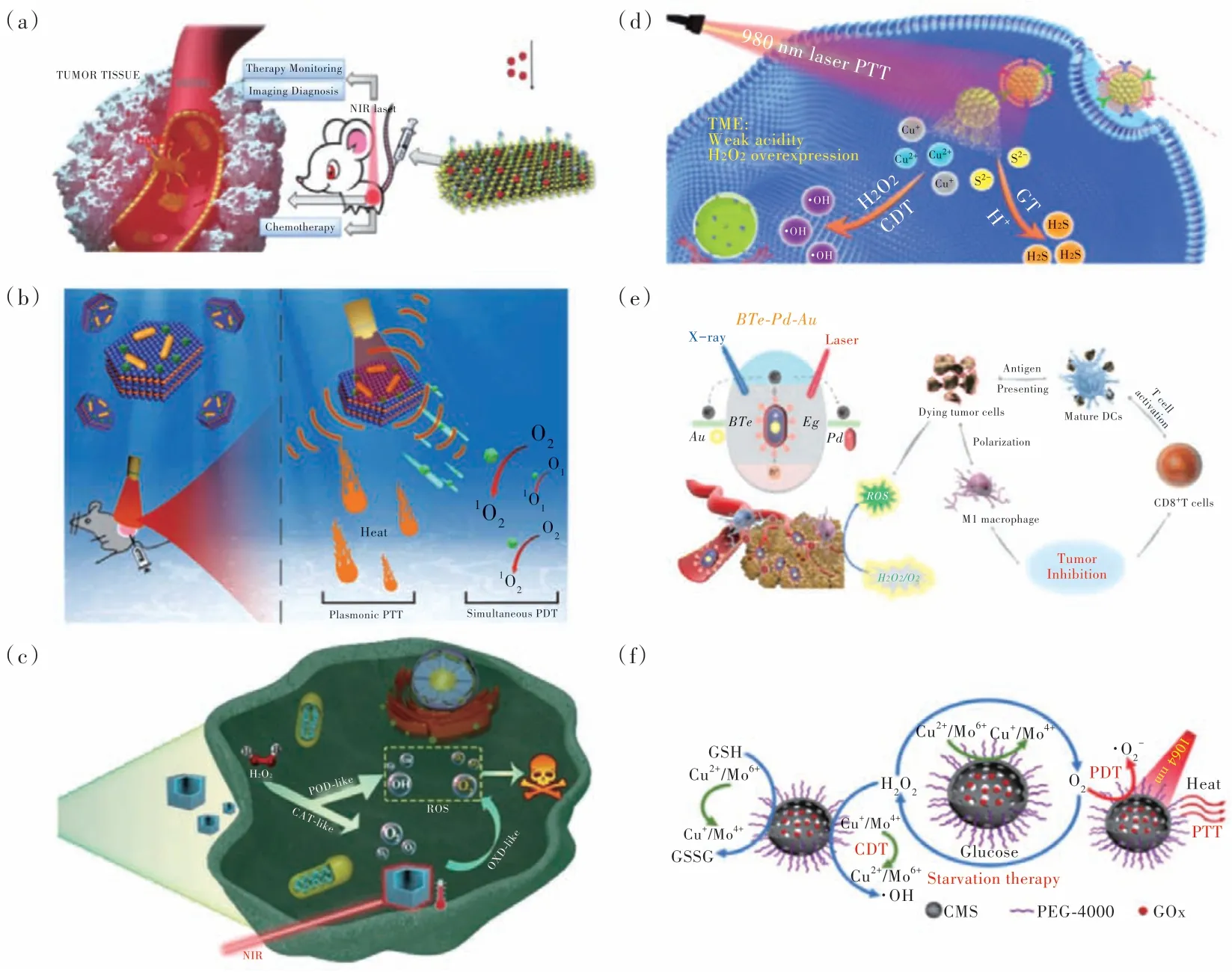
图8 (a)MoTe2-PEG-cRGD/DOX 用于热成像指导的协同PTT 和化疗[79];(b)Au/MoS2-ICG 纳米平台诱导PDT/协同等离子体PTT 工作机制示意图[80];(c)Mn 单原子纳米酶用于协同酶催化和光热疗法的抗肿瘤治疗示意图[81];(d)基于Cu7S4@MCF-7 纳米平台的协同PTT/CDT/GT 癌症治疗策略[82];(e)BTe-Pd-Au 异质结构增强放疗、PTT 和激活免疫响应机制示意图[83];(f)CMS@GOx 的协同PTT/PDT/CDT/饥饿治疗机理图[84]。Fig.8 (a)MoTe2-PEG-cRGD/DOX for thermal imaging-guided PTT and chemotherapy[79].(b)Schematic illustration of the working mechanism of the Au/MoS2-ICG nanoplatform to induce simultaneous PDT/synergistic plasmonic PTT[80]. (c)Schematic illustration of Mn-based single-atom enzyme for tumor therapy utilizing the synergetic enzyme catalysis and PTT[81].(d)Illustration of the PTT/CDT/GT synergetic strategy for cancer treatment based on the Cu7S4@MCF-7 nanoplatform[82].(e)Schematic illustration of the mechanism for enhancing radiotherapy,photothermal therapy and activating immunomodulatory potential by BTe-Pd-Au heterostructure[83].(f)Mechanism illustration of CMS@GOx-based synergistic PTT/PDT/CDT/starvation therapy[84].
受益于先进的纳米技术,多功能纳米材料的智能设计使得在单一体系中集成多种治疗方式的联合治疗展现出巨大的优势。基于PTT的联合治疗是一种有效的癌症治疗方法,其可通过将每种治疗方法的优势结合起来,并弥补不同疗法的缺陷,从而实现“1+1>2”的治疗效果。因此,设计性能优异的纳米材料以用于多模式协同治疗,可大幅度提高治疗效果,有效治疗对单一疗法有耐药性的恶性肿瘤。
4.3 解决PTAs 肿瘤富集量不足
目前,基于纳米材料的光热治疗与临床肿瘤治疗仍存在一定的差距,这是由于纳米材料在尾静脉给药后需经历五步级联递送过程,即静脉注射进入血液循环、通过高渗透性和滞留(EPR)效应富集在肿瘤部位、渗透到肿瘤组织内部、肿瘤细胞内吞和细胞内药物释放。由此可见,光热纳米材料在肿瘤部位的富集是制约光热治疗最终消融效果的一个重要因素[85]。基于此,科研工作者已开发出多种靶向PTT 模式。根据识别位点的位置,可将其分为下述三种类型。
4.3.1 细胞外靶点
细胞外靶点是指存在于肿瘤微环境(TME)中的识别位点。由于实体肿瘤代谢旺盛、生长迅速,肿瘤周围组织产生缺氧、酸性、血管增生、酶过表达等极端环境[86]。通过利用癌变组织和正常组织的不同,可实现肿瘤的特异性治疗。例如,Song等在对患者肿瘤样品进行分析时,发现低密度脂蛋白受体(LDLR)是在肿瘤细胞中过表达的有效的乏氧标志物(图9(a))[87]。因此,他们使用LDLR抗体作为乏氧靶向配体,并与光敏剂二氢卟吩Ce6、乏氧激活的抗癌药替拉扎明TPZ 和配体聚乙二醇PEG 自组装,形成了CPTA 复合物。该复合物可有效靶向乏氧癌细胞,并实现协同的PTT/PDT/化疗/放疗。
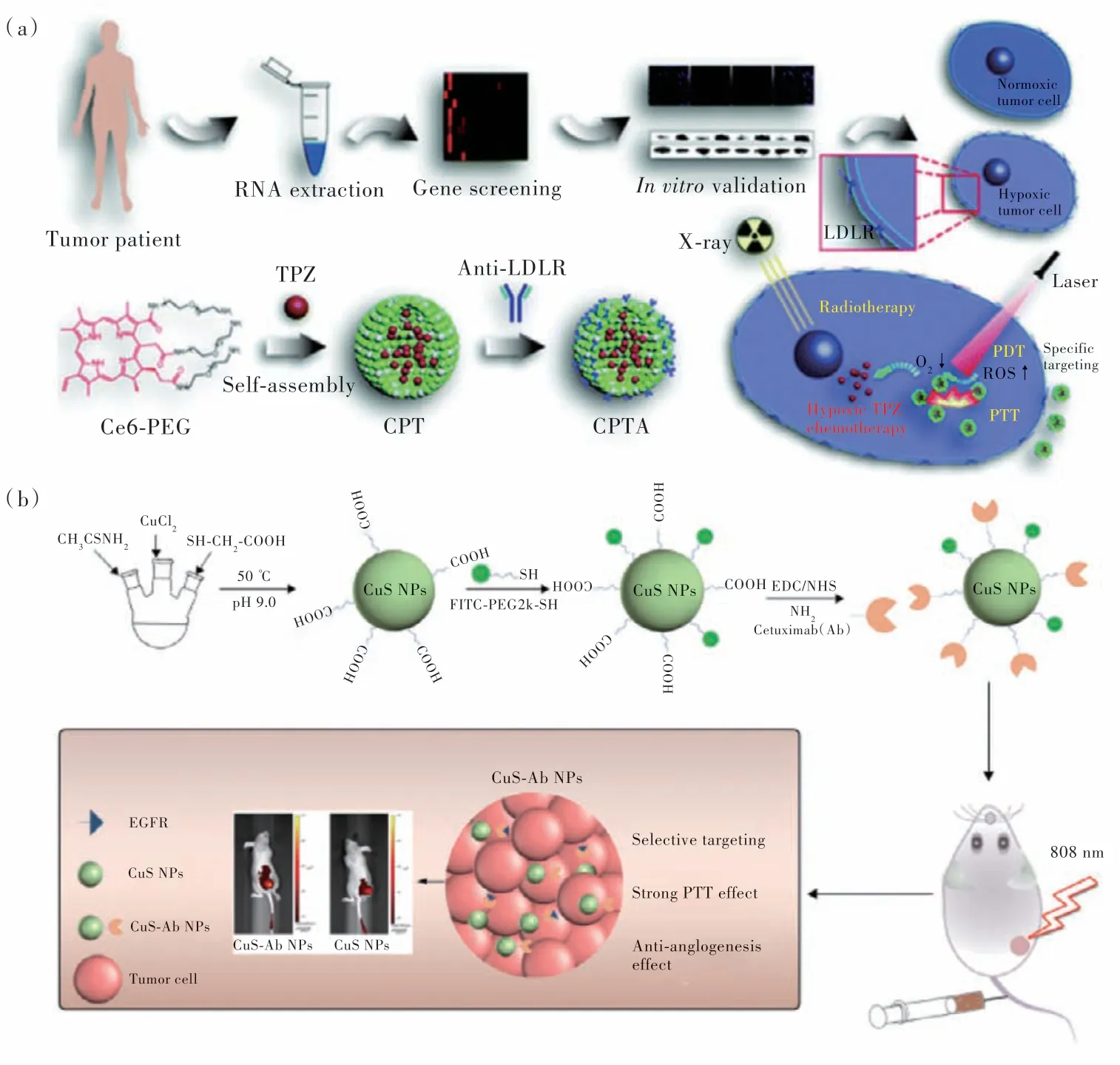
图9 (a)乏氧标志物LDLR 的基因筛选、CPTA 纳米颗粒的形成、以及肿瘤细胞乏氧靶向和协同多模态治疗示意图[87];(b)FITC-CuS-Ab NPs 的合成及靶向治疗示意图[89]。Fig.9 (a)Illustration of gene screening for hypoxia marker LDLR,the formation of CPTA nanoparticles,and hypoxic targeting and synergetic multimodal therapy in tumor cells[87].(b)Schematic diagram of synthesis and targeting therapy of FITCCuS-Ab NPs[89].
4.3.2 细胞内靶点
细胞外靶点是指受体存在于肿瘤细胞膜表面。由于细胞是相对独立的空间,物质的摄入需要嵌入细胞膜上的受体的协助。因此,细胞膜上会产生特定的受体来转移不同的物质,包括离子、小分子和生物大分子。由于肿瘤细胞代谢异常,许多受体过度表达,例如整合素αvβ3、表皮生长因子受体(EGFR)、叶酸受体(FR)、生物素受体(BR)、转铁蛋白受体(TfR)、CD44 受体等[88]。基于此,Li 等制备了西妥昔单抗(Ab)修饰的CuS 纳米颗粒(CuS-Ab)(图9(b))[89]。利用CuS-Ab 纳米平台,Ab 不仅可以定向靶向癌细胞膜上过表达的EGFR,还可以通过阻断EGFR 的磷酸化来阻止肿瘤的生长、转移和复发。该纳米体系的体外和体内实验结果表明,在Ab 的协助下,CuS 可以有效地富集在肿瘤部位,具有良好的光热肿瘤消融效果。
4.3.3 亚细胞器靶点
亚细胞器靶点是指将PTAs 与细胞器靶向配体相结合,因此PTAs 在内吞后能有效地诱导细胞器的凋亡。由于细胞器(细胞核、线粒体、溶酶体、内质网、高尔基体)中含有热敏蛋白和遗传物质,细胞器很容易被破坏,可在低剂量辐照强度下造成细胞死亡,从而减少对周围正常组织的损伤[90]。因此,细胞器靶向成像和治疗受到了广泛关注。Pan 等设计了细胞核靶向的TAT 肽功能化的Au纳米棒(GNRs-NLS)(图10(a)),其可有效增加Au 纳米棒的细胞内吞以及细胞核的药物递送,从而在较低的功率密度下实现了选择性的PTT[91]。Li 等(图10(b))设计了内质网靶向FAL 多肽修饰的吲哚菁绿(ICG)偶联的空心金纳米球(FAL-ICGHAuNS),并将其与可逆转乏氧TME 的供氧血红蛋白(Hb)脂质体(FAL-Hb lipo)一起注射入小鼠体内[92]。在近红外光辐照下,该纳米体系可有效地诱导内质网压力以及细胞膜表面钙网蛋白的暴露,实现了内质网靶向的PTT/PDT促进的免疫治疗。
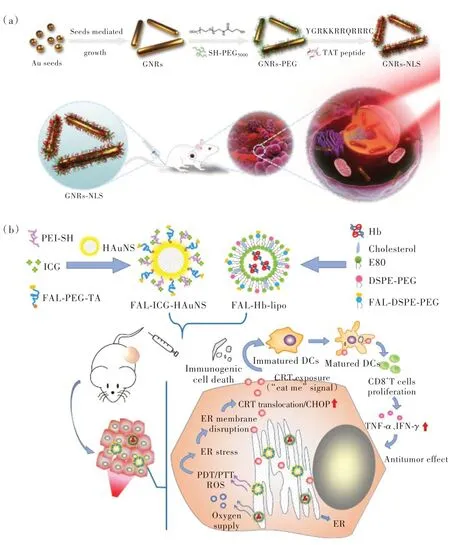
图10 (a)GNRs-NLS 合成过程及核靶向光热治疗示意图[91];(b)FAL-ICG-HAuNS 和FAL-Hb-lipo 抗肿瘤机理,内质网靶向光热/光动力疗法增强免疫原性癌细胞死亡和抗癌效果示意图[92]。Fig.10 (a)Schematic illustration of the synthetic procedure and nuclear targeted photothermal therapy of GNRs-NLS[91].(b)The antitumor mechanism of FAL-ICG-HAuNS plus FAL-Hb-lipo. Schematic illustration of enhanced immunogenic cancer cell death and anticancer effect induced by endoplasmic reticulum-targeting photothermal/photodynamic therapy[92].
总而言之,近年来,具有靶向功能的PTAs在精准癌症治疗领域展现了巨大的优势。这些智能PTAs可利用EPR 效应、受体介导的细胞内吞作用、或细胞膜包覆的同源靶向策略,促进选择性的癌细胞摄取,提高治疗效果,并最小化全身副作用。
4.4 解决PTT 对正常组织的热损伤
尽管将PTT 与其他治疗模式整合到一个纳米体系中进行协同治疗具有显著的抗肿瘤效果,但由于这种联合治疗模式缺乏对肿瘤部位的特异性,往往会对肿瘤周围的正常组织和器官造成不可避免的热损伤。因此,一方面,针对肿瘤微环境(TME)独特的特征(弱酸性、乏氧、过表达的过氧化氢和谷胱甘肽等),设计TME 激活的纳米复合材料实现“刺激-响应”性的精准靶向癌症治疗,将为PTT 的生物安全性提供有效的保障[93]。另一方面,使用正常组织可耐受的温度(38~43 ℃)实施低温PTT,避免对肿瘤周围健康组织和器官的损伤,对未来的临床转化是极其必要的[94]。
4.4.1 肿瘤微环境激活的PTAs
大量研究证据表明,半胱硫氨酸-β-合成酶的上调增加了结直肠癌微环境中内源性H2S 的产生[95]。因此,杨仕平课题组利用内源性H2S 和无光热性能的Cu2O 在结直肠肿瘤部位的原位反应,生成了具有光热性能的Cu9S8,实现了TME 激活的PTT(图11(a))[96]。在此基础上,该课题组进一步制备了Au@Cu2O 的金属半导体异质结结构(图11(b))[97]。当Au@Cu2O 通过高渗透长滞留(EPR)效应靶向到结直肠癌肿瘤部位时,肿瘤中内源性的H2S 与Au@Cu2O 在原位发生反应生成Au@Cu9S8。由于局域表面等离子共振(LSPR)耦合场的增强,Au@Cu9S8在近红外区展现出强吸收,实现了增强的PTT。此外,我们课题组制备了Cu2O@CaCO3复合体(图11(c))[98]。在弱酸性和结直肠癌肿瘤微环境触发下,CaCO3矿化层分解释放Ca2+离子,实现了钙超载治疗。随后,裸露的Cu2O 和内源性H2S 反应生成了在NIR Ⅱ区具有强吸收的可代谢的超小Cu31S16,实现了有效的PTT和PDT。该纳米体系可将促肿瘤生长的M2 型肿瘤相关巨噬细胞(TAMs)调控为可杀伤肿瘤的M1 型TAMs,逆转了免疫抑制的肿瘤微环境。进一步结合CD47 检查点封锁,可显著地激活免疫响应,有效治疗原发肿瘤,并抑制癌症的复发和转移。
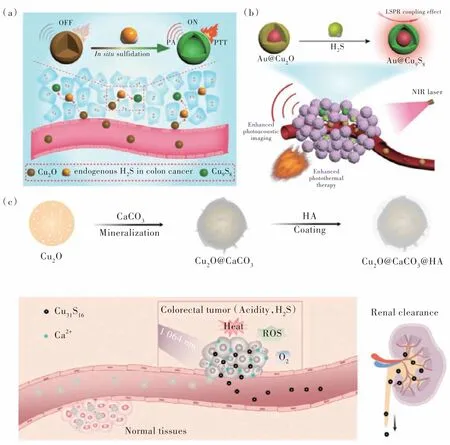
图11 (a)Cu2O 和内源性H2S 在结直肠癌处原位反应触发的PTT[96];(b)基于LSPR 效应,内源性H2S 触发的Au@Cu2O 增强的结直肠癌PTT[97];(c)Cu2O@CaCO3@HA 的合成路线和结直肠癌肿瘤微环境触发的Cu2O@CaCO3@HA 的生物分解、抗肿瘤响应和肾清除过程[98]。Fig.11 (a)The activated PTT by in situ reaction of Cu2O and endogenous H2S in colon cancer[96].(b)Based on the LSPR effect,the endogenous H2S-triggered Au@Cu2O with enhanced PTT for colon cancer[97].(c)The synthetic route of Cu2O@CaCO3@HA,and the colorectal cancer TME-triggered bio-decomposition,anti-tumor responses and renal clearance process[98].
尽管PTT 可以实现病灶的光定位,有效抑制肿瘤生长。但当光穿透过PTAs聚集的健康组织时,会对其造成不可避免的热损伤。因此,设计在体液循环过程中处于“休眠”状态的PTAs前体,并通过利用TME 异常的生化指标作为刺激因素,使其在肿瘤部位转化为具有优异的光热转换性能的PTAs,可实现肿瘤部位精准的PTT,有效避免毒副作用。
4.4.2 低温PTT
低温PTT 正在逐渐兴起,其克服了传统PTT 的耐热性和不良反应等缺点,在未来的临床应用中显现出巨大的潜力[99]。然而,由于癌细胞能激活其自我保护路径,如热休克蛋白(HSPs),以快速修复低热造成的细胞损害,低温PTT 的治疗效果往往不够理想[100]。因此,制备功能化纳米医药以提高低温PTT 的抗癌效果是极其重要的。目前,国内外学者已设计出了几种有效的低温PTT 策略。例如,(1)通过共价偶联或非共价包封将小分子HSPs抑制剂与光热剂共递送,可降低癌细胞的耐热性。苏州大学刘庄课题组将小分子HSP 抑制剂藤黄酸(GA)载入到由金属离子、吲哚菁绿和PEG 形成的一维纳米配位聚合物中,从而实现低温PTT(图12(a))[101]。相似的小分子抑制剂还有槲皮苷、17-AGG、BIIB021、
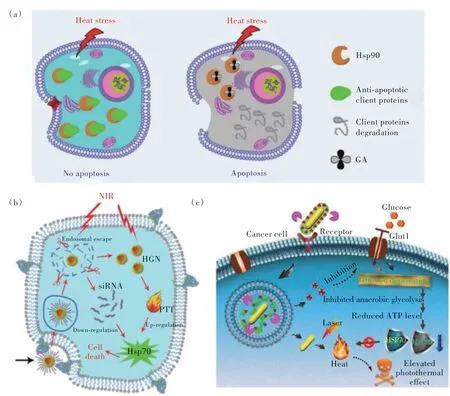
图12 (a)藤黄酸负载的配位聚合物的低温PTT[101];(b)siRNA 负载的空心金纳米壳敏化的低温PTT[102];(c)GNR/HA-DC通过干扰厌氧糖酵解代谢致敏肿瘤低温PTT 示意图[103]。Fig.12 (a)GA-loaded coordination polymers for mild PTT[101].(b)The low-temperature PTT sensitized by siRNA loaded hollow gold nanoshells[102].(c)Schematic illustration of GNR/HA-DC for sensitizing tumor to mild PTT by interfering with the anaerobic glycolysis metabolism[103].
SNX-2112、GM、VER-155008、2-PES、AHGDM、EGCG和LY2944002 等[94]。(2)siRNA 可以直接控制遗传信息流,在癌症治疗中具有巨大的潜力。它通过破坏相应信使RNA(mRNA)的翻译来抑制靶蛋白的表达。基于此,顾月清课题组设计了干扰RNA(siRNA)连接的空心Au纳米壳,通过siRNA 对肿瘤细胞中HSP70 表达的沉默,实现低温PTT 对肿瘤的消融(图12(b))[102]。(3)HSPs 的表达与三磷酸腺苷(ATP)的含量密切相关。因此,抑制肿瘤内ATP的产生被认为是抑制肿瘤耐热性的一种有效的方法。武汉大学张先正课题组通过将葡萄糖转运载体(Glut1)抑制剂双氯芬酸(DC)、光热试剂Au 纳米棒以及靶向剂透明质酸整合在一起,制备了GNR/HA-DC 纳米体系(图12(c))[103]。通过DC 诱导的Glut1 下调,有效地抑制了葡萄糖代谢和ATP 依赖的HSPs的合成。(4)在PTT 治疗过程中,自噬倾向于通过“修复”热诱导的细胞损伤来抑制治疗效果。因此,具有自噬抑制能力的功能化光热纳米剂可以协同增强低温PTT 的疗效。程义云课题组设计了自噬抑制剂氯喹(CQ)装载的聚多巴胺体系,并通过实验证明了抑制自噬能显著增强低温PTT 疗效(图13(a))[104]。(5)然而,在某些情况下,自噬可能对肿瘤抑制起积极作用。例如,自噬启动因子和肿瘤抑制因子beclin 1 诱导的自噬过程可破坏自噬的稳态功能,激活自噬性细胞死亡途径。因此,促进这一自噬途径有利于提高低温PTT 的治疗效果。程义云课题组也通过将聚多巴胺与beclin 1 衍生的多肽、PEG 和RGD 多肽结合得到了PPBR 纳米药物(图13(b))[105]。PPBR 可促进癌细胞的自噬活性,进一步显著提高低温光热杀伤细胞的效果。(6)一氧化氮(NO)作为一种气体分子,其在肿瘤组织部位具有很好的扩散能力。并且,NO也可以作为细胞内次级信使,参与并调节许多生理过程。例如,NO在浓度较高时可直接导致细胞死亡,也可通过信号通路调控增敏化疗或放疗。也有研究报道,NO可抑制自噬等亚细胞降解过程,加速细胞凋亡性死亡。其于此,赵宇亮课题组设计了Bi2S3担载NO供体BNN的纳米体系[106]。在该体系中,NO可抑制线粒体保护性自噬,使细胞色素c从线粒体中成功释放,诱导细胞凋亡,从而实现NO 敏化的低温PTT(图13(c))。(7)铁死亡发生的过程伴随着大量的脂质过氧化物(LPO)和活性氧物种(ROS)的产生[107]。LPO 能自发形成醛降解产物,使HSPs的伯胺交联,从而破坏HSPs的结构和功能[108]。此外,具有高度化学活性的LPO 能进一步自发产生大量的ROS,生成的ROS也可以与HSPs发生反应形成交联物[109]。基于这一HSPs清除途径,我们课题组制备了Pd SAzyme,其可以产生大量的羟基自由基((OH),并消耗谷胱甘肽(GSH),从而诱导铁死亡。铁死亡过程中产生的大量的LPO和ROS可有效消除癌细胞中的HSPs,从而实现了铁死亡促进的低温PTT(图13(d))[110]。

图13 (a)氯喹触发的自噬抑制敏化的低温PTT 示意图[104];(b)beclin 1 诱导的自噬增强敏化的温和PTT[105];(c)NO 气体与温和PTT 在肿瘤治疗中的协同作用机制[106];(d)铁死亡促进温和PTT 机理[110]。Fig.13 (a)Scheme of CQ-triggered autophagy inhibition sensitized mild PTT[104].(b)Illustration depicts beclin 1-induced autophagy sensitizing mild PTT[105].(c)Synergistic mechanism of NO gas and mild PTT in cancer therapy[106].(d)Schematic illustration of the mechanism of ferroptosis-boosted mild PTT[110].
与传统PTT 可能对病灶周围健康组织造成热损伤、引起炎症、产生免疫抑制细胞因子、导致肿瘤复发和转移相比,生物安全性能较高的低温PTT 正蓬勃发展,其在癌症治疗领域取得了令人鼓舞的进展,具有巨大的临床应用潜力。我们相信,随着医学研究的不断深入和纳米技术的持续发展,低温PTT将实现从实验到临床的转化,从而提高恶性肿瘤治疗效果,减少相关不良反应,改善患者的愈后生活。
5 总结及展望
本文针对PTT 目前存在的一些问题,总结了相应的突破性的解决策略。主要包括:调控纳米材料的形貌、构建异质结结构以及选择合适的光学窗口来提高纳米材料的光热转换效率;设计多模态协同治疗模式来克服单一PTT 的局限性;提高纳米材料的肿瘤富集量来增强抗癌治疗效果;以及构建肿瘤微环境激活的PTAs 和设计低温PTT 模式来提高药物的生物安全性。
尽管PTT 已经取得了许多鼓舞人心的进展,但在面向未来的临床转化中,PTT 仍然面临着许多挑战。(1)相较于紫外光/可见光,近红外光(NIR),特别是NIR-Ⅱ光,组织穿透深度大大增加,但NIR 仍难以穿透深层组织,因此NIR 激活的纳米药物更适合于浅表肿瘤,如黑色素瘤。因此,利用光学传输技术将近红外光源传输到深部组织,以实现PTT 介导的组织深处的肿瘤治疗将有效提高PTT 的应用范围。(2)相对于药物小分子,纳米颗粒(NPs)在体内滞留时间较长,因此NPs 在体内的潜在毒性是一个值得关注的问题。这种毒性不仅来自于NPs 本身,也来自于合成过程中涉及到的大多数溶剂和化学物质。尽管NPs可能在短时间内对细胞、器官或组织表现出较低的毒副作用,但其长期的细胞毒性和相关的免疫反应应该进一步地深入研究。减少安全隐患的一个可能的方向是设计可生物降解和可清除的NPs。例如,通过与可生物降解的有机二硫键结合或掺杂金属锰离子来实现二氧化硅的生物降解性;将乙烯基键、噻吩部分、亚胺键或咪唑单元整合到有机聚合物纳米颗粒中,也可以促进其在体内降解。然而,提高NPs的生物降解性和清除能力可能会牺牲其稳定性和血液滞留时间,导致肿瘤富集量较少。综合这些因素,设计同时兼备毒性小、可降解、肿瘤富集量高的PTAs是一项颇具挑战性的工作。(3)平衡纳米材料的光热效果和快速代谢是未来光热研究值得关注的问题。虽然设计尺寸小于肾脏过滤阈值的光热纳米材料(小于5 nm)可以避免纳米材料在体内长期滞留诱发的毒性,但由于肿瘤间质存在高压,小于5 nm的纳米材料到达肿瘤部位后也会更容易从肿瘤组织返回到血管中,从而降低纳米材料在肿瘤部位的富集,降低光热治疗效果。而已有文献报道5~100 nm之间的纳米材料在肿瘤组织中滞留时间更长,获得的光热治疗效果更好。因此,设计能够“按需调整尺寸”的纳米PTAs将是未来的一个研究重点。(4)先确定纳米材料在肿瘤部位富集最大量的时间点,再采取PTT是实现高效治疗的前提。因此,将成像和治疗整合到单一的纳米平台上,从而实现成像引导的精准癌症治疗,对未来PTT的临床转化具有指导性意义。
此外,PTT 的进一步发展不仅需要合成安全高效且多功能的PTAs,还需要创造新的实验设备,同时实现纳米颗粒的体内示踪、肿瘤部位的热疗、热感检测和健康参数的记录。在解决了这些挑战之后,近红外光激活的纳米药物在未来的临床实践中将为癌症的治愈带来巨大的希望。
本文专家审稿意见及作者回复内容的下载地址:http://cjl. lightpublishing. cn/thesisDetails#10.37188/CJL.20220118.

