重组黧豆蛋白酶的制备及其活性研究
王真,吴方晖,阴忆烽,张毅,刘艳丽,宋云扬(国民核生化灾害防护国家重点实验室,北京 102205)
瘙痒是一种可以引起抓挠反应的主观感觉,大多数的皮肤病以及系统性疾病都伴有瘙痒症状,长期的慢性瘙痒严重影响人们的生活质量。目前,由于瘙痒的发生发展机制尚不完全清楚,也因此缺乏较为有效完善的治疗方法。随着组胺依赖性和非组胺依赖性痒觉信号通路的发现,表明多种信号通路参与了痒觉信号的传导[1]。常见的瘙痒介质有生物胺类、神经肽类、类花生酸类、蛋白酶类及细胞因子类等多种,我们研究的黧豆蛋白酶属于蛋白酶类致痒介质,它是通过非组胺依赖性的痒觉信号通路传导瘙痒的。
黧豆(Cowhage)是豆科黧豆属植物,多生在热带、亚热带地区,黧豆豆荚毛刺可以导致瘙痒。黧豆毛刺在刺入灵长类或啮齿类动物皮肤不久后可以产生持续几分钟的痒感[2]。早期的生化研究表明,黧豆毛刺中含有一种可以引发瘙痒的蛋白酶,称之为mucunain[3]。研究人员发现,mucunain 是通过一群对辣椒素敏感的传入神经纤维引发瘙痒的,它可以激活所有的机械热敏感的C 纤维,这与介导组胺诱发瘙痒的机械刺激不敏感的C 纤维不同,mucunain 诱导的瘙痒不能被抗组胺药所阻断[4-5]。Reddy 等[6]从黧豆豆荚毛刺中分离出天然黧豆蛋白酶并进行了重组表达,鉴定了mucunain 是一种半胱氨酸蛋白酶,并发现mucunain 是蛋白酶激活受体2 和4(proteinase activated receptor 2/4,PAR2/4)的配体,而且对PAR4 的活性大于对PAR2 的活性。在之后的研究中,人们发现与组胺引发的瘙痒相比,mucunain诱导的瘙痒感觉更为强烈,其瘙痒反应与慢性瘙痒更为类似,因此,mucunain 致痒可作为研究特应性皮炎(atopic dermatitis,AD)等慢性瘙痒疾病的理想模型[7]。
在止痒药物研究方面,抗组胺药物并不能有效解决临床瘙痒问题,而mucunain 作为一种非组胺机制的致痒物,常作为与组胺进行瘙痒方面比较性研究的典型致痒剂。到目前为止,仅有一篇文献报道了mucunain 的重组表达[6]。鉴于从黧豆毛刺中大量获取mucunain 比较困难,本研究主要开展黧豆蛋白酶的基因克隆表达与纯化,采用FLIPR 检测技术对重组黧豆蛋白酶的生物活性进行研究,以期可以高效地获得大量黧豆蛋白酶,为相关止痒剂的研究提供模型物质。
1 材料
1.1 试药
pET-28a(+)-Sumo 载体(美国Novagen 公司);DH5α感受态细胞、Rosetta(DE3)感受态细胞(北京天根生化科技有限公司)。
DNA 连接酶,限制性内切酶XhoⅠ,限制性内切酶KpnⅠ,1 kb DNA Ladder,Prestained protein MW marker 26616(美国Thermo Fisher Scientific 公司);卡那抗菌药物(美国Amersco 公司);E-64(德国Sigma 公司);Ni-NTA 亲和层析柱(美国Cytiva 公司)。
1.2 仪器
MillQ-10A 超纯水净化系统(美国Millipore公司);CO2培养箱(美国Thermo Fisher Scientific公司);离心机(德国Sigma 公司,德国Eppendorf 公司);FLIPR Penta 高通量实时荧光检测分析系统(德国Molecular Devices 公司)。
2 方法
2.1 黧豆蛋白酶的重组构建
黧豆蛋白酶全长基因(NCBI:ACB87490.1)编码整个前体蛋白(前体肽和成熟肽),可分为I29 抑制肽、C1 半胱氨酸蛋白肽和颗粒蛋白3 个部分(见图1)[8]。

图1 黧豆蛋白酶的组成Fig 1 Composition of mucunain
根据结构活性预测结果,推测其活性区域位于氨基酸序列的93 ~309 位,对其进行大肠埃希菌密码子优化,全基因合成获得质粒M-pUC57(南京金斯瑞生物科技有限公司合成)。将M-pUC57 用限制性内切酶KpnⅠ和XhoⅠ双酶切后,与用同样酶酶切后的线性化表达载体pET-28a(+)-Sumo 在T4 DNA 连接酶作用下于25 ℃连接2 h,载体构建如图2所示。采用CaCl2法进行转化,将Escherichia coliDH5α(DE3)感受态细胞置于冰上孵育30 min,细胞在42℃水浴90 s,冰上孵育2 ~3 min。加入900 μL 2×YT 培养基于37℃振荡培养箱中孵育40 ~50 min,最后涂布在含有50 μg·mL-1卡那抗菌药物的2×YT 琼脂平板上,在37 ℃孵育16 h 后,挑取单菌落进行质粒提取,并通过限制性内切酶KpnⅠ、XhoⅠ进行双酶切鉴定和DNA 测序鉴定。
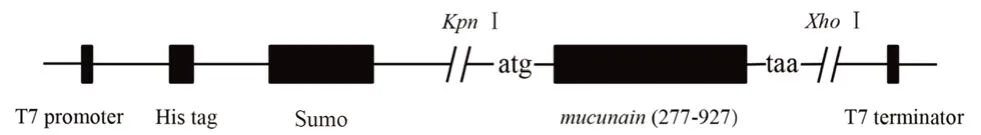
图2 M-pET-28a(+)-Sumo 表达质粒的构建Fig 2 Construction of M-pET-28a(+)-Sumo expression plasmid
2.2 黧豆蛋白酶的表达
将重组质粒M-pET-28a(+)-Sumo 转入大肠埃希菌Rosetta(DE3)菌株中进行诱导表达。挑取单个菌落,在含卡那抗菌药物(50 μg·mL-1)的10 mL 2×YT 培养基中于37 ℃、220 r·min-1条件下培养12 ~16 h。以1∶100 的比例接种于新鲜培养基中,37 ℃、220 r·min-1条件下培养至OD600达到0.6 ~0.8, 用0.05 mmol·L-1异丙基-β-D-1-硫代半乳糖苷(IPTG)在18℃诱导48 h。4℃、4500 r·min-1离心15 min,收集细胞,将其重悬于100 mL 冰冷的裂解缓冲液(20 mmol·L-1PBS,pH 7.4)中,采用低温超高压细胞破碎仪进行裂解。将裂解液进行SDS-PAGE电泳,对其进行表达形式分析。
2.3 黧豆蛋白酶的纯化
在室温下,将包涵体用洗涤液(2 mol·L-1尿素、20 mmol·L-1Tris、5 mmol·L-1咪唑和500 mmol·L-1氯化钠) 洗涤两次,9000 r·min-1离心10 min,之后溶解在增溶缓冲液(pH 7.4,8 mol·L-1尿 素、280 mmol·L-1β-巯基乙醇、20 mmol·L-1Tris、5 mmol·L-1咪唑和500 mmol·L-1氯化钠)中室温放置1 h,10 000 r·min-1离心15 min,回收溶解有目的蛋白His6-Sumo-M 的上清液。将融合蛋白His6-Sumo-M 进行纯化和重折叠复性。融合蛋白用超滤管浓缩后用SUMO 蛋白酶酶切,SUMO 蛋白酶与His6-Sumo-M 以100∶1 的比例加入到Sumo Protease Buffer(50 mmol·L-1Tris-HCl,1 mmol·L-1DTT,pH 8.0)中4 ℃过夜。然后采用镍柱亲和层析法(Ni-NTA 亲和层析柱)进行纯化得到变性蛋白。将纯化的蛋白进行透析重折叠恢复其活性。重折叠过程分以下三步进行,第一步透析是用由1.5 mol·L-1尿素、50 mmol·L-1咪唑、300 mmol·L-1氯化钠、200 mmol·L-1蔗糖、1 mmol·L-1还原型谷胱甘肽(GSH)、0.2 mmol·L-1氧化型谷胱甘肽(GSSG)和0.1%Triton X-100 组成的溶液(pH 7.4)进行的;使用由0.5 mol·L-1尿素、25 mmol·L-1咪唑、300 mmol·L-1氯化钠、200 mmol·L-1蔗糖、1 mmol·L-1谷胱甘肽、0.2 mmol·L-1GSSG 和0.1%Triton X-100 组成的溶液(pH 7.4)进行第二步透析;用100 mmol·L-1Tris、2 mmol·L-1咪唑、300 mmol·L-1氯化钠和200 mmol·L-1蔗糖组成的溶液(pH 7.4)进行最后一步透析。所有透析步骤均使用搅拌器在4 ℃冰箱内搅拌6 h,最后用0.45 μm 滤膜过滤除去沉淀物[9]。将蛋白溶液进行超滤浓缩,冷冻干燥,-20℃保存。
2.4 黧豆蛋白酶的分子量鉴定
经过蛋白表达纯化以及复性得到了重组蛋白,采用15% SDS-PAGE 确定其分子量大小是否与预期一致,并采用Edman 降解法对表达的重组黧豆蛋白酶进行N-端氨基酸序列分析,将重组蛋白溶解于500 μL 含蛋白酶抑制剂的8 mol·L-1尿素溶液中,用胰蛋白酶按酶∶底物=1∶50 的比例对蛋白进行酶切。将酶切后的多肽溶于溶剂A(0.1%甲酸水),10 000 g 离心5 min。取上清液采用Q Exactive 型液质联用质谱仪检测,以含0.1%甲酸的水(溶剂A)和含0.1%甲酸的乙腈(溶剂B)为流动相,梯度洗脱(0 ~8 min,6% ~10%B;8 ~60 min,10% ~30%B;60 ~79 min,30% ~42%B;79 ~80 min,42% ~95%B;80 ~85 min,95%B;85 ~86 min,95% ~6%B;86 ~90 min,6%B), 流速为0.6 L·min-1,总采集时间为90 min。喷雾电压为2.1 kV,毛细管温度为320℃;碰撞能量为27 eV,采集一级质量范围为300 ~1400m/z,二级扫描范围为200 ~2000m/z。使用MaxQuant 对液质联用质谱仪(LC/MS)原始数据进行处理。
2.5 黧豆蛋白酶生物活性分析
采用FLIPR 检测Hela 细胞中胞质Ca2+的变化,分析重组黧豆蛋白酶的生物活性。使用RPMI-1640 完全培养基,以(1 ~2)×105个·mL-1的密度将Hela 细胞接种于96 孔板内。培养24 h 后,弃去培养基,每孔加入80 μL Hank’s 缓冲液配制的calcium 6 染料(10×calcium 6 染 料 用 含20 mmol·L-1HEPES 的Hank’s 缓冲液以1∶10 稀释,pH 7.4),37℃避光孵育。2 h 后,分别加入20 μL 重组黧豆蛋白酶(10 μmol·L-1)及重组黧豆蛋白酶(10 μmol·L-1)与E-64(20 μmol·L-1,半胱氨酸蛋白酶抑制剂)的混合物至孔中。采用FLIPR 检测胞质Ca2+的变化,应用Max Pro 软件对数据进行分析和可视化。所有实验均重复进行三次,采用GraphPad Prism 8.0.1 软件对数据进行统计分析。
3 结果
3.1 黧豆蛋白酶的重组构建与表达
将KpnⅠ和XhoⅠ双酶切后的pET-28a(+)-Sumo 载体和胶回收纯化的黧豆蛋白酶基因片段连接,转化Escherichia coliDH5α感受态细胞,提取质粒,经KpnⅠ和XhoⅠ双酶切后鉴定得到约650 bp 大小的特异条带(见图3)。DNA 测序结果表明,与优化后的核苷酸序列一致。

图3 重组质粒M-pET-28a(+)-Sumo 的酶切鉴定Fig 3 Identify of recombinant plasmid M-pET-28a(+)-Sumo digested by restriction enzyme
实验采用了多种感受态细胞、不同的温度、不同的时间以及不同的IPTG 浓度进行诱导条件优化,发现重组黧豆蛋白酶都能进行表达,但始终以包涵体的形式存在(结果未列出)。采用Rosetta(DE3)感受态细胞,在18℃时用0.05 mmol·L-1IPTG 诱导48 h,用20 mmol·L-1PBS 裂解细菌后蛋白获得量最高,并确定其为最终的表达和裂解条件,结果如图4所示。
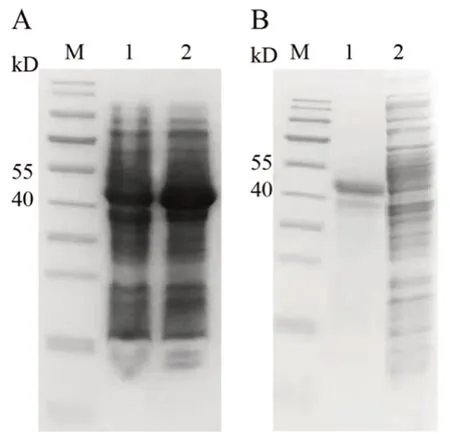
图4 重组黧豆蛋白酶的表达Fig 4 Recombinant mucunain expressed in Escherichia coli strain Rosetta(DE3)
3.2 黧豆蛋白酶的纯化与鉴定
黧豆蛋白酶纯化时同样进行了条件优化,发现先将包涵体洗涤后溶解,再进行酶切、纯化和重折叠复性,这样得到的重组黧豆蛋白酶收率较大。酶切以及重折叠复性时都应保证溶液中各成分浓度条件合适,避免沉淀的生成,最终影响复性及产率。将包涵体进行溶解、酶切、纯化和重折叠复性后得到重组黧豆蛋白酶,经超滤除盐和浓缩以及冻干后,得到的重组黧豆蛋白酶纯度≥90%,产量达到50 mg·L-1。
纯化复性后的重组黧豆蛋白酶进行SDSPAGE 电泳,结果如图5所示。重组黧豆蛋白酶用LC/MS 进行鉴定,检测到18 条肽段,蛋白序列覆盖率为68.2%(见图6,表1)。
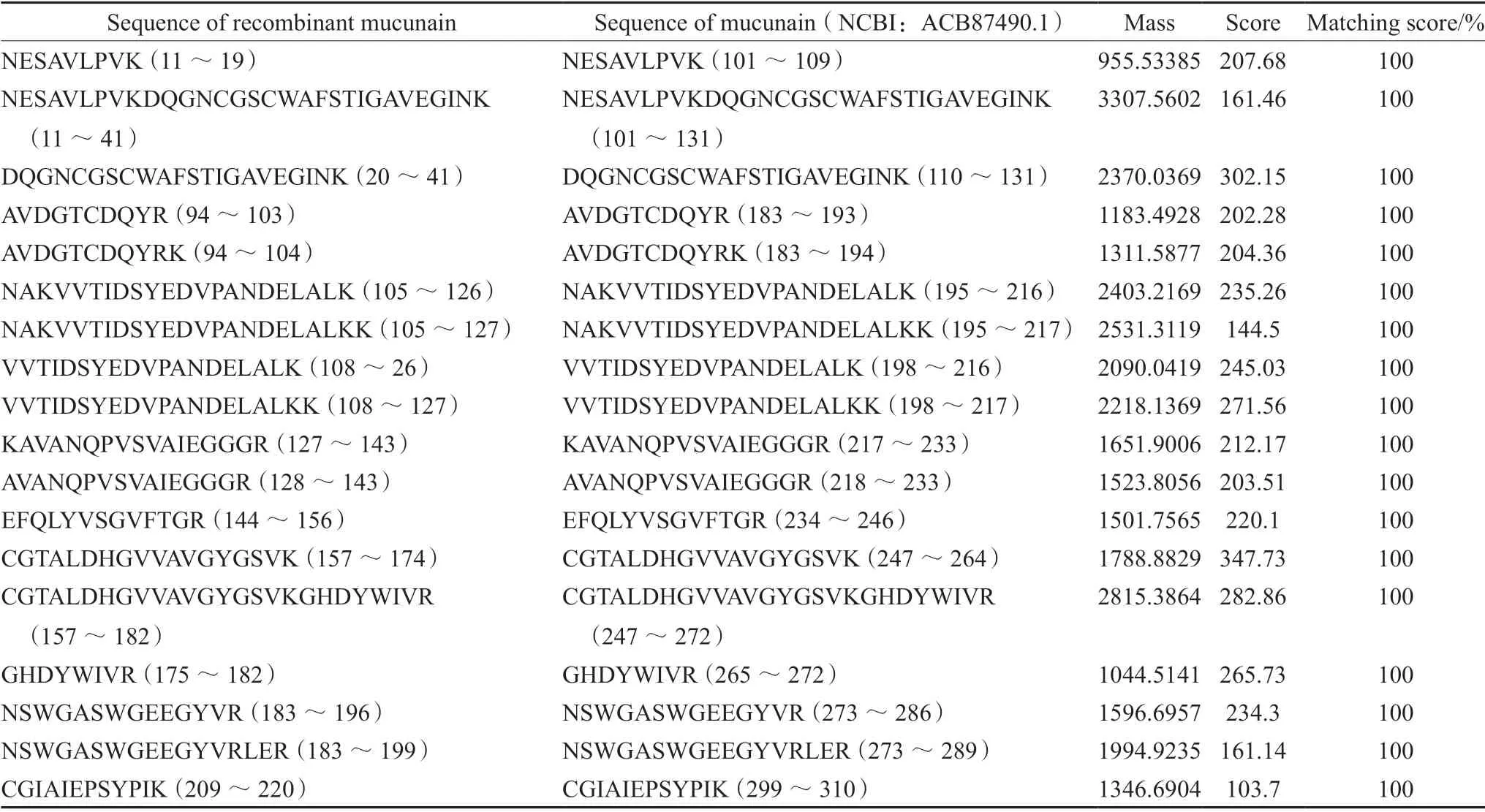
表1 重组黧豆蛋白酶的MaxQuant 搜库肽段鉴定结果Tab 1 Peptides identification of recombinant mucunain in MaxQuant library
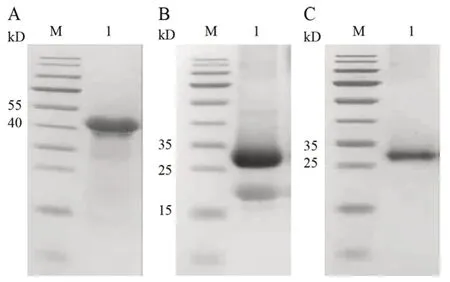
图5 重组黧豆蛋白酶的纯化结果鉴定Fig 5 15% SDS-PAGE analysis of recombinant mucunain purified by Ni-NTA

图6 重组黧豆蛋白酶经胰蛋白酶酶解的肽段质谱TIC 图Fig 6 Total ion chromatogram of recombinant mucunain obtained by trypsin
3.3 重组黧豆蛋白酶生物活性研究
将得到的重组黧豆蛋白酶刺激内源性表达PAR2 和PAR4 受体的Hela 细胞(见图7),采用FLIPR 进行了胞质钙流变化的测定,钙流变化如图8所示,发现重组黧豆蛋白酶可以引起胞内Ca2+浓度升高,持续时间约20 ~30 min,而加入重组黧豆蛋白酶和半胱氨酸蛋白酶抑制剂E-64后的混合物后胞质Ca2+无明显的变化,即E-64可以抑制重组黧豆蛋白酶引起胞内Ca2+浓度的变化,这表明获得的重组黧豆蛋白酶具有生物活性。

图7 Hela 细胞中PAR2 和PAR4 受体表达情况Fig 7 Expression of PAR2 and PAR4 receptor in Hela cells
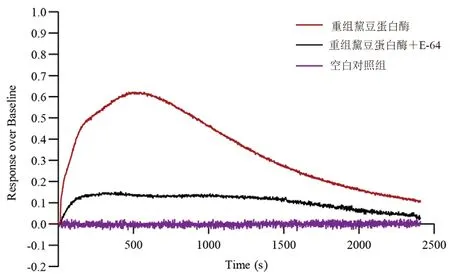
图8 Hela 细胞中Ca2+浓度变化曲线Fig 8 Changes of Ca2+concentration in Hela cells
4 讨论
Mucunain 是黧豆豆荚毛刺中引起强烈瘙痒的主要成分,是研究慢性瘙痒性疾病的理想模型。大多数文献报道中使用的黧豆蛋白酶是从黧豆毛刺中提取后直接使用的,其活性效应评价也均是通过有活性或灭活的毛刺或者制作成嵌刺板形式将天然黧豆蛋白酶作用于人体或动物体皮肤。到目前为止,仅有一篇文章报道mucunain 的重组表达[6]。考虑到从黧豆豆荚毛刺中分离提取大量天然mucunain 比较困难,本研究将mucunain基因片段克隆到pET-28a(+)-Sumo 载体上,其上带有-Sumo 和-His6 标签,以期得到可溶性表达的目的蛋白,同时便于后续进行蛋白纯化。在重组黧豆蛋白酶表达的过程中,我们采用了不同的诱导时间和温度、不同浓度的IPTG 以及多种大肠埃希菌表达菌株进行诱导表达,发现融合蛋白始终以包涵体的形式呈现。我们对包涵体的纯化和复性条件也进行了适当调整,包括蛋白的溶解、酶切、纯化以及重折叠的条件和顺序等,最终得到了重组黧豆蛋白酶,产量达到50 mg·L-1。
文献表明,mucunain 激活PAR2 和PAR4 受体,不是通过受体配体占位,而是切割PAR2和PAR4 受体使其产生一个新的栓系配体后,与细胞外受体外环-2 相互作用启动自身,活化的PAR2 和PAR4 受体激活PLC,PLC 继续激活TRPV1 和TRPA1 通道引起Ca2+内流。为了研究重组黧豆蛋白酶是否具有生物活性,本研究采用内源性表达PAR2 和PAR4 受体的Hela 细胞,使用FLIPR 检测Hela 细胞胞质Ca2+浓度变化。FLIPR 检测结果表明,重组黧豆蛋白酶可以引起胞质Ca2+持续变化20 ~30 min,而E-64 可以抑制重组黧豆蛋白酶引起的Hela 细胞胞质中Ca2+的变化,表明重组黧豆蛋白酶具有显著的生物活性。这与Reddy 等[6]的研究结果并不完全一致,他们的结果显示在分别外源性表达PAR2 和PAR4 受体的Hela 细胞中,胞质Ca2+浓度的变化持续20 ~100 s。而在本研究中使用的是内源性共表达PAR2 和PAR4 受体的Hela 细胞,这可能是重组黧豆蛋白酶引发了持续的Ca2+变化的原因,也可能是多种信号通路对Ca2+释放的协同作用。PAR2 受体下游的PLC 激活后,不仅可以激活TRPV1 和TRPA1 诱导细胞外Ca2+的内流[10],而且可以将二磷酸磷脂酰肌醇(PIP2)水解成三磷酸肌醇(IP3),IP3 能和内质网上的IP3R 结合刺激内质网内Ca2+释放进入胞质中。在RIN-5F细胞,饱和浓度的IP3 对胞质中高浓度的Ca2+抑制具有低灵敏度,呈现一个宽峰,称为高原型钙依赖曲线[11]。Pierre 等[12]的研究显示,PbTx-1诱导的钙流是多相的和持续的,钙流的变化可以持续25 min,PbTx-1 诱导的Ca2+的增加可能与偏倚通路和经典的PAR2 途径有关。目前已经有研究证实了激活后的PAR 受体的脱敏、内化和再敏化的机制[13]。在大鼠成纤维细胞中,PAR4 受体可以促进持续的信号转导反应,而且在过表达时不会出现激动剂促进的磷酸化,活化的PAR4受体也表现出缓慢的内化速率[14]。这说明重组黧豆蛋白酶激活的PAR2 和PAR4 受体的内化过程较慢也可能是导致Hela 细胞胞质Ca2+浓度持续变化的原因。另外在本研究中,经重组表达获得的蛋白为黧豆蛋白酶的活性部分——C1A 半胱氨酸蛋白酶,而Reddy 等[6]获得的是C1A 半胱氨酸蛋白酶和颗粒蛋白酶部分,这也可能与重组黧豆蛋白酶引起的Ca2+变化不一致有关。
5 结论
根据文献对mucunain 的全长序列进行分析,发现其活性片段为中间C1A 半胱氨酸蛋白酶部分。因此,我们对活性片段进行设计合成、高效表达及活性验证,获得了具有生物活性的重组黧豆蛋白酶,为非组胺依赖性痒觉信号通路研究提供模型物质。