毛红椿皮的化学成分及生物活性研究
杜丽波,李金玉,张 晓,李永红,潘卫东,*
(1.贵州中医药大学 研究生院,贵州 贵阳 550025;2.贵州省中国科学院天然产物化学重点实验室(贵州医科大学),贵州 贵阳 550014;3.南开大学 化学学院,天津 300071;4.农药国家工程研究中心(天津)(南开大学),天津 300071)
毛红椿Toonaciliatavar.pubescens为楝科Meliaceae香椿属Toona多年生乔木植物,主要分布于我国江西、云南、贵州、四川、湖南、广西、广东等低海拔至中海拔的山地密林或疏林中。因其素有“中国桃花心木”之称,是一种珍贵的药材树种,具有很高的经济价值和开发前景[1],但对其药用价值的挖掘很少吸引人们的注意。目前有关毛红椿植物中化学成分及生物活性的报导相对较少,有少量文献报道[2]从毛红椿枝叶中分离纯化得到部分香豆素、木脂素、萜类及苯丙素类等化合物。毛红椿作为香椿属植物,其中可能包含类似香椿属其他植物的化学成分[3]。此外,香椿属植物的果实、枝叶、皮等在民间常用来治疗痢疾、肠炎、出血等[4]。现代药理活性也表明该属植物具有较好的生物活性,如从香椿属植物滇红椿中发现了具有较强抗炎及抗肿瘤的活性成分[5];从香椿中分离得到了对多种癌细胞具有抑制作用的三萜[6]。最近,研究人员又从红椿中分离得到一系列具有抗炎症小体活性的化合物,部分化合物还可作为炎症反应疾病的潜在候选药物[7]。
为进一步寻找毛红椿的药效物质基础,并为香椿属植物的后续开发利用提供科学依据,本文对目前研究较少的毛红椿皮进行深入的化学成分及药理活性研究,从其95%乙醇提取物的乙酸乙酯萃取部位分离鉴定了20个单体化合物,如图1所示,分别为toonacilin(1)、odoratone(2)、bourjotinolone A(3)、dyvariabilin H(4)、piscidinol A(5)、piscidinol B(6)、3-episapelin A(7)、8(14),15-isopimaradiene-2α,3α,18-triol(8)、labd-13-ene-8α,15-diol(9)、nidorellol(10)、儿茶素(11)、1-linolenoylglycerol(12)、天师酸(13)、(-)-neoechinulin A(14)、aurantiamide acetate(15)、dibutylphthalate(16)、4,7-二甲氧基-5-甲基香豆(17)、东莨菪素(18)、(22E)-5a,8a-epidioxyergosta-6,22-dien-3b-ol(19)和β-谷甾醇(20)。其中化合物1~3、5~10、12~15和19均为首次从该植物中分离得到。抑菌活性研究表明:化合物1~4在50 mg/L对番茄早疫霉病菌A.solani、黄瓜灰霉病菌B.cinerea和辣椒疫霉病菌P.capsici等3种病原菌显示出不同程度的抑制活性;化合物1表现出一定的广谱抑菌活性,对3种病菌真菌均具有潜在的抑制活性;化合物4在50 mg/L对黄瓜灰霉病菌的抑制作用较强,抑制率达76.5%。抗肿瘤活性实验结果表明:化合物2、3、5、7对人乳腺癌细胞株MDA-MB-23、人横纹肌瘤细胞株A-673及人红细胞白血病细胞株HEL有不同程度的抑制增殖活性,特别是化合物2和5对3种肿瘤细胞株显示出选择抑制活性。
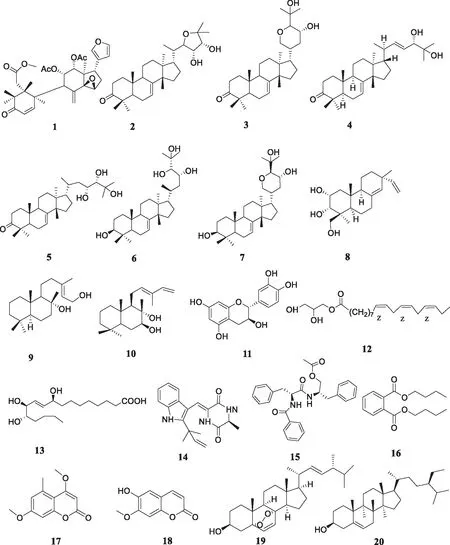
图1 化合物1~20的结构
1 材料与方法
1.1 材料与试剂
所用药材于2019年9月采自贵州省兴义市南盘江流域,由贵州省黔西南州林业科学研究所邓朝义研究员鉴定为楝科香椿属植物毛红椿T.ciliatevar.pubescens的树皮。植物标本(PTC2019B)保存于贵州省中国科学院天然产物化学重点实验室。
菌种:番茄早疫病菌A.solani、黄瓜灰霉病菌B.cinerea和辣椒疫霉病菌P.capsici由南开大学农药国家工程研究中心提供。菌株:人乳腺癌细胞株MDA-MB-231、人横纹肌瘤细胞株A-673及人红细胞白血病细胞株HEL 由贵州省中国科学院天然产物化学重点实验室提供。
柱层析硅胶(60~80目(粒径178~250 μm)和300~400目(粒径38~48 μm),青岛海洋化工厂);薄层层析硅胶GF254(粒径75~150 μm,青岛海洋化工厂);色谱用甲醇及乙腈(美国TEDIA天地试剂公司)。所用试剂除色谱纯及纯净水外,均购自上海泰坦科技股份有限公司。
1.2 主要仪器
Bruker Avance NEO 600 MHz 超导核磁共振仪(德国Bruker公司);QE Focus 型串联四极杆飞行时间液质谱联用仪(赛默飞世尔科技有限公司);Agilent 1200高效液相色谱仪(美国安捷伦科技有限公司);Eyela-1100型旋转蒸发仪(日本东京理化器械株式会社);安捷伦ZORBAXSB-C18半制备柱色谱柱(250 mm×9.4 mm,5 μmol/L,美国安捷伦科技有限公司);Milli-Q 超纯水仪(Millipore公司);多功能酶标仪(Gene 公司);Sephadex LH-20(Merck公司)。
1.3 提取与分离
取干燥粉碎后的毛红椿树皮25.0 kg,用95%乙醇(每次50 L)回流提取3次,每次4 h,合并提取液,减压浓缩除去乙醇,乙酸乙酯萃取4次,合并乙酸乙酯萃取液,浓缩后得浸膏1.26 kg。取浸膏加适量甲醇溶解,用2.50 kg的硅胶(60~80目)拌样,再经硅胶(300~400 目)柱层析进行梯度洗脱(石油醚-乙酸乙酯50∶1~1∶2,体积比,余同)。每次接馏分约1.20 L,将浓缩后的组分用薄层色谱(TLC)展开,分别观察组分在紫外灯下的荧光显色和5%硫酸乙醇试液的显色情况,合并相似组分,共获得11个洗脱部位(Fr.A~Fr.K)。其中Fr.I部位经中压液相色谱梯度洗脱(甲醇-水30∶70~100∶0),得到8个组分(Fr.I.1~Fr.I.8)。Fr.I.2组分经过硅胶柱层析梯度洗脱(石油醚-丙酮40∶1~1∶1),再经HPLC半制备液相色谱分离(甲醇-水70∶30)后得到化合物1(75 mg)。Fr.I.3组分先后经过硅胶柱梯度洗脱(氯仿-甲醇90∶1~1∶1),Sephadex LH-20凝胶柱层析(氯仿-甲醇1∶1)后,再经HPLC半制备液相色谱(乙腈-水35∶65)分离得到化合物2(43 mg)。组分Fr.I.4经过硅胶柱层析梯度洗脱(石油醚-丙酮30∶1~1∶1)后进一步重结晶纯化得到化合物3(251 mg)和4(66 mg)。
Fr.B部位经过反相中压液相色谱梯度洗脱(甲醇-水30∶70~100∶0),得到10个组分(Fr.B.1~Fr.B.10)。Fr.B.2组分经过Sephadex LH-20凝胶柱层析(氯仿-甲醇1∶1)后得到9个小组分(Fr.B.2-1~Fr.B.2-9),其中Fr.B.2-4进一步经HPLC半制备液相色谱(甲醇-水60∶40)纯化得到化合物17(14 mg)、18(15 mg)和19(8 mg)。Fr.B.2-6经Sephadex LH-20凝胶柱色谱洗脱(氯仿-甲醇1∶1),再经重结晶纯化得化合物20(8 mg)。
Fr.J部位经过反相中压液相色谱梯度洗脱(甲醇-水30∶70~100∶0),得到14个组分(Fr.J.1~Fr.J.14)。Fr.J.12组分经过Sephadex LH-20凝胶柱层析(氯仿-甲醇1∶1)后得到10个小组分(Fr.J.12-1~Fr.J.12-10),其中Fr.J.12-6进一步经HPLC半制备液相色谱(甲醇-水60∶40)纯化得到化合物5(14 mg)、6(6 mg)、7(8 mg)和8(8 mg)。Fr.J.12-8经Sephadex LH-20凝胶柱色谱洗脱(氯仿-甲醇1∶1),再经HPLC半制备液相色谱纯化(甲醇-水50∶50)后,得到化合物9(6 mg)。组分Fr.J.12-9经Sephadex LH-20凝胶柱色谱洗脱后(氯仿-甲醇1∶1),再经重结晶纯化得化合物10(8 mg)。
Fr.K部位经过反相中压液相色谱梯度洗脱(甲醇-水30∶70~100∶0),得到10个组分(Fr.K.1~Fr.K.10)。组分Fr.K.1经硅胶柱梯度洗脱(氯仿∶甲醇20∶1~1∶1)后得9个流分(Fr.K.1-1~Fr.K.1-9),其中,Fr.K.1-4经重结晶纯化后得到化合物11(607 mg)和12(17 mg)。组分Fr.K.2经硅胶柱层析梯度洗脱(氯仿∶甲醇30∶1~1∶1)后得7个流分(Fr.K.2-1~Fr.K.2-7),Fr.K.2-3进一步经HPLC半制备液相色谱(甲醇-水70∶30)洗脱后得到化合物13(27 mg)和14(19 mg)。Fr.K.3经硅胶柱层析梯度洗脱(氯仿∶甲醇30∶1~1∶1)后得10个流分(Fr.K.3-1~3-10),其中Fr.K.3-7经HPLC半制备液相色谱(乙腈-水55∶45)纯化后得到化合物15(38 mg)。Fr.K.9经硅胶柱层析梯度洗脱(氯仿∶甲醇30∶1~1∶1)后得7个流分(Fr.K.9-1~Fr.K.9-7),其中Fr.K.9-4经HPLC半制备液相色谱(乙腈-水75∶35)纯化后得到化合物16(38 mg)。
1.4 抑菌活性实验
将供试样品化合物1~4溶解在DMSO中,制成30 g/L的母液。取药液167 μL注入培养皿内,加入9.85 mL PSA培养基,制成最终浓度为50 mg/L含药平板。将培养好的供试菌种用打孔器打取直径4 mm菌饼,每皿3块,置于含药平板内,呈等边三角形摆放。以不加药剂处理做空白对照。将各处理于(24±1)℃培养箱内培养48 h后,量取各处理菌丝扩展直径,并与对照相比较,计算相对抑制百分率。活性分级指标为:A级≥90%;B级70%~90%;C级50%~70%;D级<50%。
1.5 抗肿瘤活性实验
采用MTT法测定毛红椿皮中部分化合物对人乳腺癌细胞株MDA-MB-231、人横纹肌瘤细胞株A-673及人红细胞白血病细胞株HEL的抑制活性。分别选用含10%牛血清的RPMI1640 培养基和DMEM培养基配制细胞悬液,用96孔板接种,置于体积分数5% CO2培养箱中,过夜。将待测化合物用DMSO配成5个浓度梯度的培养基。阳性对照用阿霉素配置成等浓度梯度,阴性对照为等体积0.25% DMSO的培养基,每组设3个复孔。加药后,培养48 h,离心去除上清液,加入5 g/L MTT的培养基培养孵育至甲瓒晶体充分溶解。于酶标仪490 nm处测OD值,每次实验均设阿霉素阳性化合物,以浓度为横坐标,细胞存活率为纵坐标绘制细胞生长曲线,应用两点法(Reed and Muench法)计算化合物的IC50值。
2 结果与分析
2.1 化合物鉴定
化合物1:白色粉末(氯仿),ESI-MS(m/z): 577[M+Na]+,分子式C31H38O9。1H-NMR(CDCl3, 600 MHz)∶0.97(3H, s, H-18), 1.02(3H, s, H-19), 1.09(3H, s, H-29), 1.10(3H, s, H-28), 1.81(3H, s,—OCOCH3), 2.01(3H, s,—OCOCH3), 2.27(1H, dd,J=18.0, 6.0 Hz, H-16), 2.59(1H, s, H-9), 3.66(3H, s,-COOCH3), 3.95(1H, s, H-15), 5.34(1H, d,J=4.4 Hz, H-12), 5.37(1H, d,J=4.4 Hz, H-11), 6.19(1H, d,J=10.4 Hz, H-2), 7.26(1H, d,J=10.4 Hz, H-1)。13C-NMR(CDCl3, 150 MHz): 151.8(C-1), 126.7(C-2), 202.6(C-3), 46.0(C-4), 44.7(C-5), 32.0(C-6), 174.0(C-7), 135.7(C-8), 57.2(C-9), 44.2(C-10), 74.6(C-11), 70.3(C-12), 41.9(C-13), 72.4(C-14), 60.3(C-15), 32.8(C-16), 38.5(C-17), 14.3(C-18), 20.0(C-19), 122.9(C-20), 140.1(C-21), 111.3(C-22), 142.3(C-23), 23.0(C-28), 22.7(C-29), 120.8(C-30), 169.8(11-OCOCH3), 20.8(11-OCOCH3), 168.9(12-OCOCH3), 20.6(12-OCOCH3), 51.9(1-COOCH3)。结合文献[8]比对,鉴定化合物1为toonacilin。
化合物2:白色粉末(甲醇),ESI-MS(m/z): 495[M+Na]+,分子式C30H48O4。1H-NMR(CDCl3, 600 MHz): 0.84(3H, s, H-19), 0.86(3H, d,J=6.4 Hz, H-21), 1.02(3H, s, H-18), 1.06(6H, s, H-28, H-29), 1.13(3H, s, H-30), 1.24(3H, s, H-27), 1.37(3H, s, H-26), 2.74(1H, dd,J=12.0, 6.0 Hz, H-2a), 3.67(1H, d,J=6.0 Hz, H-24), 3.84(1H, dd,J=6.4, 1.5 Hz, H-22), 3.99(1H, dd,J=12.6, 6.6 Hz, H-23), 5.32(1H, dd,J=6.6, 3.0 Hz, H-7)。13C-NMR(CDCl3, 150 MHz): 38.6(C-1), 24.9(C-2), 217.4(C-3), 47.9(C-4), 49.3(C-5), 24.5(C-6, C-29), 117.8(C-7), 145.9(C-8), 48.5(C-9), 35.0(C-10), 18.3(C-11), 33.5(C-12), 43.5(C-13), 51.2(C-14), 34.1(C-15), 27.8(C-16), 52.4(C-17), 24.4(C-18), 12.4(C-19), 37.5(C-20), 12.8(C-21), 83.7(C-22), 81.0(C-23, C-25), 77.3(C-24), 26.3(C-26), 21.6(C-27), 21.3(C-28), 27.7(C-30)。结合文献[9]比对,鉴定化合物2为odoratone。
化合物3:白色粉末(氯仿),ESI-MS(m/z): 495[M+Na]+,分子式C30H48O4。1H-NMR(CDCl3, 600 MHz): 0.79(3H, s, H-19), 1.01(3H, s, H-21), 1.04(6H, s, H-18, H-29), 1.05(3H, s, H-28), 1.12(3H, s, H-30), 1.28(3H, s, H-27), 1.32(3H, s, H-26), 2.76(1H, td,J=14.4, 5.4 Hz, H-2a), 3.40(1H, dd,J=11.4, 2.4 Hz, H-24), 3.93(1H, d,J=2.4 Hz, H-22), 3.95(1H, d,J=2.4 Hz, H-23), 5.33(1H,m, H-7)。13C-NMR(CDCl3, 150 MHz):38.5(C-1), 34.9(C-2), 217.1(C-3), 47.9(C-4), 52.3(C-5), 24.5(C-6, C-28), 118.0(C-7), 145.6(C-8), 48.4(C-9), 35.0(C-10), 18.2(C-11), 32.9(C-12), 43.3(C-13), 50.8(C-14), 33.9(C-15), 27.4(C-16), 44.7(C-17), 23.8(C-18), 12.8(C-19), 37.5(C-20), 70.1(C-21), 86.4(C-22, C-24), 64.6(C-23), 74.2(C-25), 24.4(C-26), 28.5(C-27), 22.3(C-29), 27.5(C-30)。结合文献[10]比对,鉴定化合物3为bourjotinolone A。
化合物4:白色粉末(氯仿),ESI-MS(m/z): 479[M+Na]+,分子式C30H48O3。1H-NMR(CDCl3, 600 MHz): 0.84(3H, s, H-18), 1.00(3H, d,J=6.4 Hz, H-21), 1.01(3H, s, H-19), 1.02(3H, s, H-28), 1.05(3H, s, H-29), 1.12(3H, s, H-30), 1.25(3H, s, H-27), 1.21(3H, s, H-26), 2.24(1H, t,J=3.6 Hz, H-2), 3.86(2H, d,J=7.2 Hz, H-24), 5.31(1H, m, H-7), 5.45(1H, dd,J=15.6, 7.2 Hz, H-23)。13C-NMR(CDCl3, 150 MHz): 38.5(C-1), 34.9(C-2,C-17), 217.1(C-3), 47.9(C-4), 52.4(C-5), 24.5(C-6), 118.0(C-7), 145.7(C-8), 48.4(C-9), 35.0(C-10), 18.2(C-11), 33.5(C-12), 43.6(C-13), 51.2(C-14), 34.1(C-15), 28.5(C-16), 34.9(C-17), 23.7(C-18), 12.8(C-19), 40.3(C-20), 72.9(C-21), 140.8(C-22), 126.0(C-23), 79.6(C-24), 76.8(C-25), 24.4(C-26), 21.6(C-27), 23.7(C-28), 22.1(C-29), 27.4(C-30)。结合文献[11]比对,鉴定化合物4为dyvariabilin H。
化合物5:白色粉末(氯仿),ESI-MS(m/z): 511[M+Na]+,分子式C30H50O4。1H-NMR(CDCl3, 600 MHz): 0.79(3H, s, H-18), 0.89(3H, d,J=6.4 Hz, H-21), 0.98(3H, s, H-30), 0.99(3H, s, H-28), 1.01(3H, s, H-29), 1.09(3H, s, H-19), 1.26(3H, s, H-27), 1.28(3H, s, H-26), 3.13(1H, d,J=6.9 Hz, H-24), 4.09(1H, d,J=7.2 Hz, H-23), 5.28(1H, d,J=3.0 Hz, H-7)。13C-NMR(CDCl3, 150 MHz): 38.5(C-1), 35.0(C-2, C-10), 217.3(C-3), 43.5(C-4), 52.3(C-5), 24.3(C-6), 117.8(C-7), 145.8(C-8), 48.4(C-9), 18.3(C-11), 34.0(C-12), 47.9(C-13), 51.2(C-14), 33.8(C-15), 28.4(C-16), 53.8(C-17), 22.0(C-18), 12.8(C-19), 33.6(C-20), 18.9(C-21), 40.3(C-22), 69.7(C-23), 75.0(C-24), 74.3(C-25), 26.3(C-26), 27.3(C-27), 24.5(C-28), 21.6(C-29), 27.4(C-30)。结合文献[12]比对,鉴定化合物5为piscidinol A。
化合物6:白色粉末(甲醇),ESI-MS(m/z): 499[M+Na]+,分子式C30H52O4。1H-NMR(CDCl3, 600 MHz): 0.77(3H, s, H-18), 0.85(3H, s, H-21), 0.88(3H, s, H-30), 0.95(3H, s, H-28), 0.99(3H, s, H-29), 1.00(3H, s, H-19), 1.28(3H, s, H-27), 1.33(3H, s, H-26), 3.19(1H, s, H-24), 3.51(1H,s, H-3), 4.14(1H, m, H-23), 5.29(1H, d,J=3.0 Hz, H-7)。13C-NMR(CDCl3, 150 MHz): 37.2(C-1), 27.6(C-2), 79.3(C-3), 39.0(C-4), 50.6(C-5), 24.0(C-6), 118.0(C-7), 145.6(C-8), 48.9(C-9), 34.9(C-10, C-20), 18.1(C-11), 33.7(C-12), 43.6(C-13), 51.2(C-14), 33.9(C-15), 28.5(C-16), 53.8(C-17), 22.0(C-18), 13.1(C-19), 18.9(C-21), 40.6(C-22), 69.7(C-23), 74.9(C-24), 74.3(C-25), 26.3(C-26), 27.5(C-27), 27.7(C-28), 14.7(C-29), 27.3(C-30)。结合文献[13]比对,鉴定化合物6为 piscidinol B。
化合物7:白色粉末(氯仿),ESI-MS(m/z): 497[M+Na]+,分子式C30H50O4。1H-NMR(CDCl3, 600 MHz): 0.75(3H, s, H-28), 0.78(3H, s, H-29), 0.86(3H, s, H-19), 1.00(3H, s, H-18), 1.05(3H, s, H-30), 1.27(3H, s, H-26), 1.30(3H, s, H-27), 2.90(1H, d,J=9.0 Hz, H-24), 3.39(1H, dd,J=11.4, 3.0 Hz, H-21b), 3.91(1H, m, H-23a), 3.95(1H, dd,J=11.4, 2.2 Hz, H-21a), 5.27(1H, d,J=3.0 Hz, H-7)。13C-NMR(CDCl3, 150 MHz): 37.2(C-1), 27.6(C-2, C-28), 79.2(C-3), 38.9(C-4), 50.7(C-5), 24.0(C-6, C-26), 118.1(C-7), 145.5(C-8), 48.9(C-9), 34.9(C-10), 18.0(C-11), 33.0(C-12), 43.3(C-13), 51.2(C-14), 33.9(C-15), 27.3(C-16, C-30), 44.7(C-17), 22.3(C-18), 13.1(C-19), 37.5(C-20), 70.1(C-21), 36.3(C-22), 64.6(C-23), 86.3(C-24), 74.1(C-25), 28.4(C-27), 14.7(C-29)。结合文献[12]比对,鉴定化合物7为 3-episapeline A。
化合物8:白色粉末(甲醇),ESI-MS(m/z): 319[M-H]-,分子式C20H32O3。1H-NMR(CDCl3, 600 MHz): 0.72(3H, s, H-20), 0.95(3H, s, H-18), 1.00(3H, s, H-17), 1.20(1H, dd,J=12.6, 4.5 Hz, H-6a), 1.30, 1.42(1H, m, H-12), 1.44(2H, m, H-1), 1.46(1H, d,J=3.6 Hz, H-6b), 1.45~1.55(2H, m, H-11), 1.57(1H, m, H-5), 1.72(1H, m, H-9), 1.93(1H, td,J=13.8, 4.8 Hz, H-7a), 2.20(1H, dd,J=13.8, 4.2 Hz, H-7b), 3.20(1H, d,J=10.8 Hz, H-19a), 3.50(1H, d,J=10.8 Hz, H-19b), 3.61(dd,J=3.0, 2.4 Hz, H-7), 3.72(1H,m, H-2), 4.88(2H, m, H-16), 5.19(1H, s, H-14), 5.75(1H, dd,J=17.4, 10.5 Hz, H-15)。13C NMR(CDCl3, 150 MHz): 40.5(C-1), 65.5(C-2), 72.9(C-3), 44.7(C-4), 48.3(C-5), 22.0(C-6), 36.2(C-7), 137.0(C-8), 50.5(C-9), 39.0(C-10), 19.0(C-11), 34.4(C-12), 37.5(C-13), 128.9(C-14), 149.1(C-15), 110.9(C-16), 26.3(C-17), 23.4(C-18), 64.1(C-19), 17.1(C-20)。结合文献[14]比对,鉴定化合物8为8(14), 15-isopimaradiene-2α,3α,18-triol。
化合物9:白色结晶(甲醇),ESI-MS(m/z): 331[M+Na]+,分子式C20H36O2。1H-NMR(CDCl3, 600 MHz): 0.81(3H, s, H-20), 0.82(3H, s, H-19), 0.89(3H, s, H-18), 1.15(3H, s, H-17), 1.71(3H, d,J=1.2 Hz, H-16), 4.16(2H, d,J=6.9 Hz, H-15), 5.46(1H, t,J=6.9 Hz, H-14)。13C NMR(CDCl3, 150 MHz): 39.3(C-1), 20.6(C-2, C-5), 42.0(C-3), 33.3(C-4), 56.1(C-6), 42.9(C-7), 74.1(C-8), 61.2(C-9), 39.8(C-10), 23.9(C-11, C-17), 44.6(C-12), 140.9(C-13), 123.3(C-14), 59.3(C-15), 18.5(C-16), 33.4(C-18), 21.5(C-19), 15.5(C-20)。结合文献[15]比对,鉴定化合物9为labd-13-ene-8α,15-diol。
化合物10:白色结晶(氯仿),ESI-MS(m/z): 329[M+Na]+,分子式C20H34O2。1H-NMR(CDCl3, 600 MHz): 0.84(3H, s, H-18), 0.87(3H, s, H-19), 0.92(3H, s, H-20), 1.18(3H, s, H-17), 1.81(3H, s, H-16), 4.94(1H, t,J=10.8 Hz, H-15a), 5.10(1H, d,J=17.4 Hz, H-15b), 5.59(1H, t,J=7.2 Hz, H-12), 6.37(1H, dd,J=17.4, 10.8 Hz, H-14)。13C NMR(CDCl3, 150 MHz): 39.8(C-1), 18.5(C-2), 41.6(C-3), 33.3(C-4), 53.6(C-5), 27.7(C-6), 80.4(C-7), 78.1(C-8), 60.3(C-9), 39.3(C-10), 23.9(C-11), 135.5(C-12), 132.8(C-13), 141.5(C-14), 110.7(C-15), 11.7(C-16), 17.9(C-17), 33.5(C-18), 21.6(C-19), 15.6(C-20)。结合文献[16]比对,鉴定化合物10为nidorellol。
化合物11:白色结晶(氯仿),ESI-MS(m/z): 313[M+Na]+,分子式C15H14O6。1H NMR(CD3OD, 600 MHz): 2.49(1H, dd,J=16.2, 8.2 Hz, H-4b), 2.82(1H, dd,J=16.2, 5.4 Hz, H-4a), 3.97(1H, td,J=7.8, 5.4 Hz, H-3), 4.56(1H, d,J=7.8 Hz, H-2), 5.86(1H, d,J=2.4 Hz, H-8), 5.92(1H, d,J=2.4 Hz, H-6), 6.68(1H, dd,J=8.4, 2.4 Hz, H-6′), 6.73(1H, d,J=8.4 Hz, H-5′), 6.81(1H, d,J=2.4 Hz, H-2′)。13C NMR(CD3OD, 150 MHz): 82.3(C-2), 68.2(C-3), 28.5(C-4), 157.4(C-5), 96.0(C-6), 157.0(C-7), 95.2(C-8), 131.8(C-1′), 115.0(C-2′), 145.4(C-3′), 145.5(C-4′), 115.6(C-5′), 119.9(C-6′), 100.4(C-4a), 156.6(C-8a)。结合文献[17]比对,鉴定化合物11为儿茶素。
化合物12:白色粉末(甲醇),ESI-MS(m/z): 353[M+Na]+,分子式C21H36O4。1H-NMR(CDCl3,600 MHz): 0.95(3H, t,J=7.5 Hz, H-23), 1.20~1.35(8H, m, 4×CH2), 1.65(2H, m, COOCH2CH2CH2), 2.09(4H, m, CH2CH=CHCH2CH=CHCH2CH=CHCH2), 2.32(2H, t,J=7.2 Hz, COOCH2CH2CH2), 2.83(4H, t,J=5.7 Hz, CH2CH=CHCH2CH=CHCH2CH=CHCH2), 3.57(1H, dd,J=11.4, 5.7 Hz, OCH2CHCH2O), 3.72(1H, dd,J=11.4, 3.6 Hz, OCH2CHCH2O), 3.90(1H, m, CH2CHOCH2), 5.38(6H, m, 3CH=CH)。13C NMR(CDCl3,150 MHz): 65.2(C-1), 70.3(C-2), 34.2(C-3), 29.6(C-4, C-7), 63.4(C-5), 174.4(C-6), 29.2(C-8), 29.1(C-9), 27.2(C-10), 25.6(C-11), 25.5(C-12), 24.9(C-13), 132.0(C-14), 130.3(C-15), 20.5(C-16), 128.3(C-17), 128.3(C-18), 14.3(C-19), 127.8(C-20), 127.2(C-21)。结合文献[18]比对,鉴定化合物12为1-linolenoylglycerol。
化合物13:白色粉末(氯仿),ESI-MS(m/z): 353[M+Na]+,分子式C18H34O5。1H-NMR(CD3OD, 600 MHz): 0.91(3H, t,J=6.6 Hz, H-18), 1.35(14H, m, H-4~6, H-14~17), 1.50(4H, m, H-7, 13), 1.59(2H, m, H-3), 2.28(2H, t,J=7.2 Hz, H-2), 3.41(1H, m, H-12), 3.92(1H, m, H-11), 4.05(1H, dd,J=12.0, 6.4 Hz, H-8), 5.67(1H, dd,J=15.6, 6.0Hz, H-10), 5.70(1H, dd,J=11.4, 6.0 Hz, H-9)。13C NMR(CD3OD, 150 MHz): 177.7(C-1), 35.0(C-2), 26.1(C-3, C-6), 30.2(C-4), 30.4(C-5), 38.3(C-7), 73.0(C-8), 131.0(C-9), 136.5(C-10), 76.5(C-11), 75.8(C-12), 33.5(C-13), 26.6(C-14), 30.1(C-15), 33.1(C-16), 23.7(C-17), 14.5(C-18)。结合文献[19]比对,鉴定化合物13为天师酸。
化合物14:白色结晶(丙酮),ESI-MS(m/z): 346[M+Na]+,分子式C19H21N3O2。1H NMR(DMSO-d6,600 MHz):1.37(3H, d,J=6.9 Hz, CH3-20), 1.48(6H, s, CH3-18, 19), 4.16(1H, q,J=6.9 Hz, H-12), 5.02(1H, s, H-17b), 5.05(1H, d,J=11.4 Hz, H-17a), 6.08(1H, dd,J=16.8, 10.5 Hz, H-16), 6.89(1H, s, H-8), 7.00(1H, t,J=7.5 Hz, H-5), 7.09(1H, t,J=7.5 Hz, H-6), 7.19(1H, d,J=7.8 Hz, H-4), 7.42(1H, d,J=7.8 Hz, H-7), 8.33(1H, s, NH-11), 8.67(1H, s, NH-14), 11.04(1H, s, NH-1)。13C NMR(DMSO-d6, 150 MHz): 144.5(C-2), 126.4(C-3a), 103.4(C-3b), 119.4(C-4), 119.9(C-5), 121.2(C-6), 112.1(C-7), 135.1(C-7a), 110.2(C-8), 125.3(C-9), 160.4(C-10), 51.0(C-12), 166.9(C-13), 39.0(C-15), 145.6(C-16), 110.7(C-17), 28.0(C-18, C-19), 20.1(C-20)。结合文献[20]比对,鉴定化合物14为(-)-neoechinulin A。
化合物15:白色粉末(氯仿),ESI-MS(m/z): 443[M-H]-,分子式C27H28N2O4。1H-NMR(CDCl3, 600 MHz): 2.01(3H, s, H-7), 2.74(2H, m, H-9), 3.08(1H, dd,J=13.8, 8.4 Hz, H-8β), 3.24(1H, dd,J=13.8, 6.0 Hz, H-8α), 3.84(1H, dd,J=11.4, 4.8 Hz, H-2β), 3.95(1H, dd,J=11.4, 4.8Hz, H-2α), 4.38(1H, m, H-1), 4.79(1H, dd,J=8.4, 6.0 Hz, H-3), 6.04(1H, d,J=8.4 Hz, N-Ha), 6.81(1H, d,J=7.8 Hz, N-Hb), 7.00~7.30(10H, m, H-2b-4b, 2c-4c), 7.46(2H, t,J=7.8 Hz, H-3a), 7.54(1H, m, H-4a), 7.74(2H, m, H-2a)。13C NMR(CDCl3, 150 MHz): 170.2(C-1), 49.4(C-2), 37.4(C-3), 136.6(C-4), 128.6(C-5, C-9), 128.7(C-6, C-8), 126.7(C-7), 64.6(C-10), 170.7(C-11), 20.8(C-12), 54.9(C-13), 167.1(C-14), 133.6(C-15), 127.0(C-16, C-20), 128.6(C-17, C-19), 131.9(C-18), 38.4(C-21), 136.7(C-22), 129.1(C-23, C-27), 129.3(C-24, C-26), 127.1(C-25)。结合文献[21]比对,鉴定化合物为aurantiamide acetate。
化合物16:黄色油状液体,ESI-MS(m/z):301[M+Na]+,分子式C16H22O4。1H NMR(CDCl3, 600 MHz): 0.99(6H, t,J=7.2 Hz, H-6, H-6′),1.47(4H, m, H-5, H-5′), 1.74(4H, m, H-4, H-4′), 4.33(4H, t,J=6.6 Hz, H-3, H-3′), 7.55(2H, dd,J=6.0, 3.0 Hz, H-3″, H-6″), 7.74(2H, dd,J=6.0, 3.0 Hz, H-2″, H-5″)。13C NMR(CDCl3, 150 MHz): 167.7(C-1, C-1′), 65.6(C-3, C-3′), 30.6(C-4, C-4′), 19.2(C-5, C-5′), 13.7(C-6, C-6′), 130.9(C-1″, C-6″), 128.9(C-2″, C-5″), 132.3(C-3″, C-4″)。结合文献[22]比对,鉴定化合物16为dibutylphthalate。
化合物17:白色结晶(氯仿),ESI-MS(m/z): 221[M+Na]+,分子式C12H12O4。1H-NMR(CDCl3, 600 MHz): 2.63(3H, s, CH3), 3.85(3H, s, 7-OCH3), 3.95(3H, s, 4-OCH3), 5.55(1H, s, H-3), 6.63(1H, d,J=2.4 Hz, H-6), 6.68(1H, d,J=2.4 Hz, H-8)。13C-NMR(CDCl3, 150 MHz): 163.3(C-2), 87.6(C-3), 169.8(C-4), 138.5(C-5), 115.7(C-6), 161.9(C-7), 98.7(C-8), 156.7(C-9), 107.9(C-10), 56.0(4-OCH3), 55.6(7-OMe), 23.5(5-Me)。结合文献[23]比对,鉴定化合物17为4, 7-二甲氧基-5-甲基香豆素。
化合物18:黄色结晶(氯仿),ESI-MS(m/z): 191[M-H]-,分子式C10H8O4。1H-NMR(CDCl3, 600 MHz): 3.97(3H, s, 7-OCH3), 6.28(1H, d,J=9.6 Hz, H-3), 6.87(1H, s, H-5), 6.93(1H, s, H-8), 7.62(1H, d,J=9.6 Hz, H-4)。13C NMR(CDCl3, 150 MHz): 163.3(C-2), 87.6(C-3), 144.1(C-4), 103.2(C-5), 149.8(C-6), 150.2(C-7), 113.3(C-8), 107.5(C-9), 161.5(CO), 56.4(7-OCH3)。结合文献[24]比对,鉴定化合物18为东莨菪素。
化合物19:白色粉末(甲醇),ESI-MS(m/z)∶451[M+Na]+,分子式C28H44O3。1H-NMR(CDCl3, 600 MHz): 0.83(6H, d,J=3.0 Hz, H-18, H-26), 0.84(3H, d,J=3.0 Hz, H-27), 0.86(3H, s, H-19), 0.90(3H, m, H-28), 1.02(3H, dd,J=6.6, 2.7 Hz, H-21), 3.98(1H, m, H-3), 5.16(1H, dd,J=15.3, 8.4 Hz, H-22), 5.24(1H, m, H-23), 6.26(1H, d,J=8.4 Hz, H-6), 6.52(1H, d,J=8.4 Hz, H-7)。13C NMR(CDCl3, 150 MHz): 34.7(C-1), 30.1(C-2), 66.4(C-3), 37.0(C-4), 82.2(C-5), 135.4(C-6), 130.7(C-7), 79.4(C-8), 51.1(C-9), 36.9(C-10), 23.4(C-11), 39.3(C-12), 44.6(C-13), 51.7(C-14), 20.6(C-15), 28.7(C-16), 56.2(C-17), 12.9(C-18), 18.2(C-19), 39.7 C-20), 20.9(C-21), 135.2(C-22), 132.3(C-23), 42.8(C-24), 33.1(C-25), 19.7(C-26), 19.6(C-27), 17.6(C-28)。结合文献[25]比对,鉴定化合物19为(22E)-5a,8a-epidioxyergosta-6,22-dien-3b-ol。
化合物20:白色结晶(氯仿)。与β-谷甾醇对照品薄层色谱点板显色,用3种不同的展开溶剂系统,在与对照品色谱相应的位置上,显相同颜色的斑点,并与文献[26]报道一致,故鉴定化合物20为β-谷甾醇。
2.2 抑菌活性实验结果
在植物中已发现数千种萜类化合物具有较好的杀虫和杀菌作用,有些对昆虫表现出一定的拒食、驱避、毒杀等活性[27],有些则可调控昆虫生长发育。目前研究最成熟的萜类杀虫物质主要是楝科和卫矛科的活性成分,毛红椿皮作为楝科香椿属植物,本文从中分离得到10个萜类化合物,因为部分萜类化合物量少,且在其他药理活性实验中已经耗尽,因此实验对分离得到量较多的化合物1~4进行了抑菌活性初步筛选。实验结果显示,4个化合物对番茄早疫病菌、黄瓜灰霉病菌和辣椒疫霉病菌均有一定的抑制作用,其中化合物1表现出一定的广谱抑菌活性,在浓度为50 mg/L下对上述3种病原菌均有潜在抑制作用;此外,化合物4在浓度为50 mg/L下对黄瓜灰霉病菌有较强的抑制作用,抑制率为76.5%。结果如表1所示。
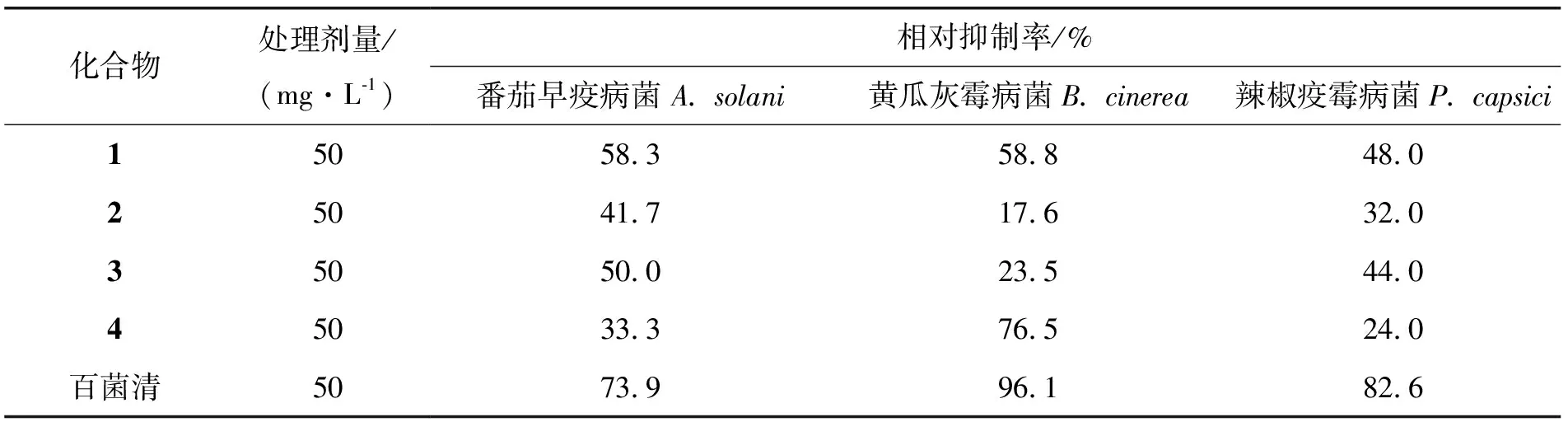
表1 抑菌活性
2.3 抗肿瘤活性实验结果
有文献报道[28],从香椿属分离得到具有清除自由基、抗炎及抗肿瘤活性的一系列化合物,本实验以此为参考,筛选了从毛红椿皮中分离得到的9个萜类化合物对人乳腺癌细胞株MDA-MB-231、人横纹肌瘤细胞株A-673及人红细胞白血病细胞株HEL的抑制增殖活性(化合物6因在其他生物活性实验已经耗尽,故无测试结果)。对抑制率大于60%的化合物进行IC50实验,结果表明,化合物2对人乳腺癌细胞株MDA-MB-231有一定抑制作用,其IC50值为12.9 μmol/L;化合物3对人乳腺癌细胞株MDA-MB-231、人横纹肌瘤细胞株A-673及人红细胞白血病细胞株HEL均有抑制增殖活性,化合物5对人红细胞白血病细胞株HEL有抑制作用,其IC50为8.4 μmol/L。化合物7对人横纹肌瘤细胞株A-673 有微弱的抑制作用。如表2、表3所示。
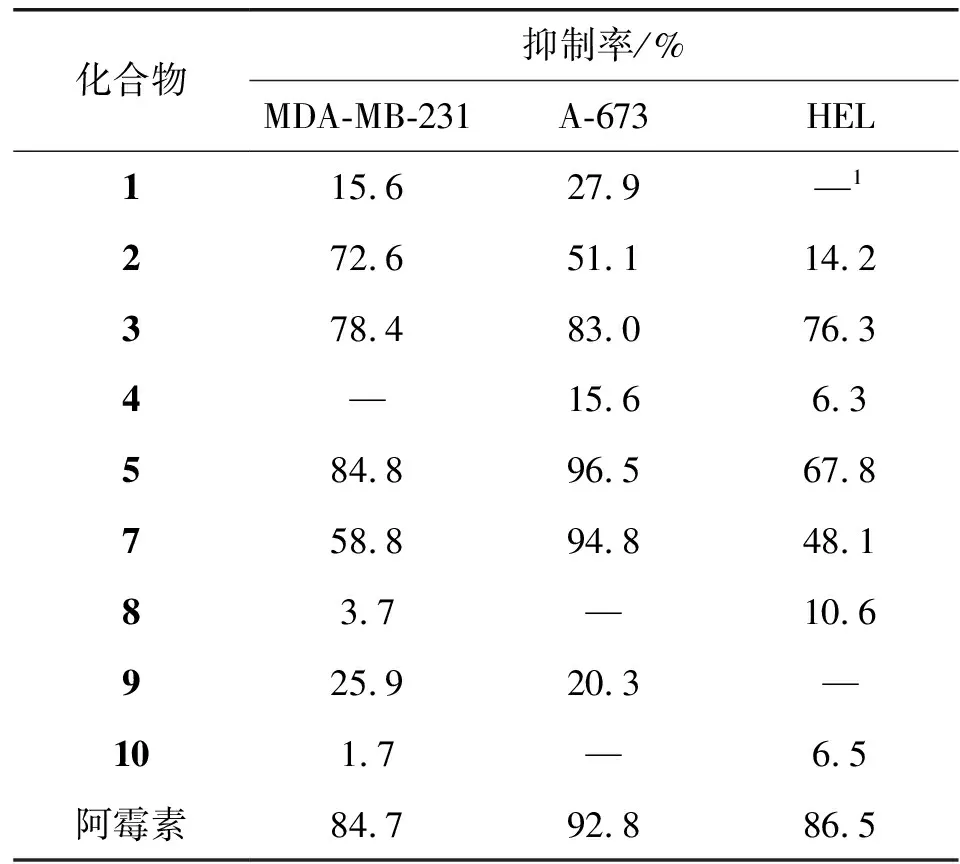
表2 化合物对癌细胞株MDA-MB-231、A-673、HEL的抑制作用(20 μmol/L)
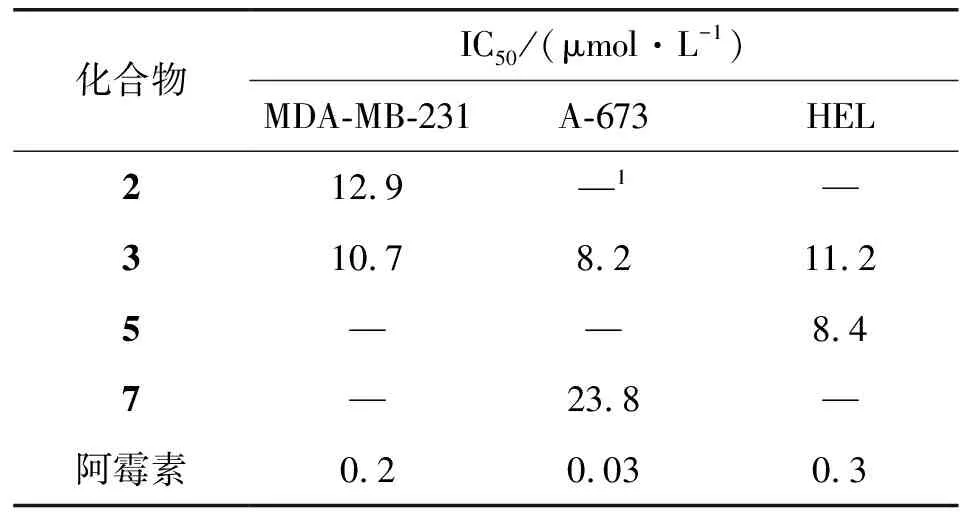
表3 化合物对癌细胞株MDA-MB-231、A-673、HEL的半数抑制率(IC50)
3 结论
香椿属植物是典型的药食两用植物,具有较高的安全性,对其进行全面深入研究不仅具有理论意义,还有着较好的经济和社会意义。该属主要包含香椿、红椿、紫椿和红花香椿4种植物,其余的大多为红椿变种。随着对香椿属植物化学成分研究的不断深入,已从中发现了不同类型的化合物,其主要成分为三萜,且多具有一定的生物活性[29]。本文对研究较少的毛红椿皮的化学成分及生物活性进行研究,从中获得20个单体化合物,包括7个三萜、3个二萜、2个甾体、3个酚酸、2个生物碱、2个脂肪酸以及1个黄酮,纯化分离实验表明,毛红椿皮中的化学成分虽然具有结构类型丰富的特点,但其中的化学成分主要为萜类。
对毛红椿皮中所分离得到的部分化合物进行抑菌活性和抗肿瘤活性实验。抑菌活性实验结果表明,其中1个三萜化合物对黄瓜灰霉病菌表现出较强的抑制作用,丰富了毛红椿中次生代谢产物的结构类型及其生物功能,并为其后续具有抗菌活性成分的挖掘提供了思路;抗肿瘤活性筛选结果表明,化合物2、3、5和7对人乳腺癌细胞株MDA-MB-23、人横纹肌瘤细胞株A-673及人红细胞白血病细胞株HEL有不同程度的抑制作用,特别是化合物3和5对3种肿瘤细胞株均显示出抑制活性。以上抗肿瘤活性结果在一定程度上为毛红椿后续的活性筛选提供新方法,也为毛红椿药材的临床药用提供了理论指导。

