饲喂过瘤胃褪黑素对荷斯坦奶牛乳中褪黑素与其合成前体和代谢产物含量、褪黑素合成酶活性及生产性能的影响
高伟星 马 慧 杨敏娜 彭述宇 曲嘉晨 曲永利**
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.北京首农畜牧发展有限公司,北京 100076)
提高产奶量是节约饲料成本的主要途径,同时提高乳品质同样能够为牧场带来收益。近年来,奶牛日单产略有所提升,但在产奶量提升的同时,会出现乳脂率、乳蛋白率下降及体细胞数(SCC)提高等问题[1]。
褪黑素(melatonin,MT)是一种由松果体分泌的来源于色氨酸的胺类神经内分泌激素[2],又称为美拉酮宁、抑黑素、松果胰素等,是动物、植物及微生物体自行产生的内源性物质[3],可作用于动物体全身的多个器官、组织和细胞,具有调节生物节律、改善睡眠、调控生殖活动、抗氧化、抗肿瘤及清除体内自由基等多种生理和药理作用[4-5]。MT作用甚广,将其科学应用于养牛生产中,不仅能为动物健康提供保障,而且能大大提升牧场效益。有研究表明,MT通过调节免疫细胞活性、促进免疫器官的生长[6],以此调节和提高动物体的免疫能力,即MT能够从多方面改善动物机体自身健康状态,增强机体免疫和抗氧化能力。因此,本试验通过在荷斯坦奶牛饲粮中添加过瘤胃褪黑素(RPMT),从而测定RPMT对荷斯坦奶牛乳中抗氧化和免疫指标及MT、MT合成前体物和代谢产物含量、MT合成酶活性及生产性能的影响。
1 材料与方法
1.1 试验材料
试验用RPMT采购于北京某公司,MT纯度>99.9%,RPMT包被浓度为5%。
1.2 试验设计及饲粮
本试验开展于北京首农畜牧发展有限公司北京奶牛中心良种场。试验选取1~4胎次、泌乳天数在200 d以内的健康荷斯坦奶牛32头,随机分为4组,分别为对照组与试验Ⅰ、Ⅱ和Ⅲ组,每组8头。各组荷斯坦奶牛平均泌乳天数如表1所示。对照组饲喂正常全混合日粮(TMR),试验组在对照组饲粮的基础上分别添加140、160、180 mg/(头·d) RPMT。试验期32 d,其中第0天为饲喂前1 d,第1~28天为饲喂期,第29~31天为停饲后3 d。饲粮组成及营养水平见表2。

表1 试验牛平均泌乳天数
1.3 饲养管理
试验期间,对照组与试验组动物均在同一圈舍饲养,定时(14:00)饲喂TMR,试验动物自由采食,自由饮水,在圈舍自由活动,每天定时清粪,保持圈舍的清洁。
1.4 样品采集与处理
1.4.1 乳样采集、保存与前处理
试验组与对照组每日进行3次机械挤奶,挤奶时间分别为06:00、13:00、21:00,用于生产性能测定体系(DHI)检测的乳样采集时间分别为第0、14、29天,每次按照DHI采样标准程序进行乳样采集后做好标记并置于4 ℃保鲜柜中保存,待全部采集完毕送至北京首农畜牧发展有限公司进行检测。
乳中抗氧化与免疫指标、MT、MT合成前体和代谢产物含量及MT合成酶活性检测的乳样采集时间分别为第0、3、7、14、28、29、31天,同时记录24 h总产奶量。每次按照挤奶操作流程进行乳样采集后做好标记置于-20 ℃冰箱冻存待测。
1.4.2 测定方法
乳成分分析仪器为乳成分SCC联机测定仪(YQ1-57)。乳中MT、5-羟色胺(5-HT)、6-羟基-褪黑素(6-OH-MT)含量及5-羟色胺-N-乙酰基转移酶(SNAT)、咖啡酸-O-甲基转移酶(COMT)及N-乙酰基-5-羟色胺-甲基转移酶(ASMT)活性通过酶联免疫吸附法进行测定[7]。乳中谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、吲哚胺2,3-双加氧酶(IDO)活性通过比色法进行测定。以上指标均为北京金海科隅生物科技发展有限公司测定,试剂厂家为北京金海科隅生物科技发展有限公司;仪器厂家为上海科华生物工程股份有限公司;仪器型号为ST-360酶标仪。
1.5 统计分析
试验数据采用SPSS 23.0中Mixed混合模型统计,固定效应有试验处理(组别)、采样时间(时间)及二者之间的交互作用。方差结构采用复合对称性协方差(CS),P<0.05为差异显著,P<0.01为差异极显著,采用Duncan氏法进行多重比较。
2 结果与分析
2.1 饲喂RPMT对荷斯坦奶牛生产性能的影响
2.1.1 饲喂RPMT对荷斯坦奶牛乳品质的影响
由表3可知,在06:00时,试验Ⅰ组乳脂率与对照组、试验Ⅲ组相比分别提高了22.19%(P<0.05)和14.11%(P<0.05),与试验Ⅱ组差异不显著(P>0.05),试验Ⅱ组与对照组相比提高了19.94%(P<0.05);试验Ⅱ、Ⅲ组乳中SCC与试验Ⅰ组相比分别降低了88.73%(P<0.05)和84.36%(P<0.05);各试验组与对照组间乳蛋白率、乳糖率均无显著差异(P>0.05)。时间对乳脂率、乳蛋白率、SCC均无显著影响(P>0.05),但对乳糖率具有极显著影响(P<0.01)。同时组别与时间对乳脂率、乳蛋白率、乳糖率及SCC均无显著交互效应(P>0.05)。
在13:00时,试验Ⅱ、Ⅲ组乳脂率与对照组相比分别提高22.56%(P<0.05)和15.32%(P<0.05),乳糖率与对照组相比分别提高8.79%(P<0.05)和9.42%(P<0.05),SCC与对照组相比分别降低了86.29%(P<0.05)和83.40%(P<0.05),而试验Ⅰ组乳脂率、乳蛋白率、乳糖率及SCC与对照组及试验Ⅱ、Ⅲ组相比均无显著差异(P>0.05)。时间对乳脂率具有显著影响(P<0.05),但对乳蛋白率、乳糖率及SCC均无显著影响(P>0.05)。组别与时间对乳糖率具有显著交互效应(P<0.05),而对乳脂率、乳蛋白率及SCC无显著交互效应(P>0.05)。
在21:00时,试验Ⅰ、Ⅱ、Ⅲ组乳糖率与对照组相比,分别提高了6.38%(P<0.05)、7.45%(P<0.05)和9.15%(P<0.05);试验Ⅱ、Ⅲ组乳中SCC与试验Ⅰ组相比分别降低了79.15%(P<0.05)和74.49%(P<0.05),各试验组与对照组间乳脂率、乳蛋白率均无显著差异(P>0.05)。时间对乳脂率、乳蛋白率、乳糖率及SCC均无显著影响(P>0.05)。同时组别与时间对上述指标也均无显著交互效应(P>0.05)。
2.1.2 饲喂RPMT对荷斯坦奶牛产奶量的影响
由表4可知,在06:00时,试验Ⅲ组产奶量与对照组及试验Ⅰ、Ⅱ组相比分别提高了27.59%(P<0.01)、10.54%(P<0.05)和19.02%(P<0.01),试验Ⅰ组产奶量与对照组相比提高了15.42%(P<0.01)。时间对产奶量无显著影响(P>0.05),组别与时间也无显著交互效应(P>0.05)。
在13:00时,试验Ⅲ组产奶量对照组及试验Ⅰ、Ⅱ组相比分别提高了23.69%(P<0.01)、17.31%(P<0.01)和22.91%(P<0.01),试验Ⅰ、Ⅱ组与对照组间产奶量均无显著差异(P>0.05)。时间对产奶量无显著影响(P>0.05),组别与时间也无显著交互效应(P>0.05)。
在21:00时,试验Ⅲ组产奶量与对照组及试验Ⅰ、Ⅱ组相比分别提高了22.44%(P<0.01)、16.24%(P<0.01)和20.34%(P<0.01),同时,试验Ⅰ、Ⅱ组与对照组间产奶量也均无显著差异(P>0.05)。时间对产奶量无显著影响(P>0.05),组别与时间也无显著交互效应(P>0.05)。
2.2 饲喂RPMT对荷斯坦奶牛乳中GSH-Px、SOD、IDO活性的影响
由表5可知,在06:00时,试验Ⅰ、Ⅱ、Ⅲ组乳中GSH-Px活性与对照组相比分别提高了7.58%(P<0.01)、6.12%(P<0.01)和6.41%(P<0.01),乳中SOD活性与对照组相比分别提高了17.08%(P<0.01)、17.00%(P<0.01)和16.84%(P<0.01);各试验组间乳中GSH-Px、SOD活性均无显著差异(P>0.05),且各试验组与对照组乳中IDO活性均无显著差异(P>0.05)。时间对乳中GSH-Px、SOD活性均具有极显著影响(P<0.01),但对乳中IDO活性无显著影响(P>0.05)。组别与时间对乳中GSH-Px、SOD、IDO活性均无显著交互效应(P>0.05)。
在13:00时,试验Ⅰ、Ⅱ、Ⅲ组乳中GSH-Px活性与对照组相比分别提高了7.82%(P<0.01)、3.21%(P<0.05)和5.27%(P<0.01),同时试验Ⅰ组与试验Ⅱ组相比提高了4.48%(P<0.01),试验Ⅰ、Ⅱ、Ⅲ组乳中SOD活性与对照组相比分别提高了23.62%(P<0.01)、17.56%(P<0.01)和21.20%(P<0.01),各试验组间乳中SOD活性均无显著差异(P>0.05),同时,各试验组与对照组乳中IDO活性均无显著差异(P>0.05)。时间对乳中GSH-Px、SOD活性均具有极显著影响(P<0.01),但对乳中IDO活性无显著影响(P>0.05)。组别与时间对乳中SOD、GSH-Px、IDO活性均无显著交互效应(P>0.05)。
在21:00时,试验Ⅰ、Ⅱ、Ⅲ组乳中GSH-Px活性与对照组相比分别提高了9.47%(P<0.01)、5.51%(P<0.01)和7.79%(P<0.01),同时,试验Ⅰ组与试验Ⅱ组相比提高了3.75%(P<0.05),试验Ⅰ、Ⅱ、Ⅲ组乳中SOD活性与对照组相比分别提高了23.98%(P<0.01)、18.30%(P<0.01)和20.60%(P<0.01),试验组间乳中SOD活性均无显著差异(P>0.05),试验Ⅲ组乳中IDO活性与对照组、试验Ⅰ组相比,分别提高了5.13%(P<0.05)和6.04%(P<0.01),其他各组间均无显著差异(P>0.05)。时间对乳中GSH-Px、SOD及IDO活性均具有极显著影响(P<0.01)。组别与时间对乳中IDO活性也具有极显著交互效应(P<0.01),但对乳中GSH-Px、SOD活性无显著交互效应(P>0.05)。
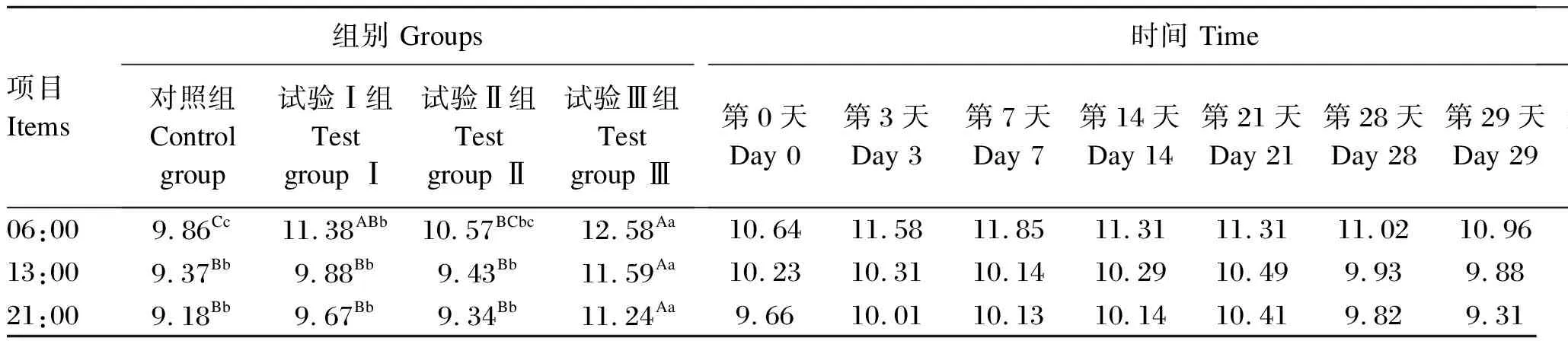
表4 饲喂RPMT对荷斯坦奶牛产奶量的影响
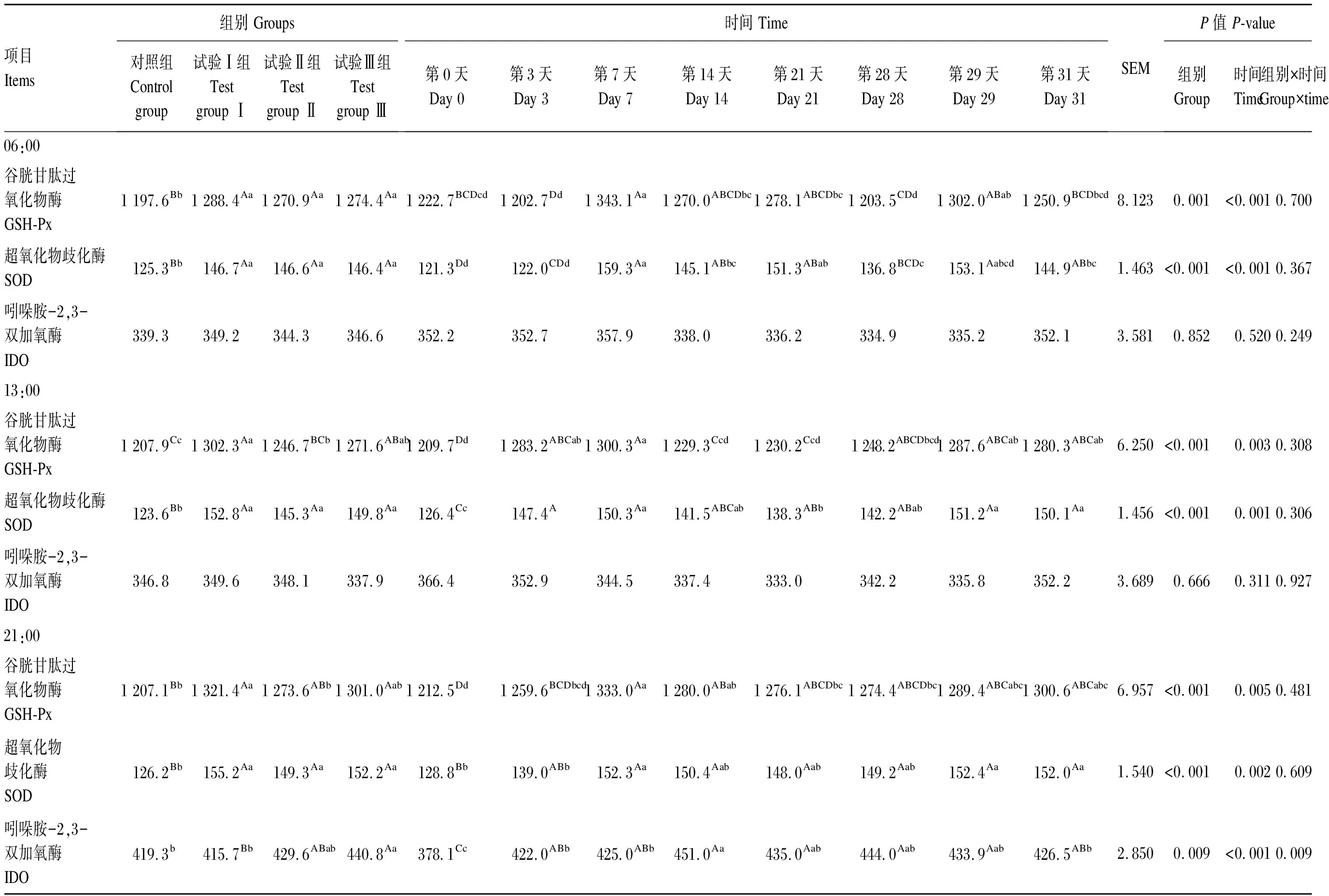
表5 饲喂RPMT对荷斯坦奶牛乳中GSH-Px、SOD、IDO活性的影响
2.3 饲喂RPMT对荷斯坦奶牛乳中MT、5-HT、6-OH-MT含量的影响
由表6可知,在06:00时与13:00时,除06:00时试验Ⅰ组乳中5-HT含量与对照组相比提高6.96%(P<0.05)外,对照组与各试验组间乳中MT、5-HT、6-OH-MT含量均无显著差异(P>0.05)。在06:00时,时间对乳中6-OH-MT含量具有极显著影响(P<0.01),而乳中MT、5-HT含量在06:00与13:00时均无显著影响(P>0.05),且组别与时间对乳中MT、5-HT、6-OH-MT含量均无显著交互效应(P>0.05)。
在21:00时,试验Ⅰ、Ⅱ、Ⅲ组乳中MT含量与对照组相比分别提高了34.69%(P<0.01)、35.70%(P<0.01)和36.70%(P<0.01),乳中5-HT含量与对照组相比分别提高了21.64%(P<0.01)、23.57%(P<0.01)和19.82%(P<0.01),乳中6-OH-MT含量与对照组相比分别提高了25.50%(P<0.01)、20.98%(P<0.01)和23.69%(P<0.01),各试验组间乳中MT、5-HT、6-OH-MT含量均无显著差异(P>0.05)。时间对乳中MT、5-HT、6-OH-MT含量均具有极显著影响(P<0.01)。组别与时间对乳中MT、5-HT含量同样具有极显著交互效应(P<0.01),对乳中6-OH-MT含量具有显著交互效应(P<0.05)。
2.4 饲喂RPMT对荷斯坦奶牛乳中MT合成酶活性的影响
由表7可知,在06:00与13:00时,各试验组与对照组乳中SNAT、COMT、ASMT活性均无显著差异(P>0.05)。时间对乳中SNAT活性具有显著影响(P<0.05),对乳中COMT、ASMT活性影响不显著(P>0.05)。组别与时间对乳中SNAT、COMT、ASMT活性均无显著交互效应(P>0.05)。
在21:00时,试验Ⅰ、Ⅱ、Ⅲ组乳中SNAT活性与对照组相比分别提高了31.15%(P<0.01)、28.42%(P<0.01)和30.33%(P<0.01),乳中COMT活性与对照组相比分别提高了28.04%(P<0.01)、28.35%(P<0.01)和28.82%(P<0.01),乳中ASMT活性与对照组相比分别提高了28.19%(P<0.01)、28.19%(P<0.01)和32.16%(P<0.01),各试验组间乳中SNAT、COMT、ASMT活性均无显著差异(P>0.05)。时间对乳中SNAT、COMT、ASMT活性具有极显著影响(P<0.01)。组别与时间对乳中SNAT、COMT、ASMT活性均具有显著交互效应(P<0.05)。
3 讨 论
3.1 饲喂RPMT对荷斯坦奶牛生产性能的影响
有研究表明,MT作为一种抗氧化和抗炎分子[8],具有应激诱导作用,从单细胞生物到哺乳动物均已得到了证实[9]。MT对促炎因子具有良好的抑制效果[10],乳房炎患病率增加,随之会造成乳中SCC增高。研究显示,饲喂MT能够显著降低SCC[11]。Yao等[12]研究结果显示,饲喂MT第7天,乳中SCC开始下降且14 d后乳中SCC极显著降低,饲喂21 d后,结果与饲喂14 d相同,在停饲后,SCC持续下降5~7 d,同时40 mg MT组乳中乳脂率、乳蛋白率均显著增加且乳糖率在饲喂14 d后40 mg MT组显著低于对照组。
Wu等[13]挑选3个不同牧场且分别在不同季节及各个年龄段及不同泌乳时期的健康荷斯坦奶牛进行试验,于10:00将MT稀释液皮下注射9.3 mg/d,连续4 d并在MT注射前和注射后15 d,收集鲜牛奶进行DHI分析,结果表明,MT通过显著抑制牛奶体细胞评分,增加乳糖和乳蛋白含量来提高牛奶的营养价值。
本试验结果显示,试验组乳中乳糖率、乳脂率增加,SCC降低,乳蛋白率并未有所增加,且与对照组并无显著差异,探究其可能原因是动物体内可自行合成MT[14],外源MT的补充导致荷斯坦奶牛机体内MT过剩,仅有少量MT通过瘤胃而被小肠吸收,从而未能对乳中乳蛋白率产生积极促进效果。本试验中,随着RPMT饲喂量增加,产奶量显著高于对照组,该结果与Avilés等[15]的研究结果相同,即饲喂RPMT能够显著增加荷斯坦奶牛产奶量,但对于乳糖率和乳脂率来说,添加适量RPMT且在饲喂有效时间内能够具有显著改善效果。

表6 饲喂RPMT对荷斯坦奶牛乳中MT、5-HT、6-OH-MT含量的影响

表7 饲喂RPMT对荷斯坦奶牛乳中SNAT、COMT、ASM活性的影响
3.2 饲喂RPMT对荷斯坦奶牛乳中抗氧化与免疫指标的影响
MT是一种生物抗氧化剂、自由基清除剂[6,16],已被广泛用于预防妊娠并发症,同时,MT能够使血清和胎盘MT含量、母胎氧化还原状态和胎盘炎症反应升高[17]。有研究表明,MT具有多种生物学效应,除了抗氧化活性,MT还具有许多功能,包括昼夜节律调节、增强免疫、生殖调节、促进睡眠和抗炎功能等[18-20]。MT可以安全地用于热应激母羊,以提高母羊在妊娠期间的生育率和氧化还原状态[21]。此外,MT可能在产前应激的后代中发挥作用,可能是通过氧化还原相关机制调节促炎细胞因子[22]。作为一种抗氧化分子,MT有2种作用方式:第1种,当它在血液中发现低含量时,它是活性氧(ROS)的清除剂;第2种,当它的含量升高时,它诱导GSH-Px等抗氧化基因的表达,从而导致高水平的GSH-Px[23]。SOD作为机体抗氧化酶系统最重要的酶之一,可以有效清除氧自由基,降低氧化作用[24],与此同时,SOD与IDO同样作为机体免疫调节酶,是体内免疫调节剂,其活性表达在机体免疫调控方面仍发挥着重要作用[25]。IDO是肝脏外唯一催化色氨酸沿犬尿氨酸途径分解代谢的限速酶,可用于调节自身免疫性[26],还具有增强炎症组织自我修复作用,同时对组织破坏也有限制作用[27]。
本试验结果表明,饲喂RPMT对荷斯坦奶牛乳中GSH-Px、SOD和IDO活性均有促进作用。同时,饲喂RPMT对于生鲜乳抗氧化性(GSH-Px、SOD活性)的影响会随着RPMT饲喂量和饲喂时长的增加而增加,在饲喂第7天效果最为显著,且能够持续至停饲后一定时长,但对于机体免疫调节指标IDO活性,仅在21:00时表现出差异性,探究其可能原因;IDO活性与机体MT合成表现出同步性,同样在饲喂第7天乳中MT含量升至最大值,而乳中IDO活性与MT合成是否有关,具体原因还需进一步探究。
3.3 饲喂RPMT对荷斯坦奶牛乳中MT、MT合成前体、MT代谢产物含量及MT合成酶活性的影响
MT的合成途径在不同的物种中是相当复杂的。例如,细菌、真菌、植物和动物都有一些共同的合成反应,但也有其他完全不同的反应发生在MT的合成途径中[28],这些差异包括起始材料、所涉及的酶、调节因子和速率限制等,在动物合成途径中,色氨酸是MT起始物质[29],因此,色氨酸的可用性限制了动物体内MT的生理水平[30]。色氨酸首先被羟基化形成5-羟色氨酸。这一步骤是由色氨酸羟化酶(TPH)催化的,动物中存在2个TPH基因(TPH1和TPH2)并产生相同的产物[30],TPH1和TPH2具有相似的功能,然而,它们在不同的组织中的表达水平不同,TPH2主要表达于脑干中,而TPH1广泛表达于松果体等器官和组织中。尽管TPH1的表达表现出与MT的产生有一定对应关系的昼夜节律,但它并不被认为是动物MT合成的限速酶[31]。其次是5-羟色氨酸脱羧形成5-羟色氨胺,以SNAT或芳酰烷基胺N-乙酰羟色胺(N-乙酰羟色胺)以及乙酰辅酶A(ANAT)作为辅助因子进行催化形成N-乙酰5-羟色胺,SNAT/ANAT/ASMT被认为是MT合成的限速酶[32-33],因为它在松果体中的表达或活动的昼夜节律与大多数被测试动物的血清MT含量的昼夜节律完全匹配[33],最后则是N-乙酰5-羟色胺O甲基化,由ASMT催化形成MT[29,34],并在动物体内代谢形成6-OH-MT[35],与此同时,有研究证明,COMT能够参与后2步MT的合成[35],且COMT在参与MT的合成与ASMT有同样重要的作用[36-37]。
本试验研究结果显示,乳中MT含量会随着RPMT饲喂时间增加而呈现先增加后降低的趋势,同时,在饲喂第7天时乳中MT含量呈现最大值,该结果与杨明辉等[38]的研究结果相同。5-HT含量在饲喂第3天时呈现最大值,而6-OH-MT含量在饲喂第7天时呈现出最大值。随着RPMT饲喂量的增加,乳中MT、5-HT与6-OH-MT含量同样增加,且试验组在21:00时乳中MT、5-HT与6-OH-MT含量极显著高于对照组,其原因可能在于采样时间距离投喂时间(14:00)最近,有研究显示,不同外源MT(肌肉注射与皮下埋值)能够使机体内MT含量在短时间内达到最大值[38],因此本试验结果可能与此原因有关;本试验中对照组在21:00时乳中MT含量同样高于06:00时,因此,原因也可能是MT合成与奶牛活动的昼夜节律性有关[39]。
本试验乳中MT合成酶活性随时间变化均与MT含量随时间变化趋势相同,有研究报道,在机体内合成MT时,ASMT比SNAT发挥更加重要的作用[40],认为5-HT可能首先被ASMT甲基化形成5-甲氧基色胺(5-甲氧基羟色胺),因为ASMT对5-HT的亲和力高于SNAT的亲和力[34],而该试验结果显示,在21:00时乳中MT含量与对照组表现出差异性时,ASMT活性同样表现出差异性,因此,该试验结果同样表明,在参与MT合成时,随着MT含量增加,乳中ASMT活性同样增强,预示ASMT发挥着更重要的作用。同时,饲喂RPMT能够显著提高21:00时乳中MT含量,且MT合成前体物和代谢产物含量会随着MT合成量变化而变化。
4 结 论
① 饲喂RPMT能够显著增加荷斯坦奶牛乳中乳脂率、乳糖率与产奶量,降低SCC,同时增强生鲜乳的抗氧化性能。
② 饲喂RPMT能够增加MT合成前体及代谢物含量,且MT合成量增加,代谢量同样增加,即MT合成与代谢呈现同步性。与此同时,在参与MT合成过程中,ASMT相比SNAT和COMT作用效果更加显著。

