热应激对肉牛血清生化指标、瘤胃发酵参数及微生物区系的影响
杨梓曼 尚相龙 陈 豪 兰 剑 聂春桃 陈 环 瞿明仁 宋小珍
(江西农业大学,江西省动物营养重点实验室/营养饲料开发工程研究中心,南昌 330045)
在动物生产中,机体因各种异常刺激而出现的非特异性防御反应称为应激反应;引起应激反应的刺激源有很多,如环境、饲养管理、运输、微生物等,其中以环境刺激最为广泛且难以避免[1]。我国南方大部分地区夏季温度高,持续时间长,且潮湿多雨,这种环境极易诱发肉牛出现热应激反应,导致其食欲下降、养分消化利用率降低、免疫力低下,大大降低了肉牛的生长性能和养殖效益,严重制约了肉牛产业的发展[2]。关于热应激对牛生产的影响,国内外均做了大量的研究。蔡庆双[3]研究表明,肉牛在热应激状态下,机体热平衡被破坏,产热大于散热,体内热量难以散发,从而导致体温升高、呼吸加速等生理变化。另有报道显示,热应激可引起机体甲状腺功能减退,使血液中促甲状腺激素(TSH)、甲状腺素(T4)和三碘甲状腺原氨酸(T3)含量分别比适温条件下肉牛降低了40.0%、45.4%和25.9%[4]。Kim等[5]发现,热应激条件下,肉牛生理异常,心率和体温、血液中皮质醇(COR)和热休克蛋白70(HSP70)含量均显著升高。Brien等[6]观察发现,夏季处于热应激状态的杂交牛,其粗蛋白质、粗脂肪、钙及磷的表观消化率显著低于非热应激状态。
瘤胃是反刍动物消化养分的主要场所,瘤胃微生物能将饲粮中大部分养分降解生成挥发性脂肪酸(VFA)和氨供机体代谢和利用。对反刍动物而言,维持瘤胃内环境稳态十分重要,一旦失衡便会直接导致瘤胃发酵功能紊乱,影响瘤胃健康[7]。尽管维持瘤胃内环境稳态对于肉牛生产十分重要,但是目前国内外有关热应激对肉牛的影响主要集中在生长性能、生理生化等表观指标上。而关于热应激对肉牛瘤胃发酵功能的影响研究较少,从瘤胃微生物多样性的角度出发研究其影响机理的报道则更少。因此,本试验选择江西省本地黄牛品种——锦江牛作为研究对象,探讨热应激对肉牛血清生化指标、瘤胃发酵参数及微生物区系的影响,以期从瘤胃微生态的变化揭示热应激影响肉牛生长性能的机制,从而为后期探索缓解我国南方肉牛热应激的合理措施提供理论参考。
1 材料与方法
1.1 试验动物及分组设计
在江西高安裕丰农牧业有限公司选择体况、体重[(330±20) kg]相近、18月龄左右、饲养管理一致的健康锦江牛20头,按照饲养时间的不同随机分为常温组和高温组,每组10头牛,单栏饲养。常温组饲养于春季适温环境(2020年4—5月);高温组饲养于夏季高温高湿环境(2020年7—8月)。试验期包括预试期10 d,正试期30 d。
1.2 饲养管理及基础饲粮
所有试验牛均采用舍饲饲养,并饲喂相同的基础饲粮,每日06:00、16:00各饲喂1次,先粗后精。自由饮水,每天清扫圈舍,保持牛舍清洁卫生。其他管理方法同牛场。
试验牛基础饲粮配方参照《肉牛饲养标准》(NY/T 815—2004),按肉牛体重300 kg、日增重0.5 kg的营养需求设计,饲粮精粗比为4∶6,其组成及营养水平如表1所示。

表1 基础饲粮组成及营养水平(风干基础)
1.3 检测指标
1.3.1 牛舍环境的温湿指数(THI)
在牛舍距离地面1.5 m处的位置悬挂3个温湿度计,避免动物接触。记录试验期内每日08:00、14:00和20:00牛舍内的温度和相对湿度,参照Berman[8]的方法,计算牛舍THI。
THI=td-(0.55-0.55RH)×(td-58)。
式中:RH为相对湿度;td为华氏温度。其中td=T×9/5+32,T为摄氏温度。
1.3.2 体温、呼吸频率
体温:在正试期间每隔10 d测定每头试验牛的肛温,计算平均值。
呼吸频率:在正试期间,每隔10 d测定每头试验牛静卧时每分钟腹部的起伏次数,计算平均值。
1.3.3 血清生化指标
在正试期第30天晨饲前,每组选6头体重相近的试验牛,绑定后进行颈静脉采血。使用非抗凝真空采血管采集30 mL血液,低速离心机3 000 r/min离心15 min,分离血清并于-80 ℃保存待测。
血清中总抗氧化能力(T-AOC)、谷胱甘肽过氧化物酶(GSH-Px)、总超氧化物歧化酶(T-SOD)活性及丙二醛(MDA)含量的测定采用比色法,参照试剂盒说明书中的推荐方法进行试验操作,样品批量测定前要先设计好预试验检测方法的准确性;血清中免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)含量的测定采用酶联免疫吸附法测定,具体测定方法参照说明书进行。以上所用试剂盒均购于南京建成生物工程研究所。
1.3.4 瘤胃发酵参数及微生物区系的测定与分析
试验结束后,每组选4头试验牛屠宰,立即收集瘤胃液,4层纱布过滤后,迅速测定pH并于-80 ℃冰箱保存,分别用于分析瘤胃发酵参数及微生物区系。
瘤胃pH使用S-320型酸度计测定;氨态氮(NH3-N)浓度参考冯宗慈等[9]的方法进行测定;菌体蛋白浓度(MCP)浓度参考王敬尧[10]的考马斯亮蓝法测定;VFA含量采用气相色谱仪(日本岛津GC-2014)测定,参考曹庆云等[11]的峰面积外标法。气相色谱测定条件如下:色谱柱为Nukol毛细管柱;柱温190 ℃;FID检测器温度250 ℃;载气为高纯氮气(N2),流速为75 mL/min;燃气为氢气(H2),流速70 mL/min;助燃气为空气,流量50 mL/min;进样量1 μL。
对所采集的瘤胃液样品进行16S rRNA基因测序,测序工作由上海美吉生物医药科技有限公司完成。通过MiSeq PE300测序平台进行微生物多样性检测,分析在门水平和属水平下的群落物种组成及丰度。以提取的样品总DNA为模板,对细菌16S rRNA V3~V4高变区两侧的引物进行PCR扩增,所采用的细菌通用引物序列为338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′) PCR。
1.4 数据统计分析
试验数据采用SPSS 17.0统计软件进行独立样本t检验分析,以P<0.05为差异显著性评判标准,P<0.01为差异极显著性评判标准。
2 结果与分析
2.1 热应激对肉牛生理指标的影响
由表2可知,与常温组相比,高温组的环境温度、环境相对湿度均极显著升高(P<0.01),呼吸频率显著升高(P<0.05),体温有升高的趋势(P=0.088)。常温组平均THI为69.86,高温组的平均THI为83.40,2组之间差异极显著(P<0.01)。

表2 不同环境条件下的THI和肉牛体温、呼吸频率
2.2 热应激对肉牛血清生化指标的影响
由表3可知,与常温组相比,高温组的血清T-AOC显著降低(P<0.05),IgA含量与GSH-Px活性均极显著降低(P<0.01)。其他指标组间均无显著差异(P>0.05)。
2.3 热应激对肉牛瘤胃发酵参数的影响
由表4可知,与常温组相比,高温组瘤胃NH3-N浓度显著升高(P<0.05),总挥发性脂肪酸(TVFA)含量极显著降低(P<0.01)。其他指标组间均无显著差异(P>0.05)。
2.4 热应激对肉牛瘤胃微生物区系的影响
2.4.1 瘤胃菌群的Venn图
如图1所示,常温组的操作分类单元(OTU)总数量为1 570个,高温组的OTU总数量为1 599个,其中包含的2组共享的OTU数量为1 362个,占OTU总数量的75.37%。常温组独有的OTU数量为208个,占总OTU数量的11.51%,高温组独有的OTU数量为237个,占总OTU数量的13.11%。

表3 热应激对肉牛血清生化指标的影响
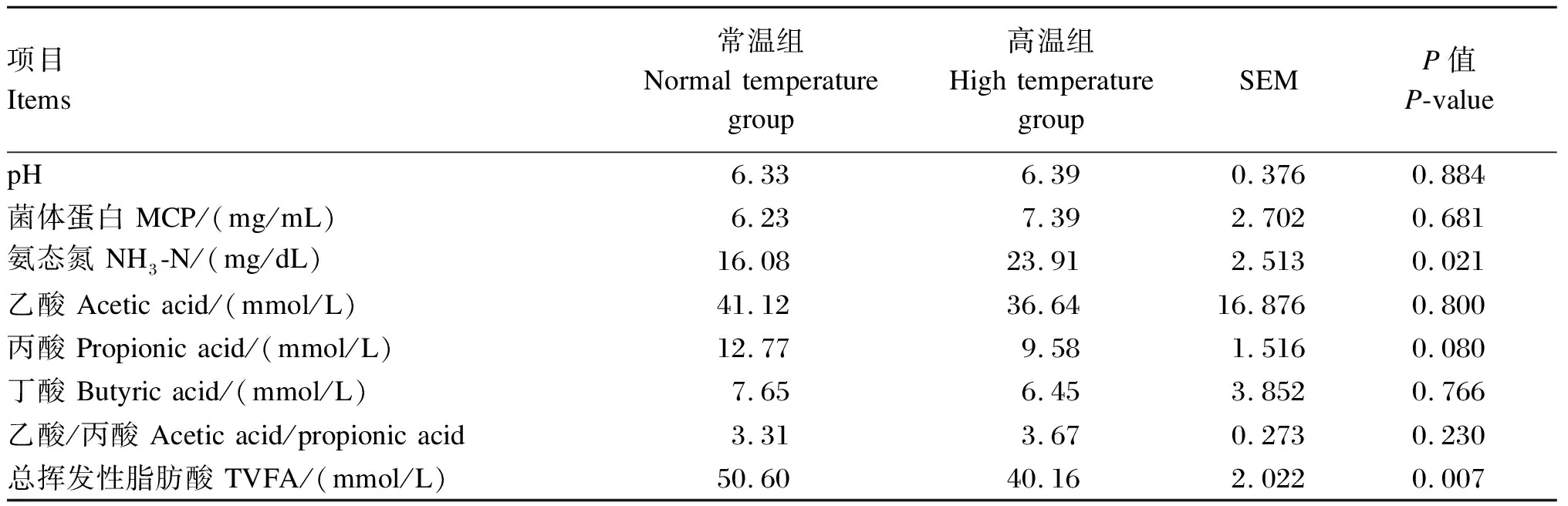
表4 热应激对肉牛瘤胃发酵参数的影响

NT:常温组 normal temperature group; HT:高温组 high temperature group。
2.4.2 瘤胃菌群α多样性指数
由表5可知,各样本覆盖指数达到0.99以上,可准确地反映瘤胃中微生物群落的种类和结构多样性。与常温组相比,高温组瘤胃液微生物的Shannon、Simpson、Ace、Chao1、覆盖指数均无显著差异(P>0.05)。
2.4.3 瘤胃菌群在门水平和属水平上的组成和相对丰度
由图2和表6可知,在门水平上,常温组和高温组瘤胃液的优势菌门均为拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes),这2个菌门占总细菌比例的90%以上。与常温组相比,高温组的放线菌门(Actinobacteriota)的相对丰度均显著升高(P<0.05),脱硫杆菌门(Desulfobacterota)和Patescibacteria的相对丰度极显著升高(P<0.01);其他菌门相对丰度组间无显著差异(P>0.05)。
由图3和表7可知,在属水平上,常温组和高温组的优势菌属均为普雷沃氏菌属(Prevotella)。与常温组相比,高温组的克里斯滕森菌科_R-7群(Christensenellaceae_R-7_group)、NK4A214_group和普雷沃氏菌科UCG-003(Prevotellaceae UCG-003)的相对丰度显著降低(P<0.05);其他菌属相对丰度组间无显著差异(P>0.05)。
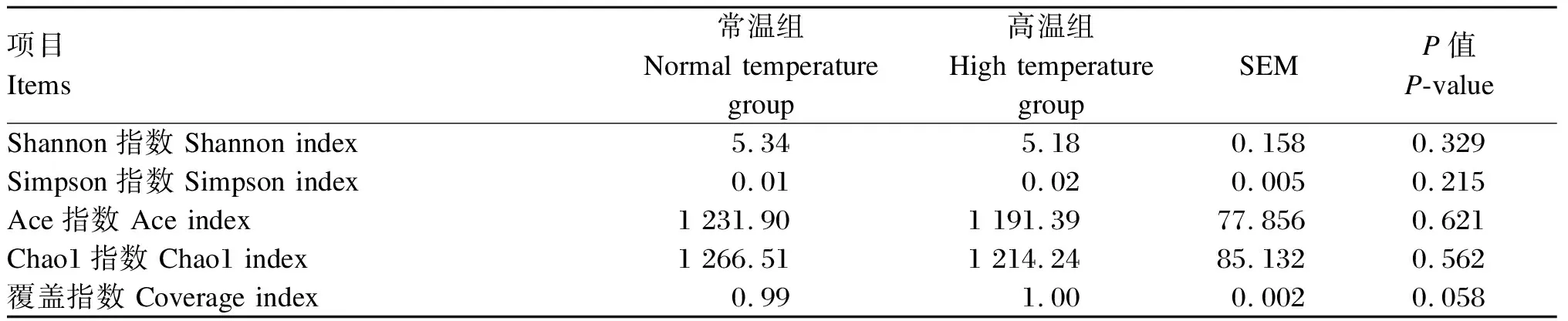
表5 热应激对肉牛瘤胃菌群丰富度和多样性的影响

Firmicutes:厚壁菌门; Bacteroidetes:拟杆菌门; Actinobacteriota:放线菌门; Desulfobacterota:脱硫杆菌门;Proteobacteria:变形菌门; Synergistetes:互养菌门; Unclassified_k_norank_d_Bacteria:未分类细菌; Others:其他。
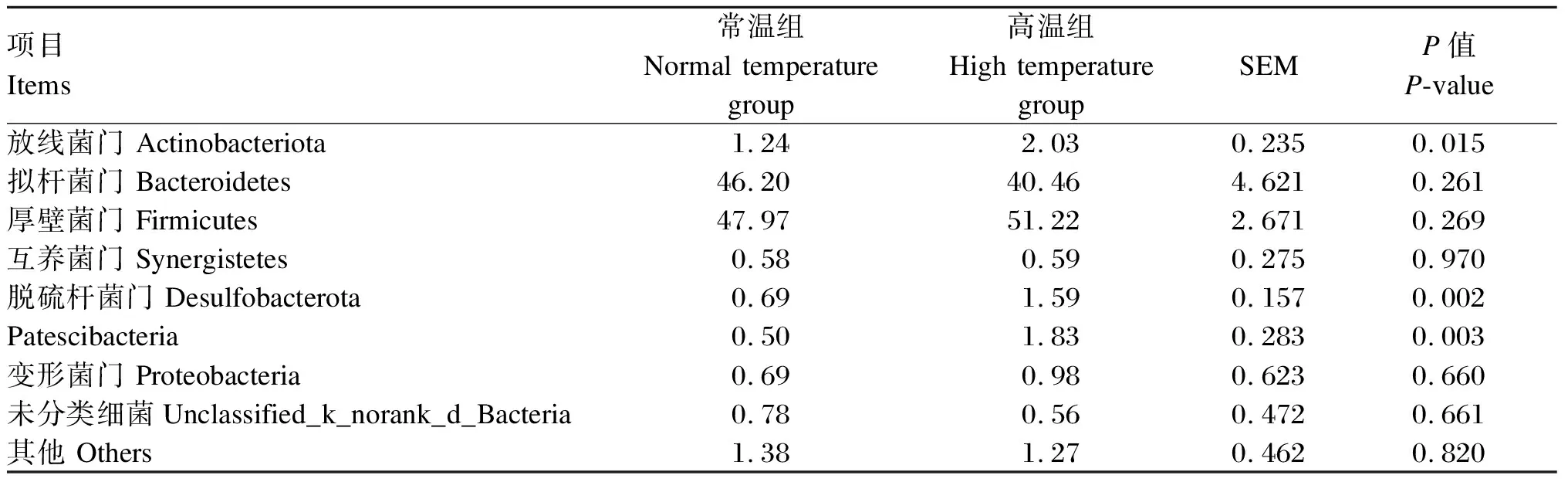
表6 热应激对肉牛瘤胃菌群门水平相对丰度的影响
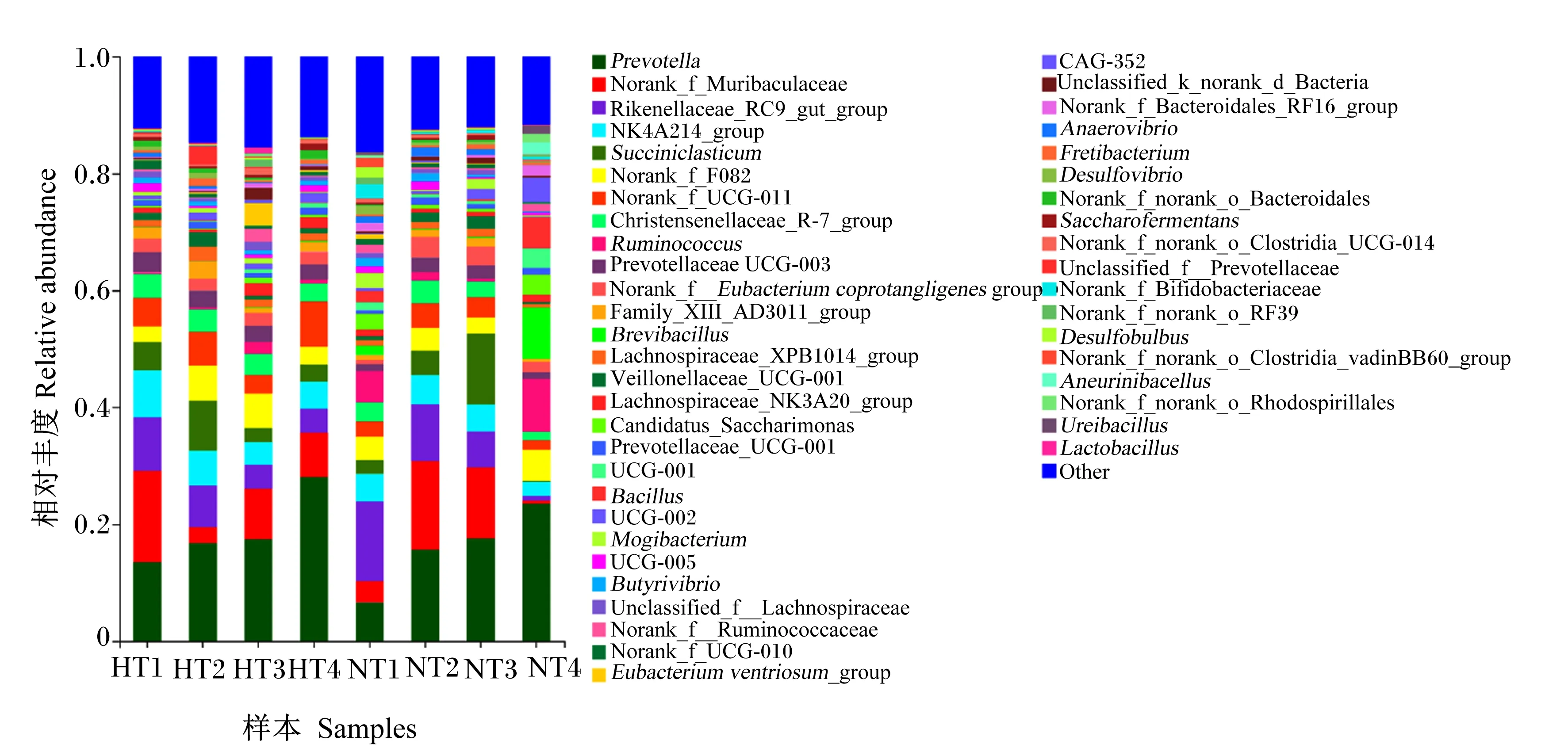
Prevotella:普雷沃氏菌属; Rikenellaceae_RC9_gut_group:理研菌科_RC9肠道群; Succiniclasticum:解琥珀酸菌属; Christensenellaceae_R-7_group:克里斯滕森菌科_R-7群; Ruminococcus:瘤胃球菌属; Prevotellaceae UCG-003:普雷沃氏菌科UCG-003; Norank_f_Eubacterium coprotangligenes group:未明确产粪甾醇真细菌群; Brevibacillus:短芽孢杆菌属; Lachnospiraceae_XPB1014_group:毛螺菌科XPB1014群; Veillonellaceae_UCG-001:韦荣氏菌科_UCG-001; Lachnospiraceae_NK3A20_group:毛螺菌科NK3A20群; Prevotellaceae_UCG-001:普雷沃氏菌科UCG-001;Bacillus:芽孢杆菌属; Butyrivibrio: 丁酸弧菌属; Unclassified_f_Lachnospiraceae:未明确毛螺菌科; Norank_f_Ruminococcaceae:未明确瘤胃球菌科;Eubacterium ventriosum_group:腹真杆菌群; Anaerovibrio:厌氧弧菌属; Desulfovibrio:脱硫弧菌属; Uunclassified_f_Prevotellaceae:未明确普雷沃氏菌科; Norank_f_Bifidobacteriaceae:未明确双歧杆菌科; Saccharofermentans:产乙酸糖发酵菌属; Desulfobulbus:脱硫球茎菌属; Ureibacillus:尿毒杆菌属; Lactobacillus:乳酸菌属; Other:其他。

表7 热应激对肉牛瘤胃菌群属水平相对丰度的影响
3 讨 论
3.1 热应激对肉牛生理指标的影响
热应激是指动物在受到高温、高湿、气流等外界刺激下出现的应激反应,引起热应激的刺激源主要为环境温度和湿度。目前,生产上常用THI来评价动物热应激程度,当72≤THI≤79,为轻度热应激;当79
3.2 热应激对肉牛血清生化指标的影响
正常情况下,氧自由基在机体内含量保持动态平衡,但受到外界刺激后,体内氧自由基大量产生,过量的氧自由基无法及时被清除,则可能造成细胞氧化损伤[15]。在本研究中,热应激状态下肉牛血清中T-AOC、GSH-Px活性显著降低。T-AOC和GSH-Px是体内重要的抗氧化酶,可反映机体对氧自由基的清除能力。有研究报道,在遭受热应激侵袭时,羊血清中GSH-Px活性、T-AOC均显著降低[16]。在肉牛研究中也有相似发现,王玲等[17]研究报道,肉牛在夏季高温环境下,血清中抗氧化酶活性显著降低。以上种种研究结果均表明热应激可导致肉牛抗氧化能力下降。
免疫球蛋白是具有抗体活性或化学结构、与抗体分子结构相似的球蛋白,是体内免疫系统的重要组成部分。IgA是机体体液免疫系统的组成部分,在机体局部发生感染时产生免疫应答。本试验结果表明,热应激肉牛血清中IgA含量极显著降低。有研究报道,热应激会使得妊娠期西门塔尔牛血清中IgA、IgG含量显著降低[18]。彭孝坤等[19]同样发现,在山羊发生热应激时,其血清中IgA含量显著降低。以上结果均表明,热应激状态下反刍动物机体的体液免疫功能会受到抑制,而热应激影响血清免疫球蛋白正常分泌的机理有待进一步研究和探讨。
3.3 热应激对肉牛瘤胃发酵指标的影响
pH作为评价瘤胃内环境稳态的重要指标之一,其最适范围为6.2~6.8,过高或过低都不利于瘤胃微生物的生存与发酵。本试验中试验牛瘤胃pH均在正常范围内,说明中度热应激并没有导致肉牛瘤胃pH异常。NH3-N是瘤胃微生物可利用的主要氮源,其浓度反映的是瘤胃微生物对饲粮含氮物质的降解程度及合成MCP效率之间的关系[20]。瘤胃液中NH3-N浓度过高、过低或释放不均匀都会对瘤胃微生物产生不利影响。据报道,瘤胃NH3-N的适宜浓度范围为0.35~29.00 mg/d[21]。在本试验中,2个组瘤胃NH3-N浓度均在适宜范围内,但高温组瘤胃液NH3-N浓度显著升高,分析可能与热应激降低了瘤胃壁对NH3-N的吸收能力和瘤胃微生物对NH3-N的利用效率有关。VFA是瘤胃微生物的主要代谢产物,可为反刍动物生命活动提供70%~80%的能量[22]。本研究发现,热应激降低了瘤胃中VFA的含量,瘤胃液VFA含量与瘤胃微生物菌群的组成有很大关系,高温应激导致VFA含量下降可能与瘤胃纤维分解菌等丰度下降有关,这在本研究结果中也得到了证实。张灿[23]研究报道,热应激可显著提高藏绵羊和山羊瘤胃液中NH3-N浓度,显著降低VFA含量,这与本研究结果是一致的。Correia等[24]也报道,热应激会使肉牛瘤胃液中VFA含量降低。
3.4 热应激对肉牛瘤胃微生物区系的影响
本试验采用高通量测序技术检测热应激肉牛的瘤胃内容物,并对其瘤胃菌群进行分析。测序结果显示,常温组与高温组的覆盖指数均达到0.99,说明测序样品取样充分,测序结果可准确真实地反映肉牛瘤胃微生物菌群的种类与结构。α多样性指数中,Shannon和Simpson指数体现微生物菌群的多样性,Chao1和Ace指数体现微生物菌群的丰富度。本试验中α多样性指数均无显著差异,这与Tajima等[25]和Correia等[24]的研究结果相似,说明热应激没有影响瘤胃细菌多样性。
瘤胃是反刍动物营养物质消化代谢的主要场所,瘤胃微生物可以将饲料中的纤维及非蛋白氮转化为VFA和MCP,为动物提供能量和蛋白质[26]。热应激引起的微生物群变化可能会改变瘤胃中的发酵模式,导致消化率、VFA产量以及甲烷排放量的变化。在本试验中,2组动物瘤胃菌群优势菌门均为拟杆菌门和厚壁菌门,占门水平总菌群数的90%以上,这与Zhang等[27]的研究结果相一致。本研究结果显示,放线菌门、脱硫杆菌门和Patescibacteria的相对丰度均显著增加。放线菌门为革兰氏阳性菌,能够代谢淀粉和低聚糖等物质,主要代谢产物为乳酸和乙酸[28];脱硫杆菌门属于变形菌门,能氧化乳酸、丙酮酸等产生乙酸和二氧化碳。有报道表明,荷斯坦牛瘤胃中Patescibacteria的相对丰度与环境温度呈正相关[29],这与本试验结果相一致。但是,Kim等[30]研究报道,反刍动物瘤胃内的放线菌门和脱硫杆菌门的相对丰度均会受热应激的影响而降低。Zhao等[31]发现,热应激发生后,瘤胃菌群中的乳酸菌种类增多,乙酸菌种类减少。这与本研究结果不一致,分析可能与热应激程度及瘤胃微生物菌群互相作用有关,有关机制还需要进一步研究。
本研究结果显示中,常温组与高温组瘤胃菌群的优势菌属均为普雷沃氏菌属,这在前人的研究中也得到证实[32]。普雷沃菌属与普雷沃氏菌科UCG-003都属于拟杆菌门,可对饲粮中的蛋白质、淀粉、寡糖及半纤维素产生积极降解作用,产生乙酸、丙酸等VFA[33-34]。本试验中,高温组普雷沃菌属的相对丰度无显著差异,但普雷沃氏菌科UCG-003的相对丰度显著降低,这可能是导致瘤胃VFA含量显著下降的主要原因。此外,克里斯滕森菌科_R-7群和NK4A214_group属于厚壁菌门,可产生纤维素酶和半纤维素酶分解瘤胃中的粗纤维产生VFA。本试验结果显示,克里斯滕森菌科_R-7群和NK4A214_group的相对丰度显著降低,说明热应激状态下肉牛瘤胃对纤维的降解作用受到抑制,这与高温组瘤胃TVFA含量显著下降的结果是一致的。
4 结 论
夏季热应激导致肉牛体温、呼吸频率升高,血清抗氧化能力、免疫功能下降,瘤胃菌群中纤维素分解菌丰富度降低,瘤胃液VFA含量下降,NH3-N浓度升高,但不影响瘤胃细菌的多样性。

