饲料胆固醇水平对克氏原螯虾生长性能、消化酶活性、抗氧化能力和脂代谢相关基因表达的影响
田红艳 杨成聪 张春暖 王爱民* 刘 飞 杨文平 於叶兵 任胜杰 张武肖
(1.盐城工学院海洋与生物工程学院,盐城 224000;2.河南科技大学动物科技学院,洛阳 471023)
胆固醇是动物体内一种重要的固醇类化合物,不仅是动物细胞膜的组成成分,还是包括类固醇激素、胆汁酸和维生素D在内的众多功能性生理物质的前体[1]。鱼类等大多数脊椎动物能够利用乙酸通过甲羟戊酸合成、异戊二酸合成、鲨烯合成以及胆固醇生成4个生理过程合成胆固醇。但虾蟹等甲壳类动物已被证明不能从头合成甾醇[2],必须摄入外源性胆固醇来维持正常生理机能。因此,对于人工养殖的虾蟹类动物而言,饲料中的胆固醇是其获得胆固醇的最主要来源,对于其维持自身良好生长和正常的生理功能具有重要意义。
饲料胆固醇主要由鱼油、鱼粉等原料提供,常用鱼油与鱼粉的胆固醇水平通常在0.1%~0.7%[1],以这些原料来补充配合饲料中的胆固醇会增加鱼粉、鱼油使用量,大大增加饲料和养殖成本。此外,随着鱼粉等渔业资源的紧张,配合饲料中鱼粉已逐渐被其他蛋白质原料替代,导致虾蟹动物配合饲料的胆固醇水平逐渐下降。因而,确定配合饲料中胆固醇这一基本营养素的需求对制定成本低、效益高的甲壳动物专用饲料变得越来越重要。克氏原螯虾(Procambarusclarkii)是我国近几年迅速发展起来的一类水产品,2020年我国克氏原螯虾养殖总产量将近240万t,是继五大宗淡水鱼品种后的第六大淡水养殖品种[3],因此饲料需求量也随着养殖规模的增加而逐年增加。绝大多数学者认为克氏原螯虾所需配合饲料蛋白质水平在26%~32%[4],而其中鱼粉用量低于5%。由于常见虾蟹类动物的胆固醇需求量一般在0.5%~1.0%[5-6],因而克氏原螯虾配合饲料中胆固醇水平可能远远不能满足自身所需。
本课题组前期研究发现,克氏原螯虾饲料中添加0.50%~0.75%的胆固醇可以有效增加蜕壳次数,提高生长性能[7]。但同时也发现,克氏原螯虾体内各组织胆固醇含量及血淋巴液中高密度脂胆固醇含量也随着饲料胆固醇添加水平的增加而不断增加。在拟穴青蟹(Scyllaparamamosain)的研究中也发现,肝脏中总胆固醇含量随着饲料胆固醇水平的增加而不断增加[8]。胆固醇作为感应机体内脂肪细胞能量储存状态的信号分子,过量的胆固醇很可能会影响机体正常脂肪代谢。因此,本试验在前期研究基础上,进一步探究饲料胆固醇对克氏原螯虾生长性能、体组成、消化酶活性、抗氧化能力和脂代谢相关基因表达的影响。本试验所得研究结果将对胆固醇促进虾蟹类生长的机理进行探讨,为今后开发克氏原螯虾专用配合饲料提供科学依据。
1 材料与方法
1.1 试验动物
试验用克氏原螯虾初重(4.4±0.1) g,购自盐城市大丰区某小龙虾养殖场,选择个体健康灵活,大小规格一致。投喂普通商品饲料,驯化1周。
1.2 试验饲料
在3%鱼粉的基础上设计分别添加0(C0组)、0.25%(C0.25组)、0.50%(C0.50组)、0.75%(C0.75组)、1.00%(C1.00组)胆固醇(纯度99.99%)的5种等氮试验饲料(饲料中胆固醇实测水平分别为0.06%、0.29%、0.54%、0.81%、1.05%)。饲料原料购自盐城某饲料有限公司,原料先经过粉碎机粉碎然后80目过筛,所有原料称重后最后逐级放大法均匀混合,胆固醇添加组需要将胆固醇均匀溶于豆油后,再与其他饲料原料混匀,混匀过程中以喷壶均匀喷洒水(按照16%质量分数添加水分),各原料充分混匀后使用饲料制粒机生产口径为2 mm的颗粒饲料,在室温下饲料风干至恒重,密封冷藏备用。试验饲料组成及营养水平见表1。
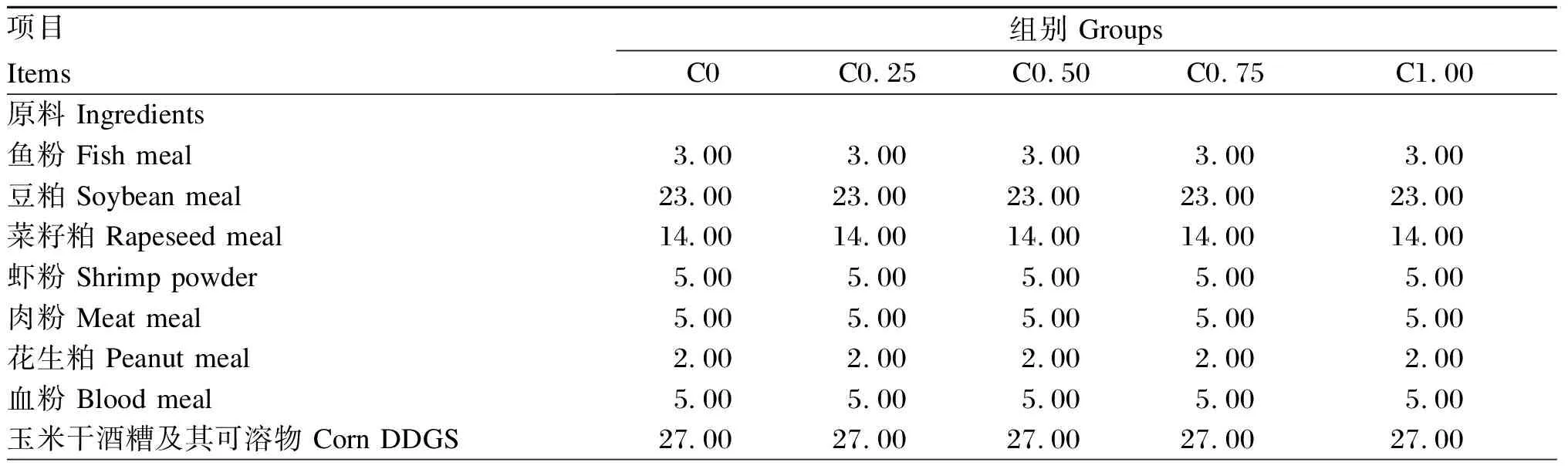
表1 试验饲料组成及营养水平(干物质基础)
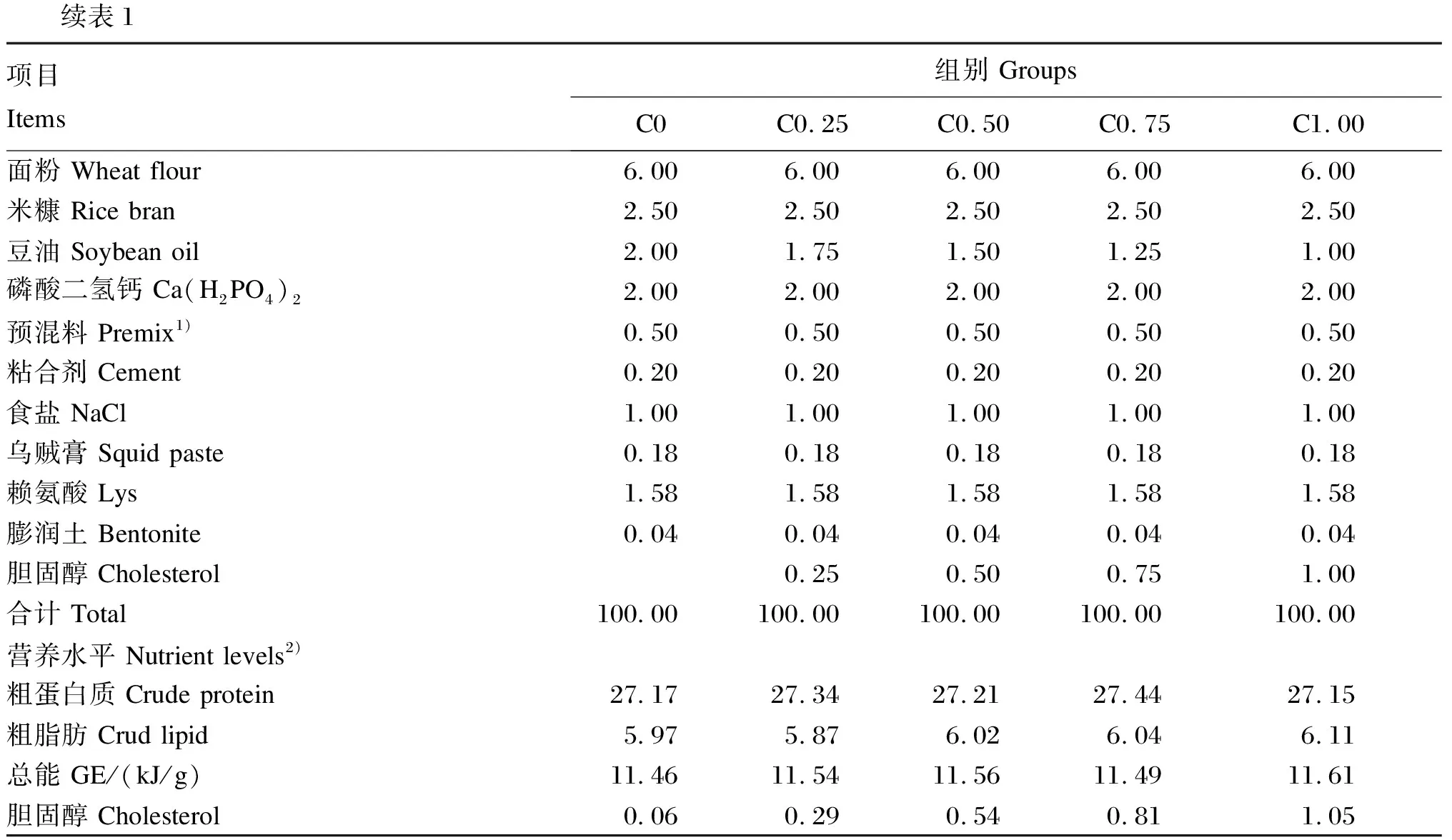
续表1项目 Items组别 GroupsC0C0.25C0.50C0.75C1.00面粉 Wheat flour6.00 6.00 6.00 6.00 6.00 米糠 Rice bran 2.50 2.50 2.50 2.50 2.50 豆油 Soybean oil2.00 1.75 1.501.251.00 磷酸二氢钙 Ca(H2PO4)22.00 2.00 2.00 2.00 2.00 预混料 Premix1)0.50 0.50 0.50 0.50 0.50 粘合剂 Cement0.20 0.20 0.20 0.20 0.20 食盐 NaCl1.00 1.00 1.00 1.00 1.00 乌贼膏 Squid paste0.18 0.18 0.18 0.18 0.18 赖氨酸 Lys1.581.581.581.581.58膨润土 Bentonite0.04 0.04 0.04 0.04 0.04 胆固醇 Cholesterol0.25 0.50 0.751.00 合计 Total100.00100.00100.00100.00100.00营养水平 Nutrient levels2)粗蛋白质 Crude protein27.17 27.34 27.21 27.44 27.15 粗脂肪 Crud lipid5.97 5.87 6.02 6.04 6.11 总能 GE/(kJ/g)11.4611.5411.5611.4911.61胆固醇 Cholesterol0.06 0.29 0.54 0.811.05
1.3 试验设计及饲养管理
将225尾克氏原螯虾随机分为5组,每组3个重复,每个重复15尾虾,每只单独放置于试验水箱中,每个水箱长25 cm、宽12 cm、高度15 cm,并且有孔,每个重复中的水箱放置于1个大水箱中使其水质相同,大水箱为塑料水箱,内尺寸长88.5 cm、宽66.5 cm、高66.0 cm,养殖期间大水箱水位在12~15 cm。试验期间每天投喂2次,分别在07:00和19:00,参照3%~5%的克氏原螯虾体重进行喂食,养殖一共持续6周。在养殖期间,养殖水体水温(23.00±1.84) ℃,以增氧泵维持溶氧含量大于6.0 mg/L,每天使用水质检测试剂盒监测水质,pH保持在7.2~7.8,氨态氮含量小于0.10 mg/L,硝态氮含量小于0.06 mg/L,光照周期为自然光照周期。
1.4 样品采集
采样前禁食24 h,克氏原螯虾用酒精消过毒的纱布擦干体表水分然后测其体重,每个重复随机选3尾解剖采集腹部肌肉样品并称重,并取3尾全虾放到-20 ℃冰箱中保存以待分析。
血淋巴液的采样:采样前禁食24 h,每个重复随机取3尾克氏原螯虾用酒精消过毒纱布擦干体表水分,心脏采血,放入肝素钠润湿过的离心管中,静置4 h后在4 ℃、3 000 r/min的条件下离心10 min,取上清液于-80 ℃保存待测。
组织液的采样:采样前禁食24 h,每个重复取5尾虾,采肝胰腺、胃、肠道。用0.85%生理盐水按1∶4(重量∶体积)比例,捣碎后移入匀浆器中制备20%的组织匀浆液。4 ℃低温离心(2 500 r/min)10 min,取上清液-20 ℃保存待测。
1.5 指标测定方法
增重率(weight gain rate,WGR,%)=
100×(Wf-Wi)/Wi;
饲料系数(feed conversion rate,FCR)=
Gd/(Wf-Wi);
存活率(survival rate,SR,%)=100×Kt/Ko;
肥满度(condition factor,CF,g/cm3)=
(Wf-Wi)/A3;
含肉率(rate of flesh content,RFC,%)=
100×Mf/Wf;
肝体比(hepatosomatic index,HSI,%)=
100×Gh/Wf。
式中:Gh为克氏原螯虾肝脏湿重(g);Wf和Wi分别为克氏原螯虾的终末体重和初始体重(g);A为体长(cm);Gd为摄入饲料干重(g);Mf为克氏原螯虾的终末肌肉重(g);Kt和Ko分别为试验结束和开始时试验池中克氏原螯虾的数量。
体组成:采用(105±2) ℃烘箱烘至恒重的方法直接测定水分含量(GB/T 5009.3—2016);采用半微量凯氏定氮法测定粗蛋白质含量(GB/T 5009.5—2016);采用索氏提取法测定粗脂肪含量(GB/T 5009.6—2016);采用马弗炉550 ℃灼烧法测定粗灰分含量(GB/T 5009.4—2016)。
消化酶活性:测定克氏原螯虾肠道、胃、肝胰腺的蛋白酶(protease,PR)、淀粉酶(amylase,AMS)和脂肪酶(lipase,LPS)活性,采用南京建成生物工程研究所试剂盒测定。
血淋巴液生化指标:谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)活性和总蛋白(total protein,TP)、白蛋白(albumin,ALB)含量均使用南京建成生物工程研究所试剂盒测定。
血清抗氧化指标:检测克氏原螯虾血清中超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活性以及丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)含量,采用南京建成生物工程研究所试剂盒测定。
饲料胆固醇水平:用三氯甲烷提取试样中的胆固醇,以氮气作为流动相,用气相色谱法分离测定[9]。
基因表达量:利用Trizol试剂法来抽提肝胰腺中的总RNA,随后通过NanoDrop®ND-1000分光光度计进行定量(260 nm吸收峰)。纯化后的RNA使用ExScriptTMRT-PCR kit反转录成cDNA。在反转录完成后,使用SYBR@Premix Ex TaqTM试剂盒,采用实时荧光定量PCR测定肝胰腺中肉碱棕榈酰转移酶-Ⅰ(carnitinepalmitoyl-transferase-Ⅰ,CPT-Ⅰ)、脂肪酸合成酶(fatty acid synthetase,FAS)、脂肪酸转运蛋白(fatty acid transport protein,FATP)、脂肪酸结合蛋白(fatty acid binding protein,FABP)mRNA相对表达量。总反应体系为20 μL,包括cDNA 2 μL、正和反引物各0.4 μL、SYBR@Premix Ex TaqTM10 μL、ROX Reference Dye Ⅱ 0.4 μL以及二乙基焦碳酸酯(DEPC)处理水6.8 μL。实时荧光定量PCR的测定使用7900HT Fast Real-Time PCR系统(Applied Biosystem,美国),系统温度达到95 ℃后,保持95 ℃ 15 s、60 ℃ 40 s反应40个循环,随后65 ℃保持。待测基因的特定引物列于表2,引物由Primer 5软件进行设计。以2-ΔΔCt计算目的基因的mRNA相对表达量,以β-肌动蛋白为内参基因。

表2 实时荧光定量PCR所用引物
1.6 数据统计与分析
用SPSS 19.0软件的one-way ANOVA程序对本试验所得数据进行分析,显著性差异水平为P<0.05,所得试验数据以“平均值±标准误”(mean±SE)表示。以克氏原螯虾饲料系数为因变量(Y),以饲料胆固醇水平为自变量(X)做折线模型,分析克氏原螯虾饲料胆固醇水平与饲料系数之间的关系。
2 结 果
2.1 饲料胆固醇水平对克氏原螯虾生长性能的影响
由表3可知,随着饲料胆固醇水平由0增加到0.50%,克氏原螯虾增重率显著增加(P<0.05),但随着胆固醇水平继续增加到1.00%,增重率又显著下降(P<0.05)。当克氏原螯虾摄食不添加胆固醇的饲料时,含肉率、肥满度和肝体指数显著低于C0.50、C0.75、C1.00组(P<0.05)。以克氏原螯虾饲料系数为Y轴,以饲料中胆固醇水平为X轴,通过折线模型分析得出y=-0.22x+1.221 7(R2=0.935 6)与y=0.4x+0.89(R2=0.787 4)的交点处的X为0.54%,此时克氏原螯虾饲料系数最低,饲料利用率最高(图1)。
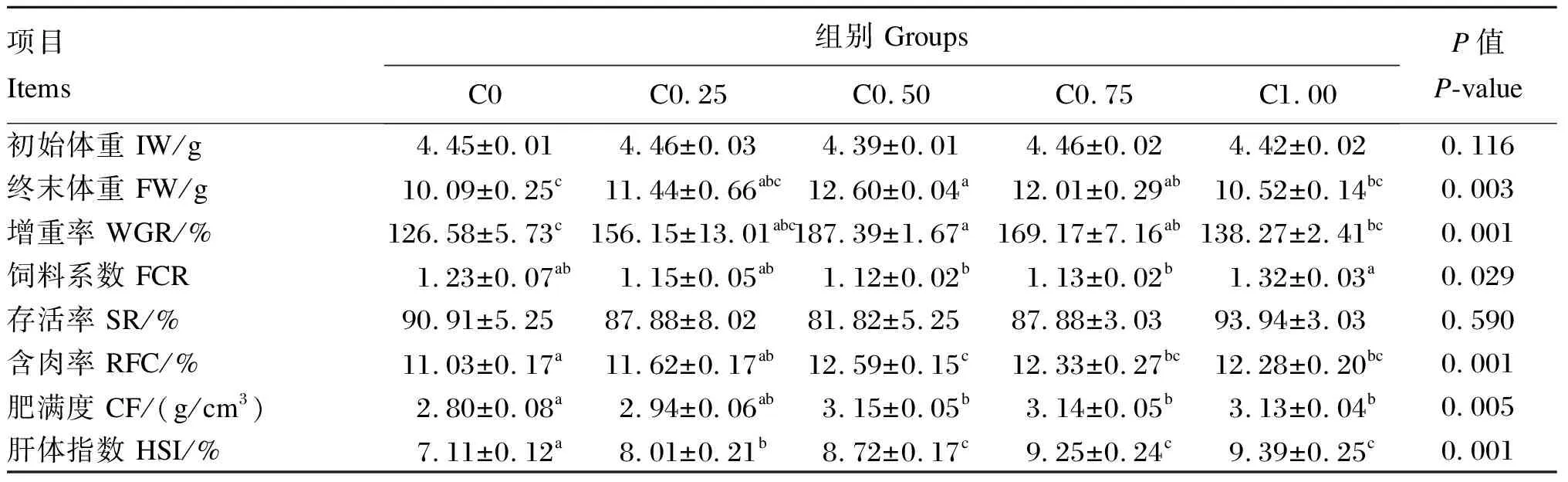
表3 饲料胆固醇水平对克氏原螯虾生长性能的影响

图1 饲料胆固醇水平对克氏原螯虾饲料系数的影响
2.2 饲料胆固醇水平对克氏原螯虾体组成的影响
由表4可知,饲料中胆固醇水平对克氏原螯虾全虾的水分、粗蛋白质、粗灰分和钙含量并未造成显著影响(P>0.05),但是显著影响了粗脂肪含量(P<0.05)。随着饲料胆固醇水平从0增加到1.00%,克氏原螯虾粗脂肪含量显著增加(P<0.05),C0.50、C0.75、C1.00组的粗脂肪含量显著高于C0、C0.25组(P<0.05)。
2.3 饲料胆固醇水平对克氏原螯虾各组织消化酶活性的影响
由表5可知,饲料中胆固醇水平对克氏原螯虾的肝胰腺、胃、肠道的脂肪酶、蛋白酶活性有显著影响(P<0.05),而对各组织的淀粉酶活性无显著差异(P>0.05)。随着饲料胆固醇水平从0增加到0.50%,肝胰腺、胃以及肠道的脂肪酶活性显著上升(P<0.05),但随着饲料胆固醇水平的继续增加而显著下降(P<0.05),C0.50组肝胰腺、胃肪酶活性均显著高于其他各组(P<0.05)。胃和肠道蛋白酶活性随着饲料胆固醇水平从0增加到0.50%而显著上升(P<0.05),但随后显著下降(P<0.05)。肝胰腺蛋白酶活性则在C0.75组最高,显著高于其他各组(P<0.05)。
2.4 饲料胆固醇水平对克氏原螯虾血淋巴液抗氧化能力的影响
由表6可知,与血淋巴液MDA含量相反,克氏原螯虾血淋巴液中SOD活性随着饲料胆固醇水平由0增加到0.50%而显著上升(P<0.05),但随着饲料胆固醇水平继续增加而显著下降(P<0.05)。克氏原螯虾血淋巴液CAT活性在C0组显著低于除C0.25组外的其他各组(P<0.05)。C0.25组血淋巴液GSH含量显著高于其他各组(P<0.05)。

表4 饲料胆固醇水平对克氏原螯虾体组成的影响(鲜重基础)
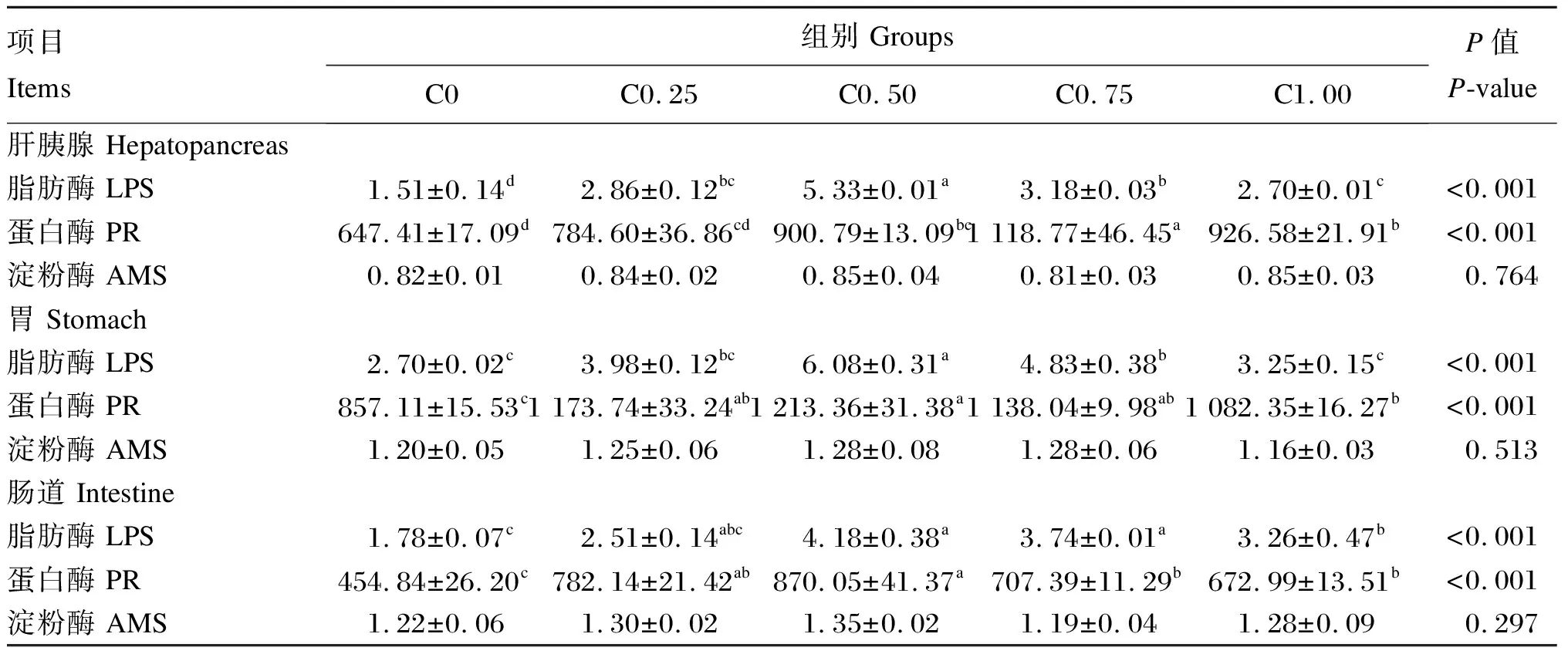
表5 饲料胆固醇水平对克氏原螯虾组织消化酶活性的影响

表6 饲料胆固醇水平对克氏原螯虾血淋巴液抗氧化能力的影响
2.5 饲料胆固醇水平对克氏原螯虾肝胰腺脂代谢相关基因表达的影响
由图2可知,肝胰腺CPT-Ⅰ mRNA相对表达量随着饲料胆固醇水平增加而不断下降,C0组显著高于其他各组(P<0.05)(图2-A)。C0.25组肝胰腺FASmRNA相对表达量显著低于C0.75、C1.00组(P<0.05)(图2-B)。肝胰腺FABP与FATPmRNA相对表达量随着饲料胆固醇水平的增加先上升,随后又下降。肝胰腺FATPmRNA相对表达量在C0.75组最高显著高于C0组(P<0.05),而FABPmRNA相对表达量在C0.50组最高,显著高于C0组(P<0.05)(图2-C和图2-D)。
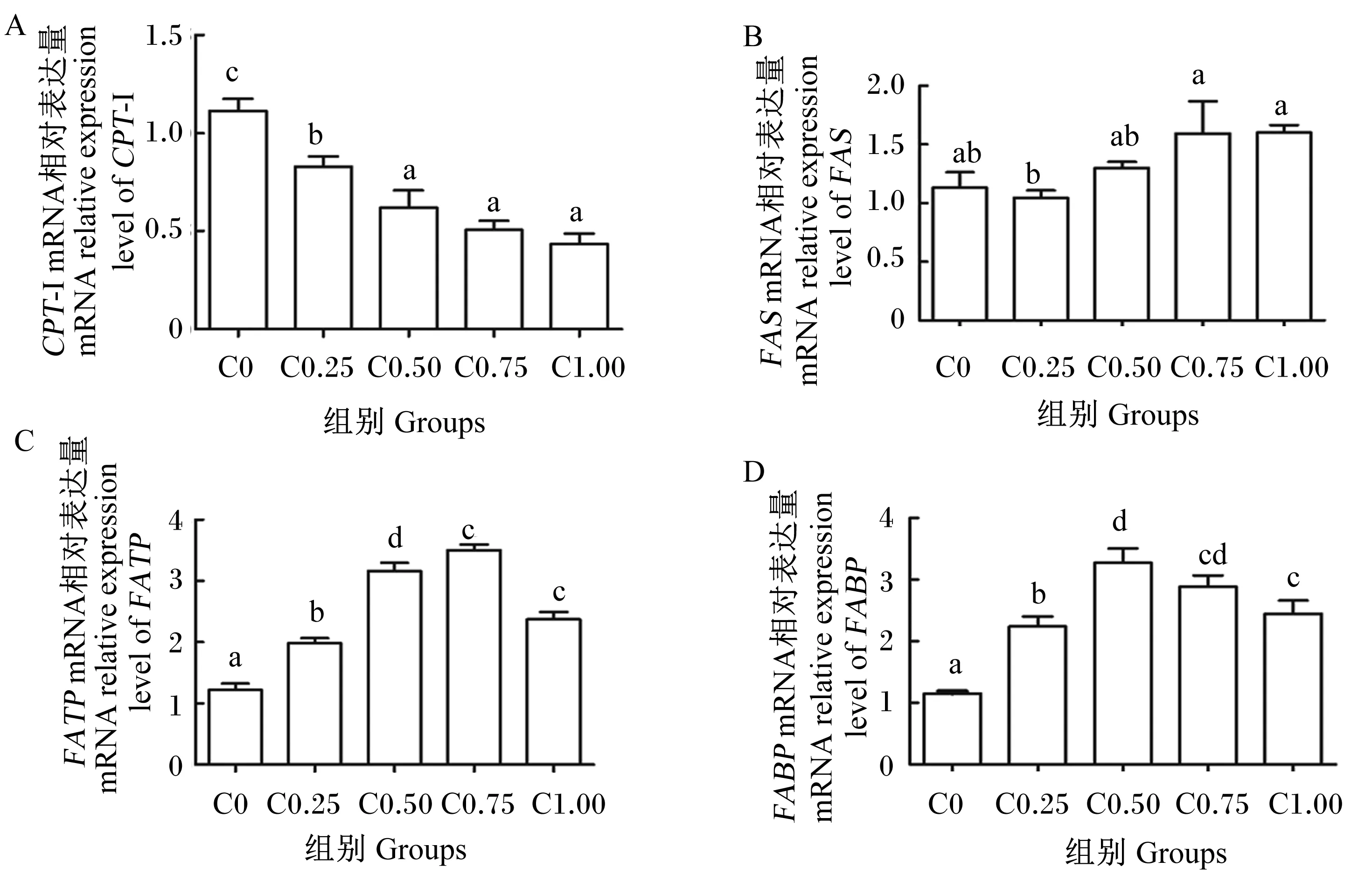
数据柱形标注不同字母表示差异显著(P<0.05)。Value bars with different letters mean significant difference (P<0.05).
3 讨 论
3.1 饲料胆固醇水平对克氏原螯虾生长性能的影响
饲料中添加适宜水平的胆固醇能显著提高甲壳类动物的生长性能[10-11]。通过折线模型分析发现,凡纳滨对虾(Litopenaeusvannamei)胆固醇的最适需要量为0.16%[12];在日本沼虾(Macrobrachiumnipponense)饲料中添加0.9%的胆固醇,能够得到较高的生长性能和较低饵料系数[13]。在红鳌鳌虾(Cheraxquadricarinatus)的研究中也发现饲料中过低或过高的胆固醇水平均不利于其生长[14]。虾、蟹等甲壳动物已被证明不能从头合成胆固醇[2],必须摄入外源性胆固醇来维持正常生理机能。因此,饲料中合理补充胆固醇对甲壳动物的生存和生长至关重要,过低或者过高的胆固醇添加水平都会影响甲壳动物的生长。为了节约鱼粉等资源,水产饲料中植物性饲料原料越来越受到广泛使用。相比于以鱼粉等动物蛋白质源为主的饲料,以植物性蛋白质源为主的饲料导致了虾蟹等甲壳动物机体内胆固醇水平的缺乏[12]。胆固醇是脂蛋白的重要组成部分,体内过低的胆固醇水平不利于脂质在动物体内的吸收和运输[15]。作为类脂的一种,胆固醇还是动物细胞膜的组成成分,为细胞膜提供结构的完整性,以抵抗环境压力,如高温和盐胁迫[16]。过低的胆固醇水平使得甲壳动物抵抗外界环境条件变化的能力减弱。此外,胆固醇是蜕皮激素的前体,过低的胆固醇水平使得甲壳动物无法合成蜕皮激素,影响正常的蜕皮,进而影响生长性能甚至造成死亡。但是过量的胆固醇不仅对生长性能没有促进作用,还会增加饲料成本。
3.2 饲料胆固醇水平对克氏原螯虾各组织消化酶活性的影响
甲壳动物消化酶活性反映其对饲料营养成分的吸收能力,活性越高吸收能力越强,对饲料的利用率越高,而不同消化酶活性受到其摄食的饲料不同营养成分的水平及来源的影响[17]。本试验中,饲料中胆固醇水平对克氏原螯虾各组织的淀粉酶活性无显著差异,且淀粉酶活性维持在较低的水平,表明克氏原螯虾对糖的吸收利用能力较弱。随着饲料胆固醇水平从0增加到0.50%,肝胰腺、胃以及肠道的脂肪酶和蛋白酶活性显著上升,但随着胆固醇水平的继续增加而显著下降。这不仅表明克氏原螯虾对饲料中蛋白质和脂肪的利用水平较高,也表明饲料中适宜的胆固醇水平能够提高克氏原螯虾各组织中脂肪酶和蛋白酶的活性。这与甘信辉[18]在雄性红鳌鳌虾和韩冰[19]在半滑舌鳎(Cynoglossussemilaevis)上的研究结果一致。饲料中0.54%的胆固醇水平有助于提高脂肪酶与蛋白酶的活性,而过量的胆固醇则会影响克氏原螯虾体内正常的营养物质代谢,影响其消化酶的活性,进而对其生长有一定的影响。此外,在肝胰腺和胃中蛋白酶活性达到1 000 U/mg prot,而在肠道中则小于900 U/mg prot,表明克氏原螯虾对饲料蛋白质的消化主要在胃部组织及肝胰腺中。
3.3 饲料胆固醇水平对克氏原螯虾体组成的影响
本试验发现,饲料中胆固醇水平对克氏原螯虾的水分、粗蛋白质、粗灰分和钙含量并未造成显著影响,但随着胆固醇水平不断增加,克氏原螯虾粗脂肪含量显著增加,表明饲料中适当的胆固醇能够促进脂肪的吸收,增加脂肪沉积。Thongrod等[20]在墨吉对虾(Penaeusmerguiensis)的研究中发现当饲料胆固醇水平增加时,全虾粗脂肪含量呈上升趋势,而粗蛋白质、粗灰分含量无显著变化,与本试验研究结果一致。在对斜带石斑鱼(Epinepheluscoioides)[21]、大菱鲆(Scophthalmusmaximus)[22]的研究中也有关于饲料中添加胆固醇促进水产动物体内粗脂肪含量增加的报道。张武财等[21]对斜带石斑鱼的研究发现,添加胆固醇组的试验鱼肝脏中CPT-Ⅰ活性显著低于对照组(未添加胆固醇),并且试验组肝脏苹果酸酶(malic enzyme,ME)活性有升高的趋势。肝脏CPT-Ⅰ的作用是催化脂酰辅酶A转化为脂酰肉碱,并将脂酰肉碱运送到线粒体基质进行β-氧化,是体内脂肪酸β-氧化分解的关键酶[23]。肝脏ME的作用是在脂肪酸合成中提供烟酰胺腺嘌呤二核苷磷酸(NADPH),是脂肪酸合成中的关键酶。由此推测,斜带石斑鱼体内脂肪含量随着饲料胆固醇水平的增加而增加是因为胆固醇促进了鱼体肝脏脂肪酸的合成,并降低了肝脏脂肪酸的分解。本试验中也发现了随着饲料胆固醇水平的升高,CPT-Ⅰ mRNA相对表达量显著下降,因此推测克氏原螯虾粗脂肪含量的上升可能也与此有关。
3.4 饲料胆固醇水平对克氏原螯虾血淋巴液抗氧化能力的影响
SOD、CAT能够清除体内多余的自由基,减少细胞的氧化损伤[24]。MDA被认为是过氧化作用的分解产物,其水平可反映肝脏损伤的程度[25]。GSH能帮助保持正常的免疫系统功能,并具有抗氧化和解毒作用[26]。Tao等[27]在中华绒螯蟹(Eriocheirsinensis)的研究中发现随着饲料胆固醇添加水平的上升,除去胃肠组织后的机体内SOD活性呈先上升后下降的趋势。而Han等[28]在研究饲粮胆固醇添加水平对三疣梭子蟹(Portunustrituberculatus)幼体生长、蜕皮和抗氧化的影响时发现,随着饲料胆固醇添加水平的上升,血清SOD活性也随之上升。Gu等[13]在研究胆固醇对日本沼虾幼虾生长、饲料系数、体组成及抗氧化指标的影响时发现肝脏CAT活性、MDA和GSH含量的变化也有类似的结果。本试验中,克氏原螯虾血淋巴液中SOD活性随着饲料胆固醇水平由0增加到0.50%而显著上升,但随着饲料胆固醇水平继续增加而显著下降。血淋巴液中MDA含量则与SOD活性呈现相反的趋势。克氏原螯虾血淋巴液中CAT活性在未添加胆固醇组显著下降。这表明饲料中适量的胆固醇能够提高克氏原螯虾的血淋巴液中抗氧化能力,而过量的胆固醇则可能降低机体的抗氧化性能。因此,饲料中添加胆固醇不仅可以为甲壳动物提供机体必要的胆固醇来源,还可以作为甲壳动物一种抗氧化剂[29]。
3.5 饲料胆固醇水平对克氏原螯虾肝胰腺脂代谢相关基因表达的影响
机体脂肪含量受到脂肪合成和脂肪分解2个代谢过程的影响[30]。当机体需能时,储存的脂肪首先被分解为甘油和脂肪酸,随后脂肪酸在CPT-Ⅰ的催化下进行β-氧化分解为机体提供能量。CPT-Ⅰ是在脂肪酸氧化过程中关键酶,调控脂肪的分解[31]。本试验发现,与C0组相比,C0.50组~C1.00组中肝胰腺CPT-Ⅰ mRNA相对表达量下降,该结果与虾体的粗脂肪含量结果正好相反。这表明饲料胆固醇水平能够影响机体脂肪代谢过程,胆固醇含量升高会下调CPT-Ⅰ的mRNA相对表达量,导致脂肪酸β-氧化水平的下降,这可能就是导致胆固醇水平为0.50%、0.75%和1.00%这3组克氏原螯虾体内粗脂肪含量显著增加的原因之一。
FAS是脂肪酸合成的关键酶,在肝脏中以复杂的七步反应将乙酰辅酶A和丙二酰辅酶A合成长链脂肪酸[32]。FABP属于脂质结合蛋白超家族,是分子质量较小的蛋白质,参与细胞内脂肪酸的运输,可与游离脂肪酸结合,特别是与长链脂肪酸有很高的结合能力[33]。FATP参与脂肪酸的转运,与FATP结合的脂肪酸能够从细胞膜被运送到下一位置进行代谢[34]。本试验中,胆固醇高水平组肝胰腺FAS、FABP与FATP的mRNA相对表达量高于胆固醇低水平组,表明高胆固醇水平会增加克氏原螯虾脂肪酸的合成,提高脂肪酸尤其是长链脂肪酸的结合与转运能力,从而促进脂肪的沉积,因此,FAS、FABP与FATP的mRNA相对表达量的升高可能也是0.50%、0.75%和1.00%这3组克氏原螯虾体内粗脂肪含量显著增加的原因之一。
4 结 论
① 饲料中添加胆固醇能够促进克氏原螯虾的生长,提高消化组织的脂肪酶活性。
② 过量的胆固醇会通过抑制脂肪的β-氧化,导致克氏原螯虾的脂肪分解水平下降,并通过增加长链脂肪酸的转运促进脂肪沉积,最终引起机体脂肪含量的增加。
③ 过低或过量的胆固醇均会降低克氏原螯虾血淋巴液抗氧化能力。
④ 本试验中克氏原螯虾饲料的胆固醇适宜添加水平为0.50%,此时饲料胆固醇实测水平为0.54%。

