高糖微环境下EMD对钛表面BMSCs成骨分化的影响及其机制研究
孟茂花 夏茜 成璐 李英 陈镜桥 王勤英 叶朝阳 董强
糖尿病(diabetes mellitus,DM)患者种植体周围炎发生的概率较高,与健康患者相比,骨结合较慢,种植体的存留率相对较低,种植术后并发症的控制和治疗较难,因此,糖尿病是口腔种植修复关注的主要基础疾病之一[1]。釉基质衍生物(enamel matrix derivatives,EMD)是从幼猪牙胚中提取的釉基质蛋白的衍生物,主要由釉原蛋白、成釉蛋白和类生长因子物质等共同构成, 在口腔相关基础研究和临床治疗中,体现出较好的组织再生效果[2]。有研究发现,EMD可以促进糖尿病大鼠颌骨缺损的骨组织再生[3], EMD治疗种植体周骨缺损,10 年种植体存留率为90.7%,同时在种植体骨缺损治疗中获得长期稳定的效果[4]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)可定向分化,是良好的种子细胞,经过处理和诱导后,能促进牙周组织缺损修复,在牙周组织再生中有较好的治疗前景[5]。BMSCs是牙槽骨损伤修复的重要细胞,有较好的归巢功能[6],在种植体植入后,BMSCs通过血液募集到种植体表面,为种植体提供较好的骨结合条件。因此,在DM患者种植体周围骨缺损修复的过程中,BMSCs在损伤部位的成骨和黏附起着至关重要的作用。经典的Wnt/β-catenin信号通路是BMSCs成骨分化的重要通路,即使在高糖微环境下也是如此[7]。
喷砂酸蚀(sandblasted and acid-etched,SLA)是钛种植体常用的表面改性技术之一,其细微粗糙的表面促进细胞黏附[8]。EMD可以促进SLA钛表面牙龈成纤维细胞[9]和成骨细胞[10]的增殖、黏附和成骨分化。因此推测EMD是否也能促进高糖微环境下BMSCs在SLA钛表面上的成骨和黏附的性能?目前,EMD在高糖微环境下,对SLA钛表面BMSCs的成骨分化和黏附的作用及其机制尚不清楚。本课题组前期研究发现,EMD可以促进正常糖状态下的BMSCs的成骨分化,并且可能是通过激活Wnt/β-catenin信号通路来实现的[11]。本研究体外采用5.5 mmol/L正常糖(normal glucose,NG)和25 mmol/L高糖(high glucose,HG),通过细胞迁移、碱性磷酸酶活性、茜素红半定量、电镜扫描、RT-qPCR和WB的检测方法,在SLA钛表面上对BMSCs进行成骨和黏附性能检测和分析,EMD在高糖微环境下,对SLA钛表面BMSCs的成骨和黏附的作用及其机制进行初步探讨。
1 资料与方法
1.1 主要试剂
10 只2 周龄SD大鼠(SPF级);EMD(Straumann,瑞士);DMEM (Gibcol,美国);胎牛血清、青-链霉素(Biological Industeries,以色列);成脂诱导分化培养基[赛业(苏州)生物科技有限公司];Anti-Runx2 (CST,美国);一抗Osterix、β-catenin、Fibronecti、Integrinβ1(Abcam,英国);Anti-Col-1(北京博奥森生物技术有限公司); XAV-939(MedChemExpress,美国);抗体CD45、CD90、CD29、CD11b(BioLegend,美国);Trizol、PrimeScript®RT反转录试剂盒(Takara,日本);SYBRTMGreenMasterMix和ECL化学发光试剂盒(Thermo Fisher Scientific,美国);PVDF膜(Millipore,美国);SLA钛片(西安泰金工业);ALP活性测定试剂盒(南京建成);氯化十六烷基吡啶一水(大连美仑生物技术有限公司);二抗(泰安普美生物科技有限公司)。
1.2 方法
1.2.1 BMSCs提取及鉴定 SD大鼠脱颈处死,剥离胫骨和腓骨,PBS冲洗骨髓腔,收集细胞,贴壁筛选法分离培养,取第3代用于后续试验。流式细胞技术进行CD29、CD90、CD45、CD11b检测。成骨诱导(10%FBS,1%青-链霉素,50 μmol/L L-抗坏血酸-2-磷酸钠、10 mmol/L β-甘油磷酸钠、100 nmol/L地塞米松)21 d,1%茜素红染色。SD大鼠干细胞成脂诱导分化培养基,21 d油红O染色。
1.2.2 SLA钛片培养细胞 用直径10 mm,厚1 mm,SLA表面处理的钛片,放入48 孔板,按2×105/孔,成骨诱导,用于后续检测。
1.2.3 EMD试剂工作浓度配制 EMD为30 mg/mL,工作浓度为75 μg/mL,取EMD加入培养基中,涡旋震荡混匀。
1.2.4 细胞迁移实验 取BMSCs,3×103/孔,200 μL DMEM重悬,加入Transwell小室中。24 孔板孔内加入800 μL培养基(NG,HG,HG+75 μg/mL EMD),培养48 h,4%多聚甲醛固定,0.5%结晶紫染色。
1.2.5 ALP活性检测 BMSCs在SLA钛表面成骨诱导7 d,提取蛋白,BCA蛋白定量,使用ALP活性检测试剂盒,520 nm波长,酶标仪测定A值。
1.2.6 茜素红半定量实验 BMSCs在SLA钛表面成骨诱导21 d,4%多聚甲醛固定,茜素红染色,每孔加200 μL 10%氯化十六烷基吡啶37 ℃摇床孵育1 h,取100 μL加入96 孔板中,562 nm波长,酶标仪测定A值。
1.2.7 电镜扫描 BMSCs在SLA钛表面成骨诱导28 d,2.5%戊二醛4 ℃固定过夜,酒精(50%、70%、80%、90%)逐级脱水,使用100%酒精脱水3 次,在钛片表面喷金,扫描电镜(SEM)拍照观察。
1.2.8 RT-qPCR BMSCs在SLA钛表面成骨诱导7 d,收集细胞,Trizol法提取总RNA,检测纯度和浓度后进行定量,逆转录成cDNA,使用SYBR Green荧光定量聚合酶链式反应检测试剂盒进行RT-qPCR,相关基因引物序列均由中国上海生工生物有限公司合成,以β-actin为内参,检测各组mRNA相对表达量(表 1)。
1.2.9 Western blot BMSCs在SLA钛表面成骨诱导7 d,收集细胞,提取蛋白。10% SDS-PAGE电泳,0.45 μm PVDF膜,5%BSA封闭1 h,一抗孵育过夜,二抗孵育1 h,化学发光仪曝光,保存蛋白条带,Image J检测蛋白条带的灰度值。

表 1 引物序列设计
1.2.10 Wnt/β-catenin信号通路抑制剂 细胞分组:NG,HG,HG+EMD、NG+XAV-939、HG+XAV-939、HG+EMD+XAV-939),使用10 μg/mL XAV-939[12],成骨诱导7 d,WB检测成骨和黏附相关蛋白的表达变化。
1.3 统计学分析
应用GraphPad Prism 8.0软件进行单因素方差分析并作图,以P<0.05为差异具有统计学意义,所有实验重复3 次。
2 结果
2.1 BMSCs鉴定
细胞贴壁,呈纤维样和漩涡样生长 (图 1A、B)。茜素红染色可见红色矿化结节(图 1C),油红O染色可见脂滴形成(图 1D)。干细胞表面标志物 CD29和CD90表达呈阳性,非干细胞相关的标志物CD45和 CD11b表达呈阴性(图 1E)。

图 1 BMSCs培养及鉴定(A~D, ×100)
2.2 EMD在高糖微环境下促进BMSCs迁移
Transwell检测EMD在高糖微环境下对BMSCs迁移的影响(图 2A),迁移细胞计数(图 2B),HG组低于NG组,HG+EMD组数量有明显上升,表明在高糖微环境下BMSCs迁移受到抑制,EMD可以改善迁移抑制。

图 2 Transwell细胞迁移
2.3 BMSCs成骨分化
使用ALP活性检测早期成骨标志物(图 3A),HG组低于NG,添加EMD后活性有明显上升。茜素红染色半定量(图 3B)检测成骨晚期矿化程度,HG组较NG组减低明显,EMD诱导后,矿化程度有上升。
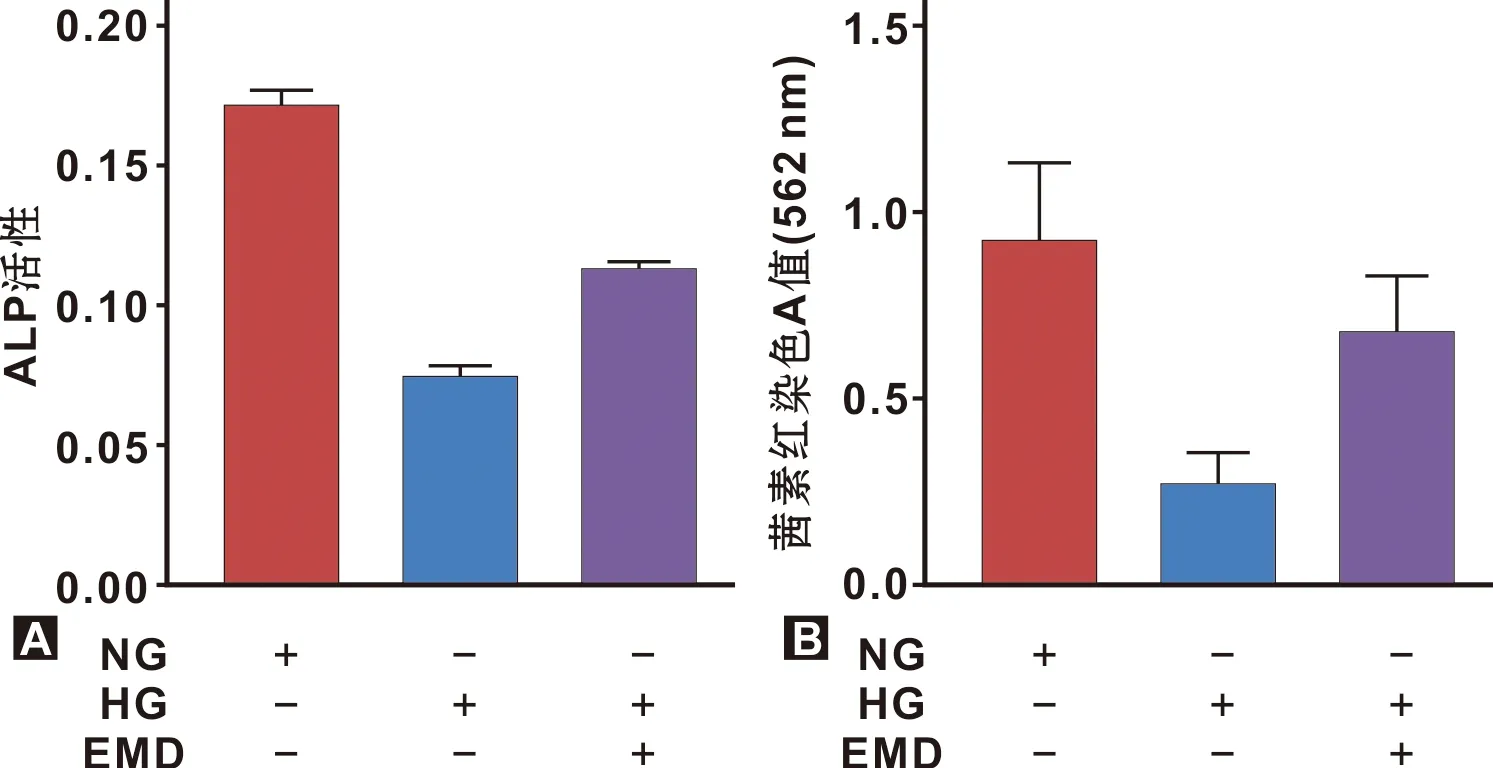
图 3 成骨分化能力检测
2.4 矿化结节表面形态
SEM观察SLA钛片表面BMSCs矿化结节(图 4),NG组的矿化结节较大,突出钛片表面较高,矿化面积最多,NG组明显降低,EMD作用后矿化面积增加。
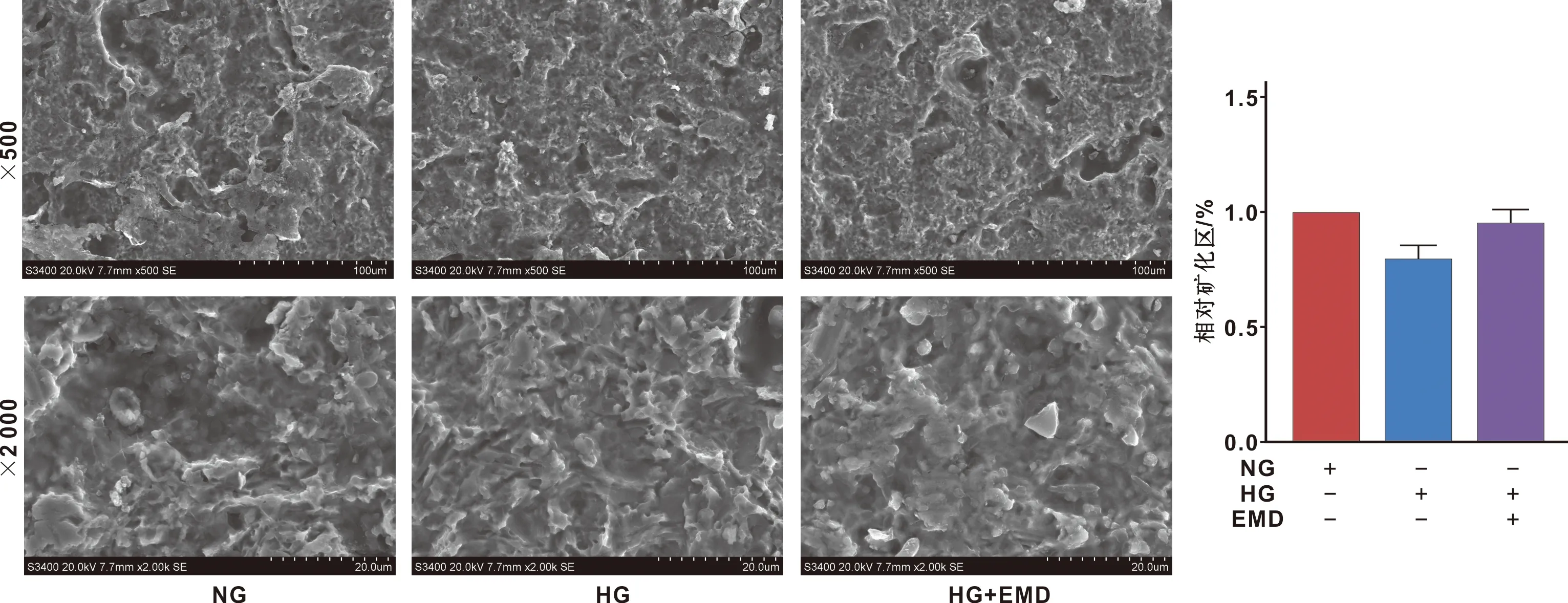
图 4 SLA钛表面矿化结节(SEM)
2.5 WB检测成骨和黏附蛋白
WB检测成骨和黏附相关的蛋白的表达(图 5A)和灰度值(图 5B),HG组较NG组成骨和黏附相关蛋白(Osterix、Runx2、COL-1、Integrin β1和Fibronectin)显著降低,HG+EMD组有不同程度的增加。
2.6 RT-qPCR检测成骨和黏附相关基因
RT-qPCR检测Osterix、Runx2、COL-1、Integrin β1和Fibronectin基因表达(图 5C),HG组成骨和黏附的mRNA的表达低于NG组,HG+EMD组升高。
2.7 β-catenin基因与蛋白表达
WB和RT-qPCR检测β-catenin的蛋白和mRNA表达(图 6);HG组β-catenin蛋白表达较量最少,EMD作用后增高,基因表达趋势与蛋白相一致。

图 6 β-catenin基因和蛋白的表达
2.8 XAV-939处理后下游的蛋白的表达变化
WB检测XAV-939处理后Wnt/β-catenin信号通路下游的成骨和黏附相关蛋白(图 7A)和灰度值(图 7B),HG组较NG组的蛋白(Osterix、Runx2、β-catenin、Integrin β1和Fibronectin)表达降低,HG+EMD表达增加,趋势与之前的检测相符合。XAV-939组的蛋白均呈下降趋势,下游的成骨和黏附相关蛋白(Osterix、Runx2、Integrin β1和Fibronectin)表达均降低(P<0.05),表明即使在高糖微环境和XAV-939的共同作用下,EMD仍可以促进SLA表面BMSCs的成骨和黏附。

图 7 XAV-939处理后Wnt/β-catenin信号通路下游成骨和黏附相关蛋白的表达变化
3 讨 论
目前,为牙列缺损的糖尿病患者进行种植义齿修复,能够获得长期有效的临床治疗效果,已是常规的口腔修复方式之一。但是,由于高血糖可能对种植体骨结合以及术后并发症的不利影响,与正常患者相比,糖尿病患者的种植体长期存留率及术后维护都具有挑战性。如何进一步改善和避免高血糖对口腔种植的不利影响?一直是口腔种植领域的关注热点之一。
本研究通过体外培养,进行细胞形态观测、成骨分化和成脂分化能力的鉴定,以及干细胞表面标志物的鉴定(图 1),证明提取细胞为BMSCs[12]。根据本课题组前期研究,在25 mmol/L葡萄糖微环境条件下,EMD诱导BMSCs增殖和成骨分化的较佳浓度为75 μg/mL,故使用该浓度进行本实验研究[13]。BMSCs在种植体表面的迁移、黏附和成骨的能力,是种植体骨结合成功的关键[14]。本研究通过Transwell检测EMD在高糖微环境中对BMSCs迁移的影响(图 2),结果提示,BMSCs迁移能力受到抑制,EMD能缓解高糖微环境对BMSCs迁移能力的损伤。ALP活性、茜素红半定量(图 3)和电镜扫描(图 4)结果提示,虽然SLA钛表面可以增加BMSCs细胞外基质的分泌以促进成骨分化[15],但在高糖微环境中,SLA钛表面BMSCs的成骨能力受到抑制,EMD可部分改善BMSCs的成骨能力。
Runx2是成骨早期的重要转录因子,Osterix 是成骨细胞才表达的转录因子,两者在BMSCs成骨分化过程中占据重要的地位[16]。COL-1可以促进细胞外基质的分泌,在成骨分化过程中使细胞外基质矿化,有利于种植体表面BMSCs的成骨和黏附,是Runx2和Osterix 成骨分化过程转录的重要下游蛋白[17]。本研究通过RT-qPCR和WB检测成骨分化的几个关键指标(Osterix、Runx2和COL-1)mRNA和蛋白的表达(图 5)。高糖微环境下,Osterix、Runx2和COL-1的表达都分别相应下调,EMD作用后,均分别出现上调,其表达趋势与ALP活性和茜素红半定量结果趋势相符合。
Integrin β1为整合素家族的重要蛋白,细胞通过整合素蛋白与生物材料相结合,Fibronectin为黏连蛋白,促进细胞外基质在种植体表面的沉积和矿化[18-19]。本研究通过RT-qPCR和WB检测Integrin β1和Fibronectin的基因和蛋白表达(图 5),在高糖微环境下其表达均下调,EMD作用下促进Integrin β1和Fibronectin表达上调。
Wnt 信号通路是由Wnt家族的配体蛋白和Frizzled家族跨膜受体蛋白结合激发的一组多下游通道的信号转导途径,根据是否依赖β-catenin蛋白,分为经典Wnt/β-catenin途径和非经典途径;其中,经典Wnt/β-catenin途径通过β-catenin在细胞质中积累,易位至细胞核后与T细胞因子/淋巴增强因子结合,启动转录下游的靶基因[20]。本研究通过RT-qPCR和WB检测β-catenin基因和蛋白(图 6),其与Osterix、Runx2、COL-1、Integrin β1和Fibronectin表达趋势一致;添加通路抑制剂XAV-939,WB结果显示(图 7),下游成骨和黏附蛋白均相受到抑制,其中,HG+XAV-939组最为显著。
综上所述,在本实验研究的高糖微环境中,SLA钛表面BMSCs成骨和黏附均受到抑制,EMD作用下可改善其抑制效应。EMD对SLA钛表面BMSCs的成骨分化和黏附的促进作用,可能与激活Wnt/β-catenin信号通路有关,其具体作用机制还需进一步研究。

