不同来源大豆寡糖的形态特征、功能组分含量和分子结构的比较研究
徐 淼 付美业 景寒松 杨桂芹*
(1.沈阳农业大学,动物科学与医学学院,沈阳 110866;2.沈阳丰美生物技术有限公司,沈阳 110179)
大豆寡糖也称大豆低聚糖,主要提取来源为大豆、脱脂豆粕、大豆乳清及大豆糖蜜等,且主要由蔗糖、棉子糖和水苏糖等组成,能替代蔗糖应用在功能性食品或低能量食品中[1-2]。研究表明,大豆寡糖功能组分[3-4]和大豆寡糖添加水平[5]显著影响肉仔鸡盲肠粪臭素的产生,对平衡家禽肠道微生态具有重要调节作用,在一定程度上能够替代抗生素[6],但大豆寡糖对动物生产性能和肠道菌群的作用效果与其来源、类型和浓度等有关[7]。《大豆低聚糖》(GB/T 22491—2008)[8]中对大豆寡糖的质量要求包括了色泽、外观、气味、杂质、灰分及大豆寡糖的含量(粉末型大豆寡糖含量≥75%,其中水苏糖、棉子糖含量大于≥30%)。由于大豆寡糖来源和加工工艺不同,其总糖、功能组分含量和分子结构会存在差异,进而影响其应用效果。已知化学结构是大豆寡糖生物活性的基础,作为混合物,分子结构能直观反映大豆寡糖的内在空间结构特征。近年来,国内外已有大量关于傅里叶红外光谱(Fourier transform infrared reflection,FTIR)技术在饲料分子结构研究中的应用报道[9-10],它具有直接、快速并且不破坏样品内在结构的特点。红外光谱能够检测饲料原料及混合饲料中碳水化合物内在结构的差异[11-13],并用于分析牛蒡寡糖的分子结构[14]。目前,有关不同来源大豆寡糖的功能组分含量及分子结构等差异的研究鲜见报道。因此,本试验选取5种不同来源的大豆寡糖,测定其微观物理形态特征、总糖和功能组分含量的差异,并利用FTIR技术测定其分子结构差异,为建立大豆寡糖结构与功能的关系奠定基础。
1 材料与方法
1.1 试验材料
本试验所用大豆寡糖均为市售商品大豆寡糖,分别记为大豆寡糖Ⅰ、大豆寡糖Ⅱ、大豆寡糖Ⅲ、大豆寡糖Ⅳ和大豆寡糖Ⅴ,其产地及产品质量标准见表1。

表1 不同来源大豆寡糖的产地及产品质量标准
1.2 试验方法
1.2.1 大豆寡糖的形态特征
利用扫描电子显微镜进行观察大豆寡糖的形态特征。将5种不同来源的大豆寡糖颗粒用双面胶固定在硅片上,通过喷金镀膜处理后,用冷场扫描电镜Regulus-8100(日立公司,日本)分别放大200×、800×、1 000×和1 500×等进行扫描,观察5种不同来源大豆寡糖的微观形态特征。
1.2.2 大豆寡糖中总糖和功能组分含量
1)总糖含量:采用蒽酮比色法[15]测定。主要仪器为UV-5500PC型紫外可见分光光度计,主要药品为蒽酮试剂和硫脲(沈阳西陇化工有限公司)、浓硫酸(分析纯)和葡萄糖标准品(分析纯)。
2)功能组分含量:采用紫外分光光度法,参照文献[16-17]测定,主要仪器为Evolution-201/220紫外可见分光光度计(Thermo Scientific公司,美国),主要试剂为寡糖(蔗糖、棉子糖、水苏糖)标准品(上海瑞永生物科技有限公司)和浓盐酸(分析纯)。
3)分子结构:采用FTIR法[18-19]测定。主要仪器为Nicolet iS5 FTIR仪(Thermo公司,美国),将干燥的5种大豆寡糖样本与溴化钾粉末混合(按1∶100的比例)后在研钵中研磨5 min,将混合物用红外压片机(769YP-15A粉末压片机)进行压片(压片厚度=0.25 mm,呈透明状),恒温箱中平衡5 min后置于FTIR仪上进行光谱扫描,扫描波段4 000~400 cm-1,检测器为氘代硫酸三甘肽(DTGS)检测器,以溴化钾为背景,背景图谱扫描256次,并对空气(CO2和水蒸气)进行校正,分辨率为4 cm-1,每个样品3个重复,收集每个样本的光谱图。
1.3 数据处理分析
利用OMINIC 8.0软件处理得到的FTIR图谱,用Excel 2010表格记录其峰高和峰面积。采用SPSS 20.0软件中的单因素方差分析(one-way ANOVA)对红外光谱数据、化学成分数据进行分析处理,当数据差异显著时,采用Duncan氏法进行多重比较,P<0.01表示差异极显著,P<0.05表示差异显著,试验结果用“平均值±标准误”表示。
2 结果与分析
2.1 不同来源大豆寡糖的形态特征
由图1和表2可知,5种大豆寡糖在颗粒形态上有球形和多面体形,在颗粒结构上有单粒结构和复粒结构。大豆寡糖Ⅰ和大豆寡糖Ⅱ呈球体、颗粒尺寸较小、分布不均匀,颗粒表面较光滑;大豆寡糖Ⅲ、大豆寡糖Ⅳ和大豆寡糖Ⅴ呈多面体,且表面有褶皱、凹凸不平,颗粒尺寸较大且大小不一。

从左至右放大倍数依次为:大豆寡糖Ⅰ,200×、800×和1 000×;大豆寡糖Ⅱ,200×、1 000×和1 500×;大豆寡糖Ⅲ,200×、1 000×和6 000×;大豆寡糖Ⅳ,200×、800×和2 000×;大豆寡糖Ⅴ,200×、1 500×和3 000×。

表2 不同来源大豆寡糖颗粒超微结构形态特征
2.2 不同来源大豆寡糖的总糖和功能组分含量
由表3可知,5种大豆寡糖(Ⅰ~Ⅴ)中的总糖含量分别为66.50%、82.75%、75.73%、65.54%和70.39%。5种大豆寡糖中3种功能组分含量依次为,蔗糖含量:大豆寡糖Ⅴ>大豆寡糖Ⅲ>大豆寡糖Ⅰ>大豆寡糖Ⅱ>大豆寡糖Ⅳ;棉子糖含量:大豆寡糖Ⅱ>大豆寡糖Ⅳ>大豆寡糖Ⅰ>大豆寡糖Ⅲ>大豆寡糖Ⅴ;水苏糖含量:大豆寡糖Ⅴ>大豆寡糖Ⅲ>大豆寡糖Ⅰ>大豆寡糖Ⅳ>大豆寡糖Ⅱ。
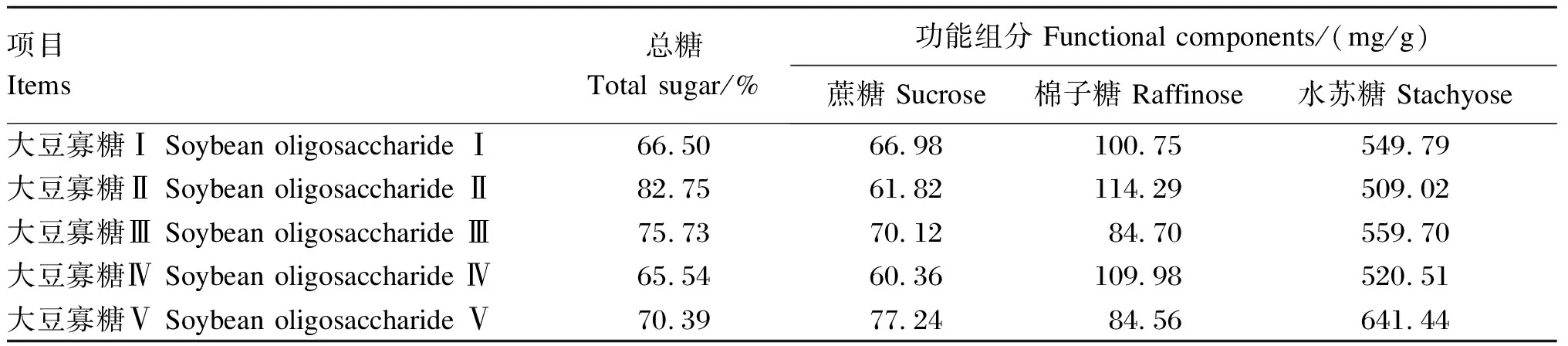
表3 不同来源大豆寡糖的总糖和功能组分含量
2.3 不同来源大豆寡糖的分子结构
图2为不同来源大豆寡糖的FTIR图谱,已知波数为860 cm-1光谱区域特征吸收峰为由C—H的变角振动差异而构成的呋喃环C型结构,波数为928 cm-1光谱区域特征吸收峰为由呋喃环的对称伸缩振动差异而构成的呋喃环A型结构,波数为1 000 cm-1光谱区域特征吸收峰为寡糖特征吸收峰。

图2 不同来源大豆寡糖的FTIR图谱(波数1 200~800 cm-1)
由表4可知,大豆寡糖Ⅱ在波数为860 cm-1位置的吸收峰面积(A_860值)极显著低于其余4种大豆寡糖(P<0.01),由大到小依次为:大豆寡糖Ⅲ>大豆寡糖Ⅳ>大豆寡糖Ⅴ>大豆寡糖Ⅰ>大豆寡糖Ⅱ,即大豆寡糖Ⅲ在空间结构中所含呋喃环C型结构占比最大。5种大豆寡糖在波数为928 cm-1位置的吸收峰面积(A_928值)之间差异极显著(P<0.01),由大到小依次为:大豆寡糖Ⅲ>大豆寡糖Ⅳ>大豆寡糖Ⅴ>大豆寡糖Ⅰ>大豆寡糖Ⅱ,说明大豆寡糖Ⅲ在空间分子结构中含呋喃环A型结构所占比例高于其余4种大豆寡糖。大豆寡糖Ⅰ和大豆寡糖Ⅲ在波数为1 024 cm-1位置的吸收峰面积(A_1 024值)与其余大豆寡糖相比差异极显著(P<0.01),由大到小依次为:大豆寡糖Ⅲ>大豆寡糖Ⅰ>大豆寡糖Ⅳ>大豆寡糖Ⅴ>大豆寡糖Ⅱ。5种大豆寡糖在波数为1 151 cm-1位置的吸收峰面积(A_1 151值)之间差异极显著(P<0.01),由大到小依次为:大豆寡糖Ⅲ>大豆寡糖Ⅳ>大豆寡糖Ⅰ>大豆寡糖Ⅴ>大豆寡糖Ⅱ,说明大豆寡糖Ⅲ在空间分子结构中含寡糖最多。
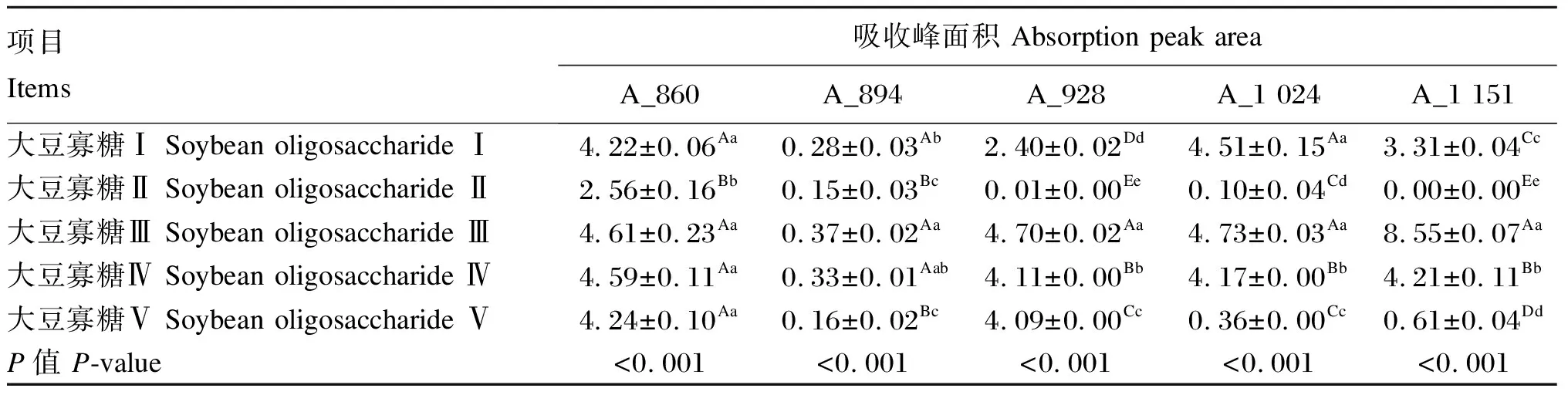
表4 不同来源大豆寡糖的FTIR图谱分析
3 讨 论
3.1 不同来源大豆寡糖的形态特征
利用扫描电子显微镜观察分析多糖微观形态结构是一种较为先进的技术方法[20-21]。扫描电子显微镜操作简单,放大倍数和分辨率高,更容易进行超微结构形态观察[22-23]。由于原料的来源、生产工艺和储存条件等的不同,多糖颗粒的形态和大小尺寸各有不同,这种形态上的差异可能对多糖的理化性质、生物学活性及营养特性有所影响[24-25]。
徐鑫[26]通过对淀粉水解寡糖的研究发现,溶液法结晶的样本与标准样品的电子显微镜扫描图有差异,而不同的干燥方法也会导致电子显微镜扫描图不同,且通过流化床喷雾干燥法可以得到外形圆整的多孔颗粒。本试验研究表明,不同来源大豆寡糖样品呈现规格不同的聚集紧密性,这可能是由于不同来源大豆寡糖的原料及加工工艺的差异,导致样品呈现不同纯化程度,进而导致大豆寡糖聚集性的紧密程度差异[27]。多糖的种属不同不会影响多糖在空间结构上的相似性[28-29]。徐铮铮[24]研究表明,在不同扫描电子显微镜观察下,不同草菇多糖的表面结构多呈不规则片状,且差异较大,可能会导致两者的生物学活性差异。本试验研究表明,5种大豆寡糖的微观颗粒结构差异较大,尺寸大小不一,颗粒形态上有球形和多面体形之分,颗粒表面的形态特征差异较大,有的表面光滑,有的较为褶皱。不同来源大豆寡糖的微观表面结构的多样性,可能会使大豆寡糖有多种生物活性。
3.2 不同来源大豆寡糖的总糖和功能组分含量
大豆寡糖是大豆及其制品中可溶性糖的总称,包含蔗糖、棉子糖和水苏糖等主要功能组分,适量大豆寡糖对人和动物肠道具有潜在的益生功能。王曙明等[30]采用碳水化合物分析仪对吉林省181份大豆品种资源中的大豆寡糖含量进行了分析,发现大豆寡糖(水苏糖和棉子糖)的含量变异范围不同,但不同地区间大豆寡糖含量没有明显的规律性。宋志峰等[31]采用高效液相色谱(HPLC)法对吉林省500份大豆种质中的大豆寡糖含量进行分析,发现大豆寡糖(蔗糖、水苏糖和棉子糖)含量品种间差异显著。王潇潇等[19]采用近红外反射光谱法测定了160份大豆制品(去皮豆粕、膨化豆粕、发酵豆粕和膨化大豆)中大豆寡糖(蔗糖、棉子糖及水苏糖)的含量,结果表明大豆制品的来源、加工工艺和年份不同,寡糖的含量差异较大,其中发酵豆粕的各种寡糖含量较低。李俊茹[32]通过分析324份大豆籽粒中大豆寡糖及其组分含量,发现各品种间大豆寡糖及其组分含量均存在极显著差异,以棉子糖含量的变异系数最大,各地区大豆寡糖的功能组分含量也存在差异。本试验通过蒽酮比色法对不同来源的大豆寡糖产品的总糖含量进行了测定,用蒽酮比色法测定总糖含量应用比较普遍,其操作简单、灵敏、快捷、准确且经济,适合大批量的样品[33-35]。本试验得出,5种大豆寡糖的功能组分含量也存在差异,大豆寡糖的总糖含量从高到低为大豆寡糖Ⅱ>大豆寡糖Ⅲ>大豆寡糖Ⅴ>大豆寡糖Ⅰ>大豆寡糖Ⅳ;通过利用紫外分光光度法对5种不同来源大豆寡糖的功能组分糖含量进行测定,结果显示大豆寡糖Ⅴ和大豆寡糖Ⅲ中所含蔗糖和水苏糖含量均高于大豆寡糖Ⅰ、大豆寡糖Ⅱ和大豆寡糖Ⅳ,棉子糖含量均低于大豆寡糖Ⅰ、大豆寡糖Ⅱ和大豆寡糖Ⅳ。不同来源大豆寡糖功能组分含量的差异可能与其提取来源、提取工艺等有关。
3.3 不同来源大豆寡糖的分子结构
利用FTIR技术分析大豆寡糖的化学成分是农业和食品领域内较为领先的技术方法之一。相比于传统的评价饲料营养价值的方法,FTIR技术能够分析饲料分子结构,饲料样品中分子的化学键可吸收红外光辐射,得出的FTIR图谱主要用于鉴别化合物的化学键类型,进而对化合物分子结构进行推测,推测其组成不同物质的各种分子基团(如O—H、N—H、C—H、S—H和CO等都有特定的吸收区域),具有简单、快速等优点,应用广泛[36]。FTIR技术可帮助识别吡喃糖、呋喃糖的构型以及判别多糖的特征吸收峰[37],图谱中的峰数、峰位和峰强与样品中组分的分子结构有关,因此被测饲料样品的光谱特征是多种组分吸收光谱的综合表现。本试验利用FTIR技术研究不同来源大豆寡糖的光谱图中所含化学键、官能团的类型差异进而分析分子结构的不同,为后续分析大豆寡糖的理化特性及其功效提供参考。
糖类即碳水化合物的光谱特征吸收峰为总碳水化合物(波数1 212~861 cm-1)、非结构性碳水化合物(波数946~813 cm-1)和结构性碳水化合物(波数1 486~1 186 cm-1)等。波数960~730 cm-1为多糖的特征吸收峰,是鉴定多糖的关键峰[38];寡糖的特征吸收峰集中在波数1 000 cm-1左右,其中光谱吸收峰为波数1 212~800 cm-1[39]。本试验结果显示,大豆寡糖Ⅰ和大豆寡糖Ⅲ的A_1 024值极显著高于其余大豆寡糖,其中大豆寡糖Ⅲ的A_1 024值最高,说明大豆寡糖Ⅲ所含寡糖含量最高。张琳[18]研究发现,在波数860 cm-1附近出现的吸收峰为C—O—C的对称伸缩振动和C—H的变角振动。本试验结果显示,大豆寡糖Ⅱ在波数为860 cm-1位置的吸收峰面积极显著的低于其余4种大豆寡糖,大豆寡糖Ⅲ在波数为860 cm-1位置的吸收峰面积最高,说明大豆寡糖Ⅲ在空间分子结构中C—O—C的对称伸缩振动和C—H的变角振动的占比可能高于其余大豆寡糖。龚加顺等[40]研究发现,多糖在波数为894 cm-1位置附近出现的吸收峰为吡喃环。由于呋喃环的空间构型是对称的,C—H在呋喃环上下的任意位置都是对等的,所以在光谱图中α-和β-键的吸收峰差异较小,呋喃环衍生物具有A、B、C和D 4种类型特征吸收区域[41]。潘晓东[39]研究发现,在波数(924±13)cm-1附近出现的吸收峰为呋喃环A型,在波数(858±7)cm-1附近出现的吸收峰为呋喃环C型。本试验结果显示,在FTIR图谱中,波数928 cm-1的特征峰吸收面积最大的是大豆寡糖Ⅲ、最小的是大豆寡糖Ⅱ,说明大豆寡糖Ⅲ的呋喃环A型和呋喃环C型结构在空间分子结构分布可能高于其余大豆寡糖。呋喃环的对称伸缩振动在空间结构上的差异,是造成这些现象的主要原因。上述测试吸收峰值不是完全套用,由于操作环境、仪器以及测试技术的差异导致试验存在一定偏差,另外,样品自身差异的不同会影响预测结果[19]。本试验也存在这种偏差,但在波数1 200~800 cm-1区域吸收峰明显。
4 结 论
① 大豆寡糖Ⅰ和大豆寡糖Ⅱ颗粒较小,多呈多囊状球体,表面光滑;大豆寡糖Ⅲ、大豆寡糖Ⅳ和大豆寡糖Ⅴ颗粒相对较大,多呈不规则多面体,表面凹凸不平。
② 大豆寡糖Ⅳ总糖含量最低,大豆寡糖Ⅱ总糖含量最高;大豆寡糖Ⅴ和大豆寡糖Ⅲ中的蔗糖和水苏糖含量高于其余大豆寡糖,棉子糖含量低于其余大豆寡糖。
③ 大豆寡糖Ⅱ的A_860、A_928和A_1 151值均极显著低于其余来源的大豆寡糖;大豆寡糖Ⅲ的A_860、A_928、A_1 024和A_1 151值均高于其余来源的大豆寡糖。

