结直肠癌肝转移合并同时性肺转移患者手术治疗疗效分析
王立军,王宏伟,金克敏,刘伟,包全,王崑,邢宝才
(北京大学肿瘤医院暨北京市肿瘤防治研究所肝胆胰外一科;恶性肿瘤发病机制及转化研究教育部重点实验室,北京100142)
肝脏是结直肠癌最常见的转移器官,完整切除结直肠癌原发灶及肝转移后5年生存(overall survival,OS)率达到30%~50%,远远优于姑息化疗[1-2]。得益于肝转移手术治疗疗效的鼓舞,肝转移手术治疗的适应人群在逐步向合并肝外转移拓展[3-4]。肺是继肝脏之后结直肠癌第二常见的远处转移器官,特别是中下段直肠癌更容易出现肺转移[5-6]。随着胸部CT 在分期检查应用中的普及[7],导致肺部结节的检出逐渐增多,因此确诊结直肠癌肝转移的同时合并肺转移或不确定肺结节的情形在临床实践中也越发常见。
目前国际指南和共识中对于结直肠癌肝转移合并可切除的肺转移应该积极手术治疗已经得到认同。回顾性研究显示,手术完整切除结直肠癌原发灶、肝转移以及肺转移的患者,5年OS 率接近50%[8-9],而单纯姑息化疗的患者5年OS 率为20%[10],中位OS 仅为16~24个月[11-12],生存差异明显。但对于合并不可切除的肺转移是否应该放弃手术暂没有定论。结直肠癌肝转移合并肺转移患者的手术涉及结直肠、肝、肺等多个部位,手术创伤大、花费高,并且需要多学科的通力合作和流程的优化,其生存能否优于姑息化疗尚存在疑问;因此,是否开启手术治疗是考验多学科团队治疗决策的难题。
在结直肠癌肺转移的诊疗专家共识[13]中根据肺转移与其他转移器官(如肝)出现的顺序将肺转移分为“初始肺转移(即同时性肝肺转移) ”和“非初始肺转移(如肝转移治疗后再出现的肺转移)”[14]。目前结直肠癌肝转移合并肺转移行手术治疗的研究纳入人群异质性较大[15-16],部分研究涵盖了合并肝、肺以外器官转移的人群和“非初始肺转移”的人群[17],后者因肝转移已完成治疗而不涉及肝转移是否手术的抉择,因此临床诊疗的争议较小。
本研究将目标人群限定于确诊结直肠癌肝转移时合并同时性肺转移的患者。根据肺转移是否接受根治性局部治疗分别统计分析两组人群接受手术治疗的生存结果,观察其是否优于文献报道的姑息化疗,并探讨合并不可切除或未切除肺转移人群的预后影响因素。
1 资料与方法
1.1 一般资料
本研究采用回顾性队列研究方法,分析2008年1月—2020年12月期间,在北京大学肿瘤医院肝胆胰外一科行肝转移手术治疗的结直肠癌肝转移患者的资料。纳入标准:⑴诊断结直肠癌肝转移的同时发现肺转移或不确定肺结节经随访观察证实为肺转移;⑵原发灶及肝转移均达到完整切除(R0/R1);⑶临床病理资料完整。排除标准:⑴射频后或手术后复发患者;⑵不确定肺结节经随访观察无变化者;⑶合并肝肺以外其他部位转移患者;⑷原发灶及肝转移灶姑息切除或分期手术未完成者。
根据上述标准,共209例患者在初始诊断结直肠癌肝转移时基线检查发现肺转移或不确定肺结节,其中82例患者在随后的随访观察中肺结节排除转移,剩余127例患者最终纳入本研究。患者原发灶及肝转移灶均按肿瘤根治原则行完整切除(R0/R1),以肺转移是否接受过根治性局部治疗(包括手术、消融或立体定向放疗),分为肺转移局部治疗组(简称“局部治疗组”)和肺转移非局部治疗组(简称“非局部治疗组”),术后根据临床实践行常规化疗,除非患者无法耐受或拒绝。化疗、手术、消融或放疗等选择均获得患者的知情同意并签署知情同意书。本研究符合赫尔辛基宣言,并获得北京大学肿瘤医院伦理委员会审批通过(伦理审批号:2019KT68-重)。
1.2 结直肠癌和肝转移的手术治疗及肺转移局部治疗方式
根据肿瘤根治原则进行结直肠癌原发灶根治性切除,手术由胃肠外科医师或肝胆外科医师完成。肝转移切除根据肿瘤部位、大小及数目分别采用楔形局部切除、肝段切除、肝叶切除或半肝及以上切除,并保证1 mm 及以上切缘。部分患者采取切除联合射频消融的组合方式达到影像学无瘤状态。通常对于肝转移灶切除超过3个肝段的,选择原发灶及肝转移瘤分期切除,除非原发灶位于右半结肠。如首次就诊时已切除原发灶,本中心手术仅处理肝转移瘤。
肺转移的处理通常在肝转移手术治疗后4 周及以上。局部手段包括肺楔形切除、肺叶切除、肺结节的冷冻消融治疗和肺结节的立体定向放疗,治疗方式的选择依据肺结节的位置、大小、数目以及与肺内重要血管或支气管的关系而确定,治疗方式的选择由胸外科、放疗科或介入治疗科医师评估后决定。
1.3 围手术期化疗
鉴于结直肠癌肝转移合并肺转移的患者属于高危复发风险人群,因此肝切除术前通常推荐全身化疗,方案选择两药或三药化疗方案(奥沙利铂和/或伊立替康联合氟尿嘧啶类药物),部分患者联合分子靶向治疗(西妥昔单抗或贝伐珠单抗),除非存在治疗禁忌或患者拒绝。
肝切除术后如无禁忌推荐常规辅助化疗,术前化疗后进展或患者拒绝及无法耐受者除外。
1.4 观察指标与随访
本研究主要观察指标为两组OS 和无复发生存(recurrence-free survival,RFS)。其中OS 定义为针对肝转移的初始化疗时间或初始手术时间至末次随访或死亡时间;RFS 定义为自肝转移手术至术后首次影像学诊断的复发时间或疾病进展时间。
患者在肝切除术后1个月内进行首次影像学评估,此后每3个月进行1 次影像学评估;采用门诊及电话随访的方式进行追踪管理,全部随访截止至2021年11月30 日。
1.5 统计学处理
采用SPSS 25.0 软件进行统计学分析。连续变量用中位数(范围)[M(范围)]描述,组间比较采用Mann WhitneyU检验;分类变量以频数及百分比[n(%)]表示,组间比较采用χ2检验。生存分析采用Kaplan-Meier 法,生存时间的比较采用Logrank 检验。单因素与多因素分析采用Cox 回归模型。P<0.05 为差异有统计学意义。
2 结 果
2.1 一般治疗情况
共127例患者纳入最终分析,其中非局部治疗组96例,局部治疗组31例,局部治疗手段包括手术15例,消融7例,放疗7例,放疗加消融联合2例。对两组患者的一般资料、结直肠癌原发灶、肝转移、肺转移和基因状态等临床病理资料分别对比分析。结果显示,两组患者在性别比例、年龄、体质量指数(BMI)、美国麻醉医师协会(ASA)分级、原发性淋巴结分期、同时性或异时性转移分布、肝转移数目、直径和术前CEA 水平、肺转移数目、RAS 基因状态分布等特征上差异均无统计学意义(均P>0.05)。两组患者肝切除术前接受化疗的比例均>80%,肝切除术前化疗方案、是否使用靶向药物、化疗周期、化疗线数、末线化疗后影像评效[部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)]、辅助化疗有无及血液学等指标方面差异均无统计学意义(均P>0.05)。局部治疗组中,原发灶T4 分期的比例更低,初次诊断时肺结节的直径更大,与非局部治疗组相比存在统计学差异(P<0.001)。另外,全组患者术后30 d 内均无手术相关死亡。两组患者一般资料比较详见表1。

表1 两组患者临床病理资料比较(续)Table 1 Comparison of the clinicopathologic data of the two groups of patients(continued)
2.2 局部治疗组与非局部治疗组患者的预后分析
全组患者中位随访时间为30(4~118)个月,失访率3%。全组患者中位OS 为41(4~118)个月,1、3年OS 率分别为96.8%和59.7%;其中非局部治疗组中位OS 为37(4~118)个月,1、3年OS 率分别为95.8% 和51.2%; 局部治疗组中位OS 为72 (15~101)个月,1、3年OS 率分别为100%和82.9%,优于非局部治疗组(P=0.001)。非局部治疗组中位RFS 为8(1~37)个月,1、3年RFS 率分别为30.8%和2.4%;局部治疗组中位RFS 为10(3~67)个月,1、3年RFS 率分别为38.7%和18.1%,两组接近统计学差异(P=0.055)(图1)。
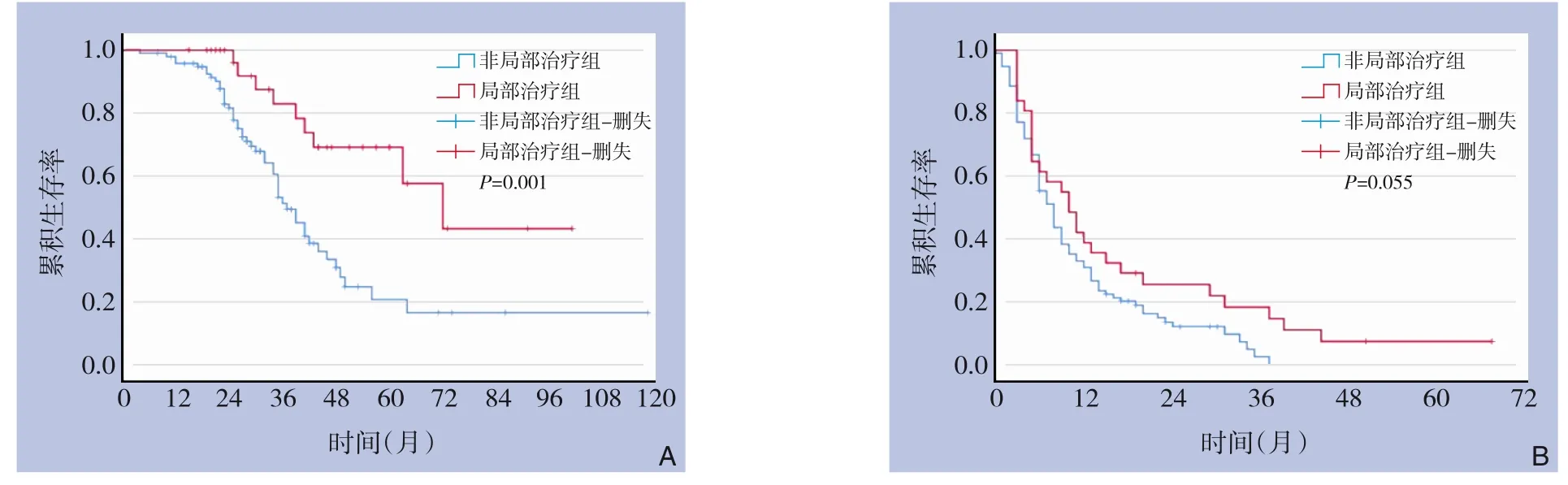
图1 局部治疗组与非局部治疗组的生存曲线 A:OS曲线;B:RFS曲线Figure 1 Survival curves of patients in local treatment group and non-local treatment A:OS curves;B:RFS curves
2.3 非局部治疗组患者的预后相关因素分析
为探讨肺转移不可切除的患者进行结直肠癌及肝转移手术治疗的意义,进一步对非局部治疗组的96例患者进行预后相关因素分析。Cox 单因素分析结果显示,原发肿瘤T4 分期和RAS 基因突变是影响OS 的危险因素,而性别、年龄、原发性淋巴结分期、同时性或异时性转移、肝转移数目、直径和术前CEA 水平、左半或右半结直肠癌、肝切除术前是否化疗以及化疗后不同影像评效、肺转移数目和直径等因素与OS 无关(表2)。将原发肿瘤T 分期和RAS 基因状态两个因素代入Cox 回归模型,多因素分析显示原发肿瘤T4 分期和RAS 基因突变是影响OS 的独立危险因素(表3)。

表2 影响结直肠癌肝转移合并不可切除肺转移患者术后OS的单因素分析Table 2 Univariate analysis of factors affecting postoperative OS in patients with colorectal cancer liver metastasis and unresectable lung metastasis

表3 影响结直肠癌肝转移合并不可切除肺转移患者术后OS的多因素分析Table 3 Multivariate analysis of factors affecting postoperative OS in patients with colorectal cancer liver metastasis and unresectable lung metastasis
将T0~T3 分期和RAS 基因野生型分别定义为0 分,将T4 分期和RAS 基因突变各自定义为1 分,两者之和定义为患者的危险评分。将3个亚组生存进行生存,结果显示,低危组(0 分)中位OS 为56 (12~71)个月,中危组(1 分) OS 为37 (10~118)个月,高危组(2 分) 中位OS 为27 (4~35)个月,组间差异均达到统计学差异(均P<0.05)(图2)。
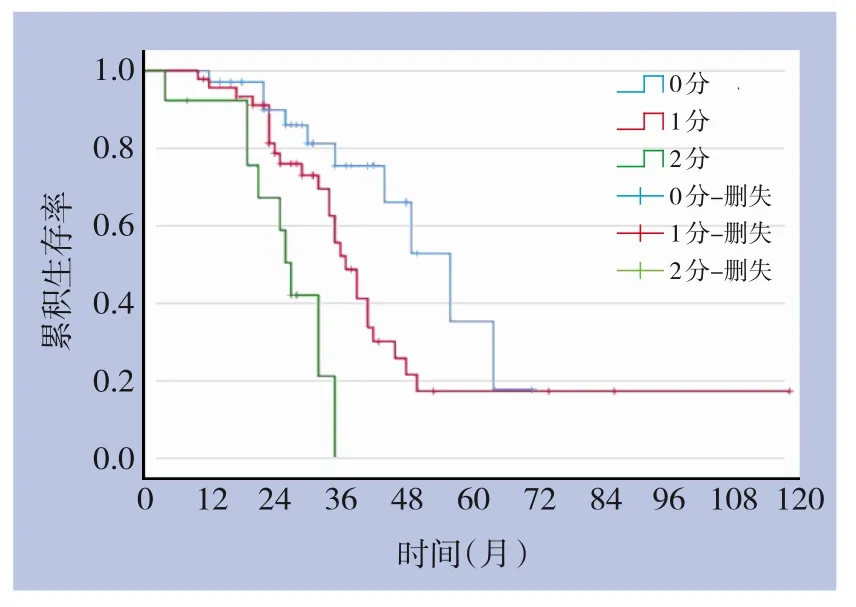
图2 非局部治疗组合并不同危险因素患者OS比较Figure 2 Comparison of the OS rates in patients with different risk factors in non- local treatment group
3 讨 论
结直肠癌肝转移患者的手术治疗疗效已经得到广泛认可。目前ESMO 指南及NCCN 指南总体原则上认为合并不可切除的肝外转移是手术的禁忌[18-19],而对于合并可切除的肝外转移患者是否可以手术治疗没有明确否定。目前支持合并肝外转移行手术治疗的研究多为回顾性研究,证据等级相对较低,没有且很难开展III 期随机对照研究,因此对于肝转移手术适应证的争议一直存在[20]。在结直肠癌肝转移合并肝外转移的器官中,探讨手术适应证值得关注的器官主要包括肺、肝门淋巴结[21-22]和腹膜[3,23],其他转移部位如骨、脑[24]等往往预示着肿瘤广泛转移的状态而较少探讨手术适应证。对于结直肠癌患者,由于解剖回流的关系,除了肝转移外,肺是最常见的远处转移器官[14],因此备受关注。本研究主要探讨确诊结直肠癌肝转移时合并同时性肺转移的人群,研究人群同质性较强,临床指导意义更精准。
得益于本中心所在单位数字化建设的完善,基线检查中胸部CT 发现的肺结节得以在随访中持续对比观察,以明确是否为转移。尽管如此,对于1 cm 以下的肺部结节的诊断及定位仍相对困难[25],另外受肺呼吸储备功能的局限和肿瘤数目的影响,目前多学科团队对于肺转移瘤的切除没有肝转移瘤切除的关注度高,因此切除率相对低下[26]。本研究中,局部治疗组的病例数明显低于非局部治疗组,另外局部治疗组基线的肺转移灶直径明显大于非局部治疗组均提示多学科团队对肺转移瘤的关注度和局部治疗的积极程度均有待进一步加强。
从生存角度来看,文献[11-12]报道结直肠癌肝转移合并肺转移的患者选择单纯姑息化疗,中位OS仅为16~24个月。一项来自欧洲的多中心研究[9]纳入了结直肠癌肝转移患者共9 619例,分成3 组。其中组1 为仅合并肝转移并切除患者;组2 为肝肺转移并均切除的患者;组3 为肝肺转移仅行肝切除而肺未切除的患者。校正后的生存分析结果显示,组2 的5年OS 率达到44.5%,与单纯肝转移手术组相比没有统计学差异,后者的5年OS 率达到51.5%。组3 的5年OS 率尽管低于组1 和组2,但也达到14.3%,部分患者得到了生存获益。本研究中,在完整切除结直肠癌和肝转移后肺转移也接受局部治疗的患者,中位OS 高达72(15~101)个月,3年OS 率为82.9%,提示即使合并肺转移也应该积极追求肠、肝、肺3个部位的手术治疗或局部治疗。另外,随着立体定向放疗[27]和消融治疗[28]等局部治疗手段的进步,给更多肺转移手术困难的病灶带来了根治性治疗的机会,因此合并肺转移的治疗应该越来越积极。
对于合并不可切除的肺转移患者是否应该切除结直肠癌原发灶及肝转移还没有定论,特别是肝转移负荷重、预计手术创伤较大时,临床医师往往难以下定“决心”手术。但从近期的回顾性研究[8-9]来看,由于肺转移进展相对缓慢,而肝转移灶的进展更快、死亡风险更高,因此积极切除原发灶及肝转移而不切除肺转移也可以给患者带来生存的延长,获得较好的3年OS 率,也优于文献报道的单纯姑息治疗。本研究发现,在肺转移不可切除或未局部治疗的亚组人群中,左半或右半结直肠癌、肝切除术前是否化疗以及化疗后不同影像评效、肺转移数目和直径等因素与OS 无关,仅仅RAS 基因突变和原发灶T4 分期与OS 相关,但即使合并上述2个高危因素的患者行原发灶及肝转移手术后中位OS 也达到27个月,尽管未能直接比较但数值上优于文献报道的姑息治疗;而没有高危因素或合并1个高危因素者,生存更佳。所以本研究认为,即使肺转移不可局部治疗,也应该积极选择原发灶及肝转移的手术治疗。但需要注意的是,患者在进行手术治疗前需要进行充分的影像评估,排除肝肺以外的其他部位转移;另外基因检测[29]和术前化疗[30]等生物学行为筛选也是必要的。最终是否手术以及手术的时机最好由多学科团队讨论后决定更为合适。
本研究存在着一定的不足之处。首先,由于为回顾性研究,不可否认的是存在一定的病例选择偏倚、随访时间不足和病例数偏少的局限性。其次,由于首诊中心的差异和患者肿瘤负荷以及是否合并急迫症状的不同,患者初始治疗的选择无法达到统一的标准,部分患者肝转移治疗前未接受系统化疗。另外3例患者因经济及标本原因无法行RAS 基因检测,可能对结果有一定影响。除此以外,患者肺转移的局部治疗于胸外科、介入治疗科或放疗科完成,部分患者甚至于外院完成,因此肺转移治疗的并发症、后续的辅助化疗周期及完成情况难以详细记录到每例患者,可能会对结果有一定影响,因此,期待有更高级别证据的研究出现,以得出更为可靠的结论。
综上所述,对于结直肠癌肝转移合并同时性肺转移的患者应该积极选择结直肠癌原发灶和肝转移的手术治疗和肺转移的根治性局部治疗。即使肺转移不可局部治疗时,切除结直肠癌原发灶及肝转移的患者的生存数据也优于文献报道的姑息治疗,尽管原发灶T4 分期同时合并RAS 基因突变的患者生存相对较差。
利益冲突:所有作者均声明不存在利益冲突。

