何首乌及首乌藤中二蒽酮类成分研究进展△
杨建波,汪祺a,高慧宇,王雪婷,宋云飞,王莹,程显隆,魏锋*,靳洪涛,段宝忠,马双成*
1.中国食品药品检定研究院,北京 100050;2.中国医学科学院 药物研究所,北京 100050;3.大理大学 药学院,云南 大理 671000
何首乌为蓼科植物何首乌Polygonum multiflorumThunb.的干燥块根,为著名传统补益类中药,有生和制何首乌之分,生何首乌具有解毒、消痈、截疟、润肠通便等功效;制何首乌具有补肝肾、益精血、乌须发、强筋骨等功效[1]183-184。首乌藤,别名夜交藤,为何首乌的干燥藤茎,秋、冬二季采割,除去残叶,捆成把或趁鲜切段,干燥,具有养血安神、祛风通络的功效,可用于治疗失眠多梦、血虚身痛、风湿痹痛和皮肤瘙痒等[1]277-278。何首乌和首乌藤均为我国传统中药,其中何首乌为传统中草药的“四大仙草”之一,被广泛应用于治疗乌发及脱发、补肝肾和调血脂的中药制剂和保健食品之中[2]。文献报道[3-12],何首乌和首乌藤中主要含有蒽醌类(单核蒽醌和双核蒽醌)、二苯乙烯类、黄酮类和多酚类等成分。但是,近年来关于服用何首乌、首乌藤及其相关制剂所引发的肝损伤不良反应报道较多,已经引起国内外科研人员的高度关注[13-14]。
本课题组首次从何首乌中分离得到双核蒽醌,即二蒽酮类成分,药理研究结果显示其也具有一定的肝毒性[15-17],提示其可能与何首乌造成肝损伤有一定的相关性。因此,本文对何首乌及首乌藤中二蒽酮类成分的提取分离、在线鉴别、安全性评价和含量测定等方面进行系统的综述,为该类成分肝毒性的进一步研究提供参考。
1 二蒽酮类成分的提取分离
本课题组采用大孔吸附树脂(DM-8 型)、十八烷基硅烷键合硅胶(ODS)、Sephadex LH-20、MCI和半制备液相等多种色谱技术,对何首乌70%乙醇提取物进行了系统的分离和纯化,从中首次分离得到14 个二蒽酮类成分[6-8],分别为反式-大黄素-大黄素二蒽酮(1)、顺式-大黄素-大黄素二蒽酮(2)、polygonumnolide A1(3)、polygonumnolide A2(4)、polygonumnolide A3(5)、polygonumnolide A4(6)、polygonumnolide B1(7)、polygonumnolide B2(8)、polygonumnolide B3(9)、polygonumnolide C1(10)、polygonumnolide C2(11)、polygonumnolide C3(12)、polygonumnolide C4(13)和polygonumnolide E(14)。薄瑞[18]采用水浴回流提取法对首乌藤中的二蒽酮类成分进行提取,获得70%乙醇提取物;采用D101型大孔吸附树脂法对首乌藤70%乙醇提取物中的二蒽酮进行了选择性富集;利用正、反相硅胶和半制备液相等多种色谱技术对其进行系统的分离和纯化,从中首次分离得到2 个二蒽酮苷类成分,分别为PMC-a-1(15)与PMC-a-2(16)。
目前,从何首乌及首乌藤中所分离得到16 个二蒽酮类成分主要为大黄素-大黄素型二蒽酮和大黄素-大黄素甲醚型二蒽酮,是通过大黄素的C-10和大黄素甲醚的C-10相互聚合而成,具体结构见图1。
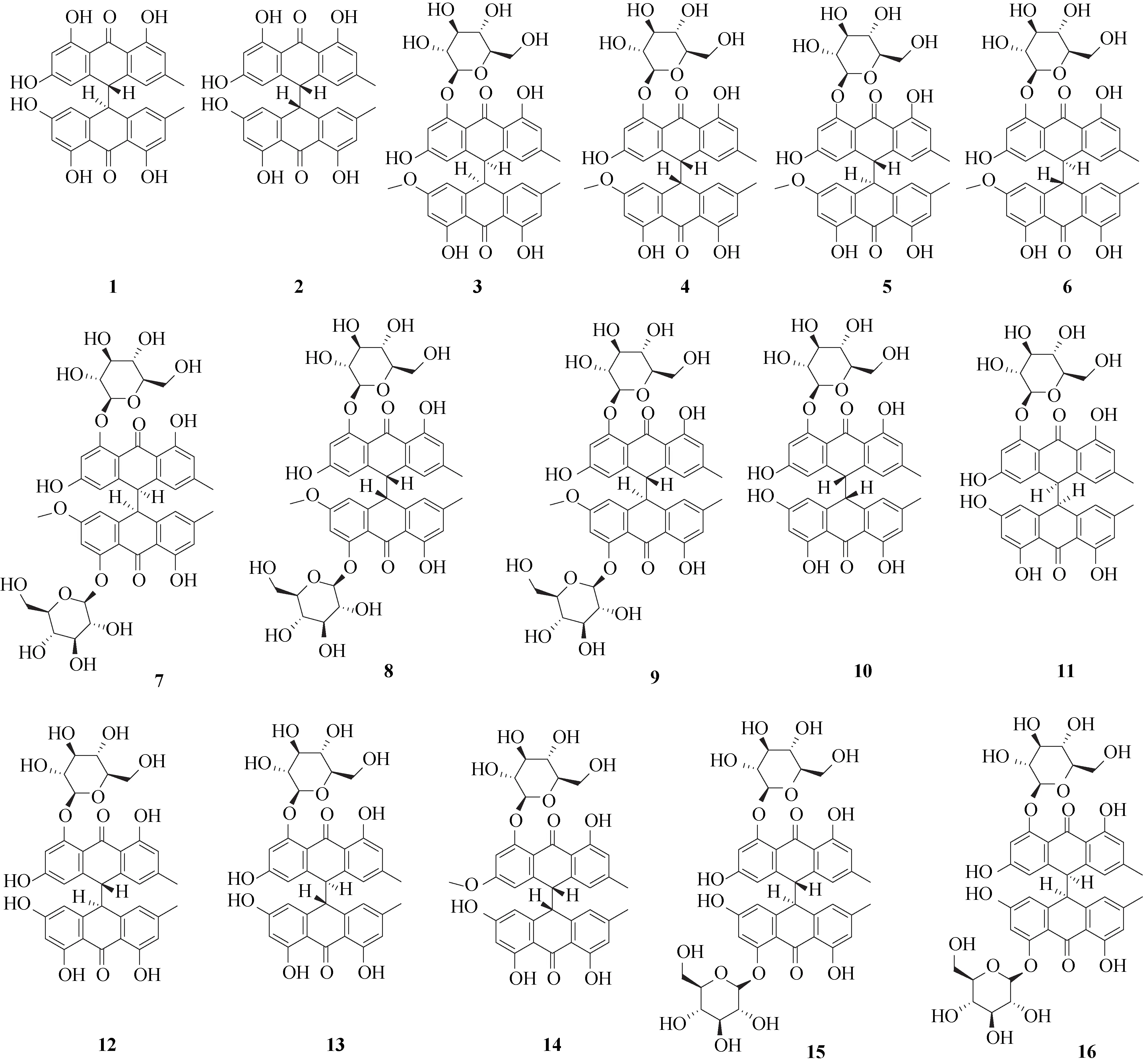
图1 何首乌和首乌藤中分离得到的二蒽酮单体化合物
2 二蒽酮类成分的在线鉴别
Xu 等[19]运用高效液相色谱-线性离子阱-静电场轨道阱质谱法(HPLC-LTQ-Orbitrap MS)对广东德庆产区何首乌的70%乙醇提取液进行分析,通过一级质谱的准分子离子峰和多级质谱碎片信息推测出28 个新的二蒽酮苷类成分,其苷元为大黄素(10→10′)大黄素型二蒽酮(Ⅰ)和大黄素(10→10′)大黄素甲醚型二蒽酮(Ⅱ),其中取代基主要为甲氧基、葡萄糖苷和丙二酰基化的葡萄糖苷等。Yang等[20]通过70%乙醇提取、DM-8型大孔吸附树脂纯化和Sephadex LH-20 凝胶柱色谱富集等方法富集得到何首乌中微量成分二蒽酮类成分,并进一步运用高效液相色谱-紫外检测器-傅里叶变换离子回旋共振质谱法(HPLC-UV-FTICR-MS)对该组分和分离得到的7个二蒽酮对照品顺式-大黄素-大黄素二蒽酮(2)、polygonumnolide A1(3)、polygonumnolide A2(4)、polygonumnolide B1(7)、polygonumnolide C2(11)、polygonumnolide C3(12)和polygonumnolide E(14)进行一级高分辨质谱和多级质谱分析,结果表明何首乌中存在45个二蒽酮类成分,其中30个二蒽酮苷类成分可能为新化合物,主要分为3 种结构类型,分别为大黄素-大黄素型二蒽酮(Ⅰ)、大黄素-大黄素甲醚型二蒽酮(Ⅱ)及大黄素甲醚-大黄素甲醚型二蒽酮(Ⅲ),其差异主要是取代基和C-10/10′的手型中心构型不同,具体见图2。
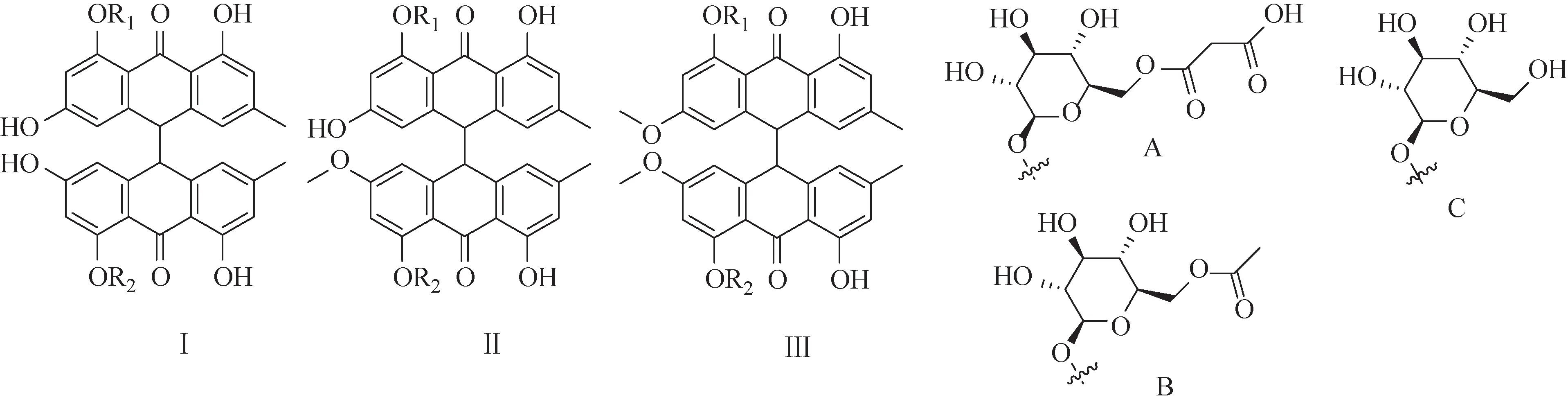
图2 何首乌和首乌藤中不同类型二蒽酮类成分及其不同取代基类型
薄瑞[18]采用超高效液相色谱串联四级杆飞行时间质谱法(UPLC-Q-TOF-MS/MS)对富集得到的首乌藤70%乙醇提取物中的二蒽酮类成分进行定性分析,首次从首乌藤中推测出72 个二蒽酮苷类成分和5个二蒽酮苷元成分,主要也分为3种结构类型,分别为Ⅰ、Ⅱ、Ⅲ,其中有29 个二蒽酮苷类成分可能为新化合物。
3 二蒽酮类成分的毒性研究
3.1 不同细胞水平的毒性评价
Yang等[6]对从何首乌中分离得到polygonumnolides A1~A4、polygonumnolides B1~B3(3~9)7个二蒽酮化合物,进行人口腔表皮癌细胞KB 的细胞毒活性评价,发现其半数抑制浓度(IC50)值分别为29.7、35.6、36.8、31.1、82.4、88.6、95.8 μmol·L-1,均表现中等强度的细胞毒活性。Yang 等[7]对从何首乌中分离得到反式-大黄素-大黄素二蒽酮(1)、顺式-大黄素-大黄素二蒽酮(2)和polygonumnolides C1~C4(10~13)6 个二蒽酮类化合物进行人正常肝细胞L02的细胞毒活性评价,结果发现化合物10~13作用24 h对L02细胞的IC50值分别为313.05、205.20、294.20、207.35 μmol·L-1,表现中等强度的细胞毒活性。Yang等[21]还对反式-大黄素-大黄素二蒽酮(1)和顺式大黄素-大黄素二蒽酮(2)进行人肝癌细胞HepaRG 的细胞毒活性评价,发现其IC50值分别为10.98、15.45 μmol·L-1。薄瑞[18]对从首乌藤分离得到的PMC-a-1(15)进行L02、HepG2细胞的细胞毒活性评价,结果发现其具有中等强度的抑制作用,作用48 h 的IC50值分别为45.25、72.78 μmol·L-1;PMC-a-2 未对HepG2 细胞表现较强的抑制活性,而对L02细胞表现一定的细胞毒活性,作用48 h的IC50值为61.11 μmol·L-1,从而提示二蒽酮类成分可能是何首乌产生肝毒性的组分之一。
3.2 酶水平的抑制作用
胆红素的异常代谢也是何首乌的临床不良反应之一。由于尿苷二磷酸(UDP)-葡萄糖醛酸转移酶1A1(UGT1A1)是唯一负责胆红素代谢的酶,因此Wang 等[17]研究了二蒽酮化合物对大鼠肝微粒体中UGT1A1的抑制作用,结果发现反式-大黄素-大黄素二蒽酮(1)、顺式-大黄素-大黄素二蒽酮(2)和polygonumnolide C2(11)均具有肝微粒体酶的抑制活性,表观抑制常数(Ki)值分别为0.863、1.083、4.291 μmol·L-1,进一步分析发现二蒽酮类化合物的6/6′位羟基为其潜在的活性基团。汪祺等[22]运用分子对接等技术对何首乌中分离得到的16 个二蒽酮类成分进行了毒性预测,结果发现这些二蒽酮类成分的大鼠经口服给药的半数致死量(LD50)为125.3~1 239.6 mg·kg-1,从而提示该类成分可能具有潜在的肝毒性。
3.3 模式生物斑马鱼的毒性评价
Yang 等[15]以斑马鱼胚胎发育为评价模型,将受精后2~4 h(2~4 hpf)的斑马鱼胚胎暴露于反式-大黄素-大黄素二蒽酮(1)、顺式-大黄素-大黄素二蒽酮(2)和polygonumnolides C1~C4(10~13)等二蒽酮类化合物,结果发现其96 hpf 的LD50值分别为(0.87±0.27)、(0.92±0.37)、(1.13±0.06)、(1.55±0.49)、(14.31±0.00)、(1.73±0.33)mg·L-1,进一步分析发现化合物1、2、10、11和13所观察到最低作用剂量(LOEL)分别为0.500、0.500、0.250、2.000、2.000 mg·L-1,表明该类成分具有一定的斑马鱼胚胎发育毒性。Li 等[16]采用斑马鱼肝毒性评价模型,以斑马鱼肝区面积、肝区灰度值和卵黄囊的吸收面积等为评价指标,对从何首乌中分离得到的反式-大黄素-大黄素二蒽酮(1)、顺式-大黄素-大黄素二蒽酮(2)、polygonumnolide C1(10)和polygonumnolide C4(13)进行肝毒性评价,结果发现游离二蒽酮较结合二蒽酮具有更强的肝毒性,推测二蒽酮类成分可能是何首乌潜在诱发肝毒性的物质基础之一。
4 二蒽酮类成分的含量分析
Yang 等[21]运用超高效液相色谱-三重四极杆质谱法(UHPLC-QQQ-MS/MS)对从不同产地和市场收集的90 批生何首乌中6 个二蒽酮类成分polygonumnolide C4(13)、polygonumnolide C3(12)、polygonumnolide C1(10)、polygonumnolide C2(11)、反式-大黄素-大黄素二蒽酮(1)和顺式-大黄素-大黄素二蒽酮(2)的含量进行分析。结果发现,何首乌中二蒽酮类成分含量差异较大,6 个二蒽酮类化合物质量分数分别为0.03~19.04、0.02~13.86、0.07~15.53、0.034~23.35、0.38~83.67、0.29~67.00 μg·g-1。选择其中15 批何首乌样品,按照《中华人民共和国药典》2015 年版制何首乌项下“清蒸工艺”进行炮制,结果发现,经过24 h炮制后何首乌中6 个二蒽酮类成分的含量下降幅度均超过80%,表明合理和规范炮制的制何首乌中二蒽酮类成分含量大幅下降。对从市场收集的86 批制首乌中6个二蒽酮类成分含量进行分析,结果发现,其质量分数分别为0.02~13.03、0.05~8.94、0.02~7.23、0.03~12.75、0.10~28.54、0.14~27.79 μg·g-1。如果以炮制24 h 制何首乌中6 个二蒽酮类成分的含量来分析市场中制何首乌的质量,发现65%以上市场中销售的制何首乌可能存在炮制不规范的问题,需要进一步深入调查与研究。
薄瑞[18]发现首乌藤中所存在的72 个二蒽酮苷类成分主要分为3 种类型,其中大黄素-大黄素二蒽酮和大黄素-大黄素甲醚二蒽酮具有m/z254、416、458的特征离子,而大黄素甲醚-大黄素甲醚二蒽酮具有m/z268、537 的特征离子,运用UPLC-Q-TOF-MS/MS,以半定量的方式初步评价了首乌藤中各类型的二蒽酮的相对含量。结果发现,在首乌藤中Ⅰ和Ⅱ型的二蒽酮类成分的含量占比相对较高,分别为54.69%和41.58%,而Ⅲ型的二蒽酮类成分的含量占比较低,为3.73%。
5 讨论
何首乌及首乌藤中二蒽酮类成分主要为2 个分子大黄素和/或大黄素甲醚蒽酮通过蒽环碳原子连接而成的化合物,主要通过C-10 和C-10′中位连接,多以单键连接。本课题组通过传统的提取分离与纯化技术首次从何首乌中分离得到二蒽酮类成分,并对其进行了L02、HepG2、HepRG 等细胞毒性评价及UGT1A1 酶、模式生物斑马鱼等毒性评价,结果发现该类成分具有潜在的肝毒性,可能为何首乌中肝毒性组分之一。然而该类成分为何首乌及首乌藤中微量成分,具有数量多和单一成分含量低等特点,所以通过传统的提取与分离获得较为费时费力,故有必要对其开展全合成研究,解决样品量不足的问题。目前,对何首乌及首乌藤中二蒽酮类成分的毒性评价主要集中在体外细胞和模式生物斑马鱼模型,这些模型与哺乳动物模型存在一定的差异,所以有必要对其进行小鼠急性毒性与大鼠长期毒性评价等实验,有助于进一步系统地阐明该类成分的肝毒性。
与此同时,二蒽酮类成分还广泛存在于蓼科植物大黄、豆科植物番泻叶和藤黄科植物贯叶连翘中,该类成分还具有较好的泻下作用[23],且具有抗肿瘤[24]、抗病毒[25]和抗抑郁[26]等活性,所以有必要对何首乌及首乌藤中的二蒽酮类成分进行系统的提取分离和结构鉴定,进一步对其有效性进行评价,从而有助于评价含二蒽酮类成分中药的安全性与有效性,为临床安全、合理用药提供参考。

