肼苯哒嗪减轻创伤性脑损伤后的认知功能障碍
吴 勋,史英武,屈 延,葛顺楠
(空军军医大学唐都医院神经外科,陕西 西安 710038)
创伤性脑损伤(traumatic brain injury,TBI)主要是由于军事作战、各类交通事故、意外坠落等原因造成的颅脑损伤,往往会伴随长期的精神障碍[12]。海马体属于边缘系统的一部分,在学习、记忆与认知中起着重要作用。TBI后海马功能障碍会导致记忆丧失和认知障碍[3]。同时越来越多的临床证据表明,TBI后发生海马体相关认知功能障碍疾病的风险显著增高[4]。但是目前TBI后诱发海马细胞结构损伤与认知功能障碍的病理机制仍不清楚,阐明其损伤机制并构建靶向治疗策略对于改善TBI患者的生活质量具有十分重要的意义。
丙烯醛(acrolein,Acr)是一类高度活性的不饱和醛产物,其半衰期明显长于活性氧(reactive oxygen species,ROS)[5]。有研究证实Acr具有神经损伤作用,在许多神经系统疾病的发生发展中发挥着重要影响,清除Acr可有效减轻脑卒中后的继发脑损伤[6]。同时,还有研究表明Acr在退行性神经系统疾病的发生发展过程中,显著影响机体认知功能;在阿尔茨海默病以及帕金森病的疾病模型中,Acr的水平显著增高,通过清除Acr可以观察到明显的认知功能改善[78]。然而,迄今为止,Acr在罹患TBI后的患者的认知功能障碍中的作用尚不清楚。肼苯哒嗪(hydralazine,Hyd)是Acr的一种高效清除剂,其有效性以及安全性已在多种神经系统疾病模型中被证实[9]。因此,本研究以Hyd治疗为干预模式,探讨清除Acr能否有效改善TBI后的认知功能障碍。
1 材料与方法
1.1 材料
成年(6~8周)C57BL/6健康雄性小鼠(体质量20~25 g)66只,由空军军医大学实验动物中心提供,每笼6只,实验前在空军军医大学唐都医院脑科研究所动物房内进行1周适应性饲养,室温22~25 ℃,12 h光照/12 h黑暗循环饲养,并给予足量的水与食物。本研究的动物及细胞实验均经空军军医大学伦理委员会批准(许可证号:TDLL2017-03-190)。
1.2 方法
1.2.1 实验方案 先将成年C57BL/6雄性小鼠随机分为假手术组(Sham组)和TBI后不同时间点(术后3、7、14、28 d)4个亚组,通过Western blotting检测海马区Acr水平的变化情况,继而确定合适时间点进行后续研究。然后再将小鼠随机分为Sham组、TBI组和TBI+Hyd(Acr清除剂)干预组,分别通过Morris水迷宫(morris water maze,MWM)实验、Western blotting、ELISA以及PCR等检测各组认知功能、突触相关蛋白表达与线粒体生物发生的变化情况,进而评估Hyd对TBI后的认知功能障碍的保护作用及其可能的作用机制。
1.2.2 小鼠TBI模型的建立及处理 本实验采用受控皮质冲击(controlled cortical impact,CCI)模型来模拟TBI损伤[10]。注射戊巴比妥钠麻醉小鼠,以俯卧位将小鼠固定于立体定位仪架上。剃除并清理小鼠头顶部毛发,10 mL/L碘伏消毒后剪皮,暴露目的区域颅骨。蘸取3 mL/L双氧水擦拭清理骨膜。以前囟后2 mm、旁开1.5 mm为中心点钻取直径3 mm的圆形骨窗。打开CCI打击器,设定参数为:速度3 m/s,深度1.5 mm,停留时间为0.2 s,实施打击。术后填补骨窗,缝合皮肤,置于恒温板待其苏醒。假手术组小鼠取出骨瓣后不进行CCI打击器打击,其余操作相同。治疗组小鼠术后每日腹腔注射5 mg/kg的Hyd,其他组腹腔注射等量的生理盐水。
1.2.3 MWM实验 通过MWM实验评估小鼠认知功能[11]。在前5 d每日将小鼠从平台的4个不同象限放入并各训练1次。在每次试验中,给小鼠60 s的时间找到站台。通过视频追踪软件观察动物在水迷宫中的活动情况,记录并分析逃逸潜伏期。第6日进行长时空间记忆测试。测试前移除平台,从4个不同方向分别测试60 s。统计分析小鼠在目标象限中的游动路程与总路程数的比值,以及小鼠经过原平台的次数。
1.2.4 Western blotting 通过Western blotting检测分子蛋白表达变化[12]。麻醉小鼠后,生理盐水灌注,取相应脑组织于离心管中,加入含有蛋白酶抑制剂的强效细胞裂解液裂解20 min。经超声匀浆机匀浆后再静置20 min,在离心机中保持4 ℃条件,以12 000g的速度离心15 min。留取上清液,使用蛋白质定量试剂盒(UA276918,赛默飞世尔科技公司,美国)进行蛋白浓度定量。加入一定量的上样缓冲液,95 ℃条件下煮沸10 min完成制样。准备好电泳仪、电泳液和凝胶,吸取蛋白样品依次上样、电泳,至样品跑至凝胶下缘时停止。电泳结束后取凝胶进行转膜,待蛋白转移至聚偏二氟乙烯膜上后,将膜置于50 mL/L牛奶溶液(Tris盐酸缓冲盐溶液+吐温溶液配置)中封闭1~2 h。封闭结束后,置于4 ℃冷库一抗孵育过夜。待次日用Tris盐酸缓冲盐溶液清洗3次,每次5 min后,室温孵育相应的二抗2 h,然后用Tris盐酸缓冲盐溶液再次清洗3次,每次10 min。配置发光液并通过成像系统(Bio-Rad,美国)进行蛋白条带检测以及灰度分析。实验中使用的主要抗体如下:Acr(1∶1 000,Abcam,英国);PSD95(1∶1 000,Proteintech,美国);synaptophysin(1∶1 000,Proteintech,美国);spinophilin(1∶1 000,Proteintech,美国);PGC1α(1∶1 000,Invitrogen,美国);Tfam(1∶1 000,Invitrogen,美国);Nrf1(1∶1 000,Proteintech,美国);β-actin(1∶3 000,abclonal,中国)。
2 结果
2.1 Western blotting检测Acr的蛋白水平及MWM实验评估小鼠认知功能
Western blotting检测各组小鼠海马区Acr的蛋白水平变化,结果发现,与Sham组小鼠相比,TBI后3 d,Acr的水平开始明显升高,14 d后Acr水平达到高峰,28 d时有所降低,但依旧维持较高水平(P<0.05,图1A~B)。在进一步的实验中,我们挑选TBI后14 d作为研究时间点,将小鼠分为Sham组、TBI组与TBI+Hyd干预组,对各组小鼠进行MWM实验,评估其认知功能改变,结果发现,各组小鼠的游泳速度没有显著差异(图1C)。与Sham组相比,TBI组小鼠的逃离潜伏期明显延长(P<0.05,图1D),经过原平台的次数明显减少(P<0.05,图1E),并且在目标象限的游泳路程与其总游泳路程的比值也明显降低(P<0.05,图1F)。当给予Hyd治疗后发现,小鼠的逃离潜伏期明显缩短(P<0.05,图1D),在目标象限的游泳路程与其总游泳路程的比值有所升高(P<0.05,图1F),经过原平台的次数也有明显增加(P<0.05,图1E)。以上实验结果说明,Acr清除剂能有效改善小鼠TBI后的认知功能损伤。
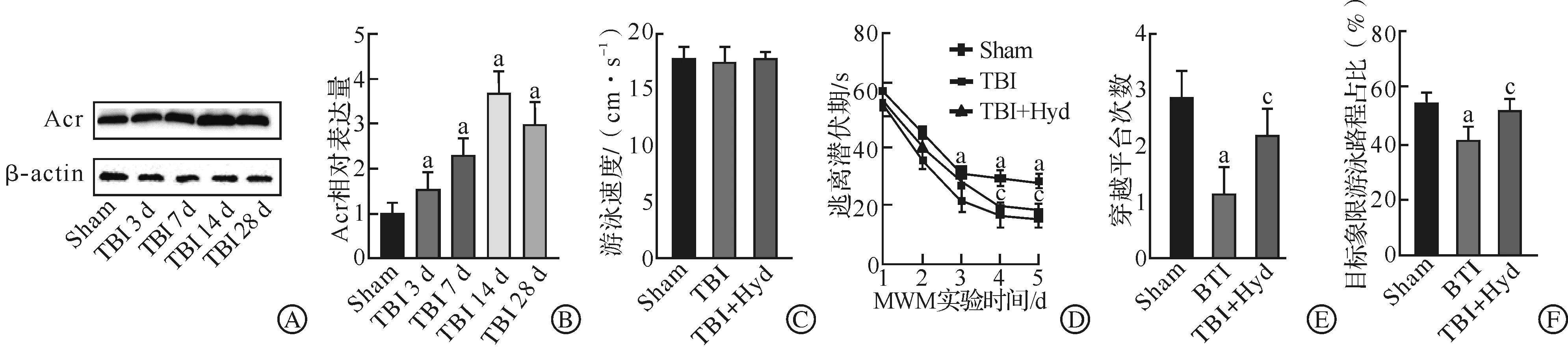
A~B:Western blotting检测各组小鼠海马Acr的蛋白表达水平;C:各组小鼠的游泳速度;D:逃离潜伏期;E:经过原平台的次数;F:目标象限的游泳路程占总游泳路程的比值。Sham:假手术;TBI:创伤性脑损伤;TBI+Hyd:肼苯哒嗪治疗;MWM:Morris水迷宫。n=6, aP<0.05 vs Sham组;cP<0.05 vs TBI组。图1 Western blotting检测Acr的蛋白水平及MWM实验评估小鼠认知功能
2.2 小鼠海马突触相关蛋白synaptophysin、PSD95与spinophilin的表达
为进一步评估Acr清除剂的保护作用,我们检测了各组小鼠的海马神经元突触相关蛋白synaptophysin、PSD95与spinophilin的表达水平,结果发现,与Sham组相比,TBI组synaptophysin、PSD95与spinophilin的表达水平均明显下降,但Acr清除剂干预后能显著扭转这一趋势(P<0.05,图2)。
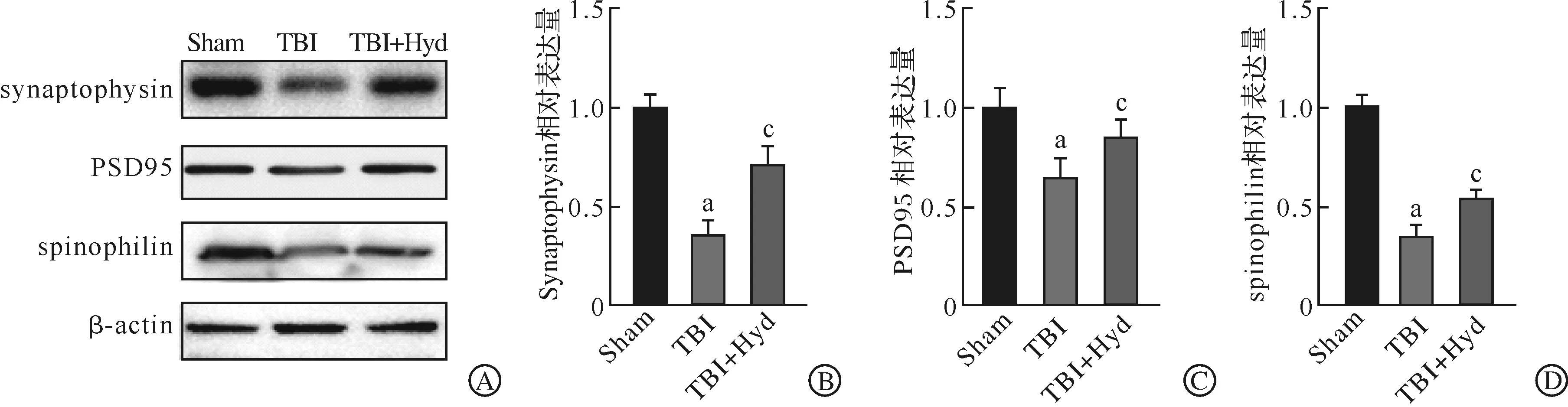
A:Western blotting检测蛋白synaptophysin、PSD95与spinophilin表达水平的条带图;B:synaptophysin的表达统计图;C:PSD95的表达统计图;D:spinophilin的表达统计图。Sham:假手术;TBI:创伤性脑损伤;TBI+Hyd:肼苯哒嗪治疗。n=6,aP<0.05 vs Sham组;cP<0.05 vs TBI组。图2 Western blotting检测小鼠海马突触相关蛋白synaptophysin、PSD95与spinophilin的表达
2.3 线粒体生物发生的相关调节因子PGC1α、Nrf1及Tfam检测结果
线粒体是促进TBI后认知功能恢复的重要靶标。细胞通过线粒体生物发生增加线粒体的数量和促进线粒体的代谢功能,为细胞修复提供必要的能量。既往研究证实,Acr能损伤线粒体正常功能[13],因此,我们对清除Acr能否有效改善线粒体生物发生、促进神经功能恢复进行了猜测。我们首先通过Western blotting对线粒体生物发生的相关调节因子PGC1α、Nrf1以及Tfam进行了检测,结果提示,与Sham组相比,TBI后海马区PGC1α、Nrf1以及Tfam的表达水平显著降低,清除Acr后能显著升高这些蛋白的表达水平(P<0.05,图3A~B)。同时,我们发现TBI后ATP与mtDNA的生成显著降低,而Acr清除剂治疗后能很大程度恢复TBI后ATP的生成水平(P<0.05,图3C~D)。以上结果都提示,清除Acr能有效改善TBI后的线粒体生物发生。

A~B:Western blotting检测线粒体发生关键蛋白PGC1α、Nrf1以及Tfam的表达水平;C:各组ATP水平检测分析;D:各组mtDNA水平检测分析。Sham:假手术;TBI:创伤性脑损伤;TBI+Hyd:肼苯哒嗪治疗。n=6, aP<0.05 vs Sham组;cP<0.05 vs TBI组。图3 线粒体生物发生的相关调节因子Pgc1ɑ、Nrf1及Tfam检测结果
3 讨论
TBI患者常常伴有长期的认知功能障碍,极大地影响了患者的生活质量。但是目前TBI患者认知功能障碍发生的分子机制不明,有效的临床治疗手段缺乏。Acr已经被证实参与多种神经系统疾病的病理过程。本研究发现TBI后不同时间点小鼠海马区Acr水平都有显著增高,因此,我们推测升高的Acr可能参与了TBI后认知功能障碍的病理发展过程。Hyd是Acr的高效清除剂,其有效性与安全性已在多种动物疾病模型中进行过充分的验证。在本研究中,我们发现Hyd给药能显著减轻TBI小鼠的认知功能障碍,且从亚细胞结构层面观察的结果同样也证实了这一点。因此,这为Acr清除剂未来作为治疗TBI后认知功能障碍的临床用药提供了初步的基础实验证据。
线粒体功能障碍是导致神经元功能失衡以及认知障碍发生的重要原因[14]。线粒体一方面可通过氧化磷酸化反应产生ATP,为细胞提供各项生理活动必需的能量,同时对ROS生成、钙离子内流以及细胞存活等都发挥着至关重要的作用。而在病理情况下,线粒体功能发生障碍,导致氧化磷酸化过程被破坏,ATP合成受阻,并伴随着大量ROS的生成及线粒体新陈代谢紊乱,最终导致神经细胞功能障碍。可以说,线粒体正常功能的破坏在TBI后认知功能障碍的发病过程中起着重要的推动作用,但目前TBI后线粒体功能障碍的发生机制不清,早期干预手段依旧缺乏。如何通过促进线粒体生物发生的恢复进而改善认知功能障碍是一个很有研究价值的方向。
Acr是一种强氧化性的α、β型不饱和醛,可由机体的内源性途径产生。Acr易与多种生物分子反应,包括DNA、蛋白质和磷脂等,而线粒体也被证明是Acr的一个重要损伤靶器官。有学者发现Acr可以损伤心肌细胞的线粒体功能,破坏氧化磷酸化酶的正常功能,导致线粒体ATP合成障碍及氧化应激损伤[13]。同时前期有研究证实Acr可诱发肺细胞的线粒体mtDNA损伤、导致线粒体自噬异常[15]。我们在本研究中发现TBI后海马区Acr显著增高,因此我们提出猜想:Acr可能是导致TBI后海马神经元线粒体损伤与认知功能障碍的一个重要病理因素。而Hyd作为Acr的高效清除剂,也已在多种疾病模型中被证实具有良好的清除效果且安全性高,具有一定的临床转化应用潜力。
在本研究中,我们发现TBI后海马区神经元线粒体生物发生失衡,而Acr水平的增高可能是造成线粒体生物发生失衡的重要原因。通过Hyd治疗后线粒体生物发生得到了明显的改善,因此提示清除Acr后,线粒体生物发生功能得到一定恢复,有助于受损神经元的结构与功能修复,达到认知功能改善的目的。总之,本实验结果表明,Acr清除剂能减轻TBI后的认知功能障碍,为未来相关临床治疗策略的建立提供新方向。

