脂多糖对仔猪肝脏损伤和程序性坏死信号通路关键基因表达的影响
陈钦亮,汪洋,李先根,周贝,王丹
(武汉轻工大学动物营养与饲料科学湖北省重点实验室,湖北武汉 430023)
肝脏是机体内物质代谢的主要器官,也是机体内最大的解毒场所。然而,在养殖生产中许多因素(如病菌感染、应激和饲料毒素残留)会导致肝脏结构破坏、功能紊乱以及肝细胞死亡。肝脏损伤会导致仔猪生产性能下降,并还会增加疾病的发生率,给养殖业带来很大损失。
肝脏损伤伴随着肝细胞的死亡。程序性坏死是一种非依赖性半胱氨酸天冬氨酸蛋白酶的细胞死亡方式。死亡细胞具有坏死细胞的典型特征,表现为细胞和细胞器体积肿大、线粒体扩大崩解、溶酶体膜破坏、核膜破裂和溶解、碎核涌出细胞,引起周围组织的炎症反应。程序性坏死信号通路主要的分子包括受体相互作用蛋白激酶1(RIP1)、RIP3 和混合系列激酶结构域样蛋白(MLKL)。程序性坏死在肝脏损伤和肝细胞的死亡中起着重要作用。如在肝损伤和肝纤维化等过程中,肝细胞会发生明显的程序性坏死;丙型肝炎病毒引起的肝损伤中,肝细胞坏死伴随着凋亡和程序性坏死的发生。脂多糖(LPS)是革兰氏阴性菌膜结构物质,通过刺激单核-巨噬细胞分泌肿瘤坏死因子-(TNF-)、白细胞介素1(IL-1)、白细胞介素6(IL-6)等细胞因子损伤肝脏。然而,程序性坏死是否介导LPS 诱导的仔猪肝脏损伤并不清楚。因此,本试验采用腹膜注射LPS 构建仔猪肝脏损伤模型,旨在探究LPS 刺激对仔猪肝脏形态及程序性坏死信号通路的影响,为揭示程序性坏死在肝脏损伤中的作用奠定理论基础,并为肝脏疾病的治疗提供新的解决思路。
1 材料与方法
1.1 试验材料 LPS:大肠杆菌血清型O55:B5,纯度>99%,为Sigma-Aldrich 化学公司产品;RNA 反转录试剂盒、定量PCR 试剂盒均为宝日医生物技术有限公司产品。
1.2 试验设计 选取12 头平均体重为(7.1±0.9)kg28 日龄杜×长×大三元断奶仔猪,随机分为对照组和LPS 组,每组6 头。所有仔猪单笼饲养并自由饮水、采食,预试14 d 后,LPS 组腹膜注射100 μg/kg BW 的LPS,对照组注射等量的生理盐水。注射LPS 4 h 后,从仔猪前腔静脉采血10 mL,静置15 min 后,离心(3 000 r/min,10 min)分离血浆,-80℃冰箱保存。将仔猪麻醉屠宰,取肝脏组织一小块,用于肝脏组织形态学的观察(4%多聚甲醛固定,然后HE 染色)。再取适量的肝脏组织,低温生理盐水冲洗干净,剪碎,包入无菌锡箔纸中,放入液氮中冻存,最后转移到-80℃的冰箱保存待测。
1.3 测定指标和方法
1.3.1 肝脏组织形态学观察 肝脏组织形态学切片采用HE 染色,主要包括脱蜡、染色、脱水、透明及封片等步骤。具体操作参照万志成的试验方法。
1.3.2 透射电镜分析 将固定于2.5%戊二醛的肝脏组织样品,通过处理后进行电镜观察,测定方法参照。
1.3.3 肝功能指标 谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(AKP)的活性采用日立7020全自动生化分析仪测定,按照试剂盒(北京四正柏生物科技有限公司)说明书操作。
1.3.4 肝脏炎性细胞因子以及程序性坏死信号通路相关基因mRNA 表达量 提取肝脏组织总RNA,按照Prime Script RT reagent kit 试剂盒(货号RR047A)步骤将RNA 逆转录成cDNA,荧光定量聚合酶链式反应采 用SYBRPremix Ex Taq(Tli RNaseH Plus)real-time PCR 试剂盒(货号RR420A)。使用-作为内参对照,采用Livak 等的2法计算目的基因的mRNA 相对表达量。、自杀相关因子死亡结构域()、c、磷酸甘油酸变位酶5()、动力相关蛋白1()、高迁移率族蛋白1(),基因的引物序列见。
1.3.5 肝脏程序性坏死信号通路关键蛋白表达量 取肝脏样品100~150 mg,使用RIPA 组织裂解液分层提取总蛋白,收集上清液并采用BCA 蛋白质定量试剂盒检测蛋白质浓度。然后将一定量的蛋白质用10% SDSPAGE 凝胶分离并转印至PVDF 膜上。脱脂奶粉封闭后采用一抗孵育12 h。特异性一抗包括兔抗RIP1(#LSB8214,LifeSpan BioSciences)、兔抗RIP3(#SC-135170,Santa Cruz Biotechnology)、兔 抗MLKL(#37705,Cell Signaling Technology)和鼠抗-actin(A2228,Sigma-Aldrich)。将膜清洗几次后,加入IgG 常温孵育2 h,使用ECL 化学发光液进行显色。
1.4 统计分析 试验所有数据采用SPSS 22.0 统计软件进行独立样本检验分析,统计结果用平均值±标准误来表示。以<0.05 表示差异显著。0.05<≤0.10 为具有显著性趋势。
2 结果
2.1 LPS 刺激对仔猪肝脏组织形态学的影响 由图1 可见,与对照组相比,LPS 组的肝脏组织有不同程度损伤,具体表现在肝细胞索紊乱,炎性细胞浸润,肝细胞核溶解、固缩,肝细胞空泡化。
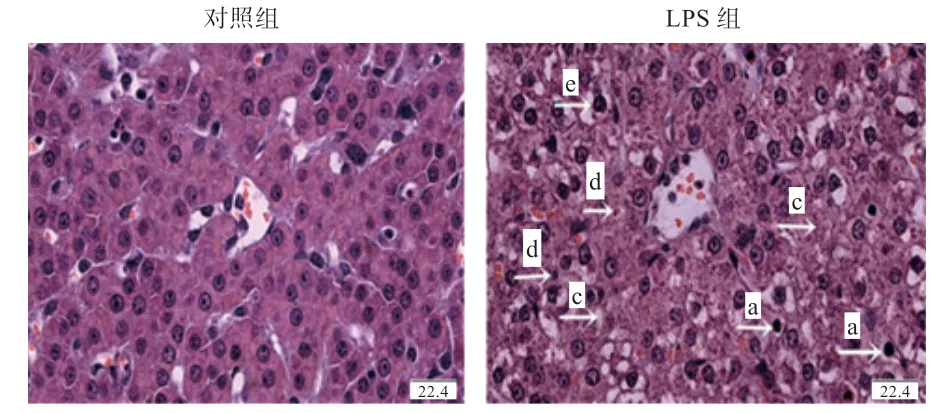
图1 LPS 刺激对断奶仔猪肝脏形态的影响(HE ×100)
2.2 LPS 刺激对仔猪肝脏超微结构的影响 由图2 可知,与对照组相比,LPS 组的肝脏组织超微结构有不同程度破坏,具体表现在肝细胞核膜破裂、染色质外溢、内质网扩张、线粒体膜破裂、线粒体溶解及线粒体自噬等现象。

图2 LPS 刺激对断奶仔猪肝脏超微结构的影响(5 000×)
2.3 LPS 刺激对仔猪肝功能的影响 由表1 可知,与对照组相比,注射LPS 后血浆中AST/ALT 升高(=0.009),碱性磷酸酶(ALP)活性有升高趋势(=0.079),而LPS 对AST 和ALT 活性则无显著影响。

表1 LPS 刺激对仔猪肝功能指标的影响
2.4 LPS 刺激对仔猪肝脏组织炎性细胞因子mRNA 表达量的影响 由表2 可知,与对照组相比,LPS 组肝脏组织中的炎性细胞因子和的mRNA含量均升高(<0.05)。

表2 LPS 刺激对仔猪肝脏炎性细胞因子mRNA 的影响
2.5 LPS 刺激对仔猪肝脏组织细胞程序性坏死信号通路相关基因mRNA 表达量的影响 由表3 可知,与对照组相比,注射LPS 诱导大多数细胞程序性坏死信号通路相关基因mRNA 表达上调,其中mRNA 表达量升高(<0.05);而mRNA 表达量无显著变化。

表3 LPS 刺激对仔猪肝脏程序性坏死信号通路相关基因mRNA 表达量的影响
2.6 LPS 刺激对仔猪肝脏组织程序性坏死信号通路关键蛋白表达量的影响 由图3 可知,与对照组相比,LPS组中肝脏细胞程序性坏死信号通路关键蛋白RIP1、RIP3 和MLKL 蛋白表达量均升高(<0.05)。
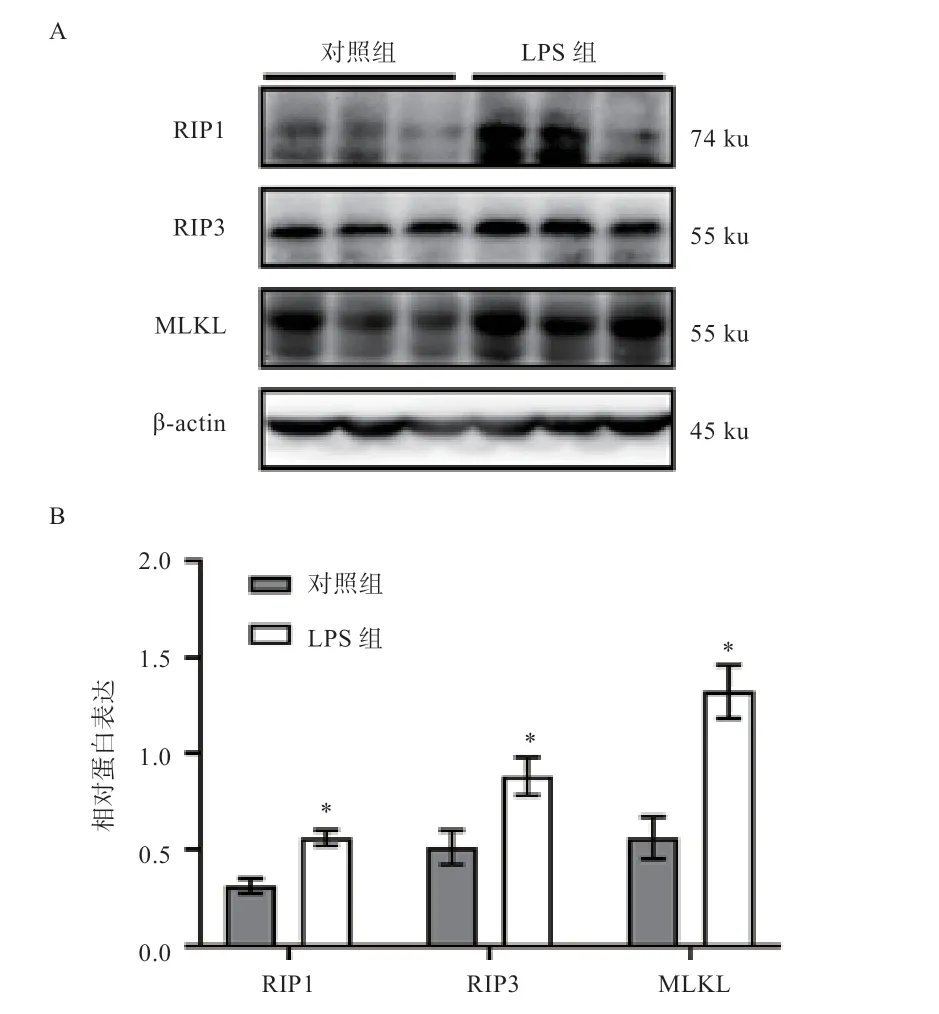
图3 LPS 刺激对断奶仔猪肝脏程序性坏死信号通路关键蛋白的影响
3 讨 论
本试验采用LPS 建立仔猪肝脏损伤模型,该模型是目前比较成熟的肝脏损伤模型。研究表明,LPS 刺激后3~6 h,肝脏组织可表现出严重损伤和功能紊乱,这些损伤伴随着大量炎性细胞因子(TNF-、IL-1和IL-6)的产生;在多种肝脏损伤中,常伴随着炎症的发生,剧烈的炎症反应会引起细胞程序性坏死的发生。因此,LPS 在诱导肝脏急性炎症时,也可能会诱导肝细胞的程序性坏死。
AST 和ALT 主要分布在肝脏、肾脏等组织中。机体健康时,血清中AST 含量较低,当组织出现损伤、细胞受到破坏时,细胞膜通透性增加,AST 就会进入血液中,故血清中AST 的浓度常作为肝脏炎症及损伤的重要指标。有研究表明,机体只要有少量的肝细胞破坏,血清中ALT 活性即可增加1 倍,因此,ALT 也是急性肝细胞损伤最敏感的标志。此外,血液中AKP 活性也是反映肝脏损伤的重要指标。本试验中,仔猪注射LPS 后能显著诱导血浆中AKP 以及AST/ALT 升高。此外,观察肝脏组织形态学切片也发现,LPS 刺激后肝脏组织有不同程度损伤,具体表现在肝细胞索紊乱,炎性细胞浸润,肝细胞核溶解、固缩,肝细胞空泡化严重。课题组前期研究也证实,LPS 刺激4 h 后,仔猪肝脏结构和功能异常,肝细胞坏死,淋巴组织增生,肝小叶结构明显紊乱。结合肝脏组织形态学结构和肝功能的敏感指标,证实LPS 能诱导仔猪的肝脏损伤。TNF-是主要由单核巨噬细胞分泌的一种细胞因子,在炎症、感染、组织损伤、癌症发生中起关键作用。IL-6 和IL-1是由单核细胞、内皮细胞等在应答感染、炎症时产生的细胞因子,它们参与机体的免疫反应及多种生理和病理过程。研究表明,这些炎性细胞因子的过量产生会导致机体组织(如肝脏)损伤。本试验中,注射LPS 后肝脏组织炎性细胞因子TNF-、IL-6 和IL-1mRNA 表达量显著升高。周滔等研究发现,LPS能诱导肝细胞对炎症介质和细胞因子的敏感性增加,而内源性和外源性内毒素的增加会导致肝脏枯否细胞的活化,分泌大量炎症介质与细胞因子。与CCl4 模型导致的肝损伤相比,LPS 模型的小鼠肝功能损伤较重,肝脏损伤中肝细胞的凋亡与程序性坏死都会发生,同时会引起肝脏的出血。这些结果表明LPS 造成了严重的肝脏损伤和炎症的发生。
为了研究炎症是否诱发细胞启动程序性坏死调节机制,进一步检测了程序性坏死信号通路相关基因mRNA 和蛋白的表达量。目前,对死亡受体介导的程序性坏死的研究最为深入。Caspase-8 被抑制的细胞受到刺激时可能引起细胞程序性坏死的发生,如TNF诱导zVAD-fmk 处理过的小鼠成纤维细胞L929 发生程序性坏死,还能使caspase-8 缺失的白血病细胞发生程序性坏死。因此,程序性坏死可能是在凋亡无法正常启动时,细胞用来执行的死亡方式,TNF 死亡通路起始于配体与受体的结合,参与这一通路的受体主要为死亡受体家族,包含死亡结构域TNFR1 等受体,TNF-与其受体TNFR1 结合后,通过信号调节,诱导形成包含FADD 和caspase-8 等蛋白的复合体。在此复合体中,如果caspase-8 切割RIP1、RIP3 使其失活,细胞就通过凋亡的方式死亡;如果caspase-8 被抑制,RIP1、RIP3 通过磷酸化MLKL 的方式启动细胞程序性坏死。大多数学者认为,激活的MLKL 聚集PGAM5,作用于DRP1 蛋白,引发线粒体的断裂和活性氧(ROS)的产生,最终导致细胞程序性坏死。本试验中,注射LPS 后肝脏程序性坏死信号通路大多数基因(如)的mRNA 表达量都显著升高,表明LPS 刺激激活了肝脏细胞程序性坏死。Long 等研究发现,程序性坏死在促进肿瘤细胞死亡、抗病毒感染上有很好的应用,抑制细胞程序性坏死还能减少心梗等疾病带来的损伤。另外,也有研究发现,感染、炎症、应激等都可导致细胞程序性坏死,激活相关信号通路,最终导致组织损伤和功能障碍。这些研究提示,抑制程序性坏死可能是缓解LPS 诱导肝脏损伤的重要调控策略。
4 结 论
本研究结果表明,LPS 刺激可导致肝脏分泌大量炎性细胞因子,激活细胞程序性坏死信号通路,引发肝脏组织程序性坏死的发生,导致仔猪肝脏结构和功能损伤。

