大花黄牡丹二次枝对结实率的影响及胚珠败育生理机制研究
陈庭巧,袁 涛,乔红雍,徐 珂
(北京林业大学 园林学院,花卉种质创新与分子育种北京市重点实验室,国家花卉工程技术研究中心,城乡生态环境北京实验室, 园林环境教育部工程研究中心,林木花卉遗传育种教育部重点实验室,北京 100083)
大花黄牡丹(Paeonialudlowii(Stern & G.Taylor)D.Y.Hong)为芍药属(Paeonia)牡丹组(Sect.Moutan)肉质花盘亚组(Subsect.Delavayanae)灌木,花黄色,一枝多花,观赏价值和育种价值高[1-2],其异交、自交亲和,但结实率低[3]。芍药属牡丹组所有种均列入国家重点保护野生植物名录,其中大花黄牡丹被列为二级[4]。
植物的花朵、果实与种子之间关系密切。花朵和果实的数量以及它们在时间和空间上的聚集方式会影响传粉者的吸引力和资源分配,从而影响生殖的成功率[5]。已有研究指出,过多的花会影响种子和果实形成[6-7]。如在盛花期对黄花草木樨(Melilotusofficinalis)进行疏花处理能明显降低资源竞争,增加子房中的胚珠数[8]。另外,果实在花序上的位置对热带低地半落叶林中7种自交不亲和树种败育有显著影响,某些位置果实和种子败育的概率高于其他位置[9]。大花黄牡丹一枝多花,在当年花枝/果枝上形成二次枝,二次枝的形成是其下一个年周期形成侧枝和开花结实的前提与保证[10]。与牡丹组其他类群相比,大花黄牡丹果实发育与二次枝生长及顶芽分化重合,三者间营养和调节物质的变化会影响引种后的结果率和结实率。因此,研究大花黄牡丹果实和二次枝及侧蕾之间的竞争关系有重要意义。
营养物质代谢、抗氧化酶活性和激素在植物营养生长、胚胎发育、果实成熟等阶段均具有重要作用[6]。有关植物胚胎发育和败育生理生化特性的研究主要集中在经济物种上,如杉木(Cunninghamialanceolata)[11-12]、西瓜(Citrulluslanatus)[13]、油松(Pinustabuliformis)[14]、玉米(Zeamays)[15-16]、荔枝(Litchichinensis)[17-18]、葡萄(Vitisvinifera)[19-21]和枣(Ziziphusjujuba)[22]等。而关于牡丹胚胎发育和败育,特别是胚胎发育和败育过程中生理生化特性及其变化规律尚鲜见报道。
本研究以河南省洛阳市栾川县芍药科迁地保护中心引种栽培的大花黄牡丹为对象,于2019年及2020年观测了果实及种子发育规律,并于2019―2021年进行田间控制试验,验证二次枝生长和果实发育过程中的竞争关系,比较正常胚珠与败育胚珠的形态、生理生化指标及内源激素含量的变化,分析大花黄牡丹果实发育的竞争关系、胚珠败育的时间及营养物质和激素的变化,以期为大花黄牡丹引种栽培及人工调控结实提供参考。
1 材料与方法
1.1 试验材料
在河南省洛阳市栾川县芍药科迁地保护中心(海拔1 245 m,33°56′05″N,111°21′36″E),以露地栽培、正常开花结实的大花黄牡丹为试验材料。2002年秋播种(采自西藏林芝野生居群),2003年起陆续出苗,2008年首次开花[23]。
1.2 开花特性观察
大花黄牡丹每花枝一般有2~5朵花,花枝最上方的一朵称为顶花(TF),位于顶花下方的均称为侧花(LF),侧花从下往上按照1~4进行排序,分别记为LF1、LF2、LF3和LF4(图1)。在5月花期,随机选取50个花枝作为观测枝,挂上吊牌,做好标记,定期对观测枝进行开花物候观测拍照,记录单个花枝上的花蕾数、开花数;当单个花枝上的花蕾数为3朵时,记录花朵的开花次序,分为5个类别,分别为TF→LF1→LF2、TF→LF2→LF1、LF1→TF→LF2、LF1→LF2→TF、LF2→TF→LF1,计算各类别占比。

A.不同花朵数的花枝示意图;B.开放3花/枝的植株。TF为顶花,LF为侧花。下同 A.Schematic diagram of flowering branches with different numbers of flowers;B.Image of 3 flowers/flowering branches. TF is top flower,LF is side flower.The same below图1 大花黄牡丹花枝示意图及实观图Fig.1 Flowering branches of Paeonia ludlowii
1.3 果实与胚珠发育及结果率调查
1.3.1 果实发育 在2019-2021年花果期(5-9月),选择开花时间基本一致的心皮,定期观察其发育情况以反映果实发育进程(开花第1天即默认授粉,视为果期第1天),并使用游标卡尺测量其纵、横径(果实两个顶点的直线距离为纵径,果实最宽处为横径),花后10~40 d每10 d观测 1 次,之后分别在花后60和90 d时各观测1次。由于大花黄牡丹心皮多为1个,少为2或3个,因此观察时以1心皮果实为主,具1个以上心皮的果实,则计算纵、横径的平均值。
1.3.2 胚珠发育 花后1~90 d,采集自然授粉后的果实,沿腹缝线从中间剖开,观察胚珠发育情况。此外,于花后0~90 d,每隔10 d使用游标卡尺测量1 次其纵、横径。
1.3.3 胚珠显微结构观察 根据1.3.2观察结果,分别采集花后20 d体积正常和异常的胚珠,置于卡诺氏固定液(体积分数95%乙醇、冰醋酸,二者体积比为3∶1)中。真空处理12 h后,转移到体积分数70%乙醇溶液中,4 ℃低温保存。采用常规石蜡切片方法将固定好的材料进行包埋,切片机(Leica RM2235)切片(切片厚度 9~12 μm)后,用番红-固绿双重染色,中性树胶封片,生物显微镜(SDPTOP CX40RFL)观察并拍照、记录。
1.3.4 结果率 花期随机选取50个花枝,观测并标记单个花枝上的开花数,果期时记录每个花枝上的结果数,计算结果率,拍照记录果实和结果枝枯萎情况。结果率=结果数/开花数×100%。
1.4 大花黄牡丹二次枝生长与果实发育田间控制试验
2019-2021年春季,选择3花/枝的花枝,分成A处理(保留不同花蕾,去除所有二次枝)、B处理(保留所有二次枝,去除不同花蕾)和对照(CK,保留所有花蕾、二次枝及腋芽),其中A处理又分为7个处理,分别为CYA1~CYA7;B处理又分为6个处理,分别为CYB1~CYB6,具体处理方法见表1。每处理5个重复。由于去除二次枝可能会使花枝上的腋芽萌发形成新的二次枝,因此A处理去除所有花枝上的腋芽;B处理则保留所有花枝上的腋芽。待种子成熟时,统计各处理的结果率、每朵花的饱满种子数、败育种子数,计算每个果实的结实率,结实率=饱满种子数/(饱满种子数+败育种子数)×100%。
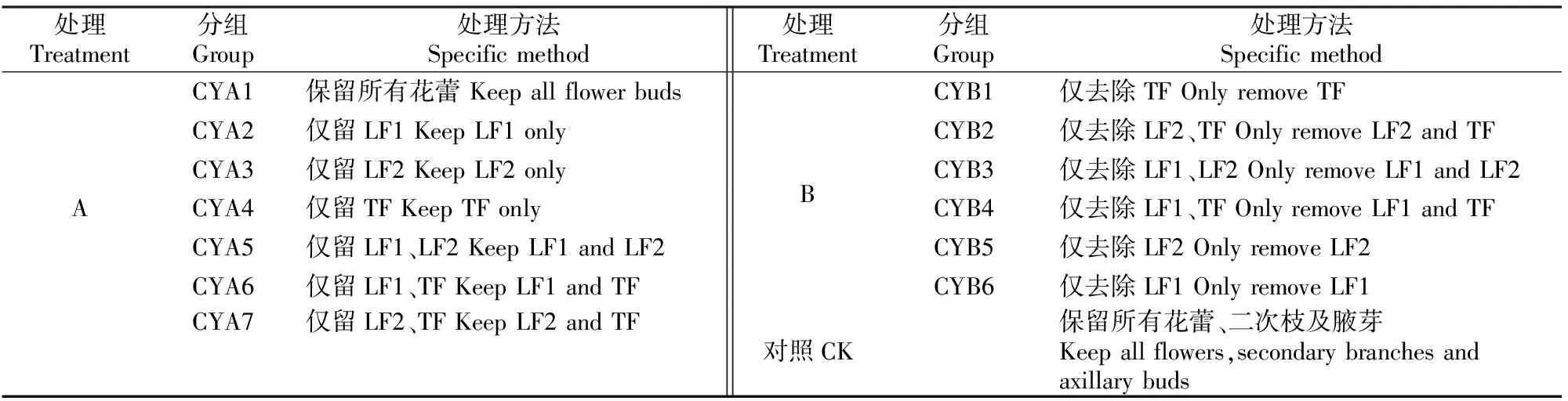
表1 大花黄牡丹二次枝田间控制试验Table 1 Field control experiment of secondary branches of Paeonia ludlowii
1.5 生理生化指标及内源激素含量的测定
分别在2019年和2020年的5-9月观察果实发育,同时于花后12,13,14,15,20,30,50 d定期采集胚珠,当果荚内出现明显败育胚珠时,将正常胚珠和败育胚珠分别取样(败育胚珠通过解剖观察确定),锡箔纸包裹后用液氮处理2~5 min,-80 ℃保存备用。
根据果实发育及显微观察结果[24],选择相应时期的样品进行生理生化指标及内源激素含量测定。用蒽酮比色法测定可溶性糖和淀粉含量,用考马斯亮蓝G-250染色法测定可溶性蛋白含量,用氮蓝四唑(NBT)光还原法测定超氧化物歧化酶(SOD)活性[25]。用酶联免疫吸附分析法(ELISA)测定脱落酸(ABA)、赤霉素(GA3)、玉米素核苷(ZR)及生长素(IAA)等内源激素的含量[26]。每个样品3个生物学重复。
1.6 数据统计与分析
采用Adobe Photoshop 2020软件对图片进行处理,使用WPS Office 2019及SPSS Statistics 17.0软件进行数据统计及分析。
2 结果与分析
2.1 大花黄牡丹开花特性观察
由表2可知,大花黄牡丹3花蕾/枝占比最高(65.96%),4花蕾/枝次之(23.40%)。因部分花蕾不能正常开放,每花枝上2朵或3朵占比最高,分别为38.30%和36.17%。大花黄牡丹的TF和LF开放顺序并不固定,以3花/枝为例,TF先开放,LF1随后开放,LF2最后开放(即TF→LF1→LF2)的花枝最多。
2.2 大花黄牡丹果实及胚珠的形态变化
2.2.1 果实发育过程中的形态变化 观察发现,大花黄牡丹单花花期8~9 d,柱头露出时即有访花昆虫。随着果实的生长,柱头颜色逐渐加深,由黄变为红色,最后黑褐色;花期时果实外表皮较平滑,在发育过程中逐渐凹凸不平,并由黄绿色变为绿色,随后变红、变黑(图2)。
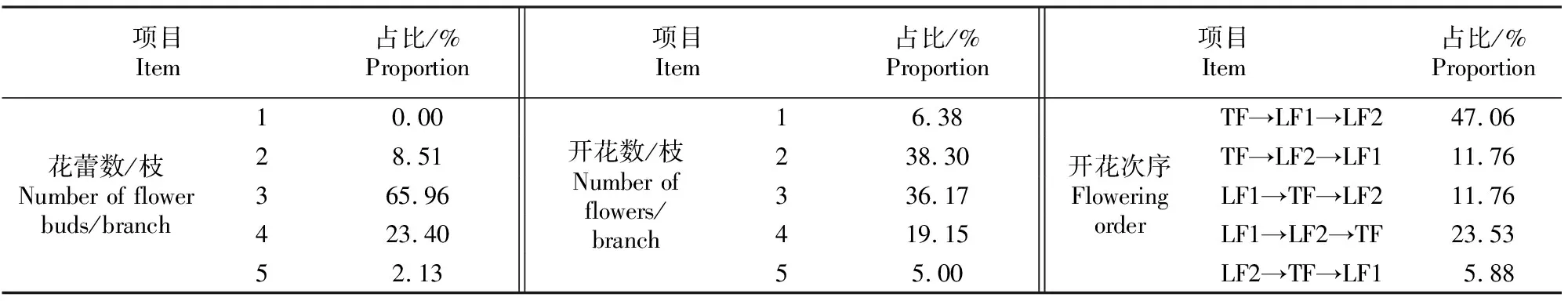
表2 大花黄牡丹的开花特性Table 2 Flowering characteristics of Paeonia ludlowii
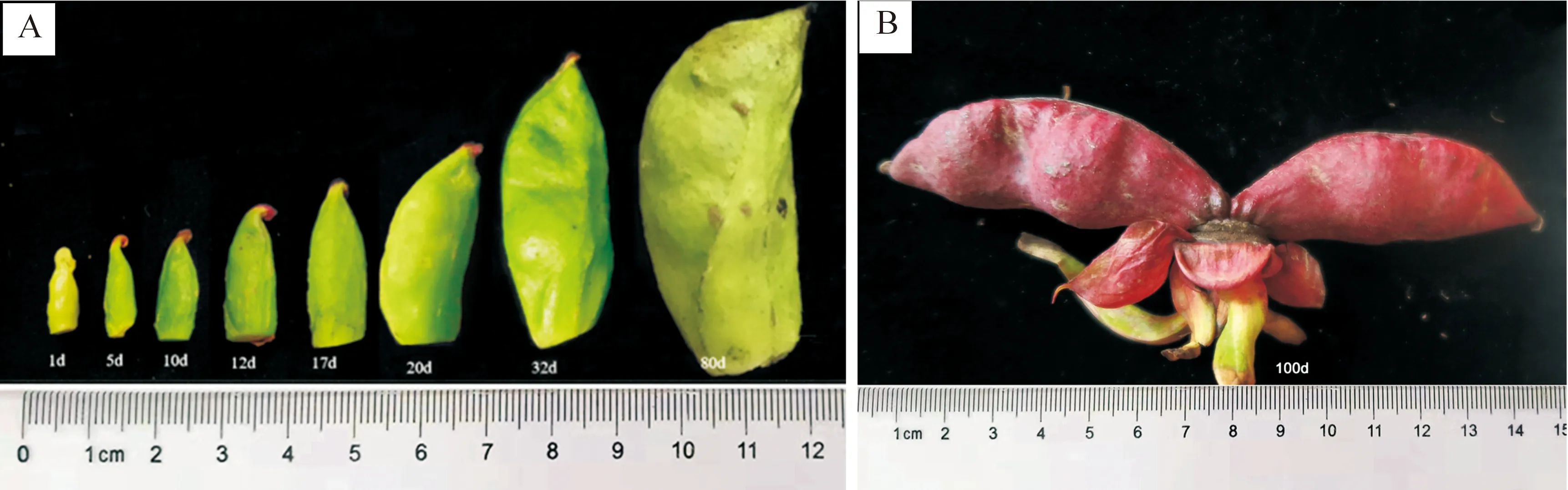
A.花后1~80 d;B.花后100 d A.1―80 d after flowering;B.100 d after flowering图2 大花黄牡丹果实发育过程中的形态变化Fig.2 Changes in fruit morphology of Paeonia ludlowii
大花黄牡丹果实不同发育时期的生长动态见图3。
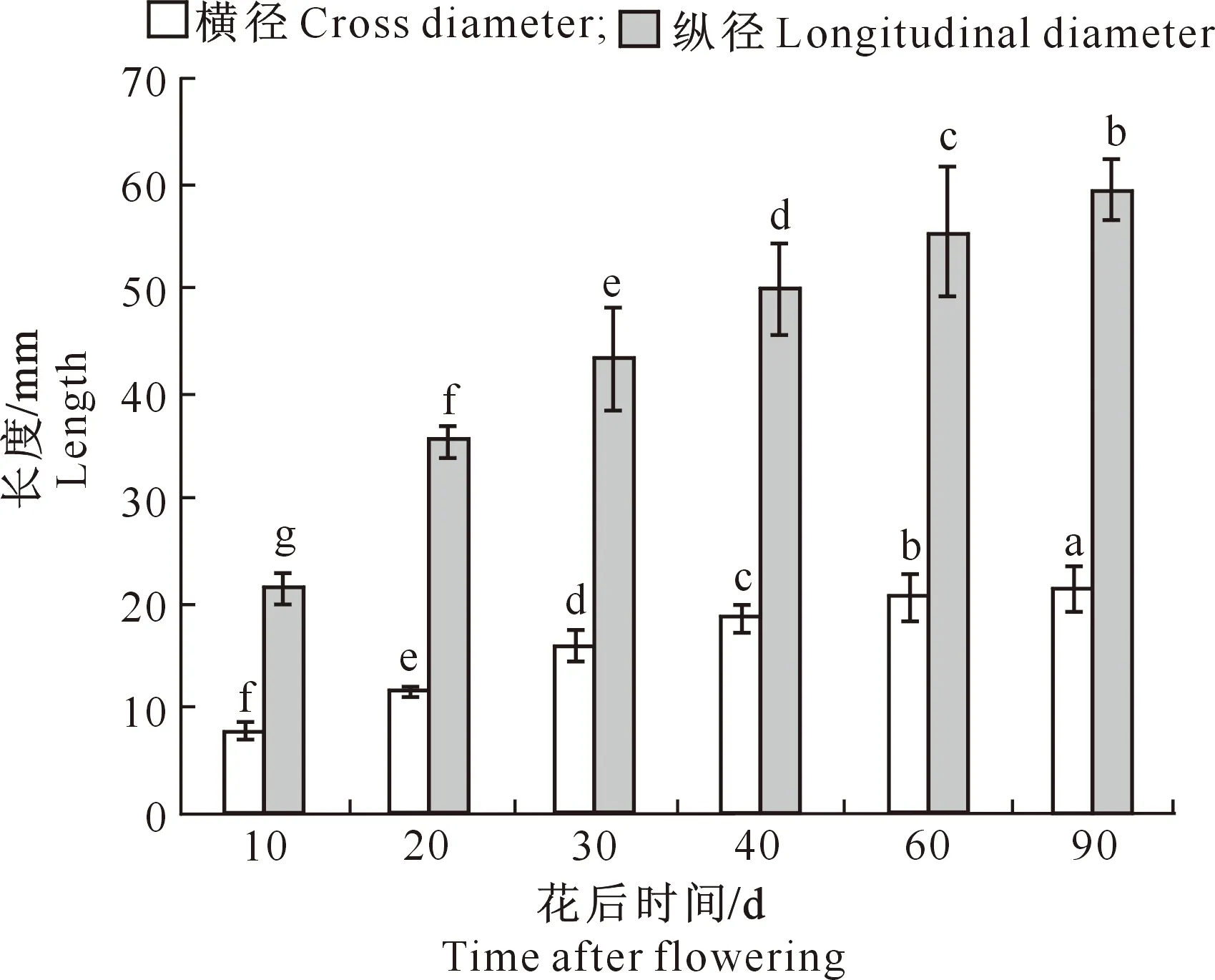
图柱上标不同小写字母表示同一指标不同时期差异 显著(P<0.05)。下同 Different lowercase letters indicate significant differences among periods(P<0.05).The same below图3 大花黄牡丹果实不同发育时期的生长动态Fig.3 Growth of Paeonia ludlowii fruit in different stages
图3显示,大花黄牡丹果实发育过程中,纵径和横径均在花后10~30 d快速增长,之后趋于平缓。其中纵径在花后10~20 d增长最快,平均日增长量为1.394 mm,花后20~30 d增长稍慢,平均日增长量为0.795 mm。横径则在花后20~30 d增长最快,平均日增长量为0.434 mm,花后10~20 d增长稍慢,平均日增长量为0.385 mm。成熟时(90 d)果实的纵横径比为2.762。
2.2.2 胚珠的形态变化 花后1~10 d,大花黄牡丹胚珠增大明显,但总体积变化不明显(图4-A~C)。花后13 d,胚珠间体积差别明显(图4-D)。之后正常胚珠体积快速增大,表面分泌黏液;部分胚珠停止增长,与正常胚珠差异逐渐明显(图4-E~F)。花后20~50 d,正常胚珠体积继续增大,胚珠表面光滑并有黏液,败育胚珠停止增长,变干,种皮变皱,二者之间的体积及外部形态差异明显(图4-G~J)。之后正常胚珠种皮逐渐变得结实坚硬,并慢慢褐化变黑,直至成熟(图4-K)。从花后13 d起,每个果实内可清楚地看到体积小的胚珠发生败育。其中部分败育的胚珠在后期体积虽然有一定程度膨大,但仍不能形成可育的种子。值得注意的是,花后20 d,部分果实中的一些胚珠体积出现异常,它们比早期明显败育的胚珠体积大,但比正常胚珠体积小(图4-G)。切片观察发现,正常胚珠的胚囊内胚乳与内珠被毗邻,胚乳游离核数量多且明显(图5-A);而体积异常的胚珠,胚囊内的胚及胚乳游离核与正常胚珠相比有退化趋势(图5-B),说明花后20 d可能存在新一轮败育。
不同发育时期大花黄牡丹正常胚珠的生长动态见图6。
大花黄牡丹正常胚珠纵径和横径的生长趋势为慢-快-慢-快-慢,花后10~30 d及40~50 d出现2个生长高峰,成熟时生长逐渐平缓(图6)。成熟期(花后90 d)种子纵横径比为1.281。
2.2.3 结果率 50个花枝开花数为215朵,收获果实148个,结果率为68.84%。自然授粉后40~80 d可见果实枯萎(图7-A、B)及结果枝枯萎(图7-C、D)现象。
2.3 大花黄牡丹二次枝生长与果实发育的关系
各试验组大花黄牡丹3年内均有不能正常开花、雄蕊脱落或果实、结果枝枯萎等现象,各年结果率及结实差异较大,且相同年份不同处理的结果率及结实情况差异也较大(表3)。

图7 大花黄牡丹自然授粉后枯萎果实(A、B)和结果枝(C、D)Fig.7 Withered fruits (A,B) and fruiting branches (C,D) of Paeonia ludlowii after being pollinated naturally
由表3可见,2019年,在A组大花黄牡丹中,每朵花的平均饱满种子数和每个果实的平均结实率均以CYA1最高,CYA6最低。可见CYA1综合表现最佳,且高于对照组(CK)。CYA2、CYA3和CYA4均仅保留了1个花蕾,但因花蕾位置不同,结实差异较大,其中CYA2每个果实的平均结实率仅次于CYA1,以CYA3最低。在B组中,除CYB1及CYB2外,其他处理组每个果实的平均结实率均高于CK,其中CYB6表现最佳,其次为CYB3。CYB2、CYB3、CYB4均仅保留1个花蕾,但以CYB3每个果实的平均结实率最高,CYB2最低。
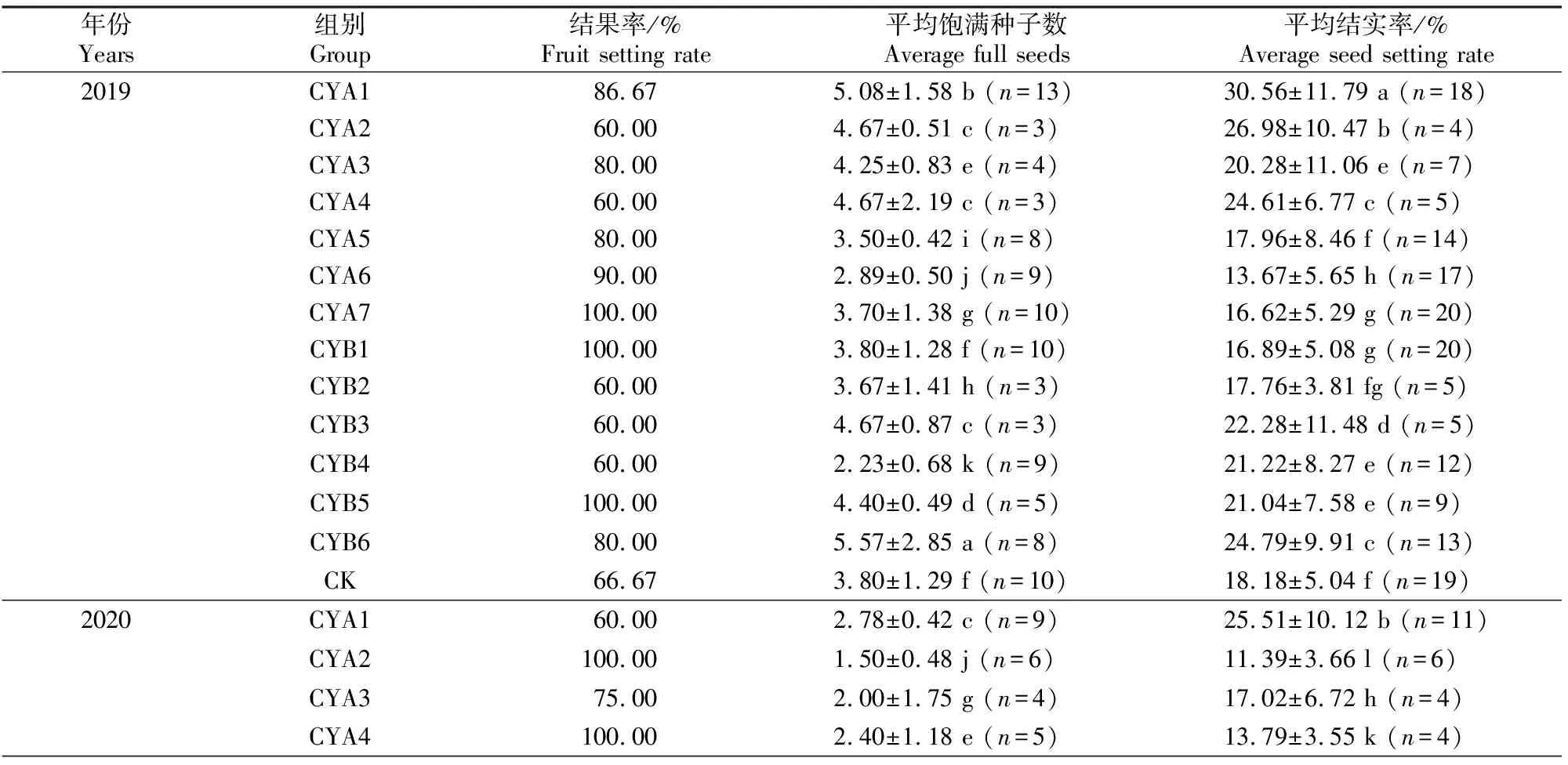
表3 大花黄牡丹二次枝的田间控制试验结果Table 3 Results of field control experiment of secondary branches of Paeonia ludlowii
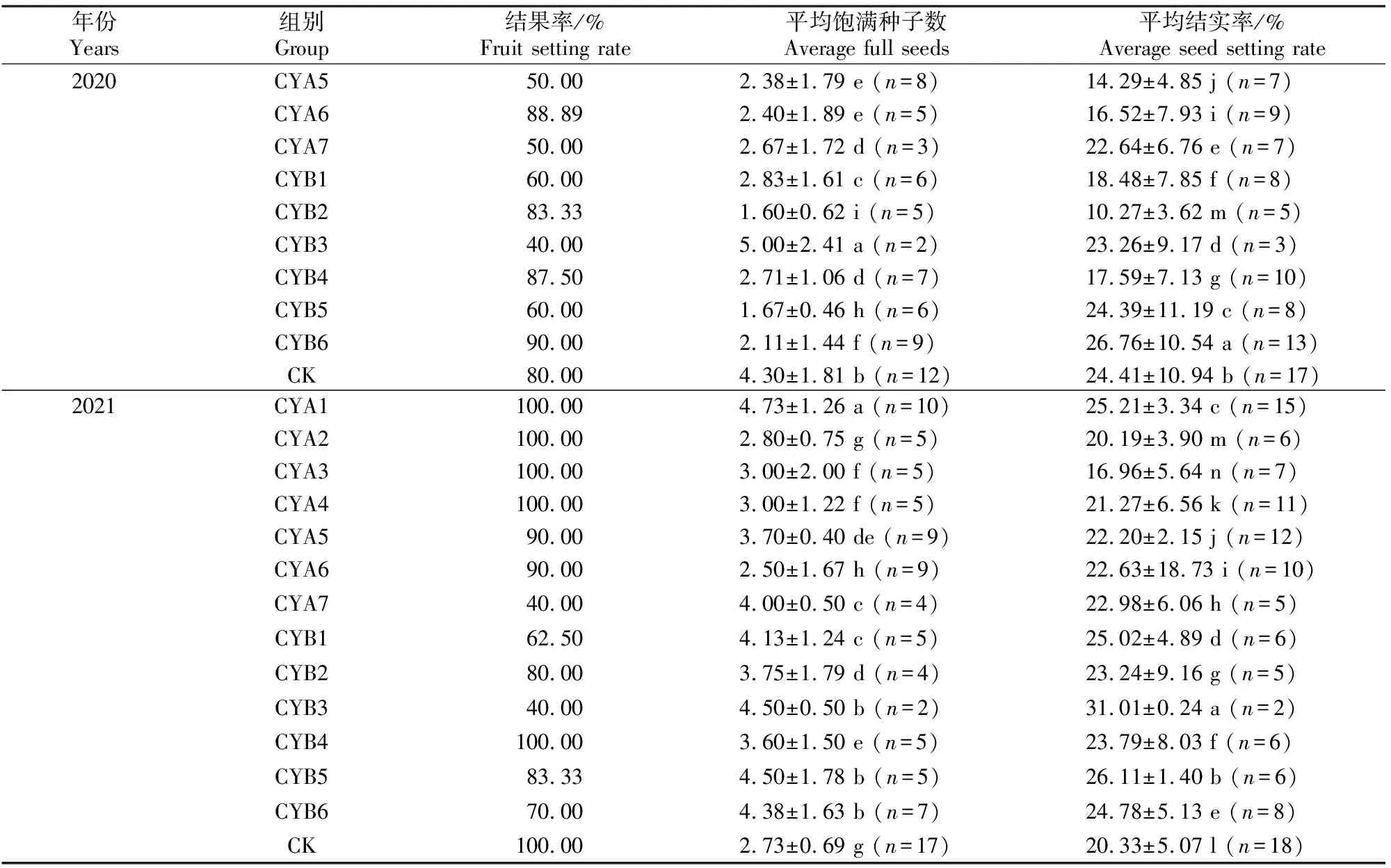
表3(续) ContinuedTable 3
由表3还可见,2020年,大花黄牡丹结果率及结实率虽低于2019年,但结实率表现最佳的处理与2019年相同,即A组CYA1和B组CYB6,其每个果实的平均结实率均高于CK。CYA2、CYA3及CYA4的平均结实率从高到低依次为CYA3>CYA4>CYA2,均低于CK;CYB2、CYB3及CYB4每个果实的平均结实率则与2019年一样,其中以CYB3最高,CYB2最低。
表3表明,2021年A组大花黄牡丹结实率以CYA1表现最佳,每个果实的平均结实率高于CK。仅保留1个花蕾的CYA2、CYA3和CYA4每个果实的平均结实率与前2年不同,依次为CYA4>CYA2>CYA3。B组所有处理每个果实的平均结实率均高于CK,其中CYB3最高,其次为CYB5,之后依次为CYB1、CYB6、CYB4;同前2年一样,B组仅保留1个花蕾的所有处理中,CYB2每个果实的平均结实率最低,说明保留二次枝时,花枝最下方的侧花结实能力在所有花朵中最弱。
2.4 大花黄牡丹胚珠败育过程中生理生化指标的变化
2.4.1 可溶性糖和淀粉含量 观察发现,花后13 d开始,大花黄牡丹胚胎败育过程中正常胚珠与败育胚珠明显可辨。如图8所示,花后12~14 d,正常胚珠中可溶性糖含量升高,而败育胚珠中可溶性糖含量则先升高后降低,之后二者变化平缓。花后12~13 d,败育胚珠中淀粉含量显著低于其他时期,之后持续上升,20 d时达到最高;花后14 d,正常胚珠中的淀粉含量最高,之后迅速下降。这可能是因为13 d后正常胚珠体积持续增大,消耗能量多,而胚珠开始败育后逐渐缩小,代谢趋缓,淀粉不再大量地转化为可溶性糖,淀粉积累大于消耗,故其含量持续上升。
2.4.2 可溶性蛋白含量 图9显示,花后13~15 d,即当败育胚珠明显可辨时,大花黄牡丹正常胚珠的可溶性蛋白含量先降低后升高,而败育胚珠的变化趋势与之相反。败育胚珠可溶性蛋白含量在花后13 d时最低,为(0.424±0.003) mg/g;14 d时升高,达到最大(1.218±0.003) mg/g,之后又急剧降低。正常胚珠可溶性蛋白含量在花后13 d最高,为(1.138±0.003) mg/g;14 d时下降达到最低值,为(0.532±0.023) mg/g;之后又缓慢升高。花后15~20 d正常胚珠与败育胚珠的可溶性蛋白含量均上升。20~50 d败育胚珠的可溶性蛋白含量先升高后大幅降低,正常胚珠则缓慢下降,但降幅不明显。
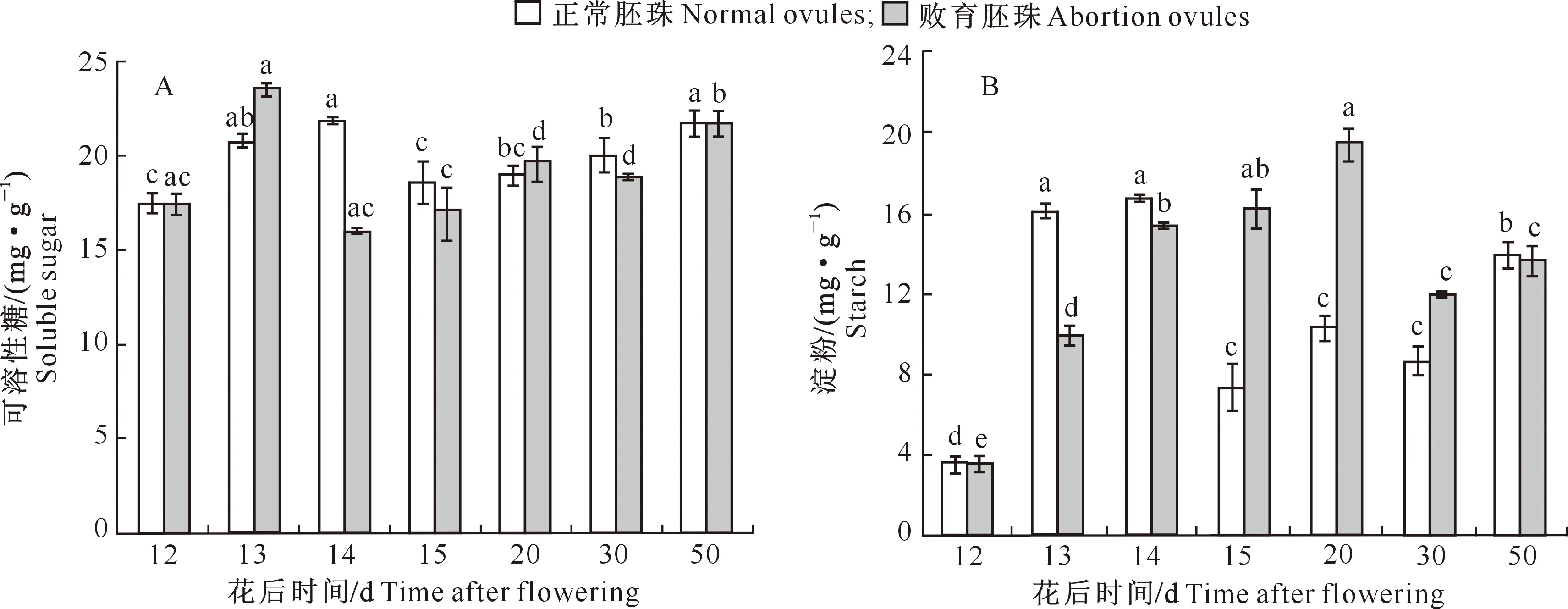
图8 大花黄牡丹果实胚珠中可溶性糖(A)和淀粉(B)含量变化Fig.8 Variation of soluble sugar (A) and starch (B) contents in ovules of Paeonia ludlowii
2.4.3 SOD活性 从图10可见,花后13~50 d,大花黄牡丹正常胚珠和败育胚珠的SOD活性变化幅度较大,但总体呈上升趋势,且正常胚珠的SOD活性始终高于败育胚珠。

图9 大花黄牡丹果实内胚珠中可溶性蛋白含量的变化 图10 大花黄牡丹果实胚珠中SOD活性的变化Fig.9 Variation of soluble protein contents in ovules of Paeonia ludlowii Fig.10 Variation of SOD activity in ovules of Paeonia ludlowii
2.5 大花黄牡丹胚珠败育过程中内源激素含量的变化
如图11所示,大花黄牡丹胚珠不同发育时期各类内源激素含量变化较复杂。花后12 d,即正常胚珠与败育胚珠形态明显可辨前,胚珠中IAA含量较高,随后急剧下降;13~20 d时,正常胚珠与败育胚珠的IAA含量总体上均先升高后降低,且正常胚珠IAA含量总体高于败育胚珠。花后20~50 d,正常胚珠的IAA 含量先降低后升高,败育胚珠则连续升高,花后30~50 d明显高于正常胚珠(图11-A)。
花后12~13 d,正常胚珠中的ABA含量降低,败育胚珠中的ABA含量升高。花后13~20 d,正常胚珠与败育胚珠ABA含量变化一致,均呈现降低-升高-降低的趋势,且败育胚珠ABA含量始终高于正常胚珠。花后20 d,败育胚珠的ABA含量继续降低,并在30 d时达到最小值((35.101±0.196) ng/g),50 d后急剧上升达到最大值((159.134±3.526) ng/g);花后20~50 d,正常胚珠ABA含量持续升高,并在花后30~50 d高于败育胚珠(图11-B)。
花后12~13 d,正常胚珠中的GA3含量升高,败育胚珠则降低。花后13~20 d,败育胚珠GA3含量呈升高-降低-升高的趋势,且总体低于正常胚珠;正常胚珠则在花后13 d后升高,并在花后14 d时达到最高值 ((13.568±0.161) ng/g),之后持续降低。花后20~50 d,正常胚珠与败育胚珠中的GA3含量变化趋势一致,均呈先升高后降低趋势,但败育胚珠中的GA3含量一直高于正常胚珠(图11-C)。
花后13~20 d,败育胚珠的ZR含量先急剧下降,随后上升;正常胚珠ZR含量则先上升后下降。花后20~50 d,正常胚珠与败育胚珠中的ZR含量均呈先升高后降低趋势,但正常胚珠的ZR含量变幅较败育胚珠大(图11-D)。
内源激素的平衡关系分析(图12)显示,花后13~20 d,败育胚珠中(GA3+IAA+ZR)/ABA、GA3/ABA和IAA/ABA小于正常胚珠,而ABA/(GA3+IAA)大于正常胚珠。花后20~50 d,以上指标的变化趋势与之前相反。
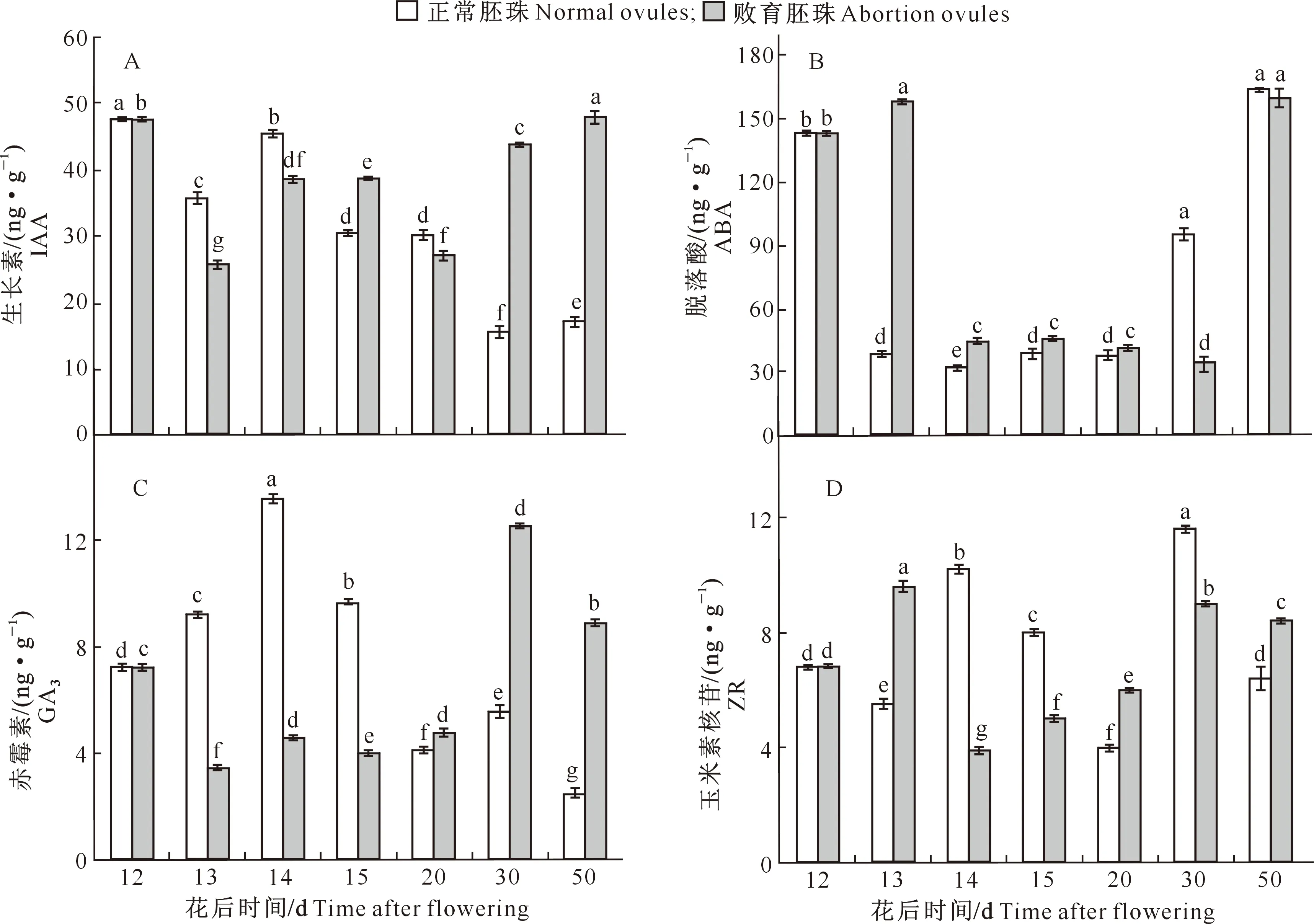
图11 大花黄牡丹果实胚珠中内源激素含量的变化Fig.11 Variation of endogenous hormones contents in ovules of Paeonia ludlowii
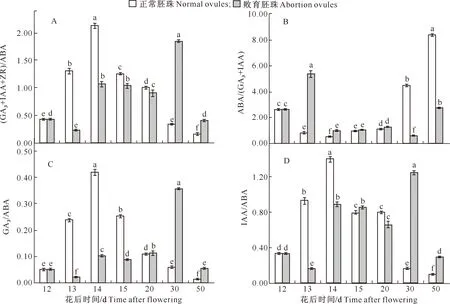
图12 大花黄牡丹果实胚珠中内源激素比值的变化Fig.12 Variation of endogenous hormones ratios in ovules of Paeonia ludlowii
3 讨论与结论
3.1 二次枝生长对胚珠败育的影响
二次枝的生长发育是大花黄牡丹开花结实的基础,是其年发育周期的重要阶段。与牡丹组其他类群相比,大花黄牡丹种子成熟过程伴随着二次枝发育。本研究的田间控制试验结果反映了二次枝生长及顶芽分化与大花黄牡丹果实发育相互影响的特点。大花黄牡丹花期在5月中旬至6月中旬[3]。开花第1天即默认为果期开始,5月上旬至6月上旬也是二次枝生长高峰。本研究观察发现,花后1~12 d胚珠外观无明显差异,10~30 d为胚珠和果实生长高峰期,从花后13 d起,正常胚珠与败育胚珠明显可辨。大花黄牡丹的果实发育高峰期、二次枝发育高峰期及胚珠败育时期重合。
早期人们认为授粉不足会导致败育,但后来证明败育的出现还涉及如资源限制等因素[27-29]。大花黄牡丹自交、异交结实,花粉活力和花粉胚珠比高[3]。授粉不足尚不足以导致大花黄牡丹胚珠败育,特别是花后20 d可能发生的新一轮败育与授粉不足关系不大。营养物质的积累是二次枝生长和果实发育的限制因子之一。本研究中,保留花蕾、去除二次枝时结实率均较高,证明了二次枝生长与胚珠发育之间存在竞争关系,因此应加强大花黄牡丹植株的营养管理,摘除部分二次枝,调控二次枝和果枝比例,以减少营养消耗从而增加结实。
一枝多花可延长牡丹的群体花期,侧蕾虽可增加结果数量但消耗资源也多;二次枝和果实之间、同一枝上不同果实间资源的竞争与分配,都会降低结果率、结实率,甚至导致枝条枯萎等。本研究中,保留大花黄牡丹二次枝去除不同花蕾的处理组的结实率虽有差异,但大多高于对照组。结合开花次序,即3个花蕾的花枝上,先开的花朵结实时同一枝条上的其余花蕾才次第开放,花、果争夺资源必然影响果实内胚珠及后开花朵的发育和结实,这也是部分花蕾不开放或花后胚珠发育不良、败育种子多的原因。因此,引种栽培时可适当去除部分过早或过晚开放的花蕾并追施营养物质,以促进花果正常发育。
本研究中,大花黄牡丹的二次枝发育与果实之间及果实与果实之间的资源分配限制,导致结果率及结实率降低甚至枝条枯萎等,这与王芳等[30]的观察结果相似。此外,本研究中,在保留花枝上所有腋芽及二次枝的情况下,仅保留花枝上最下方的花朵(即侧花1)时结实率最低,说明最下方的花朵在同一花枝上结实能力最弱,杂交时可避免给此处花朵授粉或去除此花减少营养消耗,在保证结实率的同时促进二次枝发育。
3.2 胚珠败育过程中的生理生化指标变化
在胚珠发育过程中,可溶性糖、淀粉、可溶性蛋白、酶活性及内源激素等的变化与细胞的生物功能和生理活动密切相关,糖类物质在胚珠发育过程中除作为能量物质外,还具有渗透调节、催化活性等作用[31-32]。研究发现,玉米败育籽粒中可溶性糖和淀粉含量均低于正常籽粒,这是由于有机营养物质供应不足,几乎所有营养都处于“下流”,导致玉米果穗顶部种子严重败育[33]。本研究中,花后12~14 d,大花黄牡丹正常胚珠中可溶性糖含量持续升高,而败育胚珠则先升高后降低,推测大花黄牡丹胚珠早期败育(受精结束,胚、胚乳处于游离核时期)可能与胚珠内可溶性糖含量降低有关。前人发现,除了有机物质的积累,有机物质合成能力弱也是引起玉米籽粒败育的重要生理原因[33]。本研究中,花后13~14 d,大花黄牡丹败育胚珠的淀粉含量虽有升高但仍较正常胚珠低,说明败育胚珠中淀粉转化为可溶性糖的能力较正常胚珠弱,大花黄牡丹败育胚珠合成淀粉的能力也比正常胚珠弱。
可溶性蛋白是胚胎发育的重要营养物质,它能激活细胞代谢过程,促进胚胎的形态形成。大核荔枝品种的可溶性蛋白含量普遍高于焦核品种[18]。本研究中,大花黄牡丹花后13 d时,败育胚珠可溶性蛋白含量降到最低,而此时正常胚珠的可溶性蛋白含量最高,表明胚珠内可溶性蛋白含量降低也可能导致其败育。
王飞等[19]认为,有核葡萄品种胚珠发育过程中有活性氧产生,但SOD活性持续升高迅速消除了活性氧的胁迫,而无核品种SOD活性虽升高但不能持续保持高水平,导致活性氧与膜脂过氧化产物丙二醛(MDA)积累、可溶性蛋白和糖减少,最终导致无核葡萄胚的败育。潘学军等[34]也认为,胚珠中SOD活性增强可消除活性氧毒害,保护胚珠,而SOD活性一旦下降,活性氧产生与清除的平衡被破坏,从而使胚珠败育。纪薇等[35]证实了SOD活性与无核葡萄胚败育的关联度最高。与前人研究结果相似,本研究中,花后13~50 d,大花黄牡丹正常胚珠的SOD活性始终高于败育胚珠,表明SOD活性低可能是胚珠败育的原因之一。
3.3 胚珠败育过程中的内源激素变化
有关植物胚珠发育与内源激素关系的研究表明,胚珠发育期间内源激素含量动态变化及它们之间的比例平衡与胚珠败育有着密切的联系。在雄性不育枣发育后期的败育种子中,IAA、GA3和ABA亏缺,Z异常累积[36]。四倍体刺槐(Robiniapseudoacacia)花冠展开 15 d之后的败育胚珠内生长促进类内源激素(GA3、IAA)含量低于正常胚珠,生长抑制类内源激素(ABA)含量明显高于正常胚珠[37]。本研究发现,花后13~20 d,大花黄牡丹正常胚珠中的IAA、GA3和ZR含量高于败育胚珠,而ABA含量低于败育胚珠,与上述研究结果相似。可知大花黄牡丹胚珠内低含量的IAA、GA3和ZR、高含量的ABA可能不利于胚珠的正常发育。
值得注意的是,Reed等[38]研究了玉米籽粒败育前后内源激素的变化与胚胎败育的关系,认为单一的内源激素变化不足以解释败育的成因。生长抑制类(CTK、ABA)和生长类激素(GA3、IAA)的比值与荔枝胚胎发育相关[17]。本研究中,花后13~20 d,大花黄牡丹正常胚珠中的(GA3+IAA+ZR)/ABA、GA3/ABA和IAA/ABA高于败育胚珠,而ABA/(GA3+IAA)低于败育胚珠。这与姜金仲等[37]、李建国等[39]、潘学军等[21]和贺军虎等[40]的研究结果相似,说明胚珠内较低的(GA3+IAA+ZR)/ABA、GA3/ABA、IAA/ABA,以及较高的ABA/(GA3+IAA)不利于大花黄牡丹胚珠的正常发育。
本研究形态观察结果表明,花后13 d出现了首轮败育,20 d时又出现了部分胚珠体积异于正常胚珠,切片观察发现这部分胚珠胚囊内的胚和胚乳有退化趋势,败育胚珠的生理指标及内源激素含量及比值也均在花后20 d时发生了明显变化,说明大花黄牡丹花后20 d存在新一轮胚珠败育,相关调控机理尚待进一步研究。
综上所述,大花黄牡丹胚珠败育的过程受多种因素影响,比如营养供应不足、有机物合成能力弱及内源激素代谢变化等都可能是引起胚珠败育的生理原因。在发育早期,胚珠生理活性较低时,应及时减少结果枝的营养消耗,如去除部分花蕾或二次枝。有研究表明,追肥有助于提高植株的结实率,Song等[41]给羊草追施氮肥使单株种子数增加40%;李嘉珏等[42]对引种栽培4年的大花黄牡丹植株每年人工喷施磷酸二氢钾3次后,其自交结实率为66.7%。因此,在大花黄牡丹胚珠明显败育前(即花后12 d),施用外源营养素可能有助于提高其结实率,但处理前需结合胚珠发育的状态确定,如何提高胚珠早期发育的生理活性将是今后大花黄牡丹引种、繁殖,特别是提高杂交结实率的重要研究内容。

