不同牧场及饲养方式下阿拉善双峰驼乳脂肪酸特征及产地溯源研究
马宇轩 郄梦洁 赵姗姗 胡翔宇 赵 燕 郭 军,*
(1 内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018;2 中国农业科学院农业质量标准与检测技术研究所/农产品质量安全重点实验室,北京 100081)
我国的双峰驼品种以新疆双峰驼、内蒙古阿拉善双峰驼及内蒙古苏尼特双峰驼为主[1]。自1996年起,我国的双峰驼数量逐年递减,直到2010年数量才有所回升。截至2019年年底,我国有40.5万头双峰驼,其中新疆双峰驼18.5万头,占全国双峰驼总数的45.7%,内蒙古双峰驼17.3万头,占全国双峰驼总数的42.7%。与2018年相比,2019年内蒙古双峰驼的出栏率增长了2.2%,商品率增长了4.25%[2],内蒙古双峰驼产业正在逐年稳步发展中。
驼乳被誉为“沙漠白金”,是优质的营养食品,比牛乳有更高的药用价值[3-6]。但因驼乳的产量低及地域性强,供不应求,且价格较牛奶昂贵,易被掺假冒充[7]。目前,国外学者主要针对驼乳中的益生菌、功能性物质及功能机制等方面进行了研究,且大部分为单峰驼乳[8]。此外,关于驼乳的理化性质[9-10]、脂肪酸[11-12]、矿物元素[13-14]、蛋白质[15-17]、氨基酸[18]及代谢组学[19]等方面的研究也在陆续开展。国内关于双峰驼乳的相关研究较多,但起步较晚,驼乳产品开发及标准研究等方面尚有不足,研究成果大部分集中在双峰驼乳的一般成分、基本理化性质[20-22]以及乳中的益生菌[23-24]等方面。关于双峰驼乳溯源技术的研究尚未系统全面地开展,尤其是脂肪酸技术方面,目前主要应用脂肪酸技术进行物种鉴别和含量检测研究,研究样本量较小且缺乏较为系统的相关数据[22,25]。而利用脂肪酸技术进行双峰驼乳产地溯源的研究较少。因此,本研究通过测定不同牧场及饲养方式下双峰驼乳33种脂肪酸含量,结合化学计量学方法对阿拉善5个牧场139份双峰驼乳样品进行分析,开展阿拉善双峰驼乳近距离产地及饲养方式溯源研究。参照国标对驼乳样品的脂肪酸含量进行检测,利用脂肪酸指纹特征建立判别模型,并对模型进行验证,计算各脂肪酸的重要性,选择判别模型的关键重要性因子(variable importance,VIP),以期为阿拉善双峰驼乳的系统营养评价提供依据,为双峰驼乳近距离的产地溯源及真实性鉴别提供技术支持,为乳业安全相关研究提供思路。
1 材料与方法
1.1 样品采集
2019年4月从内蒙古自治区阿拉善左旗5个牧场人工收集双峰驼乳样品共计139份,并在-20℃下冷冻。驼乳样品详细信息如表1所示,采样点位置图见图1。
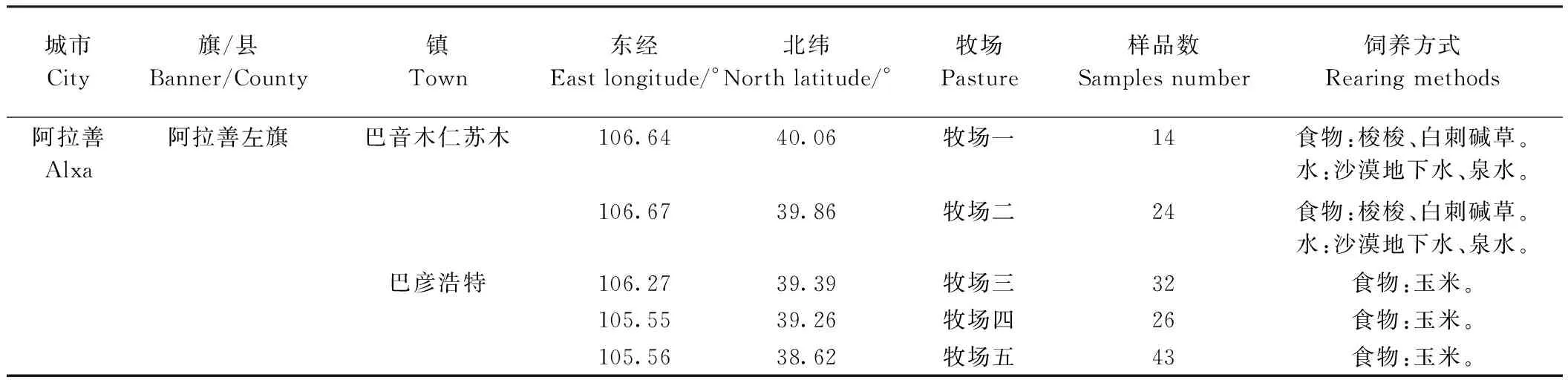
表1 驼乳样品地理信息表Table 1 Region information of camel milk samples
图1 双峰驼乳采样点位置图Fig.1 Map of Bactrian camel milk sampling sites
1.2 仪器及试剂
XS204型电子分析天平,瑞士METTLERTOLEDO公司;XMTD-204型HH系列数显恒温水浴锅,江苏科析仪器有限公司;SCIENTZ-48高通量组织研磨器,宁波新芝生物科技股份有限公司;H1850台式高速离心机,湖南湘仪实验室仪器开发有限公司;7890A 气相色谱仪-FID检测器、色谱柱DB-23(60 m × 0.25 mm,0.25 μm),美国Agilent公司;具塞试管,北京莱伯沃德科技有限公司;培养皿,北京LABSELECT公司。
氯乙酰(分析纯),上海阿拉丁生化科技股份有限公司;碳酸钾(分析纯),上海麦克林生化科技有限公司;水(蒸馏水),香港屈臣氏集团有限公司;甲醇(色谱纯)、正己烷(色谱纯),日本德山药品工业株式会社;脂肪酸甲酯混合标准品(纯度均大于99%)、内标十一烷酸甲酯(纯度均大于99%),德国Dr. Ehrenstorfer Gmbh公司。
1.3 样品制备及甲酯化
参照《GB 5009.168-2016食品安全国家标准 食品中脂肪酸的测定》[26],取15 g驼乳样品(鲜重)在 -20℃预冻,然后将其冷冻干燥26 h并研磨成细粉。称取0.2 g冻干粉置于15 mL具塞试管中,加入1 mL十一烷酸甲酯标准溶液(1 mg·mL-1),再分别加入 4 mL 正己烷和 6 mL乙酰氯甲醇溶液(v∶v,乙酰氯∶甲醇= 1∶10),盖紧塞子,旋紧螺旋盖,振荡混合后置于80℃水浴锅中水浴2 h,取出冷却至室温。将样液转移至50 mL离心管,分别用3 mL 7%碳酸钾水溶液清洗具塞试管3次,合并碳酸钾溶液,5 000 r·min-1离心5 min,取上清液进行脂肪酸测定。正乙烷作为溶剂与混合脂肪酸甲酯标准品混合,配制成适当浓度,用于脂肪酸的定性分析。
图2 双峰驼乳脂肪酸气相色谱图Fig.2 Gas chromatography of fatty acids in bactrian camel milk
1.4 气相色谱条件
色谱柱:DB-23毛细管柱(60 m × 0.25 mm,0.25 μm);程序升温条件:初始100℃,保持2 min,以25℃·min-1升至175℃,以1.5℃·min-1升至230℃,保持1 min;载气:氮气;流速:1 mL·min-1;分流比:1∶30;进样口温度:260℃;检测器:FID检测器;检测器温度:280℃;进样量:1 μL。通过对照标准品保留时间对样品中脂肪酸进行定性,内标法定量。
1.5 数据分析
用SPSS 26.0软件对数据进行单因素方差分析及Duncan多重比较,分析不同牧场样品中脂肪酸组成的差异,用独立样本t检验对不同饲养方式的驼乳脂肪酸数据进行检验,使用线性判别分析(linear discriminant analysis,LDA)评价脂肪酸数据对不同样品来源的判别效果。利用SIMCA 14.1软件对不同来源的驼乳样品进行正交偏最小二乘判别分析(orthogonal partial least-squares discriminant analysis,OPLS-DA),观察不同牧场及饲养方式下脂肪酸指纹的聚类特性,并通过计算各脂肪酸的重要性来确定影响溯源的关键因子。
2 结果与分析
2.1 不同牧场驼乳脂肪酸特征分析
通过气相色谱技术对近距离的不同牧场的驼乳脂肪酸含量进行检测,样品的气相色谱图见图2,方差分析结果见表2。所有双峰驼乳样品共测得33种脂肪酸。整体上,双峰驼乳的饱和脂肪酸(saturated fatty acids,SFA)、单不饱和脂肪酸(monounsaturated fatty acids,MUFA)、多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)及总脂肪酸(total fatty acids,TFA)含量分别为185.80~205.60、99.64~118.79、13.71~18.81及300.99~334.22 mg·g-1;SFA/TFA、MUFA/TFA及PUFA/TFA分别为58%~63%、32%~37%及4%~6%;MUFA/SFA及PUFA/SFA分别为50%~64%及7%~9%,饱和脂肪酸含量/不饱和脂肪酸含量(unsaturated fatty acid,UFA)平均为1.6。
5个牧场驼乳中脂肪酸含量由高到低依次为棕榈酸、油酸、硬脂酸、肉豆蔻酸,分别约占总脂肪酸含量的27%、25%、17%、12%,棕榈酸含量在牧场二中最高,在牧场五中最低;油酸含量在牧场三中最高,在牧场二中最低;硬脂酸含量在牧场五中最高,在牧场二中最低;肉豆蔻酸含量在牧场二中最高,在牧场五中最低。5个牧场驼乳样品SFA中含量最高的是棕榈酸,MUFA中含量最高的是油酸,PUFA中含量最高的是亚油酸,分别约占总脂肪酸含量的26%~30%、23%~28%及2%~3%。从营养学角度出发,5个牧场驼乳的n-3系列脂肪酸占总脂肪酸的0.67%~0.98%,其中牧场二驼乳的n-3系列脂肪酸占比最高,为0.98%。5个牧场驼乳的n-6系列脂肪酸占总脂肪酸的3.4%~4.6%,其中牧场一驼乳的n-6系列脂肪酸占比最高,为4.6%。
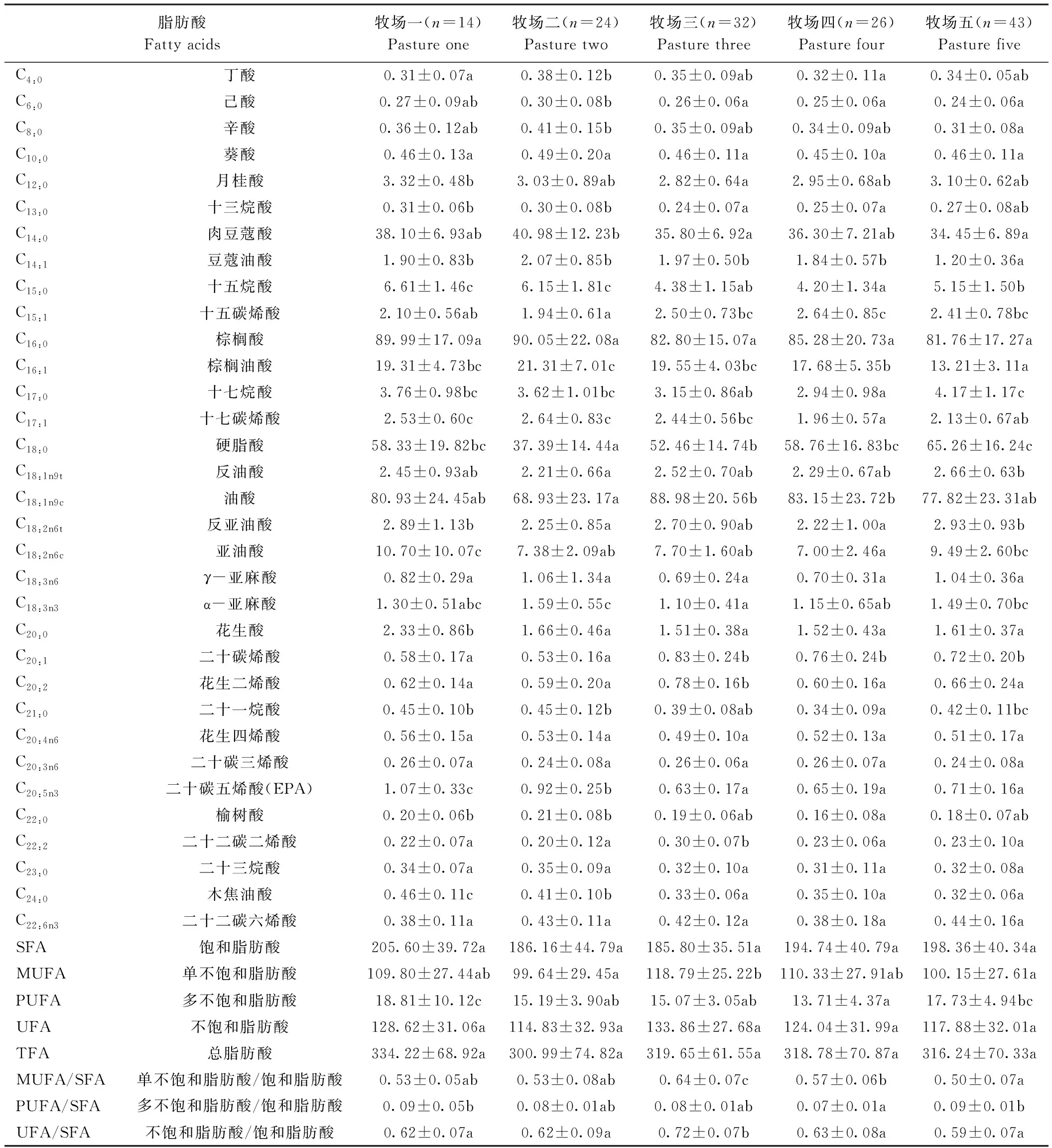
表2 不同牧场驼乳脂肪酸含量比较Table 2 Comparison of fatty acid content of camel milk in different pastures /(mg·g-1)
2.2 不同饲养方式下驼乳脂肪酸含量比较
对不同饲养方式下双峰驼乳脂肪酸含量进行统计分析,独立t检验结果见表3,在测得的33种脂肪酸中,有20种脂肪酸含量存在显著或极显著差异。草饲与谷饲方式下驼乳的SFA、PUFA、MUFA及TFA差异均不显著(P>0.05),SFA/TFA、MUFA/TFA及PUFA/TFA分别为61.72%和60.84%、33.01%和34.18%、5.28%和4.99%。两种饲养方式下的双峰驼乳脂肪酸含量由高到低均为棕榈酸、油酸、硬脂酸、肉豆蔻酸,除硬脂酸差异极显著外(P<0.01),其他3种脂肪酸含量均差异显著(P<0.05)。草饲与谷饲方式下双峰驼乳SFA中含量最高的脂肪酸均为棕榈酸,分别占总脂肪酸含量的28.74%及26.10%;MUFA中含量最高的脂肪酸均为油酸,分别占总脂肪酸含量的23.42%及26.02%;PUFA中含量最高的脂肪酸均为亚油酸,分别约占总脂肪酸含量的2.75%及2.60%。从营养学角度出发,草饲与谷饲方式下驼乳的n-3系列脂肪酸分别占总脂肪酸的0.92%及0.75%,n-6系列脂肪酸分别占总脂肪酸的4.1%及3.9%。
2.3 不同牧场驼乳的化学计量学分析
通过OPLS-DA判别不同牧场的双峰驼乳样品,结果如图3所示。5个牧场的驼乳样品分别聚类且彼此分离,牧场一与牧场二在第一、第四象限分别聚类,牧场三及牧场四在第二象限分别聚类,牧场五在第三象限聚类,说明通过测定脂肪酸含量可以区分5个牧场的驼乳样品,且将草饲方式下牧场一及牧场二的驼乳样品与谷饲方式下牧场三、牧场四及牧场五的驼乳样品明显区分。对5个牧场的驼乳样品进行分类及验证,结果见表4。总体正确分类和交叉验证的准确率分别为93.5%和82.7%,说明通过测定脂肪酸含量可以对5个牧场驼乳样品进行判别。用SIMCA 14.1软件对5个牧场驼乳样品的脂肪酸含量进行分析,获得分类脂肪酸的关键重要性因子(图4)。结果表明,驼乳中硬脂酸、棕榈油酸、木焦油酸、豆蔻油酸、 EPA等15种脂肪酸是具有较高贡献的关键重要性因子(>1),可以通过测定这15种脂肪酸识别5个牧场驼乳的来源。牧场一与牧场二的驼乳样品在OPLS-DA图中聚类距离较近,对这两个牧场驼乳的脂肪酸含量进行分析,得到分类脂肪酸的关键重要性因子(图5),结果表明硬脂酸(37.39~58.33 mg·g-1)、花生酸(1.66~2.33 mg·g-1)、 反亚油酸(2.25~2.89 mg·g-1)等11种脂肪酸是具有较高贡献的关键重要性因子,可以通过测定这11种脂肪酸识别牧场一与牧场二的驼乳样品。同样对牧场三及牧场四驼乳的脂肪酸含量进行分析,得到分类脂肪酸的关键重要性因子(图6),结果表明花生二烯酸(0.60~0.78 mg·g-1)、二十二碳二烯酸(0.23~0.30 mg·g-1)、 十七碳烯酸(1.96~2.44 mg·g-1)等10种脂肪酸是具有较高贡献的关键重要性因子,可以通过测定这10种脂肪酸识别牧场三与牧场四的驼乳样品。

表3 不同饲养方式下的驼乳脂肪酸含量Table 3 Fatty acid content of camel milk in different feeding methods /(mg·g-1)
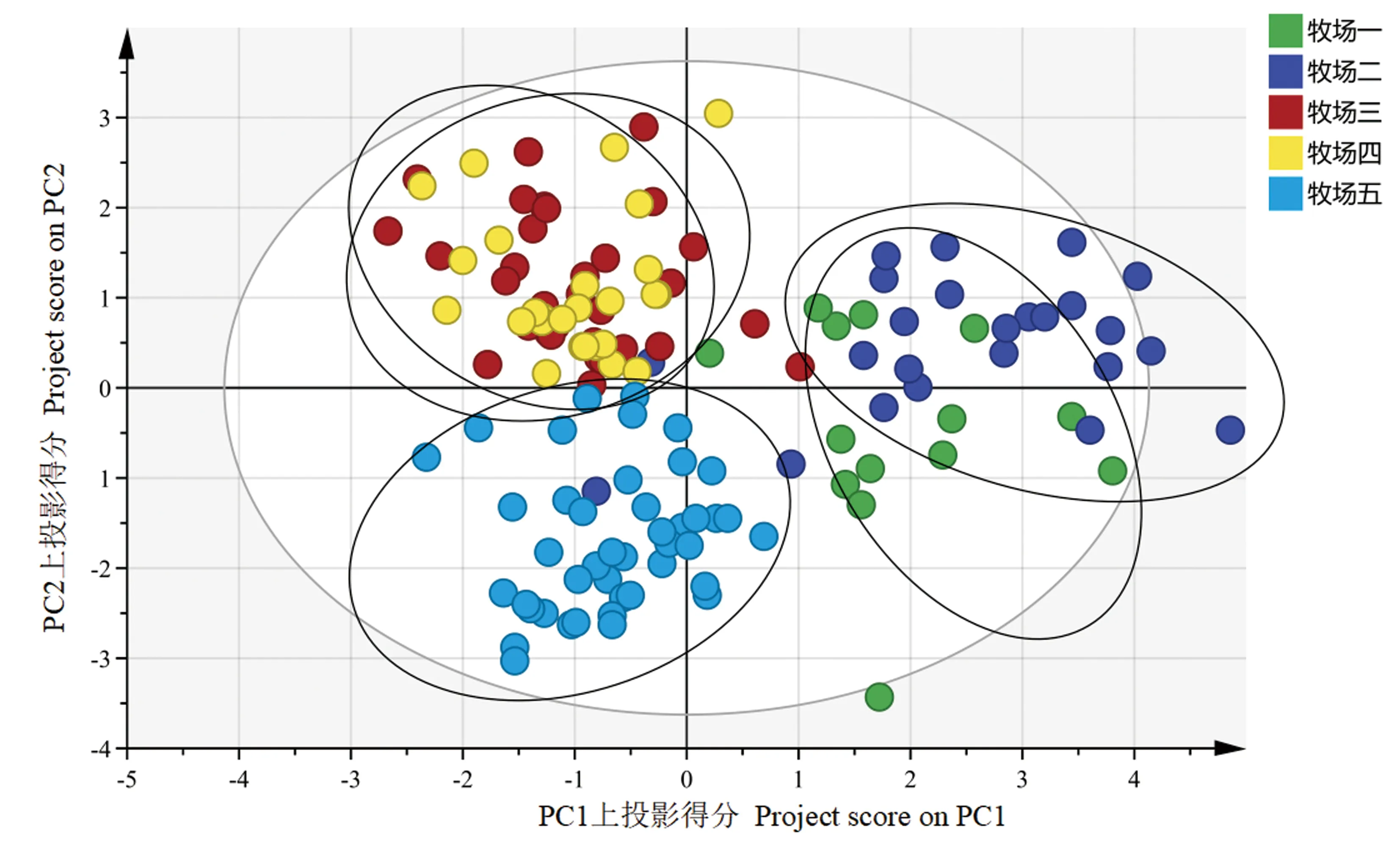
图3 5个牧场驼乳样品的OPLS-DA图Fig.3 OPLS-DA of camel milk from five pastures
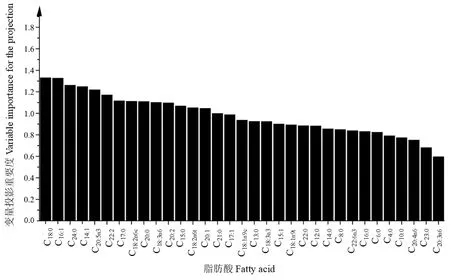
图4 5个牧场驼乳样品分类脂肪酸的重要性因子Fig.4 The importance factors of fatty acids classification in camel milk from five pastures
2.4 不同饲养方式下驼乳的化学计量学分析
根据测得的脂肪酸含量数据对不同饲养方式下的驼乳样品进行正交偏最小二乘法分析,结果见图7。两种饲养方式下的驼乳样品分别聚类且彼此有明显的分离趋势,说明可通过脂肪酸含量对两种饲养方式下的驼乳进行区分。对不同饲养方式下的驼乳样品进行分类及验证,结果见表5。总体正确分类和交叉验证的准确率分别为98.6%和95.0%,说明利用脂肪酸含量数据可以对不同饲养方式下的驼乳样品进行判别。对不同饲养方式下的驼乳样品进行分析,获得分类脂肪酸的关键重要性因子,如图8所示。结果表明驼乳中EPA、二十碳烯酸、十五烷酸、木焦油酸、硬脂酸、棕榈油酸、十三烷酸、十五碳烯酸、十七碳烯酸、花生酸、二十一烷酸、豆蔻油酸及肉豆蔻酸13种脂肪酸是贡献率较高的关键重要性因子(>1),可以通过这13种脂肪酸对不同饲养方式下的驼乳进行判别。
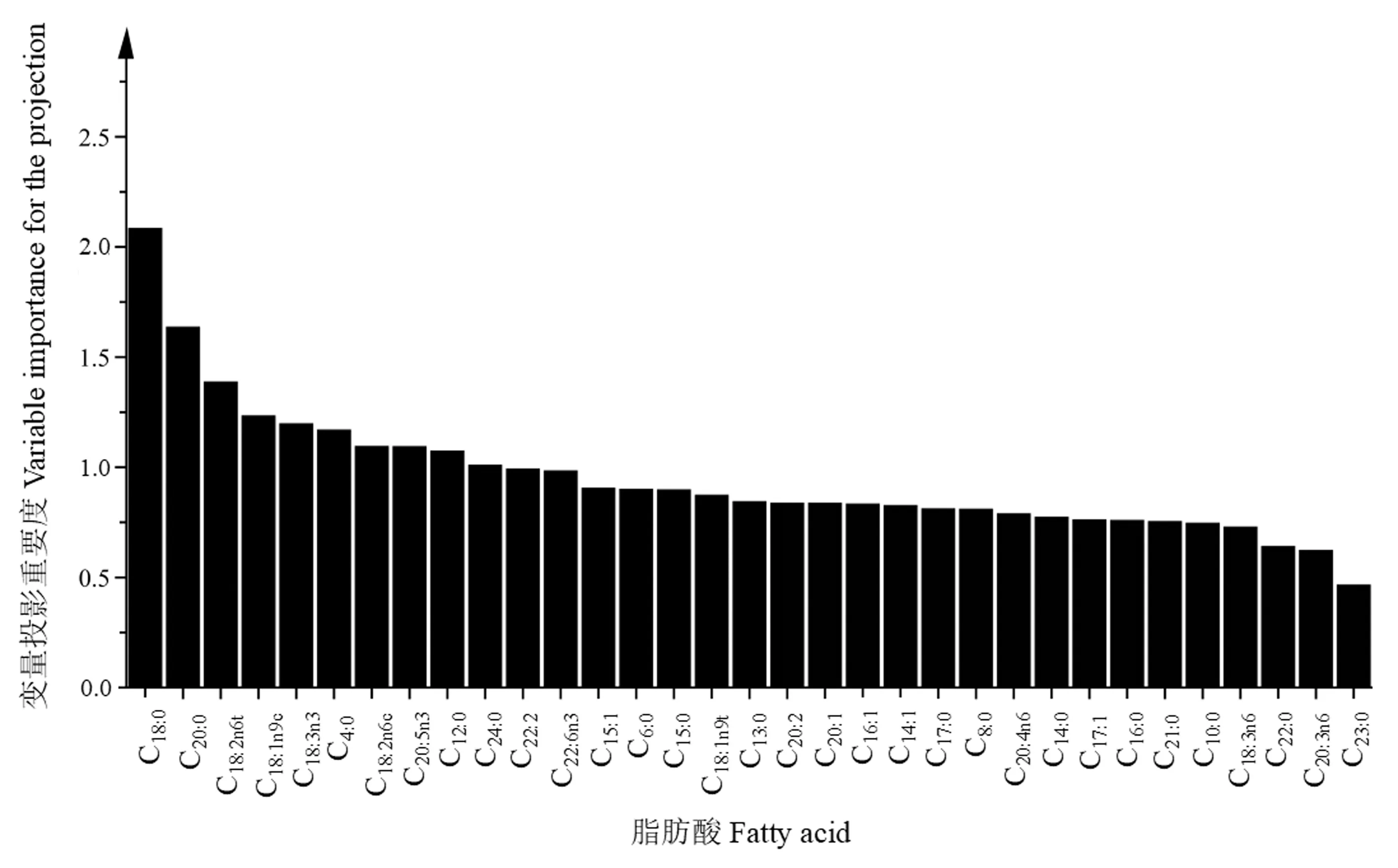
图5 牧场一与牧场二驼乳样品分类脂肪酸的重要性因子Fig.5 Important factors of fatty acids for classification of camel milk from pasture 1 and pasture 2
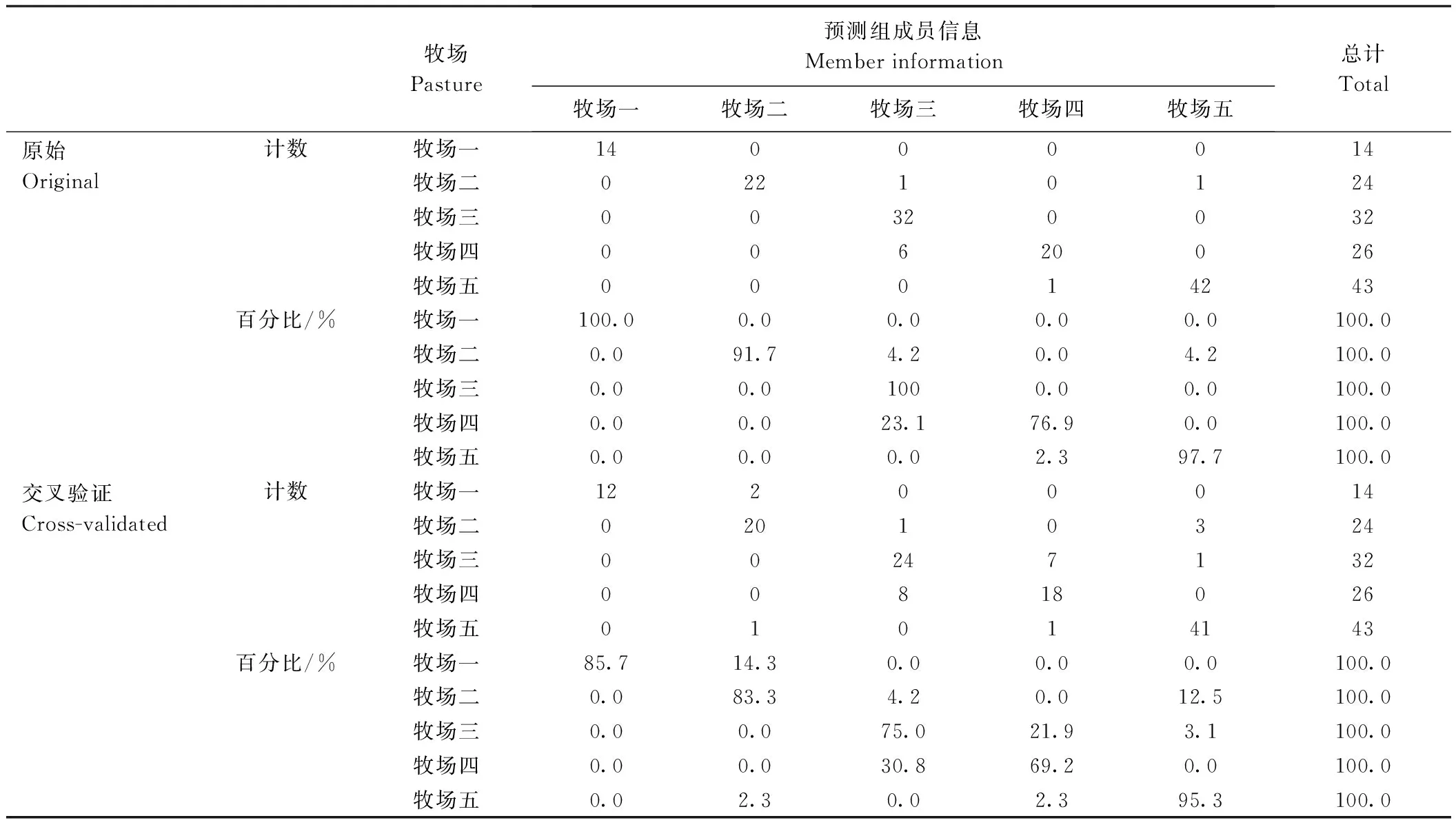
表4 不同牧场驼乳分类和正确分类的观察结果Table 4 Classification and correct verification results of camel milk from five pastures
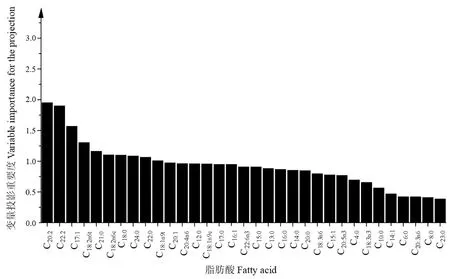
图6 牧场三与牧场四驼乳样品分类脂肪酸的重要性因子Fig.6 Important factors of fatty acids for classification of camel milk from pasture 3 and pasture 4
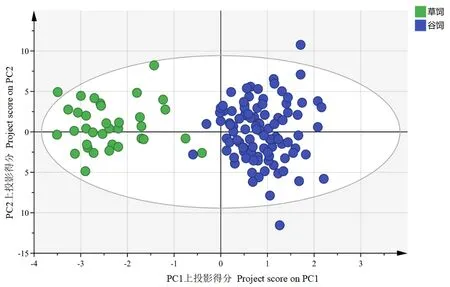
图7 不同饲养方式下驼乳样品的OPLS-DA图Fig.7 OPLS-DA of camel milk in different feeding methods
3 讨论
整体而言,本研究测得的双峰驼乳中SFA/TFA、MUFA/TFA、PUFA/TFA、MUFA/SFA、PUFA/SFA及SFA/UFA结果与伊日贵[25]及李磊等[27]的研究结果一致,且与前人[22,25]相比测出的脂肪酸种类较多。本研究测得的阿拉善驼乳SFA/UFA 为1.6,与伊日贵[25]测得的新疆驼乳相比低0.4,与呼伦贝尔驼乳相比低0.3。而SFA/UFA值越低,营养价值越高[28],说明阿拉善驼乳的营养价值比新疆驼乳及呼伦贝尔驼乳的营养价值高。
双峰驼乳中脂肪酸含量由高到低依次为棕榈酸、油酸、硬脂酸、肉豆蔻酸,测得的结果与郭珍琪[22]及伊日贵[25]的研究结果一致,其中双峰驼乳的棕榈酸、油酸、硬脂酸含量占总脂肪酸含量的27%、25%及17%,棕榈酸含量占比与呼伦贝尔驼乳及新疆驼乳相比较低,油酸含量占比较高,硬脂酸含量占比高于呼伦贝尔驼乳,低于新疆驼乳[25]。在测得的33种脂肪酸中,有26种脂肪酸含量在5个牧场驼乳样品中存在不同情况的差异性,说明采用传统统计学分析可以对5个牧场进行区分。除此之外,牧场一与牧场二的棕榈酸含量高于其他牧场,油酸及硬脂酸含量低于其他牧场。牧场一与牧场二的骆驼以梭梭为食,牧场三、牧场四及牧场五的骆驼以玉米为食,说明驼乳脂肪酸含量与骆驼的饲养方式可能具有一定关联性[29-30],饲料能够影响乳中的营养成分[22,31]。
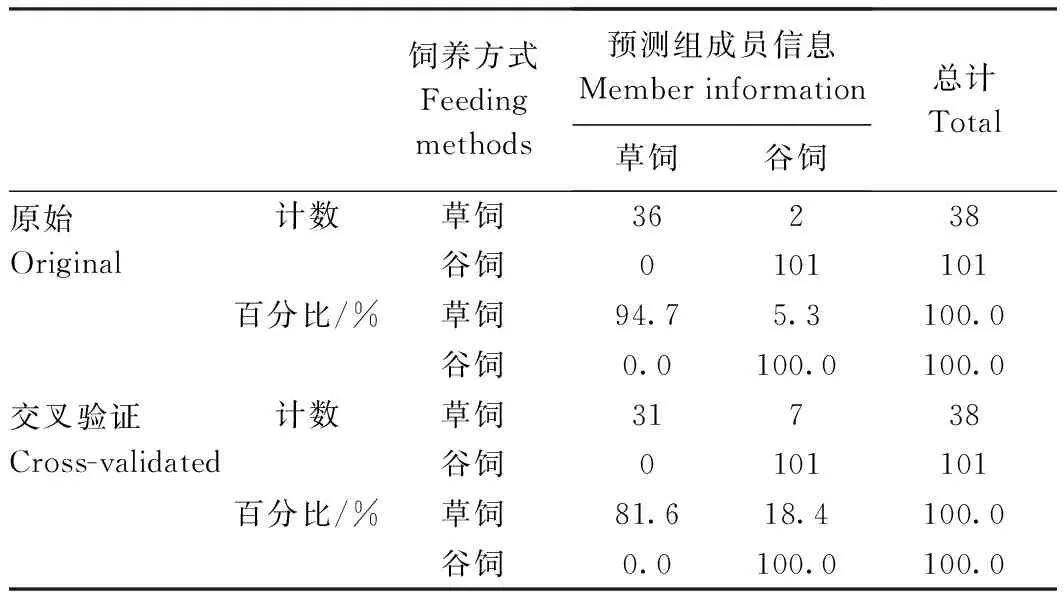
表5 不同饲养方式下驼乳分类和正确分类的观察结果Table 5 Classification and correct verification results of camel milk in different feeding methods
草饲双峰驼乳的SFA及PUFA含量比谷饲双峰驼乳高,但MUFA含量比谷饲双峰驼乳低,与Bernardini等[32]、白萨如拉[33]、丹妮[34]及张振华[35]的研究结果相似。2种饲养方式下的驼乳脂肪酸含量由高到低为棕榈酸、油酸、硬脂酸、肉豆蔻酸,这4种脂肪酸含量在2种饲养方式下存在显著或极显著差异,与前人研究结果相似[36]。从营养角度出发,草饲方式下驼乳SFA∶MUFA∶PUFA为12∶6∶1,谷饲方式下驼乳SFA∶MUFA∶PUFA为12∶7∶1,联合国粮农组织(FAO)和世界卫生组织(WHO)建议居民膳食S∶M∶P比例应尽量接近1∶1∶1[25],可见草饲方式下的驼乳更符合居民营养需求[37-38]。
与郭珍琪[22]及伊日贵[25]的研究不同,本研究利用脂肪酸数据建立判别模型,通过OPLS-OA分析及线性判别分析对不同牧场及饲养方式的双峰驼乳样品进行判别,结果表明通过测定脂肪酸含量可以区分5个牧场及2种饲养方式的驼乳样品,交叉验证效果良好,并获得可以识别5个牧场双峰驼乳来源的15个关键重要性因子(硬脂酸、棕榈油酸、木焦油酸、豆蔻油酸、二十碳五烯酸、二十二碳二烯酸、十七烷酸、亚油酸、花生酸、γ-亚麻酸、花生二烯酸、十五烷酸、反亚油酸、二十碳烯酸、二十一烷酸),以及识别2种饲养方式下双峰驼乳来源的13个关键重要性因子(二十碳五烯酸、二十碳烯酸、十五烷酸、木焦油酸、硬脂酸、棕榈油酸、十三烷酸、十五碳烯酸、十七碳烯酸、花生酸、二十一烷酸、豆蔻油酸及肉豆蔻酸)。综上,利用脂肪酸数据结合化学计量学分析可以有效地对较近距离产地的驼乳进行产地溯源判别[22,29],不同饲养方式下的驼乳进行判别[32,39]。
4 结论
本研究通过气相色谱法对不同牧场来源和不同饲养方式下的双峰驼乳脂肪酸特征及溯源进行研究,共测得阿拉善驼乳中33种脂肪酸含量,且草饲驼乳比谷饲驼乳更符合居民营养需求,弥补了驼乳中个别脂肪酸含量测定的空白并提供了驼乳相关营养数据。在前人仅检测驼乳含量的基础上,本研究还建立了驼乳不同牧场来源及不同饲养方式溯源模型,获得了良好的交叉验证结果,并分别得到了判别不同牧场和饲养方式来源的15、13个关键重要性因子。综上,利用脂肪酸特征结合化学计量学分析建立判别模型,对双峰驼乳进行较近距离的产地溯源及饲养方式鉴别是可行的。

