可穿戴电化学传感器件的研制及其应用
于 倩,吴 洁,李乐乐,鞠熀先
(南京大学 化学化工学院 生命分析化学国家重点实验室,江苏 南京 210023)
可穿戴电化学传感器件是一种将软硬件设备、电化学传感器和无线通信等技术,与日常穿戴的衣物(衣服、腕带、贴片或纹身等)相结合的智能电子设备[1],集电化学方法、可穿戴传感技术、电子信息技术与无线通信技术于一体,具有柔韧性和可伸缩性,可穿戴在皮肤表面或植入体内,对生命活动相关的生理信息进行实时连续监测[2-4]。随着电子通信技术的快速发展,可穿戴电化学传感器件可将检测到的化学信号转换为电子信号,并快速收集和计算,进一步通过无线蓝牙将数据上传到云端建立大数据库。采集的数据进一步通过医院或研究所,对获取的个人生理数据分析诊断,快速给出个人身体状况结果和健康有效的管理或治疗方案,以克服集中式医疗保健系统存在的耗时、不能及时解决病人需要的弊端,为个性化医疗保健领域的发展提供支持[5-6]。目前,可穿戴电化学传感器件的发展已不限于分子水平上的人体生理健康指标监测,还能与物理传感器集成,提供人体心率、血压、温度等行为信息[7],甚至与经皮药物传输模块相结合,实现疾病的实时监测、诊断和治疗[8]。
可穿戴电化学传感器件通过无线蓝牙等通信技术与智能移动终端设备连接完成数据交互、云端交互。近年来,随着材料科学、微纳米加工技术、电子通信技术等学科领域的交叉与合作,可穿戴电化学传感器件已被广泛应用于药物分析、环境监测、疾病诊断与医疗保健等领域。本文主要针对可穿戴电化学传感器件的研制和应用,概括了其设计思路、组成部分和各组成部件在可穿戴传感装置中的位置与功能,总结了可穿戴电化学传感器件在体表汗液中生理标记物的收集和检测、体内神经化学测量及现场分析检测(POCT)中的应用,分析并总结了可穿戴电化学传感领域的挑战,并展望了可穿戴电化学传感器件的发展前景。
1 可穿戴电化学传感器件的研制
可穿戴电化学传感器是集成传感技术与无线电子通信技术于一体的智能检测设备,其制备工艺主要包括电化学传感器的设计与构建、电路采集模块的硬件研制、无线蓝牙模块的集成、安卓端APP的研制和电源模块的组装(图1)。可穿戴电化学传感器件接通电源后,在电化学传感界面引入待测样品,目标物与传感界面的识别元件发生特异性反应,产生的生物化学信号被电路采集模块收集、调制、转换为可检测的电信号,进一步通过无线蓝牙模块将收集到的电信号传输到移动终端(手机或电脑),并利用终端设备上的APP对接收的测试数据进行分析处理,以可视化的数字形式呈现在APP界面。

图1 可穿戴电化学传感器件的制备工艺流程图Fig.1 Schematic representation of the flow chart of wearable electrochemical sensing device operation principles
1.1 可穿戴电化学传感器件的设计与构建
电化学分析具有及时、快速、灵敏等优势,是目前常用于可穿戴传感领域的方法[9]。可穿戴电化学传感器是将目标物与其对应的识别元件在传感界面的特异性反应转化为可检测电信号的传感元件,主要包括柔性电极、传感元件和信号传导模块3个部分。该传感器件因具有机械性能优异、灵敏度高、特异性好、制备简单等优势,受到研究者的广泛关注,被广泛用于医疗保健、药物分析等多个领域[10-12]。
1.1.1 柔性电极制备
人体细胞感知并将机械力(如拉伸、剪切、抓挠和压缩)转化为生物电信号的复杂过程被称为机械转导。目前,细胞将机械刺激转化为生物电信号的机制仍不清楚,因此采集、测量、解密这些指导细胞行为的生化线索,如脑电、肌电、眼电等,对多种生理疾病的诊断和预防具有重要作用[13-15]。电极作为生理电信号测量体系中的关键部件之一,能够有效地采集、激励、传递和转换生物电信号为可检测的电子信号,广泛应用于生物医学和临床诊治[16]。
除了软骨和骨骼外,大多数组织的杨氏模量在103Pa范围内,但传统的刚性电极的杨氏模量高达109Pa,无法与柔软弯曲的细胞和组织兼容以实现稳定和准确的检测,甚至引发严重且长期的组织损伤[17-33]。为解决以上问题,以柔性电极代替刚性电极,即将电极柔性化,可与身体的曲面、柔性生物组织紧密结合并实时监测生化信号。
近年来,随着材料科学和微纳米制造技术、柔性和可拉伸电子技术的快速发展,用于生物电测量的柔性电极制备工艺和应用研究也取得了长足的进步。根据不同的生物电信号获取方式,柔性电极主要分为植入式柔性电极和非植入式柔性电极[34]。植入式柔性电极为侵入性的,主要用于体内细胞和组织的机械转导过程中生物分子的实时监测,而非植入式柔性电极为非侵入的,主要用于生理液体中各种生化标志物的测量。柔性电极无论是用于体内还是体外电信号的检测,均须具有较宽的机械变形范围、优异的延展性、良好的生物相容性和耐腐蚀性。
柔性电极由基底层、电极层和封装层3部分组成,其中基底材料和封装材料对电极起着支持和保护的重要作用[35-39],必须具有生物相容性好、物理化学稳定性好、耐酸腐蚀性高、机械性能高、延展性好的优点。目前,用于可穿戴传感领域的基底和封装材料主要有聚对苯二甲酸乙二酯(PET)、聚对二甲苯(Parylene C)、聚酰亚胺(PI)、聚二甲基硅氧烷(PDMS)、纤维织物和纸张等[40-51]。柔性电极的制备材料必须具有化学惰性、生物相容性好、化学性质稳定、导电性能优异等优点,主要分为金属材料(金、铂、铱及其合金,钨、不锈钢及部分金属氧化物)、碳材料(石墨烯、碳纳米管等)和导电聚合物材料三大类[52-55]。
随着微纳米技术的不断发展,基于柔性基底材料的电极制备方法日益成熟,主要包括打印技术、紫外光刻技术和磁控溅射技术。打印技术一般有丝网印刷、柔性版印刷以及凹版印刷等[56]。紫外光刻技术和磁控溅射技术通常联用于柔性电极的制备,但单独使用磁控溅射技术亦可得到柔性电极[9,16]。如最常用的柔性金电极通过磁控溅射技术在基底材料上制得(图2)。具体方法为:通过磁控溅射仪器溅射出大量金属原子,呈中性的金属原子透过掩模版沉积在基底上,并将掩模版上的电极图案复制到基底。
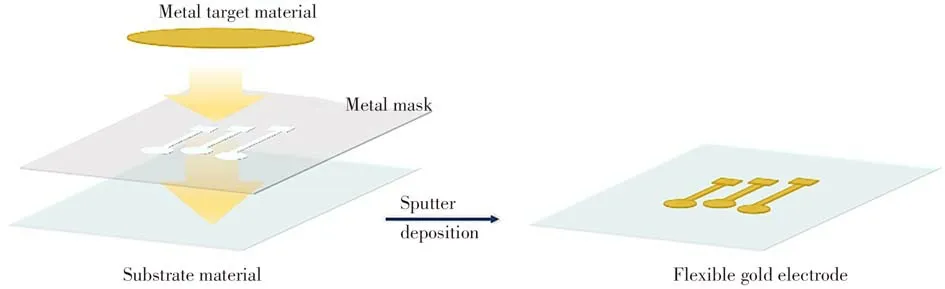
图2 柔性金电极的制备流程图Fig.2 Schematic representation of the preparation process of flexible gold electrode
1.1.2 传感界面构建
可穿戴电化学传感器件通过穿戴到体表或植入体内的方式用于细胞、组织、生理液体、药物或者环境中目标分析物的原位、实时、连续监测[16]。因此,可穿戴电化学传感器的检测环境中成分复杂、干扰因素众多。为保证传感器选择性地、准确地检测目标物质,发展选择性良好、稳定、精准的传感器非常重要。可穿戴电化学传感界面的制备是通过在柔性感应电极上修饰对目标物具有高亲和性的识别元件而实现。
1.2 电路采集与蓝牙模块、软件的设计及研制
1.2.1 电路采集模块
电路采集模块主要负责柔性传感芯片外围信号处理与传输的微型电路板,具体功能是将传感界面产生的信号进行收集、储存、放大、滤波、降噪等信号处理后,转换为可视化的数字信号。因具有功耗低、体积小等特点,电路采集模块能够确保长时间连续运行[57-58]。
1.2.2 蓝牙模块
蓝牙通信技术诞生于1985年,是由Intel、IBN和Toshiba等5家公司共同制定的短距离无线射频通信技术[59],具有设备小、成本低、能耗低、辐射低、组网方便和短距离传输等优势。蓝牙通信技术可满足短距离内大量数据的快速传输,而且可在特定条件下被多台设备同时使用,这在可穿戴设备中具有非常好的实用性,因此被广泛用于可穿戴设备中实现人机交互[60]。
1.2.3 安卓端APP研制
可穿戴电化学传感器件需满足体积小且长时间监测电信号的要求,故研发了基于便携式移动终端(手机或电脑)的APP以实现采集信号的可视化输出[61]。手机软件APP的程序设计主要包括3部分:蓝牙配置、数据接收与处理系统、手机或电脑界面设置。用户可在APP端注册个人账户,打开移动终端设备的蓝牙开关并设置为可见,搜索、显示并配对可穿戴设备的蓝牙信号,以建立软件与可穿戴设备的连接。软件接收可穿戴设备发送的测试数据后,会自动程序化地完成数据的分析处理,并通过手机或电脑界面以可视化的数字形式呈现[62]。
1.3 电源模块
可穿戴电化学传感器件需要可穿戴储能器件进行驱动才能正常工作,若要构建一体化的可穿戴传感系统,必须发展安全、微型、稳定的供能器件。目前用于可穿戴传感器件的供能器件主要是传统的锂电池,因此可穿戴传感器件存在需定期维护、循环充电和电池更换等问题,不利于其进一步的发展和应用。为解决上述问题,开发柔性自供电功能的可穿戴传感器件将成为研究重点[63]。目前柔性自供电可穿戴传感器件的自供电方式主要分为压电、摩擦电和热电3种,因其无需外接电源的优势,在环境监测、电子皮肤、运动检测等领域取得了广泛的应用。
1.4 生物液体收集
1.4.1 汗液收集
外分泌腺的汗腺遍布人体,分布于非细胞的、多孔且充满间质液的角质层中,并参与人的体温调节循环。汗腺的分泌线圈中血管高度密集,其管道的内直径约为5~40 μm,长约2~5 mm,厚度约为1~3个上皮细胞。表皮内分布大量管道,其内直径约为10~20 μm,长度约为2 mm,由双层的立方上皮组成。长度约为200~300 μm的线圈导管横穿上皮层和角质层,大多数代谢小分子或电解质均通过细胞间扩散运输作用进入汗腺分泌导管[64-65]。汗液分泌过程以脉动的方式进行。单个汗腺的汗液生成速率约为0.1~10 nL·min-1,有时在高汗液生成速率下,汗腺会以每隔几分钟分泌5 nL汗液的速度快速分泌汗液。根据身体位置的不同,汗腺密度从每平方厘米数十到数百个腺体不等[66-67]。因此,产生的总汗腺率从每平方厘米1 nL到数千nL不等。此外,由于汗液蒸发流失、生物标记物丰度低、易被污染并降解,因此提出并发展快速、精准、原位、实时的汗液收集装置是保证可穿戴汗液传感器件高准确度、精密度、稳定性、重复性的必要条件。
1.4.1.1 基于超亲水材料汗液收集装置随着交叉学科的融合发展,混合制造技术应运而生,并被迅速应用于可穿戴传感领域,以实现智能电子器件无缝穿戴到人体皮肤,完成体表生物液体中生物标志物的检测。Wang团队集成纹身转移与丝网印刷技术发展了纹身型-表皮可穿戴电化学传感系统(图3A),用于汗液中乳酸[68]、氢离子[69]及尿酸[70]的实时监测。上述研究利用双面胶直接将功能化电极紧贴皮肤表面。当人体通过一段时间的不间断高强度运动后,产生的汗液体积可以浸湿并连通工作电极与参比电极,可穿戴汗液传感器开始检测目标物并迅速输出电化学信号。由于体表汗液易迅速扩散或蒸发流失,以及电极修饰材料可能会在人体运动过程中发生形变而脱落,这些问题均会降低传感器的检测性能和使用寿命。为进一步提高汗液的利用率和收集效率,仍需要发展新的汗液检测方法。Gao团队[2]引入具有亲水性的人造纤维垫片置于传感电极下方,使其与皮肤紧密接触,以收集足够汗液用于目标物的原位分析,同时避免了传感电极与皮肤直接接触,保证检测稳定性(图3B)。大多数情况下,在可穿戴汗液传感器件中汗液收集区域和汗液检测区域并不是同一位置,因此高效的汗液传输效率对于提高传感器的检测准确性和稳定性也十分重要。基于这一设计思路,He等[71]根据中心超亲水-外围超疏水结构形成超亲水“微井”的原理,设计出高效的汗液收集与检测可穿戴贴片(图3C)。该方法集成卷对卷涂布纳米颗粒悬浮液的方法和阴影掩膜-氧等离子体刻蚀技术,制备出具有超亲水-超疏水结构的可穿戴微阵列贴片,利用超疏水二氧化硅涂层收集并快速输送汗液到超亲水“微井”检测域,以完成汗液原位收集与分析。
1.4.1.2 基于微流控汗液收集装置汗腺分泌汗液并传输到体表的过程中伴随压力高达70 000 N·m-2。根据P=2γ/r公式转化计算,该压力足够将汗液渗透进入一个半径约为2 μm的疏水性的小孔中(表面张力γ≈70 mN·m-1)。因此,体表分泌汗液产生的压力足够将汗液注入微流体或采样设备(数十至数百微米)[72]。最近的研究表明,微流体系统以薄、软、皮肤兼容的形式呈现,当汗液通过毛孔流出时,紧贴皮肤的进样口可直接从皮肤捕获汗液,并通过阀门、分离器和储层实现人体皮肤表面精确位置处汗液分泌速率和化学成分的监测。微流控装置可以立即将体表新鲜分泌的汗液与皮肤分离,降低汗液蒸发流失并最大限度地减少外部污染。该装置还可以封装和保护传感器,使其免受皮肤表面碎屑和油脂造成的生物污染和环境污染。先进的微流体设计,适应于芯片上的实验室开发的概念,利用复杂的阀门、分离器处理、微通道分流策略,将汗水引到多个孤立的传感区域,从而减少了不同传感器间的交叉干扰[66,73]。
微流控装置完全由低模量弹性体组成,能够舒适、无刺激、无缝紧贴皮肤。入口/出口尺寸、通道几何形状、粘附界面和材料选择的具体设计策略对于汗腺分泌汗液产生的压力驱动体表汗液进入微流控装置至关重要[66,74]。Rogers团队提出一种柔软的、与皮肤兼容的微流体设备平台,用于对微升汗液进行连续捕获和光学或电化学分析[75-78]。上述研究通过模拟计算和一系列科学验证实验深入探究了体表汗液生成动力学,集成微流控芯片装置与柔性传感电极,实现了汗液中多种电解质(氢离子、钠离子、钾离子、氯离子)的检测,并为汗液分泌速率与汗液中各种生物标记物的含量变化关系的研究提供了可选择的技术手段。该团队提出的多功能微流控传感装置(图3D),通过比色法进行体表汗液中代谢小分子葡萄糖与乳酸的检测,引入免疫传感方法用于汗液中皮质醇的检测,同时利用电化学阻抗法监测汗液的生成速率[78]。该方法通过光学和电学分析方法成功用于志愿者的汗液中葡萄糖、抗坏血酸、皮质醇、汗液生成速率的实时监测。但该团队提出的汗液微流控传感装置大多采用比色法检测汗液中的电解质和小分子。与光学分析法相比,电化学方法具有更简单、快速、灵敏的特点,因此发展集成电分析方法与微流控技术的可穿戴电化学传感器件是非常有意义的。不仅如此,传统的微流控芯片由疏水性聚二甲基硅烷(PDMS)制备,主要采用汗腺分泌并传输汗液到皮肤表面时产生的压力驱动汗液进入微流控通道,但该方法要求微流控芯片无缝连接皮肤,且要求装置具有高密闭性[77-79]。这大大增加了产品的制备成本和制备工艺的复杂程度。针对以上挑战,东南大学Liu等[80]利用超亲水涤纶线设计并提出了具有亲水性微通道的微流控汗液传感装置,通过毛细效应驱动体表汗液沿着微通道快速流入传感区域,实现了汗液中钠离子的原位在体检测(图3E)。

图3 可穿戴汗液收集装置Fig.3 Wearable sweat-collecting devices
1.4.1.3 基于仿生技术汗液收集装置仿生学是一种对生物个体或系统的结构和功能特征进行提取、研究、模仿、学习并重构的现代技术[81]。通过仿生技术制得的材料具有与生物体相似的结构和功能,被广泛用于医疗、智能穿戴、机器人等领域[82-88]。根据目前国内外的仿生技术研究现状和应用范围,研究者将仿生技术分为以下类型:①结构仿生:通过对生物个体或组织的研究学习,构建类生物组织结构的技术产品;②功能仿生:通过学习、研究、模仿并重构具有与相应生物体的结构与功能相仿的技术产品;③材料仿生:研制与开发模拟生物特征的仿生材料如电子皮肤、仿生组织或器官;④力学仿生:通过研究并模拟具有人体静态特征结构的仿生产品;⑤控制仿生:主要分为低级神经元仿生学、先进的神经元仿生学和进化机制的神经元仿生学。
目前,研究者除了模拟各种生物体的多尺度表面形态,还致力于将仿生技术产品集成到智能设备和系统,促进智能可穿戴电子器件、智能生物电子学[89-90]、纳米/微米结构机器和机器人技术[86]、电子皮肤等领域快速发展[91-92]。仿生-生物电子系统可以强力附着在人体内器官或组织和体外皮肤表面,具有良好的柔韧性、生物相容性、粘附性,被广泛应用于可穿戴生物电子领域[93-94]。为实现实时连续的人体健康监测,可穿戴传感装置不仅需要与皮肤保持稳定且牢固粘附,而且要能够捕获各种生物液体(如汗水、唾液、眼泪和血液),以便对其中的生理信息进行定量和动态监测[95-97]。因此,为实现这种可穿戴传感器件的更高功能,需要发展可逆使用型、用户友好型和稳健粘附型的创新性的可穿戴电子器件。Baik等[98]受雄性潜水甲虫刚毛中吸力柱塞的启发,提出了一种创新性的设计,即一种智能、一体化、柔性的仿生活塞,可随时捕获人类皮肤表面的汗液,并用于汗液pH值的快速准确分析(图3F)。该方法在干/湿条件下建立了高度稳健、可重复和多向的粘附性,且在仿生活塞结构中引入pH响应水凝胶实现了汗液收集与监测的一体化。与以上仿生原理相同,Son等[99]受仙人掌-针叶的结构功能启发,发展了具有分层微结构/纳米结构的超亲水-超疏水楔形通道的汗液收集贴片,可以有效地收集汗液,并快速和连续监测汗液中的葡萄糖、乳酸(图3G)。该贴片利用超疏水/超亲水表面材料与仿生微纳米结构的协同作用,产生单向拉普拉斯压力,能自发地将汗液输送到感测区域,表现出卓越的吸汗效率和汗液传输速率。
2 可穿戴电化学传感器件的应用
2.1 汗液中生物标记物监测
美国食品与药物监管局(FDA)同意将可穿戴传感器用于生物物理信号的监测,但因为可穿戴传感设备无法直接获得足够量的生物标记物,其对生物化学行为的监测存在挑战[100]。最早提出的可穿戴式葡萄糖或激素传感器主要利用将微针植入皮下的方式收集待测样品并完成检测,也有一些新兴的设备通过插入皮肤细丝收集液体[101-102]。随着可穿戴传感技术的进步,发展无创的生物液体中化学物质检测技术是一种很有前途的替代方法。其中,汗液作为一种典型的、其分泌遍布体表的生理液体,含有许多与细胞健康和器官功能有关的指标(如电解质)、免疫系统(细胞因子)和药物相互作用(代谢物)相关的分子[103-104]。汗液中氯离子水平是临床囊性纤维病患者的检测指标[105],钠离子、钾离子是人体代谢与电解质平衡的重要生理参数[106-107]。已有研究表明,汗液中葡萄糖含量与血液中葡萄糖含量水平变化具有正相关关系[108],汗液中乳酸含量可作为运动员体能大小的衡量指标之一[109-110]。目前,可穿戴汗液传感器的发展已取得显著成果,与微流控技术、生物仿生技术的结合进一步提高了可穿戴汗液传感器的应用范围。
2.1.1 代谢物
汗液中的代谢小分子主要包括葡萄糖、乳酸、酒精等小分子物质。汗液中的疾病标志物含量与其在血液中的水平具有正相关性[5-6]。
乳酸主要为糖的无氧酵解产物。人体剧烈运动后造成乳酸堆积引起代谢性酸中毒,即为乳酸酸中毒;婴儿腹泻、缺氧、大出血、酒精中毒等情况下也会出现乳酸酸中毒。临床出现的乳酸酸中毒的病因主要分为以下几种:休克、糖尿病、双胍类药物、感染、肝脏疾病、缺氧等[111]。乳酸酸中毒的临床症状为血压降低、呼吸深而快、腹痛、呕吐等,严重者会出现昏迷以致死亡[112-113]。已有的可穿戴汗液乳酸传感器主要分为基于乳酸脱氢酶和乳酸氧化酶的乳酸传感器。Jia等[68]提出一系列纹身型可穿戴电化学乳酸传感器用于体表汗液中乳酸的检测(图4A)。该方法制备了乳酸氧化酶包裹的普鲁士蓝修饰的丝网印刷电极,对乳酸检测的浓度最高达到20 mmol/L,并实现了运动过程中乳酸水平的动态监测。但由于乳酸氧化酶的抗噪性差、价格昂贵,研究者逐渐转向基于乳酸脱氢酶的可穿戴乳酸传感器的研究。Pilas等[114]提出基于乳酸脱氢酶的可穿戴电化学乳酸传感器。通过将乳酸脱氢酶和共反应试剂(氧化性辅酶I和[Fe(CN)]3-6)包裹到氧化石墨烯修饰的丝网印刷电极表面,制备了具有低施加电位、免试剂加入的电化学乳酸检测技术。功耗大、电池续航时间短等问题一直是可穿戴电化学传感领域中待解决的问题。人体汗液中生物燃料电池产生的能量足以激活作为微电子设备模型的电子表。Koushanpour等[115]针对可穿戴传感器件中电池续航能力差的问题发展了使用乳酸作为可氧化燃料的可穿戴生物催化电极。该方法提出阳极在氧化性辅酶I存在下乳酸脱氢酶催化氧化乳酸反应产生还原性辅酶I,与阴极在氧气存在下乳酸氧化酶催化氧化乳酸产生过氧化氢的生物燃料电池。重要的是,阴极和阳极反应是独立的,反应产物不会在电极上交叉反应,从而允许生物燃料电池在无膜的情况下运行,为原位在体汗液检测提供了可选择的技术支持。
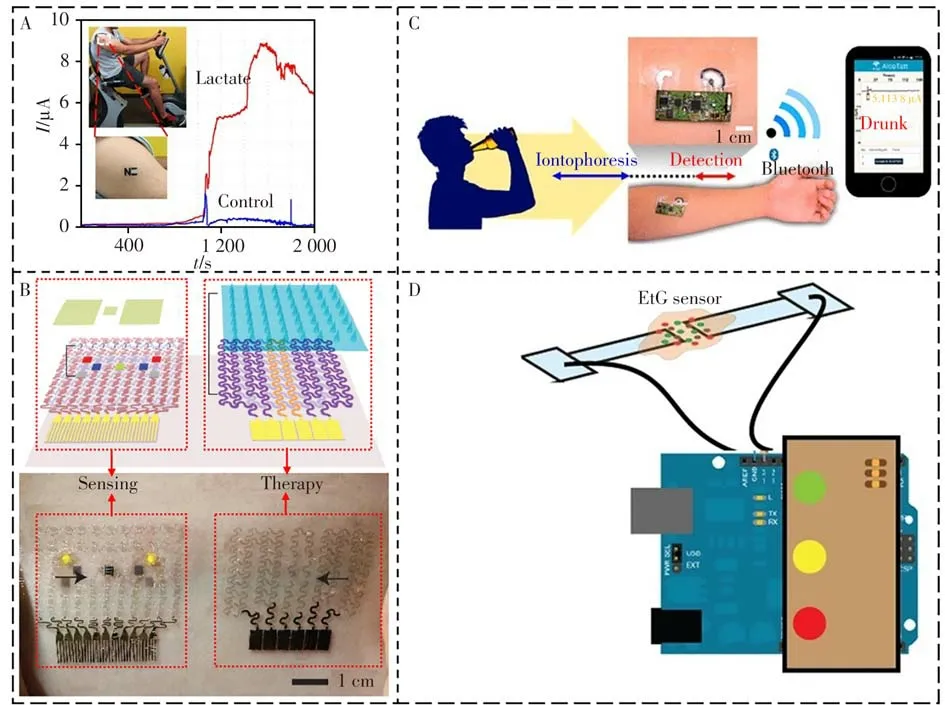
图4 可穿戴代谢分子传感器Fig.4 Wearable metabolic sensors
葡萄糖是通过糖原异生或糖原分解产生,其在血液中的含量是糖尿病诊断的重要指标[116]。糖尿病是发病率最高的现代生活疾病之一,是导致全球死亡率增加的原因之一[117-119]。每日饭前饭后的血糖监测对于糖尿病患者的管理与治疗至关重要[120]。目前大多数糖尿病患者采用检测手指末梢血中葡萄糖含量,进行日常疾病管理,但这种有创的治疗方法降低了患者的依从性,而且存在外部细菌感染的风险。无创、连续的血糖监测方法(CGM)提供了葡萄糖水平和含量的实时动态变化,从而提高了糖尿病患者的治疗质量。研究者为实现这一目标已经取得了显著成果。
虽然葡萄糖从血液到汗液的分配途径尚未得到明确的验证,但汗液中葡萄糖浓度已被证明与血糖浓度具有可靠、良好的相关性[121-122]。但由于汗液中的葡萄糖浓度较低(约为血糖浓度的1/100倍),监测汗液中的葡萄糖具有挑战性,需要高灵敏的传感系统,特别是在低血糖或皮肤葡萄糖残留污染的情况下汗液中葡萄糖的检测。贴片式可穿戴电化学传感体系用于汗液中葡萄糖检测的研究已取得进展。特别值得一提的是,Kim团队发展了一系列基于柔性材料的可穿戴电化学传感器件用于体表汗液中电生理信号的准确测量[8,123-127]。在最初的工作中,该团队通过化学气相沉积(CVD)工艺合成了高质量、大面积的石墨烯,构成了一种非常有用的新型透明、可伸缩变形的电子材料。石墨烯因具有可伸缩性、高载流子迁移率、超薄的形状因子和生物相容性,表现出优异的力学、电学和光学性能,并被广泛应用于消费者和医疗保健领域[128-129]。这种体表石墨烯掺杂的设备装置,仅可在汗液收集区完成汗液中葡萄糖和pH值的原位检测,进一步结合生物可吸收、温度响应的微针调控经皮给药过程(图4B),使糖尿病患者的实时在体检测与即时治疗成为可能[130]。
酒精消费是全社会乃至全人类的主要消费内容之一。但酒精滥用对个人健康、交通安全及医疗保健等均具有恶劣的影响[131-132]。目前血液酒精浓度的检测方法主要分为两种:①侵入性采血检测法,主要用于临床症状-酒精中毒测量;②便携式呼吸分析仪,通过应用亨利定律测量呼吸酒精浓度(BrAC)间接估计血液酒精浓度,主要用于现场酒精测量[133]。但以上方法均不适用于实时连续酒精检测。因此,为规范个人饮酒及促进医疗保健和临床治疗的发展,提供一种便携、实时连续、准确和稳健的酒精检测方法势在必行。目前集成可穿戴传感技术与电化学检测方法发展的无创、可穿戴电化学乙醇传感器吸引了众多研究者的兴趣。
汗液中酒精浓度与同时发生的血液酒精浓度密切相关,因此汗液中酒精浓度的监测至关重要。Gamella等[134]集成毛果芸香碱-经皮传感系统与电化学乙醇生物传感器制备得到可穿戴乙醇传感装置,通过计时电流法检测汗液中乙醇的浓度,并建立了汗液中酒精水平与相同时间下血液中酒精水平的相关关系。该方法对40名志愿者的血液酒精浓度分析结果与气相色谱测定结果无显著差异。Kim等[135]集成毛果芸香碱-经皮电渗流诱导汗液收集模块、可穿戴乙醇电化学传感模块、信号收集、处理与读出模块、蓝牙模块、移动终端模块,提出了一种可穿戴的临时纹身生物传感器系统用于体表汗液中酒精的检测(图4C)。通过经皮电渗给药方法诱导汗液分泌,当汗液浸湿传感界面,利用计时电流法测试得到汗液中的酒精信号,通过信号收集、处理与传输模块将以上生物化学信号转化为电信号,进一步经过无线蓝牙模块将数据传输到移动终端设备,最后通过用户友好型APP将以上信号转化处理得到可视化的数字信号。该方法使用的所有电极均在可穿戴的临时纹身纸上通过丝网印刷技术制成,制作简单、成本低廉,初步测量并比较了人体受试者在摄入酒精饮料前后产生的汗液中酒精含量变化。虽然检测血液中的酒精含量是最快速、准确的方法,但因沸点低、易挥发,酒精的快速、灵敏、高选择性检测存在挑战。乙基葡醛酸乙酯(EtG)是一种非氧化性乙醇直接代谢产物,通常在少量饮酒后的24 h左右和大量饮酒后的2、4 d内均能检测出EtG,可作为一种重要的乙醇生化标志物。Selvam等[136]以金和氧化锌为电极敏感元件,提出一种可穿戴电化学免疫传感器用于体表汗液中EtG的检测(图4D)。该方法通过电化学阻抗法检测汗液中EtG的含量,为生物液体中酒精的检测提供了可选择的技术支持。
2.1.2 电解质
电解质对一些关键的物理化学功能至关重要,如活性膜运输、水合作用、渗透平衡、神经传导、肌肉激活等[75,77]。在极端情况下,电解质失衡可导致昏迷、癫痫发作和心脏骤停等症状。因此,电解质是汗液分析研究中最广泛的靶向生物标志物。基于电位法检测的钠、钾、钙、铵和水合氢离子传感器可通过直接在电极表面修饰相对应的离子选择性膜制备[6],主要包括选择性离子载体和增塑剂。前者用于提高相对应离子选择电极的选择性,后者主要增强离子选择电极的稳定性。通常情况下选择饱和氯化钠的聚乙烯醇缩丁醛(PVB)修饰的Ag/AgCl电极作为参比电极[77]。可穿戴式钠传感器的代表性示例如图5A所示,该方法集成钠离子传感、用于信号收集与处理的电路板模块、蓝牙模块,通过检测汗液中钠离子证明了该方法的实用性(图5B)[137]。图5C显示,该方法集成钙离子传感器与pH传感器,可用电位法同时检测汗液中的钙和pH值[138]。通过比较体表传感器数据和非原位汗液分析结果(pH计和电感耦合等离子体质谱仪),揭示了钙离子传感器与pH传感器精确测量钙离子和氢离子的能力(图5D)。近期,作者[139]也提出一种可穿戴汗液传感器件,主要用于汗液中钠离子、钾离子、氢离子、葡萄糖和乳酸的同时检测。该工作集成汗液采集与定向传输模块、电化学传感阵列模块、电路采集与无线蓝牙模块和装载用户友好型APP的智能手机,提出一种可穿戴汗液电化学传感装置,手机APP通过无线蓝牙连接并远程控制电路采集模块,实现了体表汗液多生理参数的同时检测(图5E)。

图5 可穿戴电解质传感器Fig.5 Wearable electrolytic sensors
囊性纤维化是一种影响肺部和消化系统的遗传慢性疾病。离子电渗法提取的汗液中氯化物水平目前被认为是筛查囊性纤维化疾病(CF)的金标准[140]。Emaminejada等[141]设计了一个电化学增强的、可编程的离子导入界面,可实现在不引起患者不适的前提下,周期性诱导汗液分泌以提供足够的、满足分析需求的汗液量,结合可穿戴电化学传感平台实现了汗液中葡萄糖、钠离子和氯离子的原位实时监测。
越来越多的研究者可以捕捉并测量汗液中的电解质、乳酸、葡萄糖、酒精、pH值甚至重金属。通过定量分析汗液中的蛋白质和激素水平可进一步提高可穿戴汗液传感器的适用性。尽管如此,传感器仍需在保证汗液受到蒸发流失、污染和降解的前提下收集和分析汗液,因此还需要新的化学测试和分析方法用于汗液中多种生理信息的检测[142]。
2.2 体内神经化学测量
目前,与脑、心脏、年龄有关疾病(心血管疾病、帕金森疾病、阿尔兹海默症等)的发病率明显增高,并呈现早龄化趋势[143-145]。生物电子信号对神经活动的调节是预防、治疗和管理这些疾病的有力工具,例如,刺激神经活动的电子设备对治疗帕金森病、癫痫、慢性疼痛、听力丧失和瘫痪等疾病有效[146]。植入性生物电子设备通过选择性地刺激所需的神经目标为临床治疗提供准确、可靠的信息。然而,侵入性植入物伴随着额外的风险,如可能导致人体产生慢性炎症等并发症,进一步降低设备的功能甚至失效。为降低侵入性设备的体内治疗风险,可将微米或毫米级生物电子植入物经皮导管以微创的方式放置到作为神经-血管束的伴随神经,即血管系统,实现深部组织内血管神经调节治疗[147-149]。
为提高体内神经调节治疗的时效性和精准度,发展集生物电化学信号与生物电物理信号于一体的检测方法,可以促进人们对神经相关疾病的深入了解与治疗。多巴胺主要产生于脑腹侧被盖区(VTA)和黑质致密部(SNc),与人体运动、成瘾、记忆、情绪等密切相关[150-154]。当植入性生物电子设备通过电、磁等物理方式刺激体内组织或细胞发生神经活动时,神经细胞会分泌化学反馈物质,多巴胺是其中的一种神经递质。传统的多巴胺检测方法主要通过碳纤维电极氧化还原反应以监测其释放过程[155],但碳纤维电极在发生形变或扭曲情况下会产生不稳定的电信号,而且在体内不能被降解。发展柔性、轻便、微型、亲肤、可生物降解的可穿戴植入性电子器件用于脑神经、心血管疾病的治疗与管理受到越来越多研究者的关注。集成柔性材料、电化学传感、无线电子技术发展可穿戴、植入性、生物可降解的电子器件,用于生物化学信号检测是一门新兴的、多学科交叉发展的研究领域。Yang等[149]研制一种无线的、生物可降解的生物电化学信号检测系统,通过将电子器件完全植入脑深层区域,实现了神经化学信使和外周神经生理信号的同时检测。通过制备异质结结构的二维二硫化钼@铁纳米粒子修饰电极实现了脑深处神经递质多巴胺的检测。该方法有望用于神经外科手术后一段时间内可能发生的术后并发症的评估与治疗。
2.3 POCT检测
POCT是可以满足在事件发生位置附近快速分析检测的技术。POCT因具有便携、检测快速、价格低廉、操作简单、用户友好等优势,被广泛用于食品安全、药物分析、疾病诊断、环境监测及公共应急响应等领域[156]。该方法无需大型仪器设备也能承担实验室职能,满足资源匮乏地区的疾病快速诊断与预防需求。近年来,随着生物电子与传感技术领域的快速发展,研究者集成POCT、可穿戴生物传感技术、智能电子器件与无线通信技术发展了一系列药物分子、DNA、疾病标记物的POCT新方法。
电化学分析方法具有成本低、操作简单、选择性好、灵敏度高等特点,非常适合构建可穿戴电化学传感器件,并应用于POCT领域。Güder等[157]报道一种有效、简单、廉价的呼吸监测传感器。该传感器通过检测纸上吸附的水分与吸入空气和呼出空气的瞬态差异来测量人的呼吸速率。该传感器由一张带有数字打印石墨电极的纸构成,将其集成在一个柔性纺织程序口罩内(通常用于医院)。通过将功能化的口罩、信号处理与传输装置和电源连接,利用无线蓝牙将采集的数据通过蓝牙模块输送到移动终端设备,进一步通过互联网上传到云端,继而建立大数据库为个性化医疗发展提供技术支持。为拓宽POCT方法在生物分子检测中的应用,Alafeef等[158]集成信号处理与输出装置与石墨烯修饰的纸基电化学生物传感技术,发展了一种快速、准确、高选择性和超灵敏的分析方法,检测严重的急性呼吸系统综合征冠状病毒-2(SARS-CoV-2)的遗传物质。用48个临床样本,通过与美国FDA批准的对SARS-CoV-2遗传物质的金标准诊断方法(LabGun COVID-19 RT-PCR诊断试剂盒)检测结果比较,验证了传感器芯片鉴别新型冠状病毒疾病2019(COVID-19)阳性样本和阴性样本的能力。该方法可在5 min内完成SARS-CoV-2的快速、灵敏检测。为取代传统的固态电池,Sun等[159]基于可伸缩生物燃料电池发展了一种简便、成本低、用户友好的可穿戴电化学抗坏血酸传感设备。该方法可直接检测0.2 μL的无稀释血清,实现对坏血病的即时分析和准确诊断。
3 总结与展望
可穿戴电化学传感器件是集成电化学方法、可穿戴传感技术、电子信息技术与无线通信技术于一体,可穿戴在皮肤表面或植入体内的集成装置。近年来,随着材料科学、微纳米加工技术、电子通信技术等学科领域的交叉与合作,可穿戴电化学传感器件被广泛应用于药物分析、环境监测、疾病诊断与医疗保健等领域。本文主要针对可穿戴电化学传感器件的研制和应用,概括了其设计思路、组成部分和各组成部件在可穿戴传感装置中的位置与功能,总结了可穿戴电化学传感器件在体表汗液中生理标记物的收集和检测、体内神经化学测量及POCT中的应用。
可穿戴电化学传感器件通过柔性印刷电路板及无线蓝牙装置,将采集的信号传输到移动终端,并由互联网上传到云端形成大数据,以便医护人员可远程监控患者的身体状态,通过收集和分析患者的生理信号变化给出个性化治疗方案。可穿戴电化学传感器件因具有便携、小型化、生物相容性等优点,被穿戴到皮肤表面用于生理液体如汗液、尿液、唾液、泪液中生理相关物质的检测。汗液遍布全身,含有丰富多样的与人体生命活动息息相关的化学物质,如葡萄糖、乳酸、酒精、钠离子、钾离子、氢离子等,而且其无创收集方式不会产生其它病毒或细菌感染,因此该类器件的发展受到越来越多的关注。
虽然汗液可穿戴电化学传感器件的研制已取得重要进展,目前该器件的发展仍有如下挑战:(1)检测准确性受汗液分泌速率慢、汗液蒸发流失、新旧汗液交叉覆盖、皮肤表面的一些化学物质(如护肤品、身体乳)的污染影响;(2)器件的灵敏度与精准度不足,难以满足比血液中含量低近3个数量级的疾病标记物的检测需求;(3)穿戴舒适度有待改善,需要发展新的柔性材料,降低集成电路板和供电电池的体积,提高材料的伸缩性和柔韧性;(4)功耗大、电池寿命短;(5)传感界面的稳定性需提高。为解决这些问题,将亲水性材料、微流控系统、仿生技术引入可穿戴电化学传感器,通过降低汗液蒸发流失、新旧汗液交叉感染等提高传感器的准确性;用水凝胶、壳聚糖、多壁碳纳米管等生物相容性材料负载生物酶,通过增强和保护酶催化活性,确保传感器的稳定性;用仿生皮肤材料作为基底材料,发展用户友好型、无缝连接皮肤的电子皮肤器件。
神经系统疾病的高度动态特性限制了目前脑深部电刺激系统(DBS)的应用。即不能通过监测相关神经化学物质的动态变化,直接提供疾病状态信息,再根据分析结果调节神经刺激参数。个体生理条件的变化和患者间的差异需要个性化、时效性的神经调节与治疗。发展颠覆性的DBS系统是刺激疗法在临床应用的重要机遇。植入型可穿戴电化学传感器件用于心血管和脑神经疾病的诊断与治疗领域,进一步促进了神经化学测量和神经调节系统的进步。因此,发展新兴的设备和应用程序,跟踪监测神经递质的释放和浓度变化,为了解这些神经递质在神经调节系统中的角色和作用机制提供了技术支持。
通过设计简单的信号读出体系,研究者已将可穿戴电化学传感器件用于POCT检测,但在复杂实际样品测定装置的商品化方面仍存在挑战,这也是可穿戴电化学传感器件POCT应用的一个重要发展方向。需要针对POCT现场采样、灵敏检测和快速信号输出的实际需求,优化可穿戴电化学传感器件的结构设计,发展目标物收集与检测一体化技术,提高POCT的选择性、特异性,同时缩减可穿戴电化学传感器件的制备成本。

