荸荠皮多酚的纯化与抗氧化性、稳定性研究
干建松
(1.江苏财经职业技术学院粮食与食品药品学院,江苏 淮安 223003;2.中国矿业大学化工学院,江苏 徐州 221116)
荸荠(Eleochairis toberosa),俗称马蹄,是多年生浅水草本植物荸荠的地下球茎,我国荸荠资源丰富[1]。荸荠营养丰富,味甜多汁,具有较高的营养价值。荸荠可直接食用,亦可加工成菜品、罐头、果脯及饮料等[2-4]。荸荠皮为荸荠加工副产物,多被丢弃,造成资源浪费并污染环境[5]。荸荠皮含有黄酮类、多酚类、甾醇类、糖类等多种活性物质[6-9]。陈秋娟等[10]研究微波辅助提取荸荠皮多酚工艺,结果表明荸荠皮中多酚含量为3.15%。以荸荠皮为原料制备具有生物活性的多酚对荸荠皮的深度开发利用具有重要意义。
多酚类物质是一种含有多个羟基,化学性质活泼的化合物[11-12],具有抑菌、抗氧化、抗炎及抗肿瘤等活性[13-14],可用于医药、食品、饲料及日用化妆品等。目前荸荠皮多酚的研究多集中在提取工艺及粗提物的活性研究[15-16],粗提液中含有大量的蛋白质、多糖等杂质,对其生物活性的评价准确性不高[17]。因此研究适宜的方式分离纯化荸荠多酚,并评价其生物活性、理化性质是重要的研究方向。
本文考察5种大孔吸附树脂对荸荠皮粗多酚的纯化效果,筛选最佳的纯化树脂,并进行纯化工艺优化,分析纯化后荸荠皮多酚的抗氧化活性、稳定性等,为荸荠皮多酚类物质在功能性食品、药品和化妆品中的利用提供一定的参考。
1 材料与方法
1.1 材料与仪器
荸荠皮:市售,50℃热风干燥;D101(非极性)、AB-8(弱极性)、ADS-17(中等极性)、S-8(极性)、NKA-9(极性)树脂:天津波鸿树脂科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):美国sigma公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS]:上海碧云天生物技术有限公司;NaOH、HCl、福林酚、没食子酸、Na2CO3、乙酸乙酯:国药集团化学试剂有限公司;以上试剂均为分析纯。
FA2004N电子天平:上海菁华科技仪器有限公司;Centrifuge 5804R高速冷冻离心机、Eppendorf5418小型台式高速离心机:德国艾本德股份有限公司;DHC-9140A电热恒温鼓风干燥箱:上海精宏实验设备有限公司;D-8紫外可见分光光度计:南京菲勒仪器有限公司;XO-1500DN超声波萃取仪:南京先欧仪器制造有限公司;ZHWY-2102c恒温摇床:上海智城分析仪器公司。
1.2 方法
1.2.1 荸荠皮多酚的提取
取干燥荸荠皮,粉碎,加入50%乙醇,置于超声波萃取仪内,设定提取温度50℃、料液比1∶25(g/mL)、超声功率300 W、超声时间40 min、提取次数2次,合并2次提取液,减压浓缩,得到荸荠皮多酚粗提液,置于冰箱4℃保存备用。
1.2.2 大孔树脂的筛选
选取5种不同极性的大孔吸附树脂,分别为D101(非极性)、AB-8(弱极性)、ADS-17(中等极性)、S-8(极性)、NKA-9(极性)。取适量树脂置于无水乙醇浸泡24 h,用去离子水洗至无醇味,加入4%HCl溶液浸泡6 h后,用去离子水洗至中性,然后加入4%NaOH溶液浸泡6 h,用去离子水洗至中性,备用。分别取2.0 g预处理的大孔树脂,置于带塞三角瓶中,加入荸荠皮多酚粗提液50 mL,于恒温摇床中25℃、150 r/min下吸附12h,测定上清液的总多酚浓度C1。吸附结束后抽滤,树脂用去离子水清洗2次后,置于具塞三角瓶中,加入70%乙醇100 mL,于恒温摇床中振荡洗脱2 h,测上清液的总多酚浓度C2[18]。树脂吸附量、吸附率及解吸率计算公式如下。

式中:C0为初始多酚浓度,mg/mL;C1为吸附后上清液中多酚浓度,mg/mL;C2为解吸液中多酚浓度,mg/mL;W为大孔吸附树脂的质量,g;V1为多酚溶液体积,mL;V2为解吸液体积,mL。
1.2.3 树脂静态吸附与解吸
1.2.3.1 静态吸附动力学曲线
分别取2.0 g预处理的大孔树脂,置于带塞三角瓶中,加入荸荠皮多酚粗提液100 mL,于恒温振荡器中25℃、150 r/min下吸附,每隔20 min测定上清液的多酚浓度至无明显变化。计算吸附量并绘制静态吸附动力学曲线。
1.2.3.2 多酚初始浓度对吸附的影响
取2.0 g预处理好的AB-8树脂5份,分别加入100 mL 的质量浓度分别为 1.0、1.5、2.0、2.5、3.0、3.5、4.0 mg/mL荸荠皮粗多酚溶液,在25℃、150 r/min下振荡2 h,测定上清液中多酚浓度,计算吸附量。
1.2.3.3 乙醇浓度对树脂解吸效果的影响
取饱和吸附多酚且吸附量已知的AB-8树脂5份,各2.0g,分别加入50%、60%、70%、80%、90%乙醇200 mL,在25℃、150 r/min下振荡2 h,测定洗脱液中的多酚浓度,计算解吸率及纯度。
多酚纯度测定方法:多酚纯度为混合物中多酚类物质质量与混合物总质量的比值。将洗脱液减压浓缩后,真空冷冻干燥至恒重,称取一定量多酚纯化物(m1)溶解,测定多酚含量(m2),纯度按如下公式计算。

1.2.4 动态吸附-解吸
1.2.4.1 上样流速对树脂吸附效果的影响
称取适量处理好的AB-8树脂,采用湿法装柱(2.0 cm×50 cm),将质量浓度为3.0 mg/mL的样液分别以2、4、6 mL/min的流速过柱,每30 mL收集流出液一次,测定流出液中的多酚浓度,绘制穿透曲线。
1.2.4.2 洗脱速度对树脂解吸效果的影响
在多酚质量浓度为3.0 mg/mL、上样速度为1.0 mL/min条件下上样40 mL,吸附2 h后,用70%乙醇以洗脱速度分别为1、2、3 mL/min洗脱,每10 mL为一管收集流出液,测定其多酚浓度,绘制解吸曲线。
1.2.4.3 多酚浓度的测定
称取0.025 g的没食子酸,加入蒸馏水使其溶解,然后倒入1 000 mL的容量瓶中,用蒸馏水润洗烧杯倒入容量瓶中,再加蒸馏水定容至刻度线,没食子酸标准液浓度为0.025 mg/mL。吸取没食子酸标准溶液0、0.5、1.0、1.5、2.0、3.0、4.0、5.0、6.0 mL 置于 25 mL 的容量瓶中,每份都加入1.0 mL福林酚试剂,摇晃均匀,随后再加4 mL 15%Na2CO3,摇匀后加入蒸馏水定容至刻度线,避光于30℃静置1 h后,在波长760 nm下测定其吸光度,由试验数据可得出标准曲线方程为y=10.119 0x-0.017 3,相关系数R2=0.995 7。多酚样品处理同没食子酸标准溶液,对照没食子酸标准曲线计算样品中多酚的浓度。
1.2.5 多酚抗氧化活性的测定
1.2.5.1 DPPH自由基清除试验
取2 mL多酚溶液,加1 mL浓度为0.2 mmoL/L的DPPH溶液,振荡摇匀,置暗处反应30 min后,用紫外分光光度计测定517 nm处吸光度A1;取乙醇溶液1 mL与多酚溶液2 mL混匀,测吸光度A2;取乙醇溶液2 mL和DPPH溶液1 mL混匀,测吸光度A3;2 mL水与2 mL乙醇混合溶液调零[19]。DPPH自由基清除率计算公式如下。
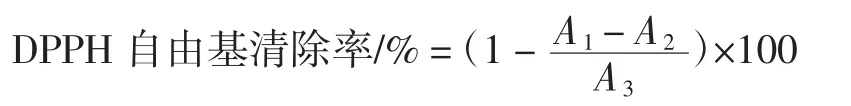
1.2.5.2 ABTS+自由基清除能力测定
参照DE等[20]的方法,分别取5mL7.4mmol/LABTS溶液与3.6 mmol/L过硫酸钾溶液,混匀,25℃避光反应12 h,得ABTS+溶液。取样品液0.4 mL,加入3.6 mL ABTS+溶液,避光反应6 min,测定734 nm处吸光度。以去离子水替代样品做空白对照。ABTS+自由基清除率计算如下。

式中:A0为空白对照吸光度;A1为样品与ABTS反应后吸光度;A2为样品吸光度。
当数据包是以HBF模式转发时,数据包目的节点是t,雷区FAR为F。节点si是任意一个节点。而节点sj是节点si的一个邻居节点。从节点si至节点sj的HTHS表示为
1.2.6 多酚稳定性研究
1.2.6.1 温度对荸荠皮多酚稳定性的影响
取一定浓度的多酚溶液,分别放置于40、60、80、100℃的水浴中,每隔1 h取样,在760 nm处测吸光度。
1.2.6.2 pH值对荸荠皮多酚稳定性的影响
用1 mol/L HCl和0.5 mol/L NaOH配成pH值为3、6、9的溶液,加入适量多酚样品,每隔2 d取样,在760 nm波长处测其吸光度。
1.2.6.3 光照对荸荠皮多酚稳定性的影响
取一定浓度的多酚溶液,密封,分别置于自然光和避光条件下,每隔2 d取样,在760 nm处测吸光度。
1.2.6.4 蔗糖对荸荠皮多酚稳定性的影响
1.3 数据处理
试验数据以平均值±标准偏差表示(n=3),采用Origin pro 18.0和Design-expert软件对试验数据进行处理和分析。
2 结果与分析
2.1 大孔树脂的筛选
5种大孔树脂静态吸附和解吸性能见图1。

图1 大孔树脂静态吸附和解吸性能Fig.1 Static adsorption and desorption properties of macroporous resin
由图1可知,非极性的D101和弱极性的AB-8的吸附量较高,极性的S-8、NKA-9吸附量较低,其中AB-8的吸附量最高,为(31.64±1.11)mg/g。D101 和AB-8的解吸率较高,其中AB-8的解吸率最高,为(88.35±2.65)%;多酚类化合物的分子中含有多个酚羟基结构,其分子的极性不高,所以弱极性或非极性的树脂吸附效果较好[2,19]。因此,本试验选择AB-8为最适宜树脂。
2.2 树脂静态吸附与解吸
2.2.1 静态吸附动力学曲线
AB-8对多酚吸附的静态吸附动力学曲线及对应的吸附速度曲线见图2。

图2 静态吸附动力学与吸附速度曲线Fig.2 Static adsorption kinetics and adsorption rate curve
由图2可知,在吸附的前80 min,吸附量迅速增加,在80 min~180 min,吸附量增加缓慢,在160 min达到了最大吸附量(31.64±1.11)mg/g。吸附速度先迅速降低,后趋于平缓。出现此变化规律的原因可能是,树脂上具有许多吸附活性位点,每个活性位点吸附固定数量的分子,在吸附起始阶段,较多的活性点处于未吸附的活性状态,导致吸附较快,从而树脂吸附量增加较快,随着吸附的进行,可利用的活性位点越来越少,吸附量趋于稳定,从而吸附速度下降。140 min时,吸附量为(31.25±1.09)mg/g,与最大吸附量无明显差异,综合考虑时间与吸附量,选择吸附时间为140 min。
2.2.2 多酚初始浓度对吸附的影响
多酚初始浓度对树脂吸附的影响结果见图3。

图3 多酚初始浓度对吸附的影响Fig.3 Effect of initial concentration of polyphenols on adsorption
由图3可知,吸附量随初始浓度的增加呈先上升后略下降的趋势,当初始浓度为3.0 mg/mL时,吸附量达到最大值(31.70±0.95)mg/mL。出现该趋势的原因一方面为浓度越高,溶液与树脂之间的浓度差越大,吸附动力也越大,故浓度越高相同时间吸附量越大;另一方面,当粗提液多酚浓度高时杂质浓度也高,部分杂质会与多酚竞争树脂的吸附活性位点,导致对多酚的吸附量降低[21]。综合考虑,选择初始浓度为3.0 mg/mL为最适初始浓度。
2.2.3 乙醇浓度对树脂解吸率和多酚纯度的影响
乙醇浓度对树脂解吸率和多酚纯度的影响结果见图4。

图4 乙醇浓度对树脂解吸率和多酚纯度的影响Fig.4 Effect of ethanol concentration on desorption rate and polyphenol purity of resin
由4图可知,多酚的解吸率随着乙醇浓度的增加呈增加趋势,但多酚纯度随乙醇浓度的增加呈先增加后减小的趋势。乙醇浓度为70%时,解吸率为(86.13±2.58)%,多酚纯度达到最大值(57.5±1.72)%;当乙醇浓度 80%时,解吸率基本达到最大值(91.07±2.73)%,但是多酚纯度降到(50.16±1.50)%。综合考虑解吸率和多酚纯度,选择乙醇浓度70%为最适洗脱溶剂。
2.2.4 上样流速对树脂吸附效果的影响
上样流速对AB-8树脂吸附荸荠皮多酚的影响结果见图5。
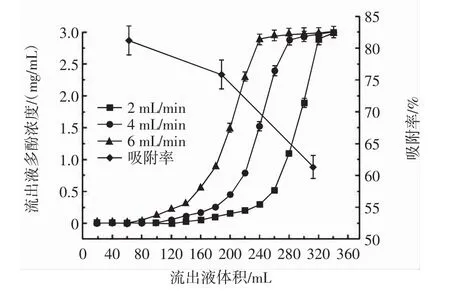
图5 上样流速对树脂吸附的影响Fig.5 Effect of sample loading flow rate on resin adsorption
当流出液中目标成分的质量浓度为上样液质量浓度的1/10时即为泄漏点,此时大孔树脂基本达到吸附饱和状态,可以停止上样[22]。由图5可知,当流速为2、4、6 mL/min时,泄漏点的流出液体积分别为240、190、140 mL,泄漏点的流出液体积随上样流速的增加而降低,导致其吸附率随上样流速的增加而降低。速度越快,样液与树脂接触时间越短,吸附率下降,反之,速度降低,吸附率增加。但是速度过慢,穿透时间越长,导致生产效率降低,综合考虑速度与吸附率,选择流速为4 mL/min。
2.2.5 洗脱速度对树脂解吸效果的影响
洗脱剂流速对多酚解吸的影响见图6。

图6 洗脱速度对解吸的影响Fig.6 Effect of elution rate on desorption
由图6可知,当洗脱剂流速较低时,洗脱峰峰型较对称、尖锐,洗脱剂流速增加,洗脱峰拖尾较严重,对洗脱剂用量为250 mL时的解吸率进行了测定,结果表明,流速为1、2、3 mL/min时,解吸率分别约为91%、87%、74%,洗脱剂流速越低,解吸效率越高。但是,洗脱速度过慢,洗脱时间太长,综合考虑,确定洗脱流速为2 mL/min。
2.2.6 纯化工艺的验证
在多酚初始浓度3.0 mg/mL、上样流速4 mL/min、洗脱剂70%乙醇溶液、洗脱流速2 mL/min条件下,采用AB-8树脂对初始纯度为12.54%的荸荠皮多酚进行纯化,多酚回收率为(81.65±2.45)%,多酚纯度为(58.64±1.76)%。
2.2.7 多酚抗氧化活性的测定
纯化前后荸荠皮多酚ABTS+自由基和DPPH自由基清除率研究结果见图7。

图7 多酚抗氧化活性Fig.7 Antioxidant activity of polyphenols
由图7可知,多酚对两种自由基的清除率都随着浓度的增加而增加,多酚粗提物的抗氧化活性较低,纯化多酚与VC的抗氧化活性相近,说明纯化多酚有较高的抗氧化活性。
2.2.8 荸荠皮多酚稳定性
为有效利用荸荠皮多酚、采取科学的加工方式提供依据,试验研究温度、pH值、光照、蔗糖等因素对荸荠皮多酚的稳定性研究,结果见图8。
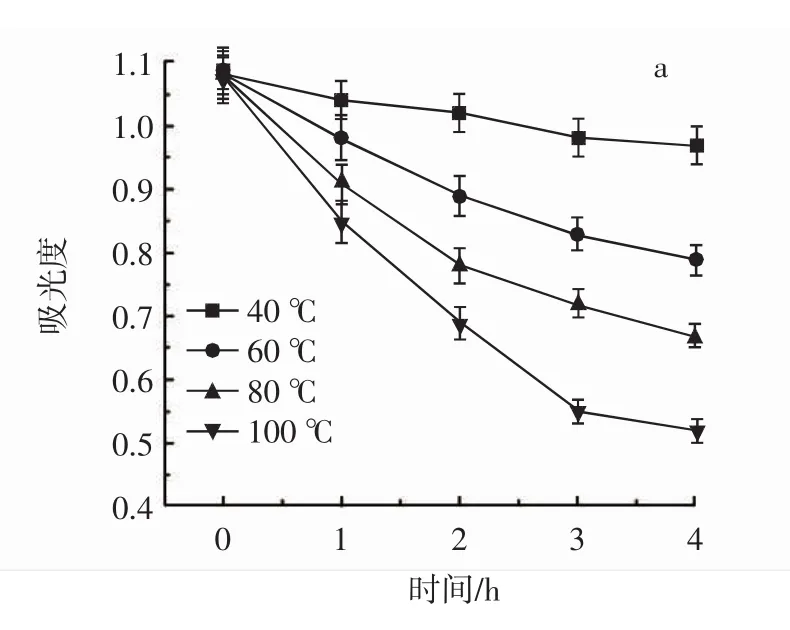

图8 荸荠皮多酚的稳定性Fig.8 Stability of Eleochairis toberosa peel polyphenols
由图8a可以看出,在不同温度下,多酚浓度随时间的延长而降低,温度为40℃时,多酚变化较平缓,4 h内基本保持稳定,60℃~100℃时,随时间延长下降较快,说明多酚热稳定性较差。由图8b可以看出,多酚在pH3时,较稳定,放置14 d后含量仍较高,在pH9时,多酚浓度迅速下降,说明多酚在较高pH值下稳定性较差。由图8c、图8d可以看出,多酚在光照和蔗糖条件下较稳定。
3 结论
采用大孔树脂对荸荠皮多酚进行纯化,对5种大孔吸附树脂,包括 D101(非极性)、AB-8(弱极性)、ADS-17(中等极性)、S-8(极性)、NKA-9(极性)的吸附和解吸性能研究,结果表明弱极性AB-8树脂的吸附量与解吸率均较高,吸附量为(31.64±1.11)mg/g,解吸率为(88.35±2.65)%,选择AB-8为最适树脂。AB-8树脂对荸荠皮多酚的静态吸附动力学曲线表明,静态吸附140 min基本达到饱和,此时树脂对荸荠皮多酚的饱和吸附量为(31.25±1.09)mg/g。树脂动态吸附-解吸研究结果表明,多酚初始浓度3.0 mg/mL、以4 mL/min的流速吸附,吸附平衡后以70%乙醇为洗脱剂,洗脱流速为2 mL/min工艺最佳。对大孔树脂纯化荸荠皮多酚工艺进行验证,纯化后,荸荠皮多酚纯度由12.54%提高到(58.64±1.76)%。对纯化前后多酚与VC的ABTS+自由基和DPPH自由基清除率研究,结果表明纯化多酚抗氧化活性高于粗多酚,纯化多酚的抗氧化活性接近VC的抗氧化活性,说明纯化多酚有较高的抗氧化活性。对多酚稳定性进行了研究,结果表明多酚热稳定性较差,在pH3、光照和蔗糖条件下较稳定。本试验为荸荠皮多酚的进一步研究及保健食品与食品加工奠定了研究基础。

