氨基磺酸改性海藻酸钠的制备及对Fe3+的吸附
王 玥, 杨 隽*, 仇 伟, 郭雅妮
(1.武汉工程大学 材料科学与工程学院,湖北 武汉 430205; 2.中国科学院武汉岩土力学研究所岩土力学与工程国家重点实验室,湖北 武汉 430071)
尾矿是选矿中分选作业的剩余产物[1],维持矿山生产必须安全储存尾矿,建立尾矿库[2]。但尾矿库具有极高势能,一旦发生溃坝,将造成重大人员伤亡、财产损失以及环境污染[3-5]。经研究发现,建立尾矿库治理体系和观测体系可以有效预防尾矿库溃坝[6-7]。但我国的尾矿库以四等及以下的小型尾矿库居多,占全国尾矿库总量的90%以上[8],故需要采用更加经济有效的防溃坝方法,如对尾矿坝排水系统采取系列防淤堵措施[9]。科研人员通过对尾矿坝土工布取样分析,发现:Ca2+和Fe3+产生的不溶物是造成尾矿坝排水设施化学堵塞的直接原因[10-11]。在土工布上涂覆吸附材料可以去除尾矿水中的Ca2+和Fe3+,这是一种直接有效的防堵塞措施。海藻酸钠是一种源自褐海藻的阴离子线性多糖,由不同比例的1,4-连接的β-D-甘露糖醛酸(M)和1,4-连接的α-L-古罗糖醛酸(G)残基组成[12]。海藻酸钠对重金属离子具有一定的吸附能力,可以作为重金属吸附剂。但目前海藻酸钠基吸附材料主要应用于Cr3+、Pb2+和Hg2+等重金属离子的去除[13-15],对Fe3+的吸附报道较少。因此,本研究以海藻酸钠为基体,高碘酸钠为氧化剂,氨基磺酸为改性材料,利用希夫碱反应在海藻酸钠分子链上引入大量磺酸基团,制备了一种氨基磺酸改性海藻酸钠吸附材料(MSA),利用FT-IR及SEM对材料进行表征,并研究了吸附时间、溶液pH值、吸附温度以及Fe3+初始质量浓度对材料吸附容量的影响[16-17],以期为尾矿坝排水系统中高性能的防淤堵吸附材料的开发提供参考。
1 实 验
1.1 试剂及仪器
海藻酸钠(SA)、氨基磺酸、高碘酸钠、乙二醇、无水乙醇、硼氢化钠、氯化钠、磷酸氢二钠、磷酸二氢钠、硫酸高铁铵、乙二胺四乙酸二钠(EDTA)等均为市售分析纯。pH值为7的磷酸缓冲溶液(0.2 mol/L)按照文献[18]方法配置;0.02 mol/L EDTA溶液按照文献[19]方法配置。
电子天平;集热式恒温加热磁力搅拌器;TG16-II医用离心机,长沙平凡仪器仪表有限公司;SCIENTZ-12N冷冻干燥机,宁波新芝生物科技股份有限公司;Nicolet 6700傅里叶变换红外光谱仪,美国赛默飞世尔科技有限公司;GeminiSEM 300场发射扫描电子显微镜,蔡司工业测量技术(上海)有限公司。
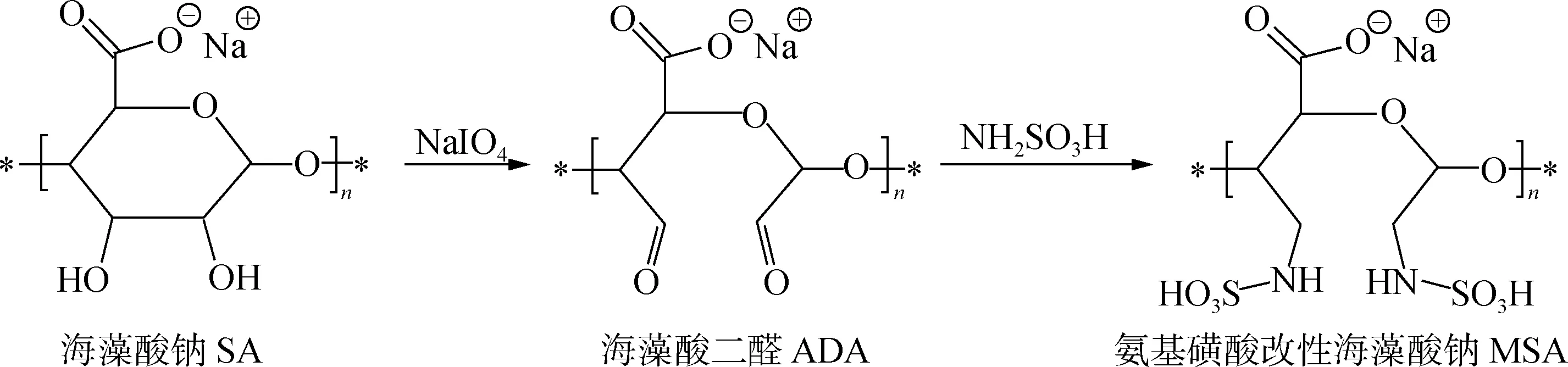
1.2 氨基磺酸改性海藻酸钠(MSA)的制备
1.2.1海藻酸二醛(ADA)的制备 按照文献[20]方法制备ADA,具体操作如下:称取2 g SA溶解于 20 mL 乙醇-水(体积比1 ∶1)溶液中,加入1.07 g高碘酸钠,25 ℃条件下避光搅拌反应6 h。加入2 mL乙二醇淬灭氧化反应,避光条件下继续搅拌2 h。加入2 g氯化钠,继续搅拌10 min。将混合液倒入烧杯并加入80 mL无水乙醇,搅拌3 min,待溶液与无水乙醇充分混合后静置10 min,悬浊液自然沉降直至溶液分层,取下层浊液放入离心机以6 500 r/min离心5 min。将离心后得到的固体(ADA)溶解在20 mL 去离子水中,充分搅拌后加入80 mL无水乙醇,搅拌3 min,使ADA再次析出,重复3次。最后将样品冷冻干燥48 h,4 ℃下保存。
1.2.2ADA的氨基磺酸改性 按照实验获得最佳配方制备MSA,具体操作如下:称取1 g ADA完全溶于20 mL磷酸缓冲溶液(pH值7)中,加入0.4 g氨基磺酸,25 ℃条件下磁力搅拌反应4 h,加入0.5 g NaBH4,完全反应24 h。产物(MSA)用无水乙醇沉淀、抽滤,再用无水乙醇浸泡、抽滤,重复此过程4次,冷冻干燥24 h,4 ℃下保存。MSA制备路线如下:
1.3 MSA吸附性能研究
1.3.1Fe3+溶液配制 称取一定质量硫酸高铁铵,溶于适量1 mol/L盐酸中,全部溶解后转入标准容量瓶中,用去离子水稀释至刻度线处,摇匀后密封放于阴凉避光处保存。改变硫酸高铁铵用量配制不同质量浓度Fe3+溶液,改变1 mol/L盐酸用量调节Fe3+溶液pH值。
1.3.2pH值对MSA吸附Fe3+的影响 称取50 mg MSA样品,将其与50 mL不同pH值(0.5、 1.0、 1.5 和2.0)的Fe3+溶液(100 mg/L)充分混合,在室温下搅拌240 min,抽滤。采用EDTA滴定法计算不同pH值下的Fe3+吸附量。
1.3.3吸附时间对MSA吸附Fe3+的影响 称取500 mg MSA样品置于1 L烧杯中,加入500 mL Fe3+标准溶液(pH值2, 50 mg/L),室温下搅拌反应24 h。在5、 10、 20、 60、 120、 180、 240、 300和360 min时取25 mL混合溶液,抽滤。采用EDTA滴定法计算不同吸附时间下的Fe3+吸附量。
1.3.4Fe3+溶液初始质量浓度对MSA吸附性能的影响 称取50 mg MSA样品,将其与50 mL不同质量浓度(50、 100、 150、 200和250 mg/L)的Fe3+溶液(pH值2)充分混合,在室温下搅拌240 min,抽滤。采用EDTA滴定法计算不同Fe3+溶液初始质量浓度下的Fe3+吸附量。
1.3.5吸附温度对MSA吸附Fe3+的影响 称取50 mg MSA样品,将其与50 mL的Fe3+溶液(pH值2,100 mg/L)充分混合,分别在20、 30、 40和50 ℃下搅拌240 min,抽滤。采用EDTA滴定法计算不同吸附温度下的Fe3+吸附量。
1.4 测试与表征
1.4.1Fe3+吸附量的测定 采用EDTA法[19]测定Fe3+吸附量,具体操作如下:向溶液中加入磺基水杨酸作为铁离子指示剂,溶液呈紫色,采用0.004 mol/L EDTA溶液作为滴定剂,溶液由紫色变为淡黄色时判定为滴定终点,若铁离子含量低,则滴定结束表现出“无色”。铁离子含量计算公式如下:
(1)
式中:C0—Fe3+溶液初始浓度,mol/L;C1—EDTA溶液初始浓度,mol/L;V0—Fe3+溶液体积,mL;V1—EDTA溶液消耗体积,mL;m—样品质量,g;qt—吸附容量,mg/g; 56—铁离子分子质量,g/mol。
1.4.2FT-IR分析 采用Nicolet 6700傅里叶变换红外光谱仪对SA、ADA以及吸附前后的MSA进行化学结构分析,判断MSA是否被成功制得并探究吸附前后吸收峰的变化。
1.4.3SEM分析 使用GeminiSEM 300场发射扫描电子显微镜对吸附前后的MSA表面形貌进行观察。
2 结果与讨论
2.1 MSA及ADA的结构分析
2.1.1FT-IR分析 对中间产物ADA和MSA吸附Fe3+前后的结构进行FT-IR分析,结果见图1。由图可以看出,SA曲线中存在3 453和1 311 cm-12个特征吸收峰。3 500和1 300 cm-1附近的吸收峰分别对应O—H的伸缩振动峰和面内弯曲振动峰。对比SA,ADA谱图中3 500 cm-1附近O—H伸缩振动峰发生偏移且峰面积减小,说明ADA中O—H减少,而719 cm-1处O—H面外弯曲振动峰强度增加是由于ADA分子链内形成半缩醛,说明SA被氧化成为ADA。对比ADA谱图,MSA谱图中3 278 cm-1处峰宽增加,是O—H的伸缩振动峰与N—H的伸缩振动峰重叠所致,856 cm-1处特征峰为N—H面外弯曲振动峰,1 145和943 cm-1处峰为—SO3H特征峰,说明—NHSO3H被引入ADA分子链上,即成功制得氨基磺酸改性海藻酸钠(MSA)。对比MSA谱图,吸附Fe3+后的MSA(即MSA-Fe3+)谱图上无新特征峰出现,在992 cm-1处MSA谱图峰出现偏移和在856 cm-1处MSA谱图峰消失表明Fe3+被MSA表面不同官能团吸附。
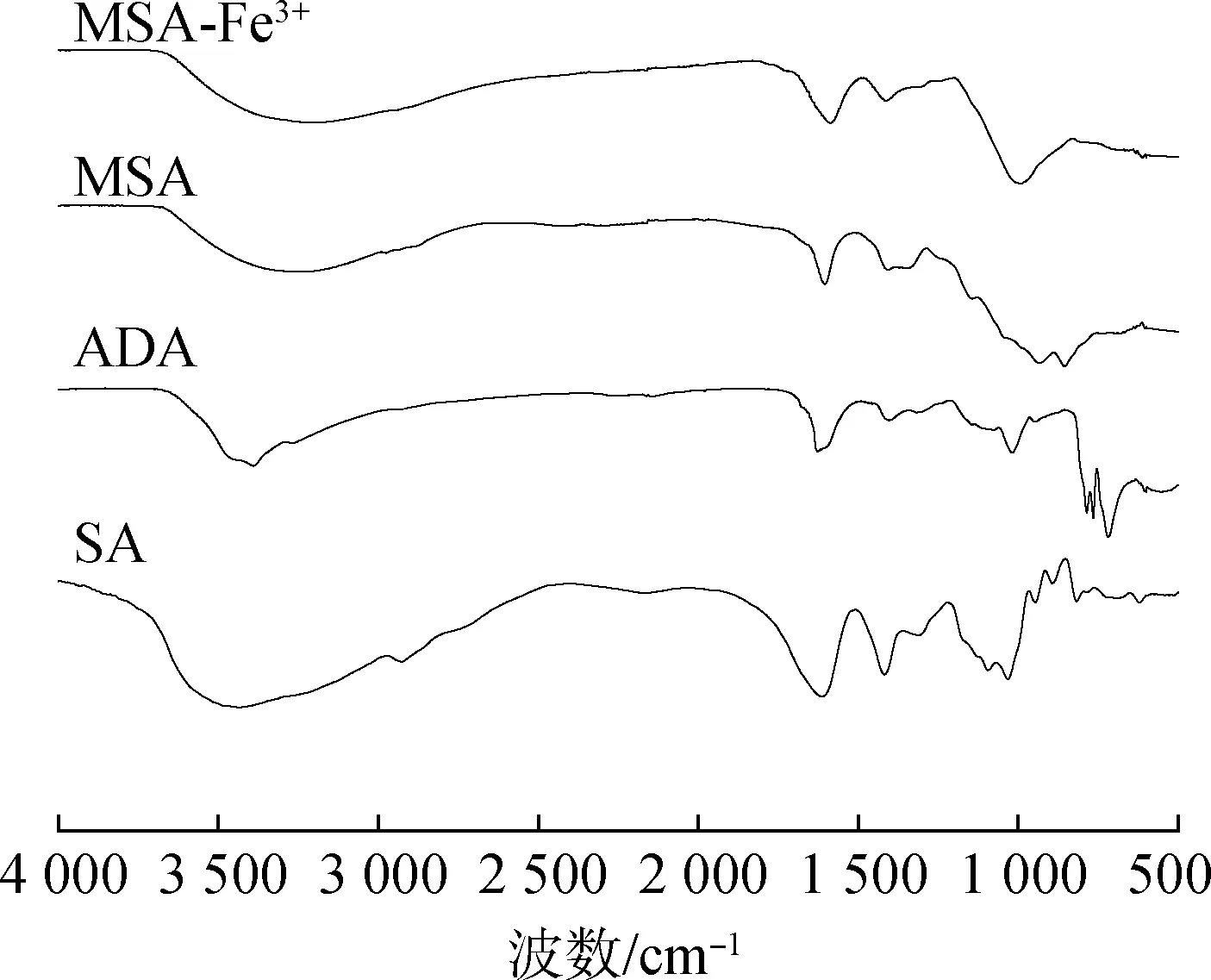
图1 样品的FT-IR图谱Fig.1 FT-IR spectra of samples
2.1.2SEM分析 对吸附Fe3+前后的MSA进行扫描电镜分析,进一步探究吸附Fe3+后MSA的表面特征,SEM照片如图2所示。由图可知,MSA为表面光滑的片层状固体,层间存在部分孔洞,吸附Fe3+后的MSA则表现出疏松多孔的形貌,这表明:MSA吸附Fe3+后分子尺寸增大,使得MSA分子链间空隙增大。

MSA: a.×5 000; c.×100; MSA-Fe3+: b.×5 000; d.×100
2.2 吸附条件对MSA吸附Fe3+的吸附性能的影响
2.2.1pH值对MSA吸附Fe3+的影响 当Fe3+溶液质量浓度为100 mg/g时,pH值大于2.4即会产生Fe(OH)3沉淀,极大影响实验结果的准确性,因此本实验只研究在pH值小于2的条件下,pH值的改变对吸附量的影响,结果如表1所示。随着pH值的增大,MSA对Fe3+的吸附量逐渐增大,当pH值为2时达到最大值为84.26 mg/g。这是因为当pH值较低时,溶液中H+较多,吸附剂中磺酸根质子化程度较大,即从—SO3·转化为—SO3H,对Fe3+的吸附效果较差,随着pH值增大,—SO3H发生电离,—SO3·与Fe3+发生配位反应,使得MSA对Fe3+的吸附量增大。因此,选择pH值为2的Fe3+溶液用于后续实验。
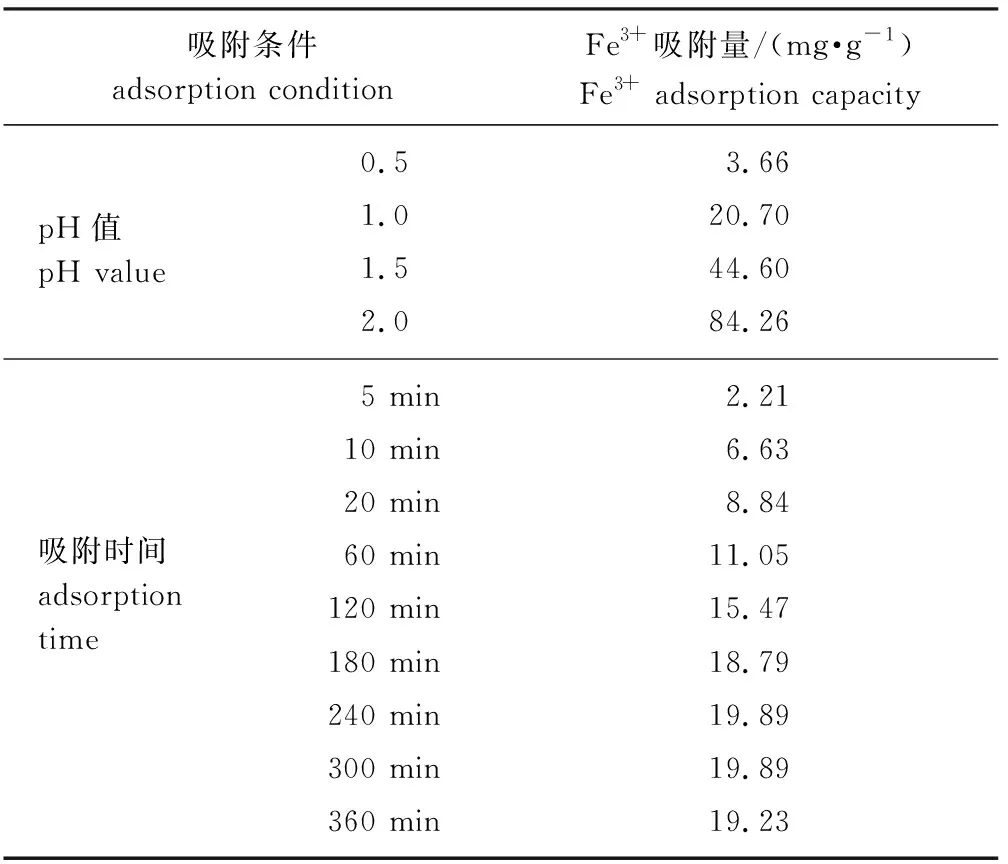
表1 pH值与吸附时间对吸附量的影响
2.2.2吸附时间的影响及吸附动力学 按照1.3.3节的方法研究吸附时间对MSA吸附性能的影响,结果如表1所示。由表可知,MSA在0~60 min内对Fe3+的吸附量迅速增加,在60~240 min内吸附速率逐渐减慢,最终在240 min时达到吸附平衡,平衡吸附量为19.89 mg/g。综合考虑,选择240 min作为最佳吸附时间用于后续实验。
为研究MSA对Fe3+的吸附速率控制步骤,采用准一级动力学模型(式(2))、准二级动力学模型(式(3))以及颗粒内扩散模型(式(4))对实验结果进行拟合,具体方程如下:
ln(qe-qt)=lnqe-k1t
(2)
t/qt=1/(k2qe2)+t/qe
(3)
qt=kpt0.5+C
(4)
式中:qt—t时刻的吸附量,mg/g;qe—平衡吸附量,mg/g;k1—准一级动力学速率常数,min-1;k2—准二级动力学速率常数,g/(mg·min);kp—颗粒内扩散模型速率常数,mg/(g·min0.5);C—与边界层有关的常数。
动力学方程拟合结果见图3,准一级动力学模型的拟合参数qe、k1和R2分别为19.114 mg/g、 0.02 min-1和0.941,准二级动力学模型的拟合参数qe、k2和R2分别为21.920 mg/g、 0.001 2 g/(mg·min)和0.989,颗粒内扩散动力学模型的拟合参数kp和R2分别为1.003 mg/(g·min0.5)和0.906。由R2数值可知,准二级动力学拟合相关系数大于准一级动力学拟合相关系数。由准二级动力学拟合得到的平衡吸附量为21.92 mg/g,与实验值(19.89 mg/g)相近,表明:MSA对Fe3+的吸附过程符合准二级动力学模型,其吸附速率控制因素为化学吸附。颗粒内扩散模型拟合曲线不过原点,表明吸附速率被多个步骤联合控制。
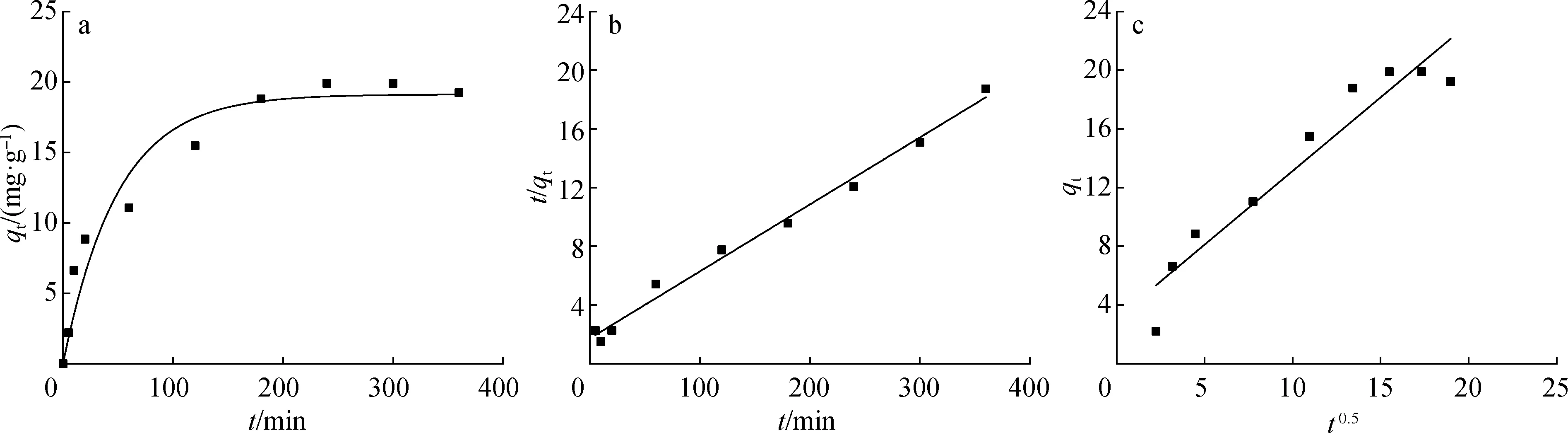
a.准一级pseudo-first-order; b.准二级pseudo-second-order; c.颗粒内扩散intra-particle diffusion
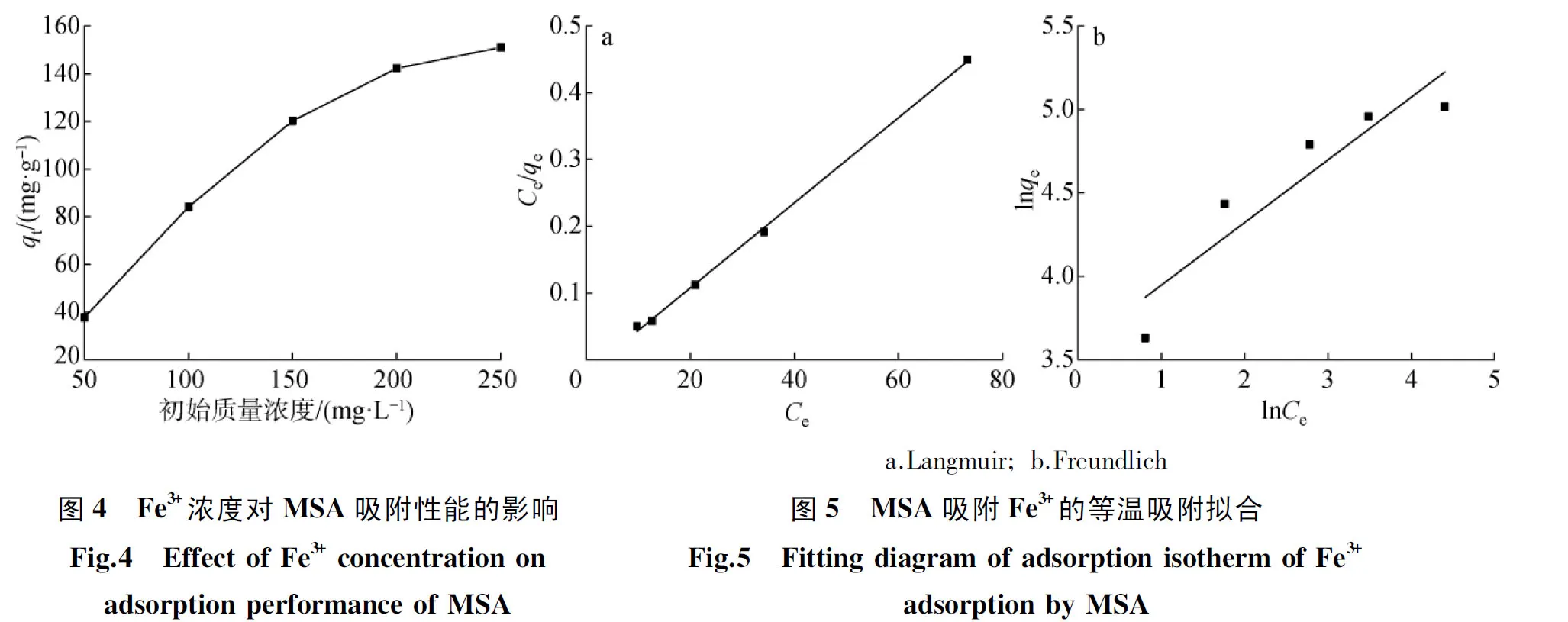
2.2.3初始质量浓度的影响及吸附等温线 按照1.3.4节的方法研究Fe3+溶液初始质量浓度对MSA的吸附性能的影响,结果如图4所示。由图可见,随着Fe3+初始质量浓度的增加,MSA对Fe3+的吸附量逐渐增大,当Fe3+初始质量浓度超过200 mg/L时,吸附量逐渐趋于稳定,最终为151 mg/g左右。因此,选择Fe3+溶液初始质量浓度为200 mg/L。
为研究MSA对Fe3+的吸附机理,采用Langmuir等温模型(式(5))和Freundlich等温模型(式(6))对平衡吸附数据进行拟合,具体方程如下:
(5)
(6)
式中:qm—单层饱和吸附量,mg/g;KL—Langmuir 吸附平衡常数,L/mg;Ce—吸附平衡后溶液中Fe3+的质量浓度,mg/L;KF—Freundlich吸附平衡常数,L/mg; 1/n―吸附强度的相对指标的常数,数值一般在0~1,它的大小反映出压力对吸附量影响的强弱。
拟合结果如图5所示,对比两个模型拟合相关系数,Langmuir等温模型(R2=0.999)明显高于Freundlich等温模型(R2=0.817),且通过拟合得到的单层饱和吸附量为163.132 mg/g,与实验数据(151 mg/g)相近,即MSA吸附材料对Fe3+的吸附过程符合Langmuir等温模型,为单分子层吸附。Freundlich等温拟合参数1/n为0.376,小于0.5,表明压力对吸附过程影响较小。
2.2.4吸附温度的影响及吸附热力学 按照1.3.5节的方法研究温度对MSA吸附Fe3+的吸附性能的影响,结果见表2。由表可知,随着温度从20 ℃升高至50 ℃,Fe3+吸附量上下波动不超过8%,说明温度的变化对MSA的吸附能力影响不大。综合考虑,选择吸附温度为室温(即25 ℃)。为进一步说明MSA对Fe3+的吸附机理,对吸附数据进行热力学参数(ΔHӨ,ΔSӨ,ΔGӨ)计算,具体方程如下:
(7)
ΔGӨ=-RTlnK
(8)
(9)
式中:R—气体常数,8.314 J/(K·mol);T—热力学温度,K;K—吸附分配系数,L/mg; ΔGӨ—吉布斯自由能,kJ/mol; ΔHӨ—焓变,kJ/mol; ΔSӨ—熵变,kJ/(mol·K)。
吸附热力学参数的计算结果见表2,吸附过程ΔGӨ<0,说明吸附反应是自发进行的。随着吸附温度升高,ΔGӨ的绝对值减小,说明升高温度不利于吸附反应进行。ΔHӨ和ΔSӨ分别为-9.01 kJ/mol和-0.01 kJ/(mol·K),说明MSA对Fe3+的吸附过程为放热的熵减过程。
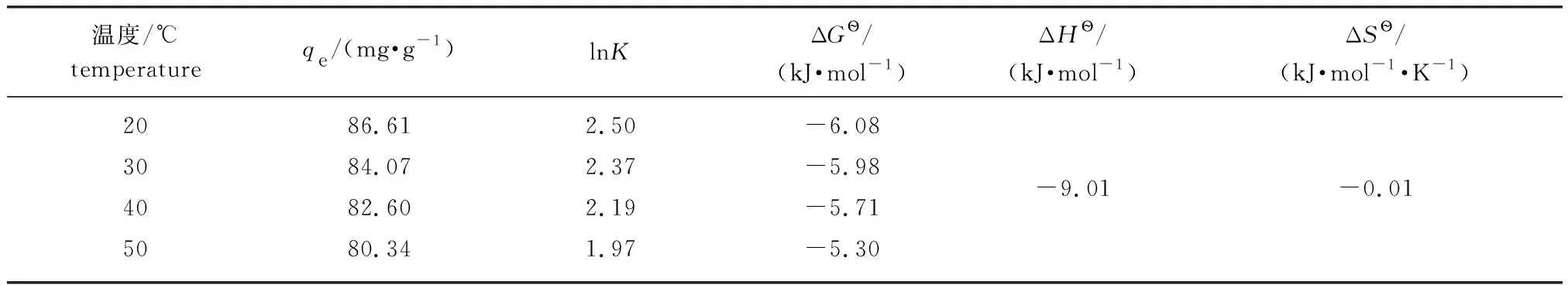
表2 热力学相关参数
综上所述,MSA的较佳吸附条件为Fe3+初始质量浓度200 mg/L、Fe3+溶液pH值2、吸附时间240 min,吸附温度25 ℃,此时MSA对Fe3+吸附量为151 mg/g;同等条件下,SA对Fe3+吸附量为90.09 mg/g。与SA相比,经过氨基磺酸改性得到的MSA的吸附性能有了较大提高。
3 结 论
3.1以海藻酸钠(SA)为基体,高碘酸钠为氧化剂,氨基磺酸为改性材料,制备氨基磺酸改性海藻酸钠(MSA)。FT-IR分析结果表明:—NHSO3H被引入到海藻酸二醛(ADA)中,成功制备了一种氨基磺酸改性海藻酸钠吸附材料;SEM分析结果表明:MSA吸附Fe3+后分子尺寸增大,使MSA分子链间空隙增大。
3.2将MSA用于吸附Fe3+,较佳吸附条件为Fe3+初始质量浓度200 mg/L、Fe3+溶液pH值2、吸附时间240 min,吸附温度25 ℃,此条件下,MSA对Fe3+吸附量最大,为151 mg/g。
3.3MSA对Fe3+的吸附过程符合Langmuir等温模型,说明吸附过程为单分子层吸附,单层饱和吸附量为163 mg/g;吸附动力学研究结果表明:MSA对Fe3+的吸附在240 min时达到平衡,吸附量为19.89 mg/g,吸附过程符合准二级动力学,其吸附速率的主要控制步骤为化学吸附;吸附热力学研究结果表明:MSA对Fe3+的吸附过程中ΔGӨ<0、ΔHӨ<0和ΔSӨ<0,此吸附过程是一个自发的放热熵减过程。

