EGCG浓度对肌原纤维蛋白侧链结构和凝胶水分分布的影响
李玲,蔡爽,陈娇娇,田心蕊,杨致远
(临沂大学生命科学学院,山东 临沂 276000)
近年来,我国肉类工业发展迅速,肉类质量安全问题一直受到广大从业者的重视。蛋白质是肉及肉制品中的主要成分,蛋白质结构和组成对肉制品的营养和感官风味有重要的作用[1]。蛋白质氧化会引起肉与肉制品嫩度和保水性下降、色泽变差、产生异味、货架期缩短等问题,因此如何有效控制肉类加工贮藏过程中蛋白质的氧化以及延长食品货架期具有重要的现实意义[2]。蛋白质氧化修饰主要发生在氨基酸侧链上,如游离巯基形成二硫键、酪氨酸聚合、芳香族氨基酸苯环羟基化、形成羰基等。张海璐等[3]将羊肉进行羟自由基氧化处理,发现氧化时间延长到5 h,肌原纤维蛋白羰基含量显著增加,而总巯基含量显著下降,蛋白质分子间发生了交联。崔文斌等[4]采用高铁肌红蛋白氧化处理牦牛肉肌原纤维蛋白,随着氧化剂浓度的增加,羰基含量升高,表面疏水性和二聚酪氨酸含量增加,巯基浓度下降,说明高铁肌红蛋白加速了肌原纤维蛋白的氧化进程。
植物多酚在肉制品中的应用是近年来的研究热点,如多酚在抑制肉中的脂肪和蛋白质氧化、抑制微生物生长和提高产品质量等方面的应用研究。Xiang等[5]在广式香肠中添加桑葚多酚,可以显著降低香肠的硫代巴比妥酸值和羰基含量,可以有效抑制香肠贮藏过程中的挥发性盐基氮含量,减少氧化,提高产品的安全性。Jongberg等[6]以经过紫外线照射处理的猪肉制作香肠,发现绿茶或迷迭香提取物可以抑制硫代巴比妥酸和蛋白质羰基的形成,但是添加绿茶提取物后,由于还原键的聚合作用,巯基损失增加,肌球蛋白重链和肌动蛋白损失明显,可能是由于植物提取物中的醌类化合物与蛋白质巯基之间的反应,产生苯酚介导的蛋白质聚合。李玲等[7]在肌原纤维蛋白氧化体系中添加茶多酚,发现茶多酚可以保护肌原纤维蛋白侧链结构,提高凝胶保水性。近年来针对酚类单体的抗氧化研究逐渐深入,Cao等[8]发现绿原酸可有效抑制蛋白质羰基的形成,促进蛋白质结构展开,但是高浓度绿原酸会降低蛋白质巯基含量,氨基含量相应减少,蛋白质发生交联聚集,溶解度下降,最终导致蛋白质凝胶特性变差。Jongberg等[9]研究认为含有多个邻羟基的多酚氧化形成醌,与蛋白质侧链自由巯基发生迈克尔加成反应形成“巯基-醌”加成产物,最终形成蛋白-多酚-蛋白-多酚交联聚合物。表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是茶多酚的主要成分,其分子式为C22H18O11,结构中含有6个邻位酚羟基,在性质和功能上优于其它儿茶素[10]。目前关于EGCG与蛋白质侧链结构的相互作用研究很少,本研究通过在羟自由基氧化体系中添加EGCG这种抗氧化剂,研究EGCG对肌原纤维蛋白侧链结构和凝胶水分分布的影响。
1 材料与方法
1.1 材料与试剂
新鲜猪背最长肌:市售;表没食子儿茶素没食子酸酯(纯度90%):上海源叶生物科技有限公司;哌嗪-1,4-二乙磺酸(piperazine-1,4-bisethanesulfonic acid,PIPES)、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na)、 水 溶 性 维 生 素 E(Trolox)、溴酚蓝(bromophenol blue,BPB)、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、抗坏血酸(VC)、2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzenesulfonic acid,TNBS)、甘氨酸、牛血清蛋白、5,5'-二硫代双(2-硝基苯甲酸)[5,5'-dithio bis-(2-nitrobenzoic acid),DTNB]、三羟甲基氨基甲烷[tris-(hydroxymethyl)-aminomethane,Tris]:上海阿拉丁生化科技股份有限公 司 ;KCl、MgCl2、Na2HPO4、NaCl、NaOH、CuSO4、FeCl3、H2O2、HCl、盐酸胍、尿素、酒石酸钾钠:国药集团化学试剂有限公司。以上化学试剂均为分析纯。
1.2 仪器与设备
Allegra 25R高速冷冻离心机:美国Beckman公司;F-4600荧光分光光度计:日本日立公司;PQ001核磁共振分析仪:上海纽迈电子设备有限公司;H-S4数显恒温水浴锅:金坛市医疗仪器厂;UPW系列超纯水机:成都超纯科技有限公司;SP-756P紫外-可见分光光度计:上海光谱仪器有限公司;M3多功能酶标仪:美国MD公司。
1.3 方法
1.3.1 肌原纤维蛋白的提取
参考Park等[11]和Feng等[12]的方法提取猪肉肌原纤维蛋白。取新鲜猪背最长肌,用刀剔除猪肉上多余的筋膜、脂肪后,将猪肉切成均匀的小块并用绞肉机搅碎,所得肉糜用于提取猪肉肌原纤维蛋白。称取50 g肉样,加4倍体积的pH7.0缓冲液(0.1 mol/L KCl、2 mmol/L MgCl2、1mmol/LEDTA、10mmol/LNa2HPO4),13000 r/min匀浆 30 s,4℃、2 000×g离心 15 min,弃去上清液,取沉淀重复上述步骤3遍。沉淀加入4倍体积的0.1 mol/L NaCl溶液,11 000 r/min 匀浆 30 s,2 000×g、2 ℃离心15 min,弃去上清液,沉淀重复洗涤2次,第3次加NaCl溶液匀浆后,用4层纱布过滤以除去结缔组织等,最后用0.1 mol/L HCl溶液调节pH值为6.25,2 000×g、2℃条件下离心15 min弃去上清液,所得膏状物为肌原纤维蛋白。
1.3.2 氧化处理
参考Xiong等[13]的方法在溶解后的肌原纤维蛋白溶液中加入 EGCG,再加入 FeCl3、VC、H2O2溶液用来构建羟自由基的模拟氧化体系,整个体系含有以下成分:40 mg/mL猪肉肌原纤维蛋白、0.01 mmol/L的FeCl3、0.1 mmol/L的VC和10 mmol/L H2O2,其中EGCG浓度分别为 0、0.1、0.2、0.5、1.0、2.0 mmol/L。在 4 ℃氧化 12 h后,用10 mmol/L Trolox终止氧化反应,即为氧化后的猪肉肌原纤维蛋白,贮藏于0℃~4℃,2 d内使用。以未加EGCG和氧化剂的肌原纤维蛋白溶液作为空白对照组。
1.3.3 蛋白质巯基含量的测定
游离巯基和总巯基含量测定采用DTNB法[14]。将样品用TGB缓冲溶液(0.086 mol/L Tris,0.09 mol/L甘氨酸,4 mmol/L EDTA,pH8.0)稀释至 1 mg/mL,其中游离巯基含量测定用不含尿素的TGB缓冲溶液,总巯基含量测定用含有8 mmol/L尿素的TGB缓冲溶液。吸取1.5 mL氧化处理后的肌原纤维蛋白溶液,加入15 μL DTNB混匀,另外取1.5 mL相应TGB缓冲溶液+15 μL DTNB混匀作为空白对照组。室温放置1 h,每10 min振荡 1次,使之充分反应,离心(12 000×g,10 min)后取上清液,在412 nm波长处测定吸光度。
1.3.4 蛋白质侧链羰基、游离氨基、二聚酪氨酸含量和表面疏水性的测定
羰基含量测定采用2,4-二硝基苯肼法,参考Cao等[8]的方法进行。酸性条件下,蛋白质羰基与DNPH反应生成2,4-二硝基苯腙,呈现红棕色,用盐酸胍溶解后在370 nm波长处测定吸光度。
表面疏水性测定采用溴酚蓝结合法。参照Chelh等[15]描述的方法将肌原纤维蛋白用20 mmol/L磷酸盐缓冲溶液稀释到5 mg/mL。取1 mL该溶液,加入0.2 mL 1 mg/mL的溴酚蓝溶液,充分混匀,离心取上清液,测定上清液在595 nm波长处的吸光度。
游离氨基含量的测定参考Liu等[16]的方法,通过使蛋白质与2,4,6-三硝基苯磺酸发生反应,测定反应溶液在420 nm波长处的吸光度。
二聚酪氨酸含量的测定参考Davies等[17]的方法。利用酶标仪测定吸光度,激发波长325 nm,发射波长420 nm,狭缝宽度10 nm,灵敏度2。二聚酪氨酸含量用荧光强度大小表示。
1.3.5 内源色氨酸荧光强度的测定
内源色氨酸荧光强度采用荧光分光光度计进行检测,参考李玲等[7]的方法进行。用15 mmol/L PIPES溶液将样品稀释为0.1 mg/mL,吸取0.1 mL上述溶液置于石英比色皿中,室温条件下于283 nm波长处激发,记录300 nm~400 nm波长范围的发射光谱供后续分析。激发和发射狭缝宽度均设置为5 nm,电压为700V。
1.3.6 动态流变学测定
把样品均匀涂布在流变仪的测试平板上,样品加热采用1℃/min的升温速率,记录20℃~90℃的升温曲线。凝胶性能通过储能模量(G′)评价。
1.3.7 凝胶保水性及水分分布
将猪肉肌原纤维蛋白浓度调整到40 mg/mL,80℃水浴30 min制得凝胶,测定凝胶保水性并进行凝胶水分分布分析。凝胶保水性(water holding capacity,WHC)用离心法测定。称量制备好的蛋白凝胶和离心管质量(m1),于 4℃、6 000×g离心 15 min,记录离心后离心管与凝胶的质量(m2)以及空管质量(m)。WHC的计算公式如下。
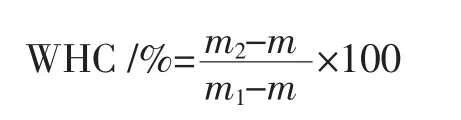
低场核磁水分分布分析参考Han等[18]的方法进行。
1.4 数据处理
试验重复进行3次,结果用平均值±标准差表示。用SPSS 25.0进行单因素方差分析和Duncan’s多重比较。
2 结果与分析
2.1 EGCG浓度对猪肉肌原纤维蛋白巯基含量的影响
EGCG浓度对猪肉肌原纤维蛋白游离巯基和总巯基含量的影响见图1。

图1 EGCG浓度对猪肉肌原纤维蛋白巯基含量的影响Fig.1 Effect of EGCG concentration on the sulfydryl content of pork myofibrillar protein
由图1可知,空白对照组的游离巯基含量高达67 nmol/mg蛋白,总巯基含量为102 nmol/mg蛋白,羟自由基氧化处理后的0 mmol/L EGCG组游离巯基和总巯基含量均低于空白对照组,但差异不显著(P>0.05)。氨基酸残基对自由基氧化敏感,半胱氨酸的巯基会氧化交联形成二硫键。研究发现随着羟自由基浓度的增加,游离巯基含量显著降低[19]。当添加0.1 mmol/L~2.0 mmol/L的EGCG后,游离巯基和总巯基含量均显著低于0 mmol/L EGCG组和空白对照组(P<0.05)。说明EGCG显著降低了体系中的游离巯基和总巯基含量,这是因为EGCG作为多酚类抗氧化物质,多酚的羟基可以与蛋白质侧链巯基结合,使检测到的巯基数量减少。Tang等[20]通过研究发现,多酚可以与肌原纤维蛋白上的巯基形成“巯基-醌”加成产物,且这种加成产物会随着多酚与肌原纤维蛋白混合搅拌时间的延长而增加。
2.2 EGCG浓度对猪肉肌原纤维蛋白羰基、游离氨基、二聚酪氨酸含量和表面疏水性的影响
EGCG浓度对猪肉肌原纤维蛋白侧链结构中羰基、游离氨基、二聚酪氨酸含量和表面疏水性的影响见表1。
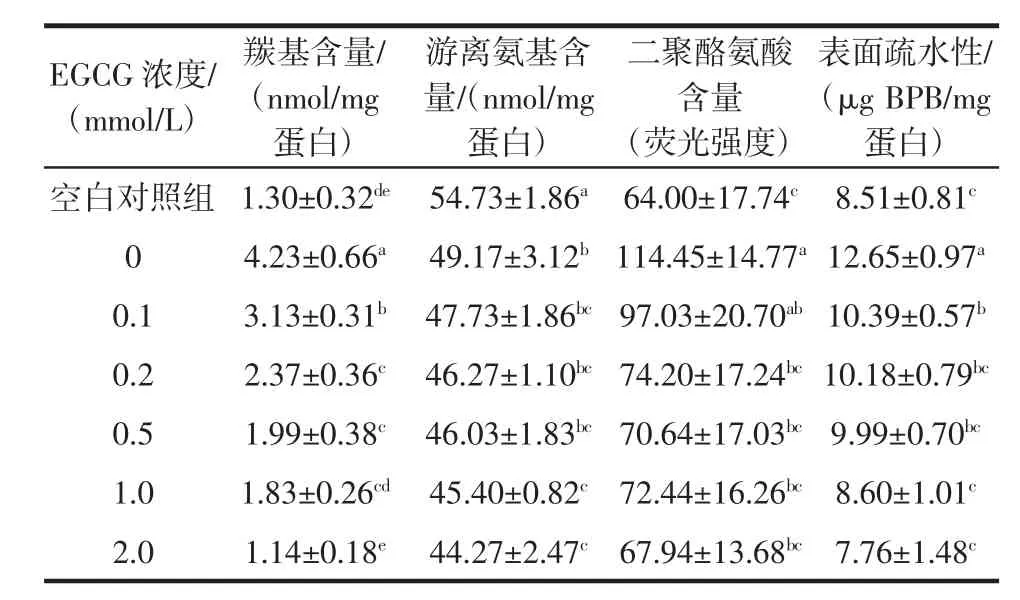
表1 EGCG浓度对猪肉肌原纤维蛋白羰基、游离氨基、二聚酪氨酸含量和表面疏水性的影响Table 1 Effect of EGCG concentration on the carbonyl content,free amino content,dityrosine content and surface hydrophobicity of pork myofibrillar protein
空白对照组游离氨基含量为54.73 nmol/mg蛋白,氧化后的0 mmol/L EGCG组下降到49.17 nmol/mg蛋白,两组差异显著(P<0.05)。随EGCG浓度增加,游离氨基含量进一步降低,与空白对照组差异显著(P<0.05),其中2.0 mmol/L EGCG组游离氨基含量最低。有研究表明,随着儿茶素、表儿茶素添加量的增加,巯基和氨基的含量减少[23-24]。Tang等[25]研究发现,多酚氧化产物醌类物质与肌原纤维蛋白发生加成反应,迷迭香酸与肌原纤维蛋白中不同氨基酸结合,形成“氨基-醌”加成产物。
氧化处理后的0 mmol/L EGCG组二聚酪氨酸含量是空白对照组的1.79倍,二者差异显著(P<0.05)。蛋白质氧化生成的羰基衍生物可以与赖氨酸的氨基反应形成交联,酪氨酸残基可交联聚合形成双酪氨酸[26]。随EGCG浓度增加,二聚酪氨酸含量整体呈降低趋势,其中0.2 mmol/L~2.0 mmol/L EGCG组与0 mmol/L EGCG 组差异均显著(P<0.05)。Li等[27]在研究茶多酚对草鱼蛋白质氧化修饰效果中发现,低浓度茶多酚能有效抑制二聚酪氨酸的形成,抑制巯基和蛋白质α-螺旋构象的丢失,从而阻止了蛋白质侧链结构的改变。
空白对照组猪肉肌原纤维蛋白表面疏水性为8.51 μg BPB/mg蛋白,氧化后的0 mmol/L EGCG组升高到 12.65 μg BPB/mg蛋白,二者差异显著(P<0.05),说明氧化处理导致蛋白质结构展开,其疏水性显著升高。李玲等[19]研究发现,随着过氧化氢浓度从0增加到10 mmol/L,肌原纤维蛋白表面疏水性显著增大,蛋白质空间结构被破坏,更多疏水氨基酸暴露在分子表面。本研究中随EGCG浓度的增加,表面疏水性逐渐降低,2.0 mmol/L EGCG组最低。这是由于EGCG的酚羟基可以插入肌原纤维蛋白分子结构中,导致BPB的结合量降低。酚类物质的疏水堆积作用,不仅降低了肌原纤维蛋白与荧光探针的亲和力,而且还引入了极性基团。
2.3 EGCG浓度对猪肉肌原纤维蛋白内源色氨酸荧光强度的影响
色氨酸的荧光特性对色氨酸微环境的极性变化非常敏感,它被广泛用作蛋白质三级结构的测量指标。EGCG浓度对猪肉肌原纤维蛋白内源色氨酸荧光强度的影响见图2。
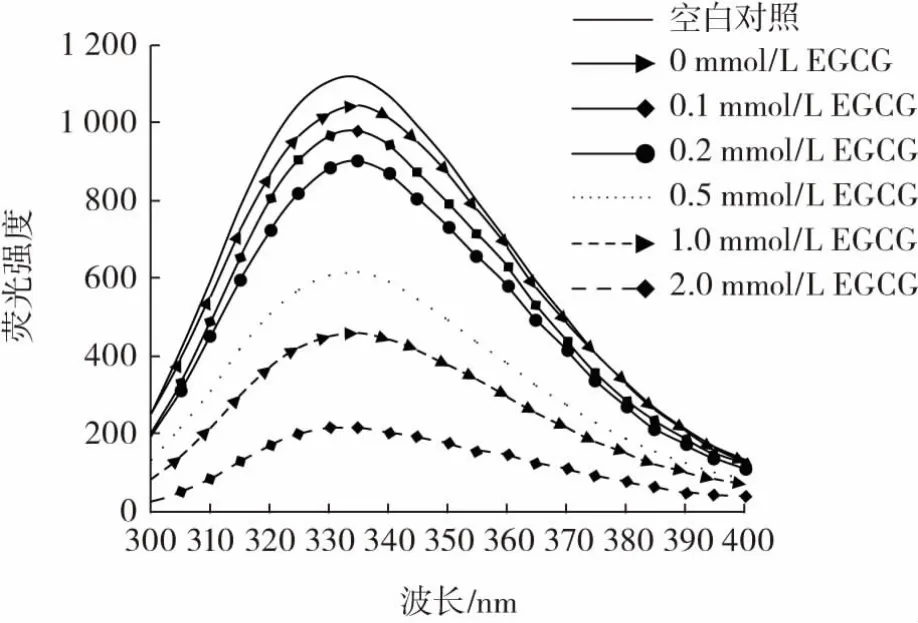
图2 EGCG浓度对猪肉肌原纤维蛋白内源色氨酸荧光强度的影响Fig.2 Effect of EGCG concentration on the tryptophan fluorescence of pork myofibrillar protein
由图2可知,氧化处理后,肌原纤维蛋白荧光强度降低。随EGCG浓度逐渐增加,荧光强度逐渐降低,2.0 mmol/L EGCG组最低。这与本研究中表面疏水性的变化一致,表明氧化导致蛋白质侧链修饰,氨基酸侧链与酚类化合物的相互作用导致其疏水结构进一步发生改变。这与前期对绿原酸以及表儿茶素的研究结果一致[8,24]。酚与蛋白质相互作用,使蛋白质结构去折叠且暴露了色氨酸,将酪氨酸和苯丙氨酸转移到更为亲水的环境中,因此荧光猝灭[26]。
2.4 EGCG浓度对猪肉肌原纤维蛋白流变学性能的影响
储能模量(G′)用于表示凝胶的弹性,测定结果见图3。
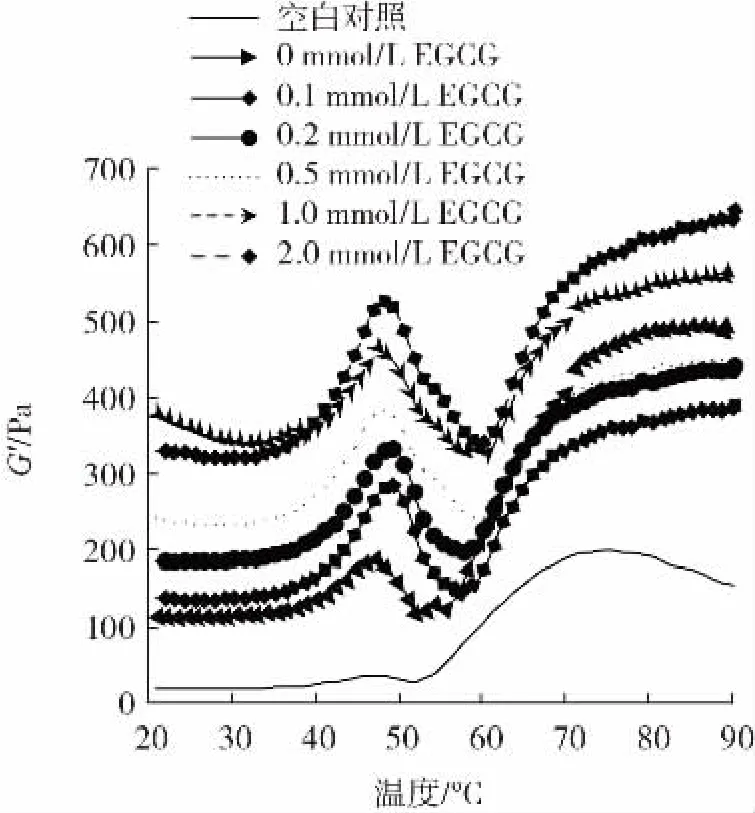
图3 EGCG浓度对猪肉肌原纤维蛋白储能模量(G′)的影响Fig.3 Effect of EGCG concentration on the storage modulus(G′)of pork myofibrillar protein
由图3可知,0 mmol/L EGCG组的G′高于空白对照组,表明氧化提高了蛋白质的储能模量,促进了蛋白质侧链结构之间的相互交联。经2.0 mmol/L EGCG处理的肌原纤维蛋白乳液凝胶的G′高于0 mmol/L EGCG组,可能是EGCG的多个酚羟基结构与蛋白质侧链结合,形成“巯基-醌”和“氨基-醌”加成产物,促进蛋白质之间的交联聚集。这与表儿茶素处理肌原纤维蛋白的研究结果一致[24]。Feng等[12]研究认为,在低浓度NaCl(0.2 mol/L)条件下,EGCG会抑制肌原纤维蛋白的共价交联作用而降低G′值,而在高浓度NaCl(0.6 mol/L)条件下,EGCG与肌原纤维蛋白的共价和非共价交联作用会导致蛋白质分子膨胀变大,降低表面疏水性,改善蛋白质乳液凝胶的G′值。
2.5 EGCG浓度对猪肉肌原纤维蛋白凝胶保水性的影响
凝胶保水性是指当凝胶受外力作用时,保持其原有水分与添加水分的能力,EGCG浓度对猪肉肌原纤维蛋白凝胶保水性的影响见图4。
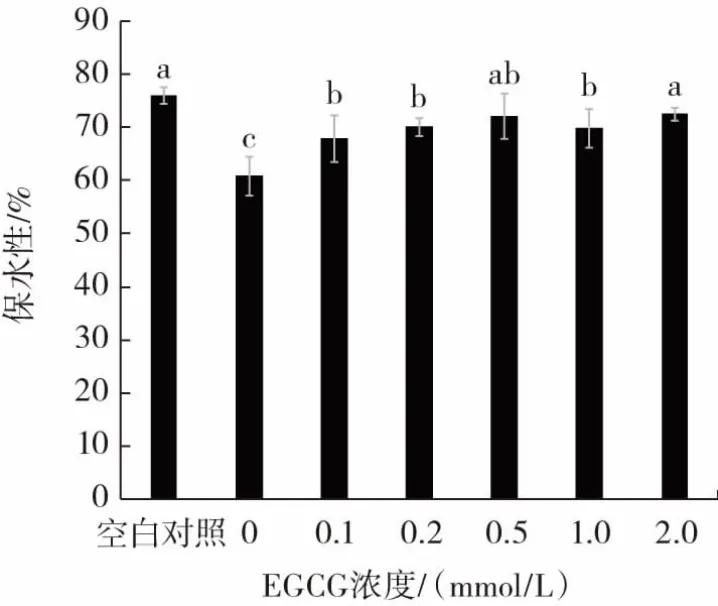
图4 EGCG浓度对猪肉肌原纤维蛋白凝胶保水性的影响Fig.4 Effect of EGCG concentration on the water holding capacity(WHC)of pork myofibrillar protein
从图4可知,氧化处理的0 mmol/L EGCG组的凝胶保水性显著低于空白对照组(P<0.05)。随EGCG浓度增加,凝胶保水性整体呈升高趋势。本研究中,EGCG的酚羟基结构与蛋白质侧链结合,形成的加成产物促进蛋白质之间的交联聚集,增强了对水的束缚能力,与凝胶流变学结果一致。
2.6 EGCG浓度对猪肉肌原纤维蛋白凝胶水分分布的影响
EGCG浓度对猪肉肌原纤维蛋白凝胶弛豫时间的影响见图5。
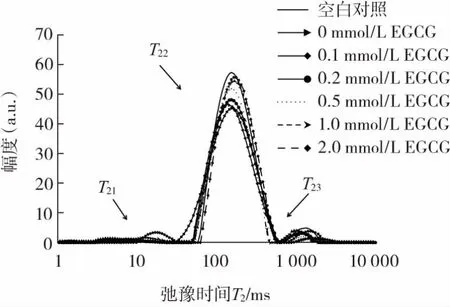
图5 EGCG浓度对猪肉肌原纤维蛋白凝胶弛豫时间T2的影响Fig.5 Effect of EGCG concentration on the relaxation time T2of pork myofibrillar protein gel
由图5可知,肌原纤维蛋白凝胶低场核磁水分分布在1 ms~10 000 ms的弛豫时间内出现了3个峰,3种状态水分的弛豫时间T2由大到小为 T23>T22>T21。可根据驰豫时间的长短,判断水分的分布状态。弛豫时间T21在0~25 ms之间,属于凝胶中的结合水;弛豫时间T22在51 ms~471 ms之间,属于凝胶中的不易流动水;弛豫时间T23在666 ms~2 025 ms之间,属于凝胶中的自由水。关于凝胶中水分低场核磁研究的描述与相关研究[28]结果一致。
EGCG浓度对猪肉肌原纤维蛋白凝胶水分峰面积比例的影响见表2。
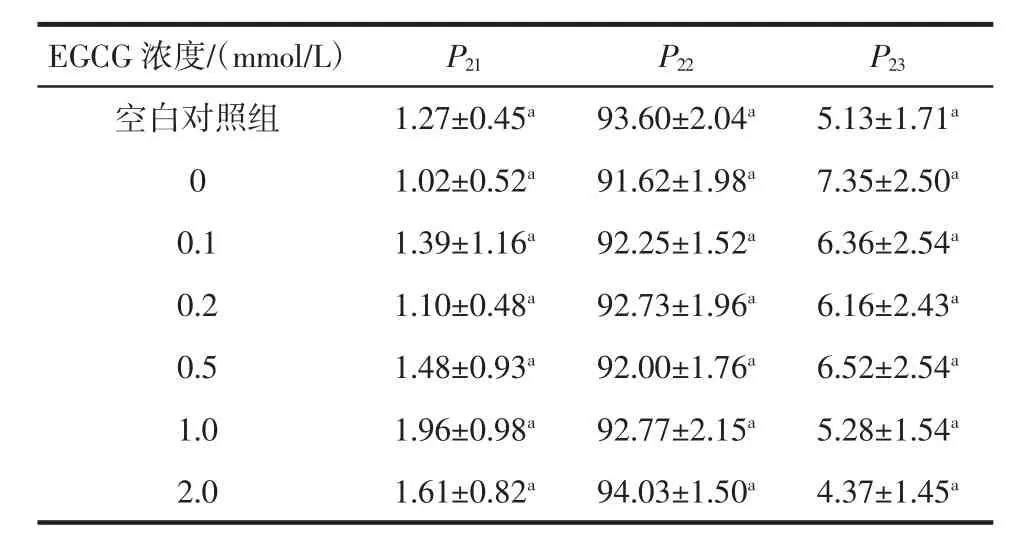
表2 EGCG浓度对猪肉肌原纤维蛋白凝胶水分峰面积比例的影响Table 2 Peak area proportion of pork myofibrillar protein gel treated with EGCG at different concentrations
由表2可知,与空白对照组相比,氧化处理的0 mmol/L EGCG组肌原纤维蛋白凝胶不易流动水减少,自由水增加(P>0.05),说明氧化处理后,凝胶中的一部分不易流动水可能会变成自由水,凝胶保水性降低,这与2.5节中蛋白质氧化后凝胶保水性降低的研究结果相一致。可能是因为经羟自由基氧化处理后,肌原纤维蛋白侧链被修饰,蛋白质结构展开,α-螺旋结构解折叠,疏水基团暴露,导致其空间结构松散[29]。随EGCG浓度增加,不易流动水比例整体上呈增加趋势,自由水比例整体上呈降低趋势,说明EGCG提高了凝胶的保水性。前期通过在氧化蛋白中添加儿茶素发现[24],酚类化合物具有提高凝胶保水性的作用,与本研究结果一致。
2.7 相关性分析
氧化蛋白体系中EGCG浓度与蛋白质侧链基团含量和水分峰面积比例之间的相关性(不包含空白对照组)见表3。
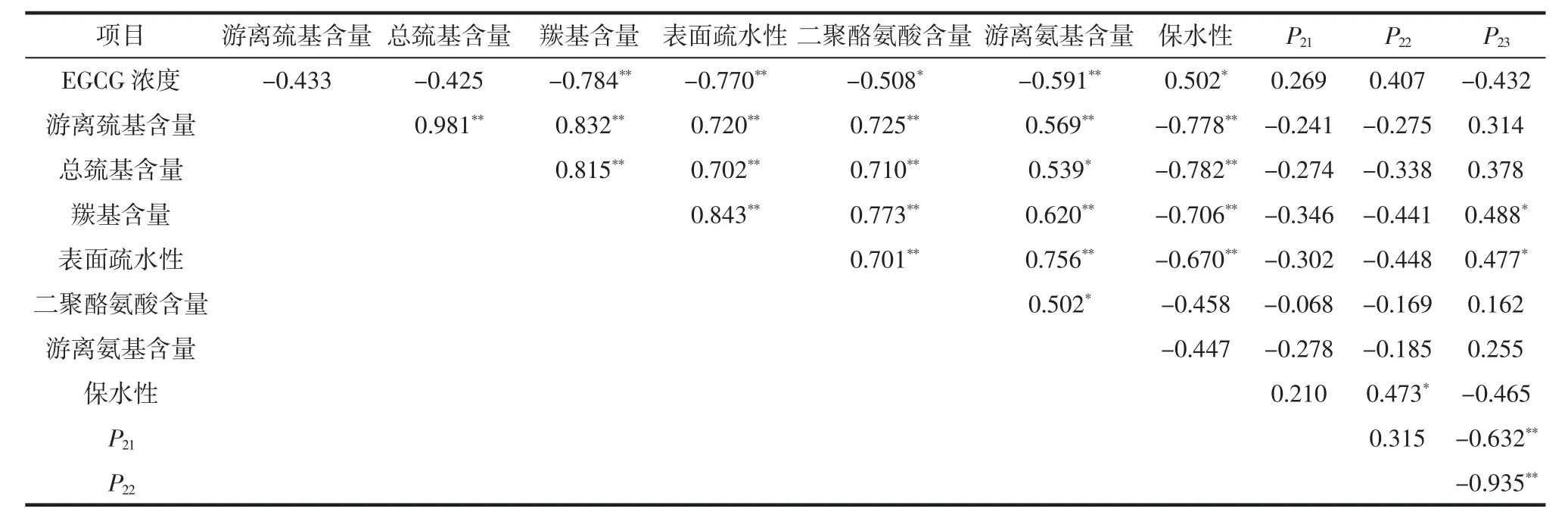
表3 EGCG浓度与肌原纤维蛋白侧链基团含量和水分峰面积比例之间的相关性Table 3 Correlation coefficients between EGCG concentration,myofibrillar protein side chain group content and water peak area proportion
由表3可知,在羟自由基氧化条件下,EGCG浓度与蛋白质侧链羰基含量、游离氨基含量和表面疏水性呈极显著负相关(P<0.01),EGCG浓度与二聚酪氨酸含量呈显著负相关(P<0.05),说明EGCG显著影响了肌原纤维蛋白侧链结构。但是EGCG浓度与凝胶水分峰面积相关性不显著,在考察的EGCG浓度范围内,凝胶性能改变不大。游离巯基含量与总巯基含量、羰基含量、表面疏水性、二聚酪氨酸含量和游离氨基含量均呈极显著正相关(P<0.01),说明蛋白质侧链基团相互影响和相互作用,呈现相似的变化趋势。凝胶保水性与游离巯基含量、总巯基含量、羰基含量、表面疏水性呈极显著负相关(P<0.01),说明侧链基团包埋在蛋白质三维结构中,有利于提高凝胶保水性。本研究中,自由水峰面积比例(P23)与羰基含量和表面疏水性呈显著正相关(P<0.05),未观察到与其他蛋白质侧链基团之间的强相关性。
3 结论
肌原纤维蛋白经氧化处理后,蛋白质侧链结构中游离巯基、总巯基、游离氨基的含量和内源色氨酸荧光强度均下降,而羰基含量和表面疏水性整体上增加。在氧化体系中,当EGCG浓度为0.1 mmol/L~2.0 mmol/L,游离氨基含量、羰基含量、内源色氨酸荧光强度和表面疏水性均随EGCG浓度增大而降低。EGCG浓度为0.1 mmol/L~2.0 mmol/L时提高了肌原纤维蛋白的凝胶保水性,降低了自由水比例。

