地奥司明缓解脓毒症大鼠心肌损伤
王晓婉 代 会 赵腾飞 刘玉旗 费爱华
脓毒症是宿主对感染的反应失调,进而导致危及生命的器官功能障碍,临床上40%~50%的脓毒症患者存在心肌损伤[1,2]。脓毒症合并心肌损伤患者的病死率可高达70%~90%[3]。脓毒症心肌损伤的发病机制涉及炎性反应、氧化应激、线粒体损伤等,且多种因素间常互为因果,共同影响疾病的发生、发展[4]。研究表明,脓毒症时细胞内过度激活的活性氧(reactive oxygen species, ROS)和大量的炎性细胞因子介导线粒体损伤,后者进一步造成ROS产生和堆积,形成恶性循环,导致脓毒症心肌损伤[5,6]。
地奥司明是一种黄酮类化合物,临床上常用于治疗慢性静脉功能不全、静脉溃疡。近年来研究发现,地奥司明在心肌梗死、心肌缺血再灌注损伤和其他心血管疾病中发挥保护性作用,并表现出抗炎、抗氧化等多种生物学活性[7~10]。然而地奥司明在脓毒症心肌损伤中的作用和机制鲜有报道。本实验拟通过腹腔注射LPS建立脓毒症模型,观察地奥司明对脓毒症心肌损伤的影响并探讨其潜在机制。
材料与方法
1. 材料:地奥司明(货号:PHR2799)和脂多糖(lipopolysaccharide,LPS,货号:L2630)购自美国Sigma公司;一抗:线料体动力相关蛋白/(dynamin-related protein1,DRP1,货号:12957-1-AP)、线粒体融合蛋白2(mitofusin 2,MFN2,货号:12186-1-AP)、线粒体转录因子A(mitochondrial transcription factor A,TFAM,货号:22586-1-AP)、甘油醛-3-磷酸脱氢酶(gluceraldehyole-3-p hosphate dehydrogenase,GAPDH,货号:10494-1-AP)和超氯化物歧化酶2(superoxide dismutase2,SOD2,货号:10269-1-AP)购自武汉三鹰生物技术有限公司;ATP含量测定试剂盒(货号:A095-1-1)购自南京建成生物有限公司;TNF-α(货号:JL13202)、IL-1β(货号:JL20884)酶联免疫吸附(ELISA)测定试剂盒购自上海江莱生物科技有限公司;DHE染色试剂盒(货号:S0063)购自上海碧云天生物技术有限公司。
2.实验动物和脓毒症模型构建:60只雄性SD大鼠(220~250g)由上海交通大学医学院附属新华医院实验动物中心提供,采用随机数字表法将60只SD大鼠分为对照组、模型组、地奥司明组,每组20只。地奥司明组大鼠连续7天给予30mg/(kg·d)地奥司明灌胃,对照组和模型组连续7天给予等量的0.9%氯化钠溶液灌胃。第7天灌胃后1h,模型组和地奥司明组大鼠腹腔注射LPS(10mg/kg)以构建脓毒症模型。12h后处死3组大鼠,收集大鼠血液和心脏组织。
3.HE染色:取大鼠心脏,将心脏充分浸于4%多聚甲醛溶液中固定24h,随后浸蜡和包埋,制成4μm石蜡切片。对切片进行二甲苯透明,梯度乙醇脱水,苏木精染色,盐酸分化,伊红染色,乙醇脱水透明和树脂封片,光学显微镜下观察。
4.ELISA法检测TNF-α、IL-1β:收集大鼠血液,3000×g离心10min获得上层血清。根据ELISA试剂盒说明书上的步骤依次检测血清TNF-α、IL-1β的含量。
5.石蜡切片免疫组织化学染色:在心肌组织石蜡切片的基础上,对切片进行二甲苯脱蜡、柠檬酸抗原修复、血清封闭、一抗SOD2孵育,二抗孵育及显色后,光学显微镜下观察。
6.线粒体超微结构观察:取1mm×1mm×1mm 体积的左心室前壁心肌组织,浸于2.5%戊二醛溶液中固定,再经1%锇酸溶液固定、脱水包埋和切片(2μm)后,于透射电子显微镜下观察。
7.ATP检测:取新鲜的大鼠左心室组织,称重后加入双蒸水制成匀浆液, 100℃加热15min,冷却离心(3500×g,10min)后在96孔板中加入上清液,随后用酶标仪在636nm处测定吸光度(A)值,根据吸光度和样本浓度计算组织中ATP的浓度。
8.Western blot法检测左心室SOD2、DRP1、MFN2、TFAM蛋白的相对表达量:提取大鼠左心室组织总蛋白,经电泳、转膜、封闭后,分别用一抗SOD2、DRP1、MFN2、TFAM和GAPDH在4℃孵育12h,随后常温孵育二抗2h,使用Amersham Imager 600采集图像。
9.DHE染色:冷冻切片机将大鼠心脏制成约5μm的组织冷冻切片,加入DHE染色液,37℃孵育20min,在荧光显微镜下观察。

结 果
1.各组大鼠血清炎性细胞因子水平的比较:LPS刺激可明显增加大鼠血清TNF-α,IL-1β水平(P<0.01)。地奥司明预处理使脓毒症大鼠血清中TNF-α、IL-1β水平明显降低(P<0.01),详见表1。
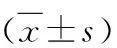
表1 血清TNF-α、IL-1β和心肌组织ATP的含量
2.各组大鼠心肌组织HE染色结果:对照组大鼠心肌纤维排列紧密且规则,细胞形态正常且结构清晰;模型组大鼠心肌纤维排列紊乱、甚至中断,心肌细胞水肿;地奥司明组大鼠心肌纤维排列稍紊乱,细胞水肿较模型组减轻,详见图1。
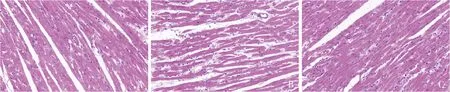
图1 心肌组织HE染色结果(×400)A.对照组;B.模型组;C.地奥司明组
3.各组大鼠心肌氧化应激结果:DHE染色结果显示,对照组大鼠心肌细胞表达微弱的红色荧光,模型组可见明显的红色荧光,地奥司明组红色荧光强度较模型组降低,详见图2。免疫组化和Western blot法结果表明,模型组大鼠心肌组织中SOD2蛋白水平较对照组明显降低(P<0.05),地奥司明预处理使脓毒症大鼠心肌组织中SOD2蛋白水平明显升高(P<0.05),详见图3。

图2 心肌组织DHE染色结果(×400)A.对照组;B.模型组;C.地奥司明组
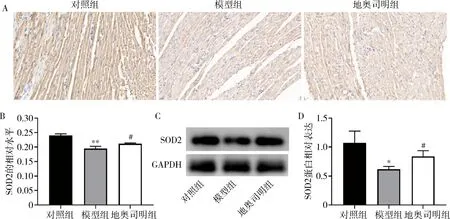
图3 心肌组织SOD2蛋白表达A.心肌组织SOD2免疫组化结果(×400);B.SOD2免疫组化结果相对表达量;C.心肌组织SOD2的Western blot法条带图;D.SOD2 Western blot法结果相对表达量。与对照组比较,*P<0.05;**P<0.01;与模型组比较,#P<0.05
4.各组大鼠心肌线粒体结构和功能:透射电镜结果显示,对照组大鼠心肌细胞线粒体结构和线粒体嵴清晰、完整;模型组线粒体肿胀,部分线粒体膜破裂,线粒体嵴溶解断裂;而地奥司明组线粒体轻微肿胀,线粒体嵴结构较清晰,排列较齐,详见图4。模型组大鼠心肌组织ATP含量较对照组明显降低(P<0.05),地奥司明预处理使脓毒症大鼠心肌组织ATP含量明显升高(P<0.05),详见表1。Western blot 法检测结果表明,模型组大鼠心肌组织DRP1表达水平较对照组明显升高(P<0.05),MFN2、TFAM表达水平较对照组明显降低(P<0.05),地奥司明预处理使脓毒症大鼠心肌组织DRP1表达水平明显降低(P<0.05),MFN2、TFAM表达水平明显升高(P<0.05),详见图5。
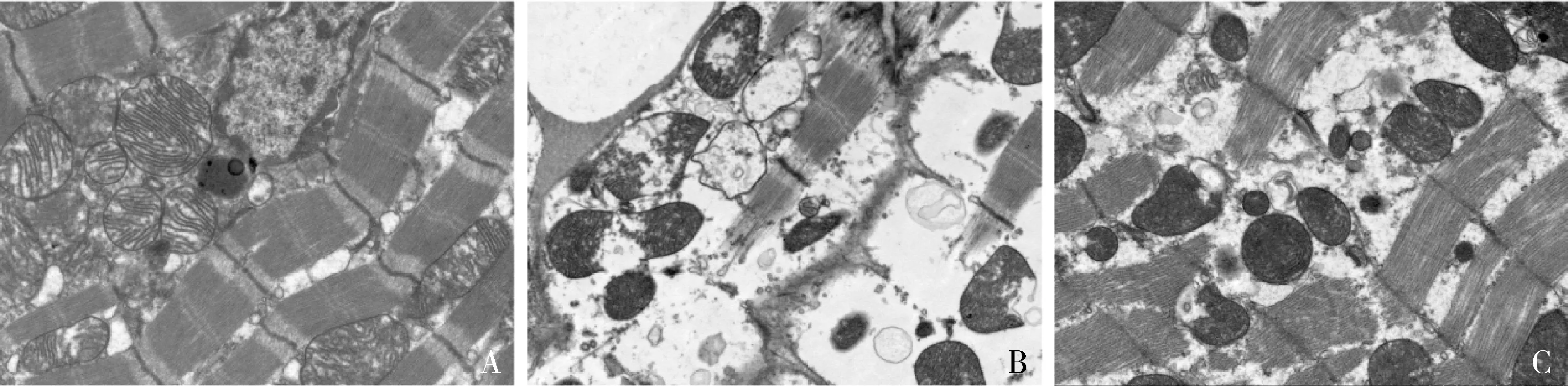
图4 心肌细胞线粒体透射电镜图(×7000)A.组照组;B.模型组;C.地奥司明组
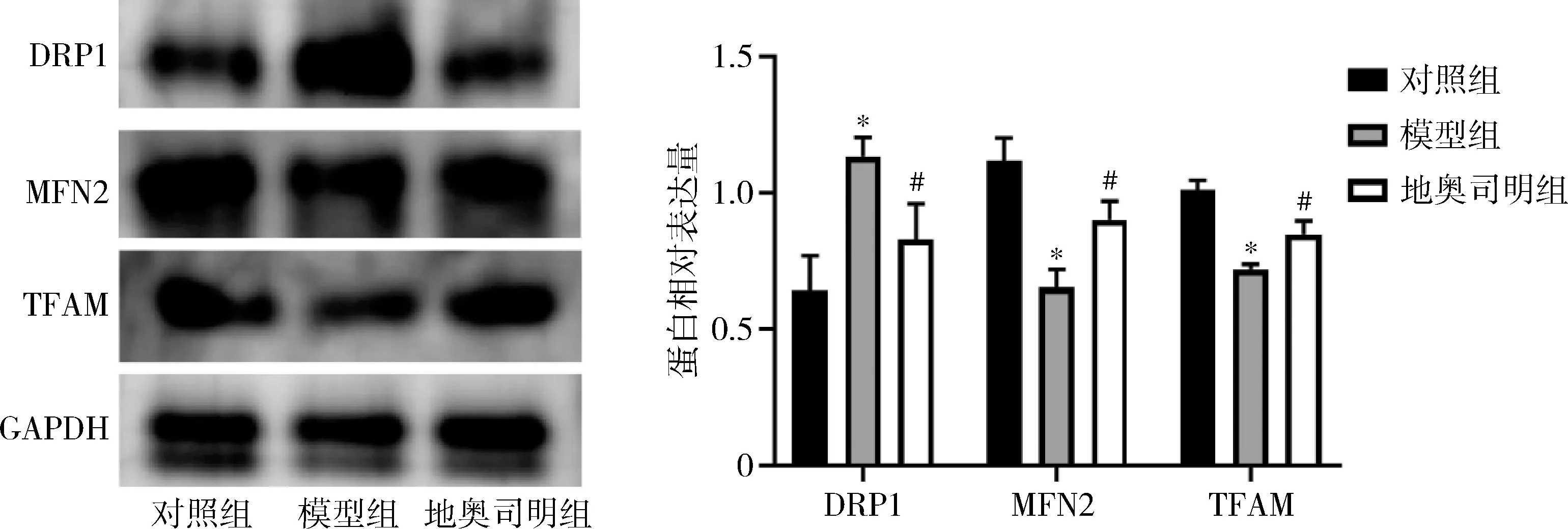
图5 心肌组织DRP1、MFN2和TFAM蛋白表达与对照组比较,*P<0.05;与模型组比较,#P<0.05
讨 论
多项研究表明,炎症瀑布反应、氧化应激、细胞能量代谢障碍、线粒体功能损伤等会造成心肌细胞损伤[11]。因此,以改善心肌损伤为靶向可成为脓毒症的一种潜在有效的治疗方法。本研究发现,地奥司明预处理降低LPS刺激引起的大鼠血清炎性细胞因子水平升高,改善心肌组织结构损伤,降低ROS含量,改善线粒体超微结构损伤,改善线粒体功能障碍和线粒体动力学失衡。本研究结果表明,地奥司明在脓毒症心肌损伤中具有保护性作用。
LPS刺激激活核因子κB(nuclear factor-κB,NF-κB)信号通路,释放大量下游的TNF-α和IL-1β等炎性细胞因子。笔者研究发现模型组大鼠血清TNF-α和IL-1β明显升高。地奥司明干预明显降低血清TNF-α和IL-1β含量,表明地奥司明减轻脓毒症大鼠的炎性反应。
脓毒症时心肌细胞大量的活性氧和超氧阴离子,通过氧化线粒体膜蛋白和脂质,损伤心肌线粒体膜的完整性,诱导线粒体产生更多的活性氧类(即活性氧诱导的活性氧释放现象)进一步加重线粒体损伤[12]。SOD2是抗氧化酶类的重要成员,能有效清除线粒体ROS,是线粒体清除过度氧自由基的第一道防线,TFAM调控着线粒体氧化磷酸化复合物的表达,与线粒体氧化代谢功能密切相关,对线粒体起保护作用[13]。本研究发现,地奥司明组ROS含量比模型组明显降低,且SOD2和TFAM表达水平比模型组明显升高,表明地奥司明能降低脓毒症心肌损伤时线粒体氧化应激水平,发挥保护作用。
线粒体是心肌细胞能量代谢的中心。在脓毒症患者及动物模型中, 心肌细胞均显示线粒体超微结构破坏,电镜下可以观察到脓毒症大鼠静脉注射LPS后6h可出现部分心肌细胞线粒体肿胀、线粒体嵴结构消失、肌丝溶解;24h多数线粒体会出现空泡样变性, 心肌纤维出现断裂[14,15]。脓毒症不但导致心肌细胞线粒体结构损伤,并且导致能量供应不足,是脓毒症心肌损伤的重要发病基础[16]。线粒体是不断进行分裂融合的细胞器,其分裂融合动态不仅决定着线粒体的形态、体积、分布和功能,也参与线粒体的损伤修复[17]。DRP1介导线粒体分裂,MFN2介导线粒体外膜融合,抑制DRP1表达可减轻线粒体病理分裂,改善线粒体功能障碍和细胞能量供应,改善脓毒症小鼠的心功能、提高其生存率,而促进线粒体分裂抑制线粒体融合则会导致预后不良[18~20]。本研究发现,经LPS处理的脓毒症大鼠心肌纤维排列紊乱、断裂,心肌细胞的线粒体膜破裂,线粒体嵴溶解断裂,组织ATP含量也明显降低,提示LPS导致线粒体形态和功能发生异常,而地奥司明治疗能逆转LPS造成的线粒体形态和功能发生异常。此外,笔者研究发现,模型组大鼠线粒体分裂融合相关蛋白DRP1、MFN2表达异常。地奥司明干预后,笔者研究发现,地奥司明能逆转LPS造成的DRP1和MFN2表达异常,地奥司明通过促进MFN2的表达和抑制DRP1的表达来维持线粒体的分裂融合动态平衡。
本实验用地奥司明干预脓毒症大鼠,观察各组大鼠血清炎性细胞因子水平,心脏组织结构、心肌细胞线粒体超微结构、ATP含量、DRP1、MFN2和TFAM蛋白的表达以及检测线粒体ROS含量和SOD2表达,来探讨地奥司明在脓毒症心肌损伤治疗中的作用机制。实验结果表明,地奥司明能够减轻脓毒症大鼠血清炎性细胞因子水平,改善心脏结构损伤,改善心肌细胞线粒体形态上的病变和功能上的障碍,维持线粒体的分裂融合动态平衡,降低脓毒症心肌损伤时线粒体氧化应激水平。综上所述,地奥司明具有减少炎性细胞因子的产生,减少活性氧的产生,保护线粒体形态和功能,缓解脓毒症心肌损伤的作用,其详细机制有待于进一步探讨。

